.
Condición fitosanitaria: Presente
Grupo de cultivos: Cereales
Rango de hospedantes: Ggt infecta principalmente al trigo, pero también puede infectar al triticale, la cebada y el centeno, así como a otros cereales y pastos (*)
Especie hospedante: Trigo (Triticum aestivum), Bromus (cebadilla), Festuca, Lolium (ryegrass), Poa, gramíneas.
Etiología: Hongo. Necrotrófico
Agente causal: Gaeumannomyces tritici (Gaeumannomyces graminis var. tritici, Ggt) (Sacc.) Arx & D.L. Olivier, (1952) (Walker 1972)
Taxonomía: Fungi > Dikarya > Ascomycota > Pezizomycotina > Sordariomycetes > Magnaporthales > Magnaporthaceae > Gaeumannomyces
.
(*) La enfermedad denominada «pietín» en Poaceae es causada por la especie de hongo fitopatógeno Gaeumannomyces graminis (Magnaporthaceae). Se reconocen cuatro variedades dentro de la especie G. graminis según el tamaño de las ascosporas, la morfología hiphopodial y la preferencia por el hospedante (Turner, 1940, Walker, 1972, Yao et al., 1992). La variedad tipo Gaeumannomyces graminis var. graminis (Ggg) causa la pudrición (negra) de la vaina de la corona del arroz, la muerte regresiva en el pasto Bermuda, la pudrición de la raíz del pasto St. Augustine o el declive de la raíz de otros pastos de estación cálida (Walker, 1972, Walker, 1981, Elliott, 1991, Ward y Bateman, 1999). Es el menos agresivo y también se encuentra a menudo como un patógeno débil o saprófito en cereales, pastos y soja (Walker, 1980, Roy et al., 1982, Ward y Bateman, 1999). Gaeumannomyces graminis var. avenae (Turner, 1940, Dennis, 1960) (Gga) provoca pietín en avena y pastos , aunque también puede infectar el trigo, el centeno y la cebada. Gaeumannomyces graminis var. tritici (Walker 1972) (Ggt) es la variedad más agresiva y se la conoce como el hongo que causa pietín en trigo. Infecta principalmente al trigo, pero también puede infectar al triticale, la cebada y el centeno, así como a otros cereales y pastos (Walker, 1980, Ward y Bateman, 1999, Freeman y Ward, 2004). Gaeumannomyces graminis var. maydis (Yao et al. 1992) (Ggm) es la variedad más recientemente descrita y causa la destrucción total del maíz, pero también puede infectar levemente el sorgo y otros cereales.
.
.
Antecedentes
El pietín del trigo («take-all», en Inglés) es la enfermedad de la raíz del trigo más importante desde el punto de vista económico a nivel mundial (Kwak y Weller, 2013). En el sur de Australia, el “pietín” (“take-all”) fue reconocido como una enfermedad del trigo en 1852 (Hornby, 1998). El patógeno recibió el nombre de Ophiobolus graminis en 1881. En 1952, von Arx y Olivier estudiaron los peritecios, ascos y ascosporas del hongo y lo asignaron a un nuevo género, Gaeumannomyces, bajo el orden Diaporthales, dando como resultado su designación actual, Gaeumannomyces graminis (Sacc.) Von Arx y Olivier var. tritici Walker (Ggt) (Cook, 2003; Hornby, 1998).
.
Síntomas y signos
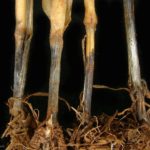
La base del tallo y las raíces presentan una coloración negra brillante. Es común observar rodales o manchones de plantas muertas y espigas blancas cuando el cultivo comienza la espigazón. Puede atacar en cualquier estado de crecimiento pero es más evidente y común después de la floración. En espigazón se observan manchones de plantas muertas con coloración blanca. Si se arranca una planta atacada, y se lavan las raíces, se puede observar la pudrición de color oscura con costras negras y brillantes, constituidas por el micelio del hongo Las raíces al arrancarse no ofrecen resistencia. En ataques tempranos, las flores abortan y las espigas se vuelven blancas. La muerte de la planta determina la madurez precoz de algunas espigas con la formación de granos chuzos. La cebada es menos susceptible. Como es un hongo de suelo su distribución en el lote es en manchones. En ataques severos las plantas manifiestan crecimiento reducido o enanismo, desuniformidad de altura, bajo número de macollos, clorosis, retraso de la floración, pobre llenado de la espiga y senescencia anticipada.
.
Morfología del agente etiológico
En cultivos puros de Gaeumannomyces graminis (Sacc.) Von Arx et Olivier, la esporulación es rara y, por lo tanto, la identificación es difícil. Los conidios se encuentran solo en cultivos in vitro de Ggt, nunca en tejidos infectados naturalmente, por lo que se desconoce su rol en la epidemiología de la enfermedad. Los conidios no se observan normalmente en cultivos jóvenes de Ggt en medios simples como APG. Ggt forma peritecios.
Se ha demostrado que los hifopodios tienen un valor taxonómico en la identificación de especies y variedades (Walker, 1972, 1980) basado en el reconocimiento de Gaeumannomyces como un género hipofodiado. Walker (1980) definió un hifopodio como una célula o hinchazón producida por las hifas epiófitas vegetativas para la fijación y penetración. Puede ser terminal, lateral o intercalar (célula ganglionar), simple o lobulada, hialina o coloreada, sésil o acechada (estigmatopodio o estigmopodio, con un estigmatocito terminal). En el hospedante, la invasión del tejido por la hifopodia puede estar limitada a la formación de haustorios en las células del hospedante o puede ser más extensa. En G. graminis var. tritici Walker, el estigmatopodio definido como el tallo o rama corta sobre la cual la célula de penetración, el estigmatocisto, es transportada, induce una proliferación similar a una clavija de penetración o clavija de infección en la pared celular del hospedante, el lignituber. Ambas estructuras, hifopodios y lignitubers, se desarrollan en los coleóptiles de las plántulas de trigo.
.
Ciclo de la enfermedad y Epidemiología
Este hongo persiste en el suelo, casi exclusivamente como micelio en tejidos previamente infectados principalmente en la corona de las plantas enfermas. En estos tejidos forma estructuras de reproducción de origen sexual (peritecios) que al hidratarse liberan ascosporas que son diseminadas por el viento hacia nuevas plantas. Cuando el micelio entra en contacto con las raíces de las plantas de trigo, el patógeno se disemina sobre su superficie, desintegrando el xilema y floema, y avanzando sobre la raíz principal y la base del tallo. Los primeros síntomas se observan aproximadamente a los 7‑10 días después de la penetración del hongo. La colonización en los tejidos determina una interferencia en la absorción y transporte de agua y nutrientes. Luego de colonizar los tejidos del hospedante, G. graminis formará peritecios, los que sobrevivirán junto con el micelio, en los restos culturales o en las gramíneas nativas. G. tritici no forma conidios. No es considerado un típico hongo de suelo en el sentido de que solo sobrevive asociado a tejidos del hospedante, como micelio o peritecios.
.
Condiciones predisponentes
Suelos alcalinos y saturados. Suelos mal aireados, con alta humedad y baja fertilidad. Intensas precipitaciones que provoquen saturación con falta de drenaje. Intenso monocultivo de trigo. La severidad se incrementa con varios años de monocultivo. Desbalance nutricional del suelo, baja dotación de nitrógeno y fósforo. Presencia de malezas gramíneas susceptibles. Temperaturas entre 12 y 18ºC favorecen la infección.
.
Detección temprana
Se han desarrollado primers para la detección asintomática del patógeno (Keenan et al., 2015).
.
Manejo de la enfermedad
Las medidas preferenciales que deben ser llevadas a cabo complementariamente son:
* Variedades de trigo resistentes o tolerantes: si bien se han encontrado fuentes de resistencia, aún se continúan con los esfuerzos por introducir genes de resistencia a variedades comerciales en los programas de mejoramiento genético (Liu et al., 2001; McMillan et al., 2014; Gholizadeh Vazvani et al., 2017).
* Rotación de cultivos: La gramíneas susceptibles (cebada, centeno, triticale) no deberían ser cultivadas en un lote donde hubo ocurrencia de la enfermedad. El período de rotación debe ser el suficiente para que se produzca la mineralización de los tejidos radiculares infectados. Algunos cultivos no susceptibles que pueden sembrase en invierno son: lino, colza y avena. Se recomiendan rotaciones de cultivos de 2 a 4 años con maíz o soja para campos problemáticos. Sin embargo, incluso un año sin sembrar trigo o cebada puede reducir significativamente la posibilidad de que el consumo total dañe los cultivos de trigo posteriores. Es importante recordar que la rotación de cultivos reduce la incidencia y la severidad del efecto tóxico, pero no eliminará el agente causal de un campo (especialmente las rotaciones de corta duración). El hongo comúnmente sobrevive en cultivos no sintomáticos, como cebada, avena, centeno y muchos pastos.
Baker y Cook (1974) demostraron que 3 años de cultivos sucesivos de trigo podrían ser suficientes para el desarrollo de una supresión específica. Como excepción, una rotación basada en trigo-triticale y avena durante más de 10 años, también resultó ser supresor de Ggt. Las raíces de avena producen saponina avenacina, un metabolito secundario triterpenoide glicosilado con propiedades antifúngicas que ha estado involucrado en la determinación de la resistencia de la avena a patógenos fúngicos del suelo (Osbourn et al., 1994; Freeman y Ward, 2004). La saponina avenacina es un inhibidor preformado del crecimiento de hongos y se encuentra en las raíces de las especies de avena.
* Eliminación de plantas voluntarias y otros hospedantes (gramíneas nativas): En campos donde existen gramíneas nativas invasoras o cultivadas tales como: Bromus (cebadilla), Festuca, Lolium (ryegrass), Poa, etc., es conveniente tomar medidas para su control, debido a que estas plantas son parasitadas por el pietín. Si bien algunas veces, en Bromus y otras gramíneas no se manifiestan los síntomas, estas plantas actúan como reservorios del hongo.
* Manejo nutricional: buen balance de fósforo, manganeso y cobre (Rengel et al., 1993).
* Tratamietno de semillas: hay variabilidad en los resultados obtenidos en diferentes investigaciones. Por ejemplo, mientras algunos investigadores obtuvieron cierto control de la enfermedad con el tratamiento químico de semillas (Bateman, 1986; Bockus, 1983; Mathre et al., 1986; Andrade, 2004), Rothrock (1988) no obtuvo control de la enfermedad con fungicidas tales como triadimefon.
* Suelos supresivos: los suelos supresivos se definen como “suelos en los que el patógeno no se establece o no persiste, se establece pero causa poco daño, o se establece y causa enfermedad por un tiempo pero la enfermedad es menos importante aunque el patógeno puede persistir en el suelo” (Baker y Cook, 1974; Weller, 1988; Weller et al., 2007). De acuerdo con Durán et al. (2017) este método de control es potencialmente muy promisorio, de manera que la identificación y caracterización de suelos supresivos pueden ser clave para el desarrollo y aplicación de herramientas de manejo sustenteables.
* Biocontrol: se han llevado a cabo experiencias de control biológico con bacterias antagonistas del patógeno. Por ejemplo, P. protegens, produce una gama muy amplia de compuestos antimicrobianos (Loper y Gross, 2007; Loper et al., 2012; Weller et al., 2012; Jasem et al., 2018). Las pseudomonas con actividad de control biológico también producen biosurfactantes como mecanismo de supresión de patógenos. Por ejemplo, se ha identificado el lipopéptido cíclico (CLP), la anfisina, que funciona como biosurfactante y tiene actividad antifúngica. También se identificó phenazine, lo que sugiere que las dos clases de moléculas antagonistas funcionaron aditivamente en estos estudios (D’aes et al., 2011).
.
.
- Autor: Dirceu Gassen
- Autor: Dirceu Gassen
- Autor: Dirceu Gassen
- Autor: Dirceu Gassen
- Autor: Dirceu Gassen
- Pietín en trigo. Autor: Dr. Marcelo Carmona
.
.
Bibliografía
AHDB. Exploring the genetic and mechanistic basis of resistance to take-all disease in wheat. Link
AHDB. Identification and charactersation of resistance to the take-all fungus in wheat. Link
UKRI. Engineering wheat for take-all resistance. Link
Amelung D (1991) A simple method for identification of Gaeumannomyces graminis var. tritici walker. Link
Andrade VO (2004) Efectividad de diferentes desinfectantes de semilla sobre la pudrición radical (Gaeumannomyces graminis var. tritici) del trigo, en el sur de Chile. Agricultura Técnica, 64(2): 111-126. doi: 10.4067/S0365-28072004000200001
Baker KF, Cook RJ (1974) Biological Control of Plant Pathogens. W.H. Freeman, San Francisco. 433pp.
Bateman GL (1986) Effects of triadimenol-containing seed treatment on winter wheat infected with take-all. Zeitschrift fiir Pflanzenkrankheiten und Pflanzenschutz 93: 404-414.
Bockus WW (1983) Effects of fall infection by Gaeumannomyces graminis var. tritici and triadimenol seed treatment on severity of take-all in winter wheat. Phytopathology 73: 540-543.
Brown ME (1981) Microbiology of roots infected with the take-all fungus (Gaeumannomyces graminis var. tritici) in phased sequences of winter wheat. Soil Biology and Biochemistry 13(4): 285-291. doi: 10.1016/0038-0717(81)90064-X
Cook RJ, Rovira AD (1976) The role of bacteria in the biological control of Gaeumannomyces graminis by suppressive soils. Soil Biol. Biochem. 8:269−273.
Cook RJ, Thomashow LS, Weller DM, et al. (1995) Molecular mechanism of defense by Rhizobacteria against root disease. Proc. Natl. Acad. Sci. USA 92:4179−4201.
Cook RJ (2003) Take-all of wheat. Physiological and Molecular Plant Pathology 62: 73−86. doi: 10.1016/S0885-5765(03)00042-0
Dori S, Solel Z, Barash I (1995) Cell wall-degrading enzymes produced by Gaeumannomyces graminis var. tritici in vitro and in vivo. Physiological and Molecular Plant Pathology 46(3): 189-198. doi: 10.1006/pmpp.1995.1015
Durán P, Jorquera M, Viscardi S, Carrion VJ, Mora ML and Pozo MJ (2017) Screening and Characterization of Potentially Suppressive Soils against Gaeumannomyces graminis under Extensive Wheat Cropping by Chilean Indigenous Communities. Frontiers in Microbiology 8: 1552. doi: 10.3389/fmicb.2017.01552
Freeman J, Ward E (2004) Gaeumannomyces graminis, the take-all fungus and its relatives. Molecular Plant Pathology 5: 235–252. doi: 10.1111/j.1364-3703.2004.00226.x
Gholizadeh Vazvani M, Dashti H, Saberi Riseh R, Bihamta MR (2017) Screening bread wheat germplasm for resistance to Take-all disease (Gaeumannomyces graminis var. tritici) in greenhouse conditions. Journal of Agricultural Science and Technology 19: 1173-1184. Link
Hernández-Restrepo M, Groenewald JZ, Elliott ML, Canning G, McMillan VE, Crous PW (2016) Take-all or nothing. Studies in Mycology 83: 19-48. doi: 10.1016/j.simyco.2016.06.002
Hornby D (1998) Take-All of Cereals. A Regional Perspective. CAB International, Wallingford, UK.
Jasem AM, Sharifi R, Abbasi S (2018) Induced systemic resistance to wheat take-all disease by probiotic bacteria. Journal of Plant Protection Research 58(3): 304-310. doi: 10.24425/jppr.2018.124639.
Keenan S, Cromey MG, Harrow SA, et al. (2015) Quantitative PCR to detect Gaeumannomyces graminis var. tritici in symptomatic and non-symptomatic wheat roots. Australasian Plant Pathology 44: 591–597. doi: 10.1007/s13313-015-0379-y
Kwak YS, Weller DM (2013) Take-all of Wheat and Natural Disease Suppression: A Review. The Plant Pathology Journal 29(2): 125‐135. doi: 10.5423/PPJ.SI.07.2012.0112
Liu C, Xue Y, Shang H, et al. (2001) Resistance of oat to ‘take-all’ causing fungus (Gaeumannomyces graminis var. tritici). Chinese Science Bulletin 46, 1817. doi: 10.1007/BF02900558
Litvintseva AP, Henson JM (2002) Cloning, characterization, and transcription of three laccase genes from Gaeumannomyces graminis var. tritici, the take-all fungus. Appl Environ Microbiol. 68(3): 1305-11. doi: 10.1128/aem.68.3.1305-1311.2002
Loper JE, Gross H (2007) Genomic analysis of antifungal metabolite production by Pseudomonas fluorescens Pf-5. Eur. J. Plant Pathol. 119:265−278. doi: 10.1007/s10658-007-9179-8
Loper JE, Hassan KA, Mavrodi DV, et al. (2012) Comparative genomics of plant-associated Pseudomonas spp.: Insights into diversity and inheritance of traits involved in multitrophic interactions. PLoS Genetics 8: e1002784. doi: 10.1371/journal.pgen.1002784
Marschner P, Ascher JS, Graham RD (1991) Effect of manganese-reducing rhizosphere bacteria on the growth of Gaeumannomyces graminis var. tritici and on manganese uptake by wheat (Triticum aestivum L.). Biology and Fertility of Soils 12(1): 33-38. doi: 10.1007/BF00369385
Mathre DE, Johnston RH, Andengel R (1986) Effect of seed treatment with triadimenol on severity of take-all of spring wheat caused by Gaeumannomyces graminis var. tritici. Plant Disease70: 749-751.
Mathre DE (2000) Take-all disease on wheat, barley, and oats. Online. Plant Health Progress doi: 10.1094/PHP-2000-0623-01-DG
Mazzola M, Fujimoto DK, Thomashow LS, Cook RJ (1995) Variation in sensitivity of Gaeumannomyces graminis to antibiotics produced by fluorescent Pseudomonas spp. and effect on biological control of Take-all of wheat. Applied and Environmental Microbiology 61(7): 2554–2559.
Macdonald AJ, Gutteridge RJ (2012) Effects of take-all (Gaeumannomyces graminis var. tritici) on crop N uptake and residual mineral N in soil at harvest of winter wheat. Plant Soil 350: 253–260. doi: 10.1007/s11104-011-0900-1
McMillan VE, Hammond‐Kosack KE, Gutteridge RJ (2011) Evidence that wheat cultivars differ in their ability to build up inoculum of the take‐all fungus, Gaeumannomyces graminis var. tritici, under a first wheat crop. Plant Pathology 60: 200-206. doi: 10.1111/j.1365-3059.2010.02375.x
McMillan VE, Gutteridge RJ, Hammond-Kosack KE (2014) Identifying variation in resistance to the take-all fungus, Gaeumannomyces graminis var. tritici, between different ancestral and modern wheat species. BMC Plant Biol. 14: 212. doi: 10.1186/s12870-014-0212-8
Okagaki LH, Nunes CC, Sailsbery J, et al. (2015) Genome sequences of three phytopathogenic species of the Magnaporthaceae family of fungi. G3: Genes, Genomes, Genetics 5(12): 2539-2545. doi: 10.1534/g3.115.020057
Osbourn AE, Clarke BR, Lunness P, et al. (1994) An oat species lacking avenacin is susceptible to infection by Gaeumannomyces graminis var. tritici. Physiological and Molecular Plant Pathology 45: 457-467. doi: 10.1016/S0885-5765(05)80042-6
Palma-Guerrero J, Chancellor T, Spong J, et al. (2021) Take-All Disease: New Insights into an Important Wheat Root Pathogen. Trends in Plant Science. doi: 10.1016/j.tplants.2021.02.009
Peixoto CN, et al. (2013) Biology of Gaeumannomyces graminis var. graminis isolates from rice and grasses and epidemiological aspects of crown sheath rot of rice. Tropical Plant Pathology 38: 495-504. doi: 10.1590/S1982-56762013000600005
Rengel Z, Graham RD, Pedler JF (1993) Manganese nutrition and accumulation of phenolics and lignin as related to differential resistance of wheat genotypes to the take-all fungus. Plant Soil 151: 255–263. doi: 10.1007/BF00016291
van Toor RF, Chng S, Warren RM, Butler RC, Cromey MG, Craigie RA, McCloy BL (2016) Wheat cultivar susceptibility to Gaeumannomyces graminis var. tritici and influence on Pseudomonas fluorescence numbers in the rhizosphere. Australasian Plant Pathology 45: 595-607. doi: 10.1007/s13313-016-0444-1
van Toor R, Chng S, Warren R, Butler R (2017) Influence of glyphosate herbicide treatment of couch grass on take-all caused by Gaeumannomyces graminis var. tritici with the addition of soil-borne microorganisms. New Zealand Plant Protection, 70: 186-195.
, , , et al. (2020) A functional analysis of mitochondrial respiratory chain cytochrome bc1 complex in Gaeumannomyces tritici by RNA silencing as a possible target of carabrone. Molecular Plant Pathology 12: 1529– 1544. doi: 10.1111/mpp.12993
Ward E (1995) Improved polymerase chain reaction (PCR) detection of Gaeumannomyces graminis including a safeguard against false negatives. European Journal of Plant Pathology 101(5): 561-566. doi: 10.1007/BF01874481
Weller DM (1988) Biological control of soilborne plant pathogens in the rhizosphere with bacteria. Annu. Rev. Phytopathol. 26:379−417.
Weller DM, Raaijmakers JM, McSpadden-Gardener BB, Thomashow LS (2002) Microbial populations responsible for specific soil suppressiveness to plant pathogens. Annu. Rev. Phytopathol. 40:309−348.
Weller DM, Landa BB, Mavrodi OV, Schroeder KL, De La Fuente L, Bankhead BS, Allende Molar R, Bonsall RF, Mavrodi D, Thomashow LS (2007) Role of 2,4-diacetylphloroglucinol-producing fluorescent Pseudomonas spp. in the defense of plant roots. Plant Biol. 9:4−20.
Weller DM, Marrodi DV, van Pelt JA, Pieterse CM, van Loon LC, Bakker PAHM (2012) Induced systemic resistance in Arabidopsis thaliana against Pseudomonas syringae pv. tomato by 2,4-diacetylphloroglucinol-producing Pseudomonas fluorescens. Phytopathology 102: 403−412. doi: 10.1094/PHYTO-08-11-0222
Yang L, Han X, Zhang F, Goodwin PH, Yang Y, Li J, Xia M, Sun R, Jia B, Zhang J, Quan X, Wu C, Xue B, Lu C (2017) Screening Bacillus species as biological control agents of Gaeumannomyces graminis var. tritici on wheat. Biological Control, available online 7 November 2017 (In Press). doi: 10.1016/j.biocontrol.2017.11.004
Zhang D, Gao T, Li H, Lei B, Zhu B (2017) Identification of antifungal substances secreted by Bacillus subtilis Z-14 that suppress Gaeumannomyces graminis var. tritici. Biocontrol Science and Technology 27(2): 237-251. doi: 10.1080/09583157.2016.1275522