.
Condición fitosanitaria: Presente
Grupo de cultivos: Frutícolas
Especie hospedante: Duraznero (Prunus persica)
Rango de hospedantes: duraznero, nectarinas, damasco, almendro.
Epidemiología: considerada monocíclica
Etiología: Hongo. Necrotrófico
Agente causal: Taphrina deformans (Berk.) Tul. 1866 (teleomorfo) / Lalaria deformans (anamorfo)
Taxonomía: Fungi > Dikarya > Ascomycota > Taphrinomycotina > Taphrinomycetes > Taphrinales > Taphrinaceae > Taphrina
.
.
Importancia económica
El Torque del duraznero (en inglés: Peach leaf curl fungus) es una de las enfermedades más importantes de los frutales de carozo. Fue declarado plaga de la Agricultura. Ha llegado a producir el 80% de pérdidas. Es endémica. Las plantas se debilitan año tras año por la restitución de las hojas. Pero hay que considerar que es fácilmente controlable si se emplean medidas adecuadas.
.
Distribución geográfica
Las zonas de mayor humedad como San Pedro en la Provincia de Buenos Aires, Santa Fe, Entre Ríos y Corrientes, son propicias para el desarrollo de la enfermedad. En Río Negro la incidencia es menor.
.
Sintomatología
Las lesiones se presentan en hojas, brotes, flores y frutos, pero el síntoma característico se observa sobre las hojas, de manera característica, inconfundible con otras enfermedades. Durante la brotación, entre la finalización del invierno y comienzo de la primavera, en las hojitas que se despliegan de la yema foliar, se presentan áreas amarillentas a rojizas, dichas áreas paulatinamente se van engrosando, haciéndose más carnosas y se enrulan con los bordes hacia adentro. Es decir, se produce una infección localizada en el parénquima foliar, hay hipertrofia e hiperplasia del parénquima en empalizada mientras que las nervaduras permanecen sanas. Esta desigualdad de crecimiento dentro de la misma hoja provoca que la misma aparezca distorsionada parcial o completamente. El color rojizo (por acumulación de compuestos antociánicos como respuesta de defensa, metaplasia) se va tornando más violáceo y posteriormente adquiere un aspecto plateado, una serosidad (semejante al brillo de la cera) grisácea que constituye el signo de la enfermedad. Finalmente la hoja se torna amarronada y se desprende de la planta. En un ataque precoz los brotes se hinchan más que los normales y mueren, o la hoja se desarrolla con la lámina totalmente deformada. Ocasiona muerte de brotes, los que a veces exudan una sustancia viscosa. Las hojas pueden aparecer en rosetas por acortamiento de entrenudos.
La defoliación producida de las hojas atacadas es seguida por una restitución de las mismas, estas nuevas hojas no serán afectadas salvo que se mantengan las condiciones ambientales favorables. En condiciones climáticas normales no hay infecciones secundarias. La restitución del follaje perdido provoca una disminución de la producción por el consumo de energía que la planta destina para ello.
Las ramitas se ampollan y se quiebran. El ataque a yemas florales produce aborto de flores. La lesión en los frutos se presenta muy raramente, en este caso se verán áreas salientes, rosadas, de tamaño pequeño y de forma irregular. En ataques intensos se pueden observar lesiones locales y verrugosas y hasta resquebrajamiento con aparición del signo. Se produce además la caída temprana de las flores y los frutos afectados.
En cuanto a la manifestación del patógeno (signo), la serosidad grisácea que aparece sobre las lesiones corresponde a los ascos libres dispuestos en empalizada.
.
- Autor: Francisco Sautua
.
Cambios fisiológicos debido a la infección
El impacto de Taphrina deformans sobre hojas infectadas causa una disminución significativa de la cantidad de pigmentos plástidos. Este efecto se observó en varios estudios. Raggy (1966, 1967), por ejemplo, informó que las concentraciones de clorofila en las hojas rizadas se redujeron entre 30% y 50% en comparación con los controles, mientras que según Nikolae y Mitrea (2009) la reducción de este parámetro asciende a 53,62%. Estos investigadores descubrieron que la disminución del contenido de clorofila no era causada por la actividad elevada de la clorofilasa, como es el caso de algunas infecciones virales; y Nikolae y Mitrea (2009) sugirieron que la razón es la inhibición de la biosíntesis de pigmentos. Además, otros autores como Marte y Gagiulo (1972), Syrop (1975), Bassi et al. (1984) y Huang et al. (1993) supusieron que en hojas rizadas el número de cloroplastos podría reducirse severamente y los cloroplastos restantes, caracterizados con una estructura dañada tanto de la red tilacoide como de las granae. El análisis de Koleva et al. (2017) sobre la ultraestructura de las células del mesófilo de las hojas infectadas con Taphrina deformans confirmó la hipótesis de que los cloroplastos se degeneran con la progresión de la enfermedad. En el genoma de Taphrina deformans se encuentran genes responsables de la biosíntesis de compuestos relacionados con la patogénesis, tales como: proteasas, que permiten la digestión de los tejidos vegetales; metabolitos secundarios, que facilitan las interacciones del patógeno fúngico con el medio ambiente, incluida la planta hospedante; y hormonas que son responsables de los síntomas típicos de hipertrofia e hiperplasia (Cisse et al., 2013). Por lo tanto, los cambios estructurales en las hojas afectadas se relacionan con este desequilibrio hormonal provocado por el patógeno. En particular, el crecimiento celular y el contenido de agua potenciados están en correlación con una concentración aumentada de auxinas, mientras que la división celular estimulada y otras anomalías de crecimiento están influenciadas por una actividad elevada de citoquininas. De hecho, se ha demostrado que la actividad de citoquininas y los niveles de ácido indol-3-acético (auxina) y triptófano son mayores, respectivamente, con 81% y 65%, en hojas infectadas por Taphrina deformans (Szirakiet et al., 1975, Yamada et al., 1990). La acumulación significativa de auxinas y citoquininas en estas hojas probablemente induce su capacidad para atraer fotoasimilados. De acuerdo con Goodman et al. (1986), los fotoasimilados se redireccionan desde hojas sanas, que muestran una mayor fijación de CO2, a las infectadas para compensar parcialmente su escasez de carbohidratos. Finalmente, la medición de la concentración de prolina libre indicó que se incrementó en las hojas infectadas con síntomas observables. Esto se correlaciona positivamente con la fuerte hidratación de las células dañadas (Piperkova y Vasilev, 2000). Resultados similares también fueron obtenidos por Raggy (1967), quien observó la elevación de los niveles de los aminoácidos libres prolina, ornitina y glicina durante el período de incubación de la infección. Este fenómeno podría explicarse por la presencia de sustancias químicas (elicitores) liberadas por el hongo, que estimulan la biosíntesis de dichos compuestos o por el aumento de la degradación de las proteínas en las células de la planta hospedante. Esta segunda hipótesis se vio respaldada por el hecho de que el contenido total de proteína en las hojas infectadas también se redujo (Raggy, 1967). En otro estudio del mismo autor (Raggy, 1987) se demostró que el contenido de agua de las hojas infectadas es de 2,4 a 9,6 veces mayor que en las hojas sanas. Es bien sabido que la prolina libre sirve como osmolita y se acumula en respuesta al estrés hídrico: déficit hídrico, estrés salino, estrés por bajas temperaturas, condiciones de saturación del suelo (Olgun et al., 2008, Hayat et al., 2012). En las plantas atacadas por Taphrina deformans, el mayor contenido de prolina puede ser causado por estímulos químicos secretados por el patógeno y/o el estado híper hidratado de las células afectadas.
.
Histología Patológica
El hongo se desarrolla subcuticular e intercelularmente, esto provoca el amarillamiento de la zona afectada. La hiperplasia (aumento del número de células) e hipertrofia (aumento en el tamaño) que se produce en el parénquima en empalizada (sin afectar la nervaduras) se debe a la formación de una sustancia cuya actividad es semejante al Acido Indol Acético (auxina). El pH del tejido foliar desciende trayendo como consecuencia un aumento en la concentración de los pigmentos antociánicos (metaplasia) por ello se observa la lesión de color vinoso.
.
- Autor: José V. Die
.
Ciclo de la Enfermedad
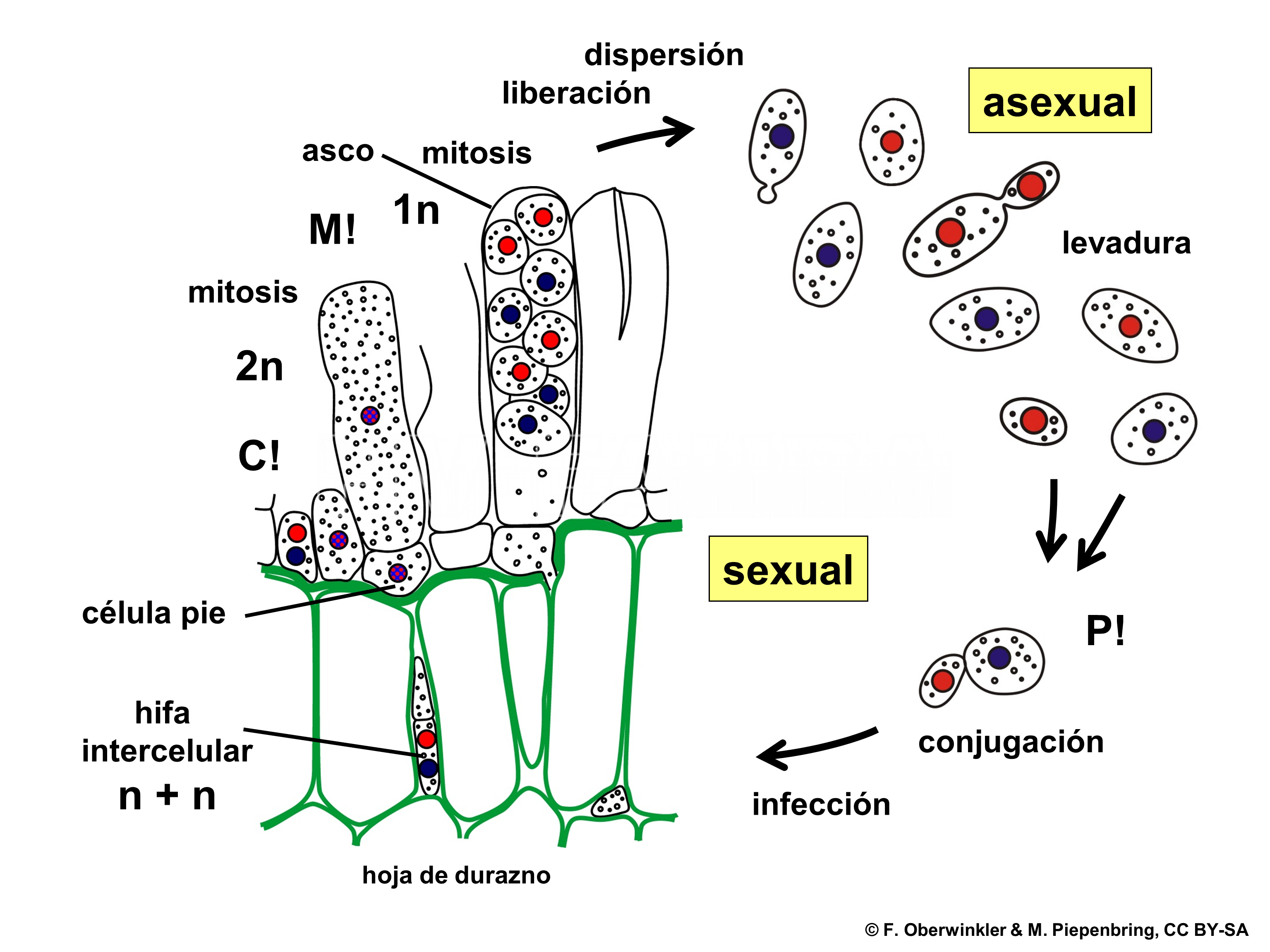
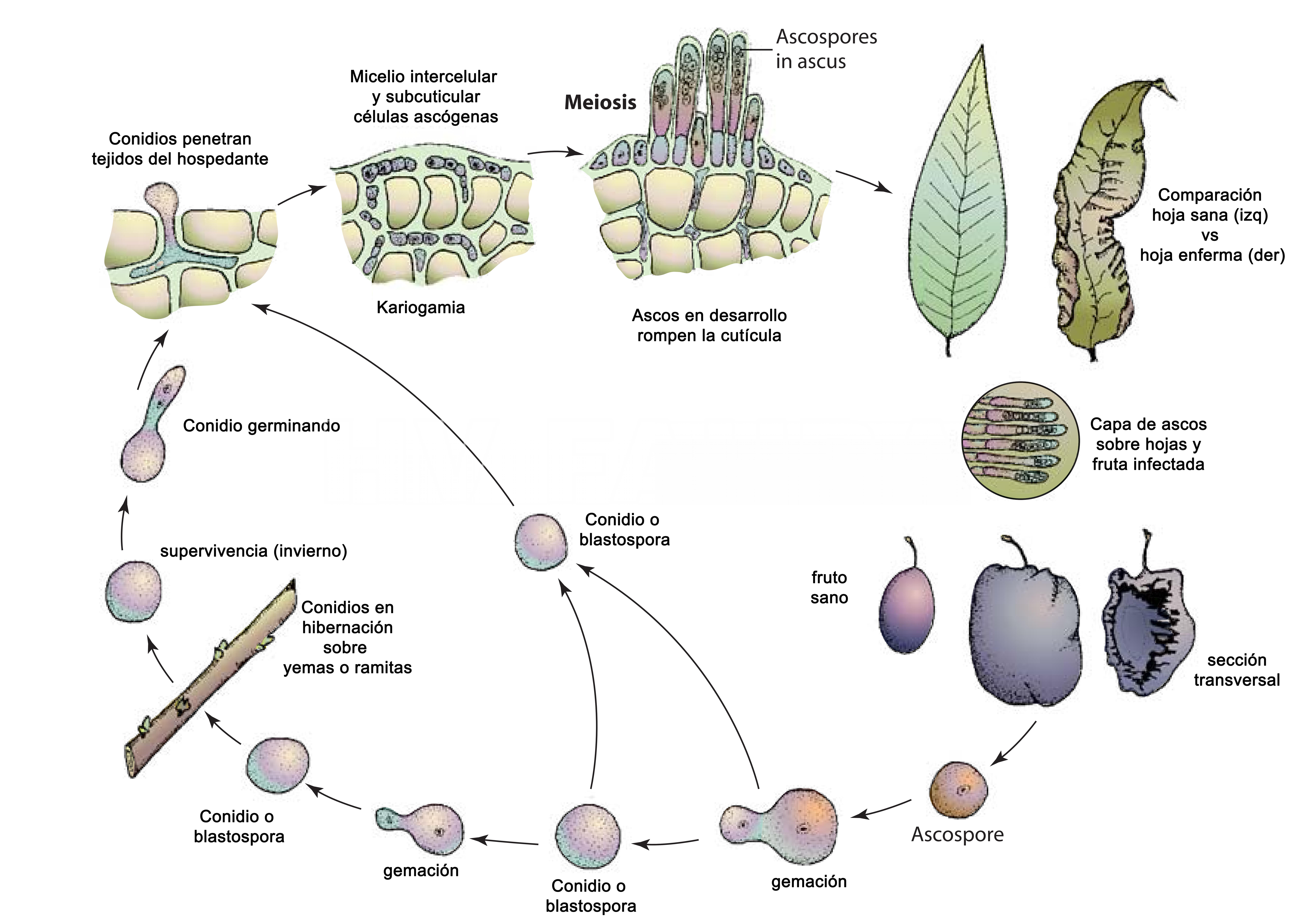
Las ascosporas producidas en los ascos durante la primavera sobre las hojas infectadas son liberadas. Dichas ascosporas forman por gemación células denominadas blastosporas o conidios que a su vez también se multiplican por gemación. Tanto las ascosporas como las blastosporas pueden sobrevivir permaneciendo de una estación a otra en las escamas de las yemas, en las resquebrajaduras de la corteza o grietas de ramas o troncos. A fines de invierno o con la llegada de la primavera, con temperaturas bajas y elevada humedad y al hincharse las yemas foliares estas blastosporas o esporas invernantes germinan mediante un tubo germinativo que penetra a través de la cutícula originando verdadero micelio intercelular, infectando las nuevas hojitas en las que se desarrollará la sintomatología descripta hasta la aparición del signo. Los órganos del hospedante adquieren resistencia al envejecer y el aumento de la temperatura a medida que avanza la primavera impide el desarrollo del patógeno y no se produzcan ciclos secundarios. Las blastosporas pueden permanecer viables por más de dos años.
.
- Esquema del ciclo reproductivo de Taphrina deformans
.
.
- Ciclo de la enfermedad del Torque de la hoja de durazno y de ciruelo causado por Taphrina spp. Fuente: Agrios, 2005.
.
Condiciones predisponentes
Primaveras frías y húmedas, es decir, bajas temperaturas y alta humedad en el comienzo de la brotación. La temperatura óptima para el crecimiento del hongo es de 20ºC con un mínimo de 8.9ºC y un máximo entre 26 y 30ºC.
La penetración se produce con facilidad entre 10-21ºC. El mayor número de infecciones se produce en los límites inferiores y no superiores de temperatura. La humedad relativa requerida para la infección debe ser mayor a 95%.
En la República Argentina es raro encontrar ataque en fruto o en hojas restituidas ya que las condiciones climáticas (altas temperaturas) impiden el desarrollo del patógeno y favorecen la maduración de los órganos vegetales, los que al madurar adquieren resistencia.
.
Manejo Integrado
Evitar plantar cultivares susceptibles.
Aplicación de fungicidas. Es una medida eficiente en un 95-98% siempre que los tratamientos se hagan oportunamente. Se recomienda realizarlos en forma preventiva, la primera aplicación en otoño a la caída de las hojas y la segunda en prebrotación. En años muy húmedos y en variedades muy susceptibles (ej. Flordaking) se recomienda una tercera pulverización en estadío yema hinchada.
.
- 01 Síntomas foliares del Torque del duraznero causado por Taphrina deformans.
- 02 Síntomas foliares del Torque del duraznero causado por Taphrina deformans.
- 03 Síntomas foliares del Torque del duraznero causado por Taphrina deformans.
- 04 Síntomas foliares del Torque del duraznero causado por Taphrina deformans.
- 05 Síntomas foliares del Torque del duraznero causado por Taphrina deformans.
- 06 Síntomas foliares del Torque del duraznero causado por Taphrina deformans.
- 07 Síntomas foliares del Torque del duraznero causado por Taphrina deformans.
- 08 Síntomas foliares del Torque del duraznero causado por Taphrina deformans.
- 09 Síntomas foliares del Torque del duraznero causado por Taphrina deformans.
- 10 Síntomas foliares del Torque del duraznero causado por Taphrina deformans.
- 11 Síntomas foliares del Torque del duraznero causado por Taphrina deformans.
- 12 Síntomas foliares del Torque del duraznero causado por Taphrina deformans.
- 13 Síntomas foliares del Torque del duraznero causado por Taphrina deformans.
- 14 Síntomas foliares del Torque del duraznero causado por Taphrina deformans.
- 15 Síntomas foliares del Torque del duraznero causado por Taphrina deformans.
- 16 Síntomas foliares del Torque del duraznero causado por Taphrina deformans.
- 17 Síntomas foliares del Torque del duraznero causado por Taphrina deformans.
- 18 Síntomas foliares del Torque del duraznero causado por Taphrina deformans.
- 19 Síntomas foliares del Torque del duraznero causado por Taphrina deformans.
- 20 Síntomas foliares del Torque del duraznero causado por Taphrina deformans.
- 21 Síntomas foliares del Torque del duraznero causado por Taphrina deformans.
- 22 Síntomas foliares del Torque del duraznero causado por Taphrina deformans.
- 23 Síntomas foliares del Torque del duraznero causado por Taphrina deformans.
- 24 Síntomas foliares del Torque del duraznero causado por Taphrina deformans.
- 25 Síntomas foliares del Torque del duraznero causado por Taphrina deformans.
- 26 Síntomas foliares del Torque del duraznero causado por Taphrina deformans.
- 27 Síntomas foliares del Torque del duraznero causado por Taphrina deformans.
- 28 Síntomas foliares del Torque del duraznero causado por Taphrina deformans.
- 29 Síntomas foliares del Torque del duraznero causado por Taphrina deformans.
- 30 Síntomas foliares del Torque del duraznero causado por Taphrina deformans.
- 31 Síntomas foliares del Torque del duraznero causado por Taphrina deformans.
- 32 Síntomas foliares del Torque del duraznero causado por Taphrina deformans.
- 33 Síntomas foliares del Torque del duraznero causado por Taphrina deformans.
- 34 Síntomas foliares del Torque del duraznero causado por Taphrina deformans.
- 35 Síntomas foliares del Torque del duraznero causado por Taphrina deformans.
- 36 Síntomas foliares del Torque del duraznero causado por Taphrina deformans.
- 37 Síntomas foliares del Torque del duraznero causado por Taphrina deformans.
- 38 Síntomas foliares del Torque del duraznero causado por Taphrina deformans.
- 39 Síntomas foliares del Torque del duraznero causado por Taphrina deformans.
- 40 Síntomas foliares del Torque del duraznero causado por Taphrina deformans.
- 41 Síntomas foliares del Torque del duraznero causado por Taphrina deformans.
- 42 Síntomas foliares del Torque del duraznero causado por Taphrina deformans.
- 43 Síntomas foliares del Torque del duraznero causado por Taphrina deformans.
- 44 Síntomas foliares del Torque del duraznero causado por Taphrina deformans.
- 45 Síntomas foliares del Torque del duraznero causado por Taphrina deformans.
- 46 Síntomas foliares del Torque del duraznero causado por Taphrina deformans.
- 47 Síntomas foliares del Torque del duraznero causado por Taphrina deformans.
- 48 Síntomas foliares del Torque del duraznero causado por Taphrina deformans.
- 49 Síntomas foliares del Torque del duraznero causado por Taphrina deformans.
- 50 Síntomas foliares del Torque del duraznero causado por Taphrina deformans.
- 51 Síntomas foliares del Torque del duraznero causado por Taphrina deformans.
- 52 Síntomas foliares del Torque del duraznero causado por Taphrina deformans.
- 53 Síntomas foliares del Torque del duraznero causado por Taphrina deformans.
- 54 Síntomas foliares del Torque del duraznero causado por Taphrina deformans.
- 55 Síntomas foliares del Torque del duraznero causado por Taphrina deformans.
- 56 Síntomas foliares del Torque del duraznero causado por Taphrina deformans.
- 57 Síntomas foliares del Torque del duraznero causado por Taphrina deformans.
- 58 Síntomas foliares del Torque del duraznero causado por Taphrina deformans.
.
Bibliografía
2016. Torque del duraznero. Una enfermedad a tener en cuenta en un año “niño”. INTA E.E.A. Alto Valle. Link
Bassi M, Conti GG, Barbieri N (1984) Cell wall degradation by Taphrina deformans in host leaf cells. Ultrastructural and cytochemical observations. Mycopathologia 88(2–3): 115–125. doi: 10.1007/BF00436441
Cissé OH, Almeida JMGCF, Fonseca Á, et al. (2013) Genome sequencing of the plant pathogen Taphrina deformans, the causal agent of peach leaf curl. mBio 4(3): e00055-13. doi: 10.1128/mBio.00055-13
Crady EE, Wolf FT (1959) The Production of Indole Acetic Acid by Taphrina deformans and Dibotryon morbosum. Physiologia Plantarum, 12: 526–533. doi: 10.1111/j.1399-3054.1959.tb07974.x
Fu J and Wang S (2011) Insights into auxin signaling in plant–pathogen interactions. Frontiers in Plant Science 2: 74. doi: 10.3389/fpls.2011.00074
Goldy C, Svetaz LA, Bustamante CA, et al. (2017) Comparative proteomic and metabolomic studies between Prunus persica genotypes resistant and susceptible to Taphrina deformans suggest a molecular basis of resistance. Plant Physiology and Biochemistry 118: 245-255. doi: 10.1016/j.plaphy.2017.06.022
Goodman RN, Király Z, Wood KR (1986) Physiological plant pathology the biochemistry and physiology of plant disease. University of Missouri Press. (xii + 433 pages). doi: 10.1016/0968-0004(87)90136-8
Hayat S, Hayat Q, Alyemeni MN, Wani AS, Pitchel J, Ahmad A (2012) Role of proline under changing environments. Plant Signaling & Behavior 7(11): 1456–1466. doi: 10.4161/psb.21949
Huang L, Zhensheng K, Zhiping L (1993) Light and electron microscopy observation of leaf curl disease of peach caused by Taphrina deformans. Plant Diseases 21: 29-32. Link
Koleva-Valkova L, Piperkova N, Petrov V, Vassilev A (2017) Biochemical Responses of Peach Leaves Infected with Taphrina deformans Berk/Tul. Acta Univ. Agric. Silvic. Mendelianae Brun. 65: 871-878. doi: 10.11118/actaun201765030871
Marte M, Gargiulo AM (1972) Electron microscopy of Peach leaves infected by Taphrina deformans (Berk.) Tul. Phytopathologia Mediterranea 11: 166-179. www.jstor.org/stable/42684144
Nicolae M, Mitrea R (2009) Physiological modifications in Prunus persica as a result of the attack produced by Taphrina deformans. Analele Universitatii din Craiova – Biologie, Horticultura, Tehnologia Prelucrarii Produselor Agricole, Ingineria Mediului. 14: 517-522. ISSN : 1453-1275
Olgun M, Kumlay A, Adiguzel MC, Calgar A (2008) The effect of waterlogging in wheat (T. aestivum L.). Acta Agriculturae Scandinavica 58(3): 193-198. doi: 10.1080/09064710701794024
Perley JE, Stowe BB (1996) On the Ability of Taphrina deformans to Produce Indoleacetic Acid from Tryptophan by Way of Tryptamine. Plant Physiology 4(2): 234-237. doi: 10.1104/pp.41.2.234
Piperkova N, Vasilev A (2000) Physiological state and photosynthetic activity of infected by Taphrina deformans (Berk.) Tul. peach leaves. Rastenievadni nauki. 37: 501-508. Link
Raggy V (1966) Fotosintesi in piante di Pesco colpite da Taphrina deformans /Berk./ Tul. Riv. Pat. Veg. 4: 23-29.
Raggy V (1967) Changes in peach trees (cv. Red Haven) attacked by Taphrina deformans, with particular reference to nitrogen metabolism in infected and non-infected leaves. Can. J. Bot., 45(4): 459-477.
Raggi V (1987) Water relations in Peach leaves infected by Taphrina deformans (Peach leaf curl)—diffusive resistance, total transpiration and water potential. Physiological and Molecular Plant Pathology 30(1): 109-120. doi: 10.1016/0885-5765(87)90086-5
Svetaz LA, Bustamante CA, Goldy C, et al. (2017) Unravelling early events in the Taphrina deformans–Prunus persica interaction: an insight into the differential responses in resistant and susceptible genotypes. Plant, Cell & Environment 40: 1456–1473. doi: 10.1111/pce.12942
Syrop M (1975) Leaf curl disease of Almond caused by Taphrina deformans (Berk.) Tul. Protoplasma 85(1): 57-69. doi: 10.1007/BF01567758
Sziraki I, Balazs E, Kiraly Z (1975) Increased levels of cytokinin and indoleacetic acid in peach leaves infected with Taphrina deformans. Physiological Plant Pathology 5: 45-50. doi: 10.1016/0048-4059(75)90069-7
Tavares S, Inácio J, Fonseca, et al. (2004) Direct detection of Taphrina deformans on peach trees using molecular methods. European Journal of Plant Pathology 110(10): 973-982. doi: 10.1007/s10658-004-4844-7
Tsai IJ, Tanaka E, Masuya H, et al. (2014) Comparative genomics of Taphrina fungi causing varying degrees of tumorous deformity in plants. Genome Biology and Evolution 6(4): 861-872. doi: 10.1093/gbe/evu067
Yamada T, Tsukamato H, Shirasaishi T, et al. (1990) Detection of indoleacetic acid biosynthesis in some species of Taphrina causing hyperplastic diseases in Plants. Annals of the Phytopathological Society of Japan 56(4): 532-540. Link