.
Condición fitosanitaria: Presente
Grupo de cultivos: Cereales
Rango de hospedantes: Los hospedantes incluyen cebada, trigo, centeno y especies de malezas y pastos (Jones y Clifford, 1983). El trigo y la cebada son los hospedantes económicamente más importantes (Murray et al., 1998).
Especie hospedante: Cebada (Hordeum vulgare; Hordeum vulgare var. distichon (L.) Hook.f., 1896)
Epidemiología: policíclica, subaguda.
Etiología: Hongo. Hemibiotrófico
Agente causal: Bipolaris sorokiniana (Sorokin) Shoemaker, 1959 (Syn. Helminthosporium sativum H. sorokiniana) (teleomorfo Cochliobolus sativus)
Taxonomía: Eukaryota > Fungi > Dikarya > Ascomycota > Pezizomycotina > Dothideomycetes > Pleosporales > Pleosporaceae > Bipolaris
.
.
.
Síntomas
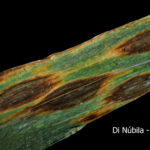
Produce lesiones en coleoptiles, plúmulas, hojas y vainas. Las lesiones son marrones sin contornos definidos (borrosa), de forma oval o redondeadas (elípticas), circundadas por un halo de tejido amarillento. A veces con centro claro y borde pardo-oscuro. También puede atacar espigas, causando necrosis de los frutos (cariópside). En el caso de infecciones intensas se puede observar oscurecimiento total o parcial (punta negra) de los granos.
.
Daños
En países tales como Brasil y Uruguay es una de las principales enfermedades que atacan los cultivos de cebada, con daños de hasta el 30-40%, afectando además la calidad maltera de los granos. Esta enfermedad puede aparecer en cultivares muy susceptibles desde plántula en adelante. Frecuentemente se la observa desde encañazón, y las muestras de semilla presentan infección por este patógeno. Durante los últimos años la frecuencia e incidencia de la mancha borrosa a campo se incrementaron en las regiones más calurosas. A medida que la frontera agrícola de cebada avanzó hacia esas regiones, el riesgo aumentó debido a las mayores temperaturas.
.
Epidemiología
Las principales fuentes de inóculo son las semillas infectadas, el rastrojo y los conidios libres en reposo en el suelo. Los dos primeros son las más importantes. El viento puede transportar los conidios sólo a cortas distancias por tratarse de esporas grandes y pesadas. La diseminación a grandes distancias es a través de la semilla infectada. Para la infección foliar se requieren temperaturas de 20-25ºC y más de 15 horas de mojado. El patrón de distribución en el lote es generalizado y uniforme.
.
Factores de riesgo
* La siembra de semillas infectadas introduce la enfermedad en campos nuevos o bajo rotación
* El monocultivo asegura la presencia indefinida del patógeno en el cultivo. Resulta más grave cuando se trata de siembra directa.
* Temperaturas de 20-25ºC y humedad relativa elevada en el ciclo de cultivo.
.
Medidas preferenciales de manejo (económicas y antes de la siembra):
* Uso de semilla sana
* Tratamiento eficiente de semillas con fungicidas
* Rotación de cultivos
* Ambas deben ser llevadas a cabo complementariamente.
.
Otras:
* Resistencia varietal
* Aplicación de fungicidas foliares cuando se alcance el UDE
* Eliminación de plantas guachas
.
- 01 Conidios de Bipolaris sorokiniana sobre semilla de cebada
- 02 Conidios de Bipolaris sorokiniana sobre semilla de cebada
- 03 Conidios de Bipolaris sorokiniana
- Colonia de B. sorokiniana creciendo en APG.
- Conidio de B. sorokiniana
- Conidios de B. sorokiniana
- Mancha ocular causada por B. Sorokiniana
- Planta de cebada inoculada con B. sorokiniana
- Planta de cebada inoculada con B. sorokiniana
- Planta de cebada inoculada con B. sorokiniana
- Planta de cebada inoculada con B. sorokiniana
- Planta de cebada inoculada con B. sorokiniana
- Planta de cebada inoculada con B. sorokiniana
- Abundante esporulación de B. sorokiniana sobre hoja de cebada
- 01 Síntomas foliares en plantas de cebada variedad Shakira inoculadas con Bipolaris sorokiniana.
- 02 Síntomas foliares en plantas de cebada variedad Shakira inoculadas con Bipolaris sorokiniana.
- 03 Síntomas foliares en plantas de cebada variedad Shakira inoculadas con Bipolaris sorokiniana.
- 04 Síntomas foliares en plantas de cebada variedad Shakira inoculadas con Bipolaris sorokiniana.
- 05 Síntomas foliares en plantas de cebada variedad Shakira inoculadas con Bipolaris sorokiniana.
- 06 Síntomas foliares en plantas de cebada variedad Shakira inoculadas con Bipolaris sorokiniana.
- 07 Síntomas foliares en plantas de cebada variedad Shakira inoculadas con Bipolaris sorokiniana.
- 08 Síntomas foliares en plantas de cebada variedad Shakira inoculadas con Bipolaris sorokiniana.
- 09 Síntomas foliares en plantas de cebada variedad Shakira inoculadas con Bipolaris sorokiniana.
- 10 Síntomas foliares en plantas de cebada variedad Shakira inoculadas con Bipolaris sorokiniana.
- 11 Síntomas foliares en plantas de cebada variedad Shakira inoculadas con Bipolaris sorokiniana.
.
.
.
Bibliografía
Aboukhaddour R, Hafez Abdel-Fattah M, McDonald M, et al. (2023) A revised nomenclature for ToxA haplotypes across multiple fungal species. Phytopathology. doi: 10.1094/PHYTO-01-23-0017-SC
Agostinetto L, Trezzi Casa R, Bogo A, et al. (2015) Barley spot blotch intensity, damage, and control response to foliar fungicide application in southern Brazil. Crop Protection 67: 7-12. doi: 10.1016/j.cropro.2014.09.012
Al-Sadi AM (2021) Bipolaris sorokiniana-Induced Black Point, Common Root Rot, and Spot Blotch Diseases of Wheat: A Review. Front. Cell. Infect. Microbiol. 11: 584899. doi: 10.3389/fcimb.2021.584899
MA (2021) Sensitivity of Bipolaris sorokiniana to strobilurin, triazole, and carboxamide premixes. Archives of Phytopathology and Plant Protection 54: 1764-1777. doi: 10.1080/03235408.2021.1938920
Duczek LJ, Sutherland KA, Reed SL, et al. (1999) Survival of leaf spot pathogens on crop residues of wheat and barley in Saskatchewan. Canadian Journal of Plant Pathology 21: 165-173. doi: 10.1080/07060669909501208
Dutbayev Y, Kuldybayev N, Daugaliyeva S, et al. (2022) Occurrence of Spot Blotch in Spring Barley Caused by Bipolaris sorokiniana Shoem. in South-Eastern Kazakhstan. Scientific World Journal. 2022: 3602996. doi: 10.1155/2022/3602996
Friesen TL, Faris JD, Solomon PS, Oliver RP (2008) Host-specific toxins: effectors of necrotrophic pathogenicity. Cell Microbiol. 10(7): 1421-8. doi: 10.1111/j.1462-5822.2008.01153.x
Holz TM, Dorneles KR, Brunetto AE (2022) Effect of silicon and fungicide on photosynthetic responses in barley leaves challenged by Bipolaris sorokiniana. Physiological and Molecular Plant Pathology 120: 101849. doi: 10.1016/j.pmpp.2022.101849
Hückelhoven R, Kogel K-H (1998) Tissue-specific superoxide generation at interaction sites in resistant and susceptible near-isogenic barley lines attacked by the powdery mildew fungus (Erysiphe graminis f. sp. hordei). Mol. Plant–Microbe Interact. 11: 292–300. doi: 10.1094/MPMI.1998.11.4.292
Jones DG, Clifford BC (1983) Cereal diseases, their pathology and control. John Wiley & Sons Ltd.
Kervinen T, Peltonen S, Teeri TH, Karjalainen R (1998) Differential expression of phenylalanine ammonia-lyase genes in barley induced by fungal infection or elicitors. New Phytologist 139: 293-300. doi: 10.1046/j.1469-8137.1998.00202.x
Kumar J, Hückelhoven R, Beckhove U, et al. (2001) A compromised Mlo pathway affects the response of barley to the necrotrophic fungus Bipolaris sorokiniana (teleomorph: Cochliobolus sativus). Phytopathology 91: 127–133. doi: 10.1094/PHYTO.2001.91.2.127
Kumar J, Schäfer P, Hückelhoven R, et al. (2002) Bipolaris sorokiniana, a cereal pathogen of global concern: cytological and molecular approaches towards better control. Molecular Plant Pathology 3: 185-195. doi: 10.1046/j.1364-3703.2002.00120.x
Leng Y, Zhong S (2015) The Role of Mitogen-Activated Protein (MAP) Kinase Signaling Components in the Fungal Development, Stress Response and Virulence of the Fungal Cereal Pathogen Bipolaris sorokiniana. PLoS ONE 10(5): e0128291. doi: 10.1371/journal.pone.0128291
Manamgoda DS, Rossman AY, Castlebury LA, et al. (2014) The genus Bipolaris. Studies in Mycology 79: 221-288. doi: 10.1016/j.simyco.2014.10.002
Matusinsky P, Frei P, Mikolasova R, et al. (2010) Species-specific detection of Bipolaris sorokiniana from wheat and barley tissues. Crop Protection 29(11): 1325-1330. doi: 10.1016/j.cropro.2010.07.013
McDonald MC, Ahren D, Simpfendorfer S, et al. (2017) The discovery of the virulence gene ToxA in the wheat and barley pathogen Bipolaris sorokiniana. Molecular Plant Pathology (in press). doi: 10.1111/mpp.12535
Murray TD, Parry DW, Cattlin ND (1998) A color handbook of diseases of small grain cereal crops. Iowa State University Press, Ames, Iowa.
Reis EM, Zanatta T, Danelli AD (2014) Effect of the concentration of inoculum and tensoactive on the efficiency of Bipolaris sorokiniana infection in wheat leaves. Summa Phytopathologica 40(2): 178-181, 2014. doi: 10.1590/0100-5405/1869
Rohringer R, Kim WK, Samborski DJ, Howes NK (1977) Calcofluor: An optical brightener for fluorescence microscopy of fungal parasites in leaves. Phytopathology 67: 808–810. doi: 10.1094/Phyto-67-808
Sharma S, Sahu R, Navathe S, et al. (2018) Natural Variation in Elicitation of Defense-Signaling Associates to Field Resistance Against the Spot Blotch Disease in Bread Wheat (Triticum aestivum L.). Frontiers in Plant Science 9:636. doi: 10.3389/fpls.2018.00636
Tan YP, Crous PW, Shivas RG (2016) Eight novel Bipolaris species identified from John L. Alcorn’s collections at the Queensland Plant Pathology Herbarium (BRIP). Mycological Progress 15: 1203. doi: 10.1007/s11557-016-1240-6
Walters DR, Avrova A, Bingham IJ, et al. (2012) Control of foliar diseases in barley: towards an integrated approach. Eur J Plant Pathol 133: 33–73. doi: 10.1007/s10658-012-9948-x
Zhao W, Chi YK, Ye MD, et al. (2021) Development and Application of Recombinase Polymerase Amplification Assay for Detection of Bipolaris sorokiniana. Crop Protection 105619. doi: 10.1016/j.cropro.2021.105619