.
Condición fitosanitaria: Presente ampliamente distribuida
Grupo de cultivos: Cereales
Especie hospedante: Maíz (Zea mays)
Rango de hospedantes: específico / estrecho. Infecta maíz y también puede infectar los teosintes (grupo de gramíneas del género Zea que se encuentran en México, Guatemala y Nicaragua). Especies de teosintes:
Zea mays subsp. huehuetenangensis (Iltis & Doebley) Doebley, 1990
Zea mays subsp. parviglumis Iltis & Doebley, 1980
Zea luxurians (Durieu & Asch.) R.M.Bird, 1978
Zea perennis (Hitchc.) Reeves & Mangelsd., 1942
Zea mays subsp. mexicana (Schrad.) Iltis, 1971
Zea diploperennis Iltis, Doebley & R.Guzman, 1979
.
Epidemiología: monocíclica, subaguda.
Etiología: Hongo. Biotrófico
Agente causal: Ustilago maydis (DC.) Corda (anteriormente conocido como U. zeae)
Taxonomía: Eukaryota > Fungi > Dikarya > Basidiomycota > Ustilaginomycotina > Ustilaginomycetes > Ustilaginales > Ustilaginaceae > Ustilago
.
.
.
Antecedentes
Puede ocurrir en todas las regiones pero puede ser mas grave en climas húmedos y templados.
.
Daños e importancia económica
La enfermedad causa daños más graves en plantas jóvenes, en activo crecimiento y puede producir enanismo o la muerte de las mismas. Los daños en híbridos susceptibles pueden ser muy significativos. Algunos trabajos correlacionan el tamaño de la agalla con el daño, agallas menores a 5 cm de diámetro reducirían el rendimiento aproximadamente en un 9%, agallas de 5 a 7,6 cm de diámetro, 14% y agallas mayores a 7,6 cm de diámetro podrían provocar casi el 40% de daños (Reis y Casa, 1996).
.
- Autor: Claire Cooke
.
Síntomas
Todos los tejidos de la parte aérea son susceptibles durante el crecimiento vegetativo. El hongo ataca las mazorcas, los tallos, las hojas y las espigas. El síntoma más evidente del carbón común del maíz es el desarrollo de “gajos”, tumores globosos e irregulares también llamados soros, principalmente en las espigas y ocasionalmente en las hojas. Las agallas están constituidas por un crecimiento exagerado del número y/o tamaño de las células por hiperplasia e hipertrofia. Estas agallas blancas cerradas muy conspicuas sustituyen a los granos individuales. No obstante, el meristema apical de las plántulas puede ser infectado cuando las plantas son todavía jóvenes. En este caso, los gajos se desarrollan debajo de la superficie del suelo. Los gajos se forman solamente a partir de la infección de tejidos meristemáticos. En el inicio de su formación, los gajos son blancos y brillantes o blancas-grisáceas cerradas, muy conspicuas. Su interior consiste de tejido blanco suave mostrando estrías negras como resultado inicial de la formación de las teliosporas. En la medida que el hospedante madura, el gajo interno se transforma en una masa negra pulverulenta de teliosporas. Bajo condiciones de rápida maduración celular, la formación de gajos es parcialmente paralizada permaneciendo pequeñas, duras y formando pocas teliosporas. La enfermedad causa daños mas graves en plantas jóvenes en estado activo de crecimiento y puede causarles enanismo o matarlas.
.
- Autor: Dr. Rubén Rellán-Álvarez, College of Agriculture & Life Sciences at NC State University
.
Diagnóstico
Esta enfermedad es de fácil diagnóstico y el síntoma más evidente es el desarrollo de “ampollas, tumores o agallas”, principalmente en las espigas y ocasionalmente en las hojas u otros órganos
.
Características del patógeno
Aunque U. maydis es un patógeno vegetal biotrófico, puede cultivarse fácilmente en condiciones axénicas para producir un inóculo estandarizado. Para realizar pruebas de patogenicidad, las infecciones pueden llevarse a cabo en condiciones de laboratorio mediante la inoculación con jeringa en todos los órganos aéreos del maíz (Redkar y Doehlemann, 2016).
.
- Autor: Seth Murray
.
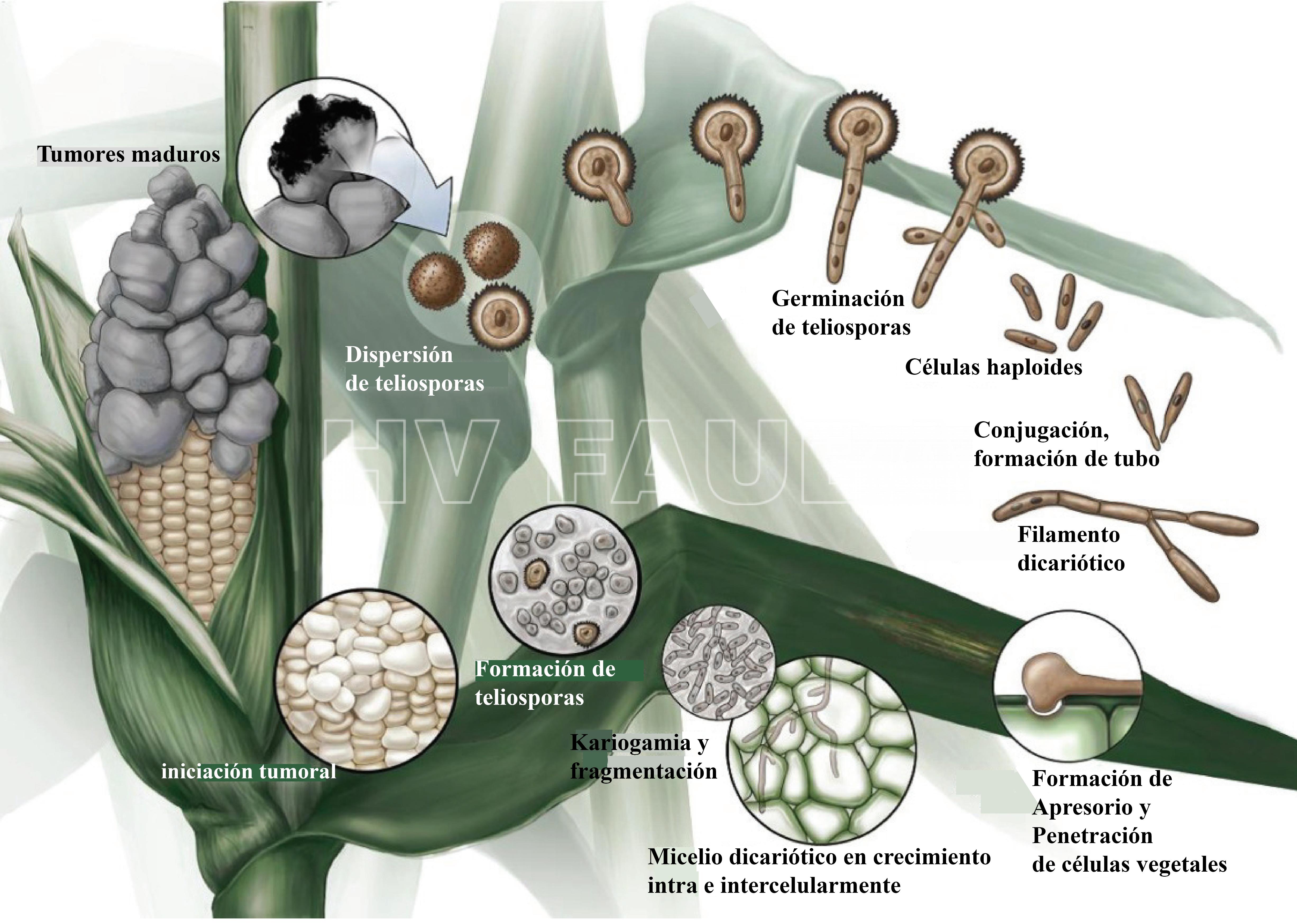
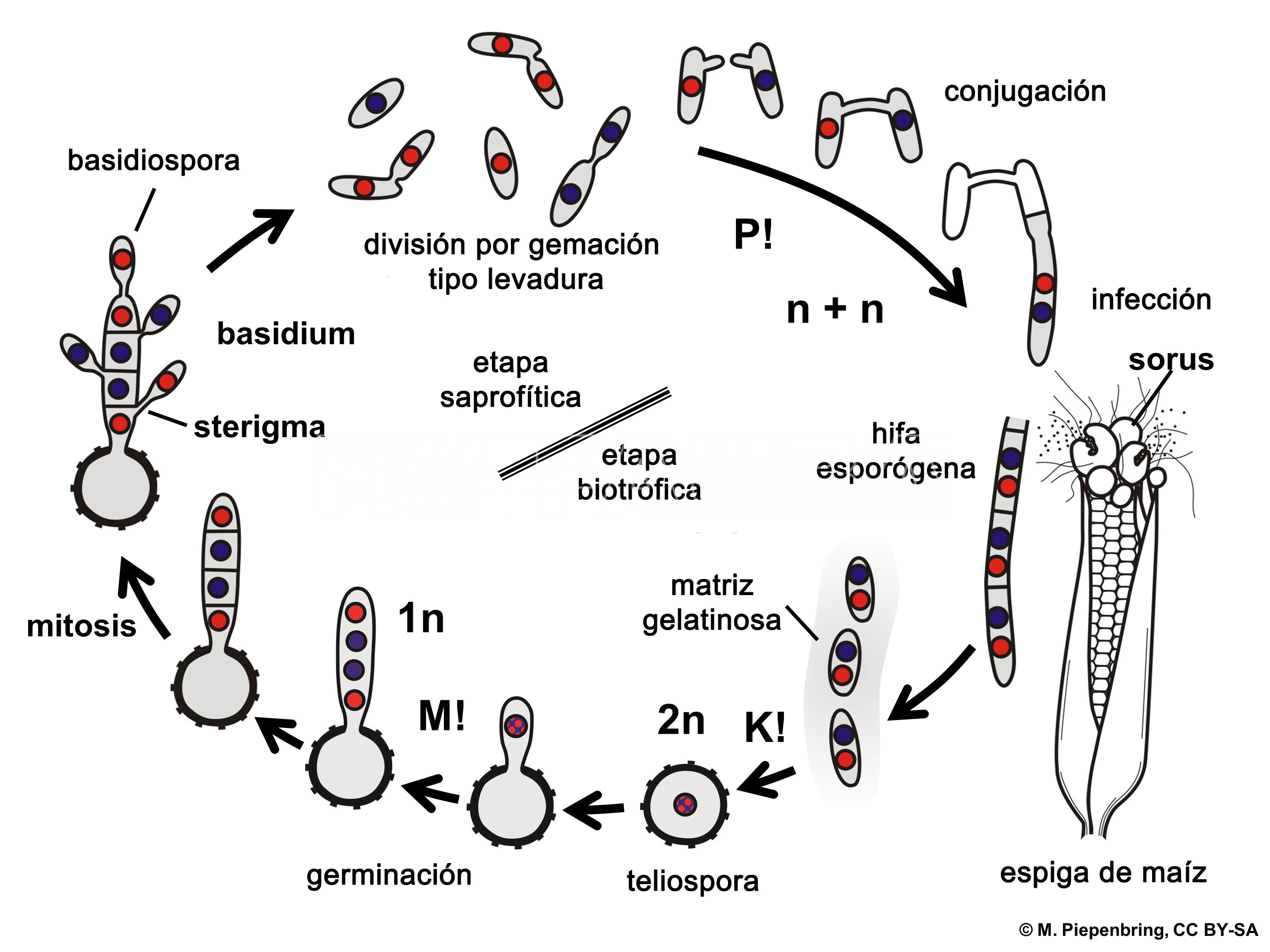
El ciclo de vida de U. maydis incluye tres etapas distintas
Durante su ciclo de vida, U. maydis muestra tres tipos de células diferentes: (i) una forma saprofítica, unicelular, haploide, similar a la levadura que se divide por gemación, (ii) una forma filamentosa (hifal), dicariótica, patógena, el producto de apareamiento de células haploides sexualmente compatibles que invaden la planta hospedante e inducen la formación de tumores (soros), y (iii) una espora diploide, la teliospora, formada dentro de los tumores que germina fuera del hospedante y sufre meiosis para producir basidios septados (fragmobasidia) a partir de los cuales nacen las basidiosporas haploides (Cabrera-Ponce et al., 2012).
Las teliosporas diploides se forman en agallas o tumores (en las espigas, cuando el hongo reemplaza los granos por masas de teliosporas) en hospedantes infectados y son los propágulos de hibernación del hongo (supervivencia). Es decir, sobrevive al invierno como teliosporas diploides en el rastrojo o sobre el suelo (las teliosporas pueden sobrevivir por varios años). Cuando una teliospora germina forma un promicelio septado, sufre meiosis y forma basidiosporas (también llamadas esporidios) que generalmente tienen un solo núcleo (haploides). Los esporidios haploides se mantienen fácilmente en cultivos que muchos consideran la etapa saprófita del hongo. Bajo condiciones ambientales apropiadas, los esporidios (basidiosporas) genéticamente compatibles se aparean y forman hifas de infección dicarióticas. Las células en esta tercera etapa son patógenas y pueden infectar el maíz. Cualquier tejido meristemático, en activo crecimiento puede ser infectado sobre el suelo.
A nivel celular en las anteras de maíz, U. maydis solo puede colonizar las células de anteras inmaduras aún no diferenciadas, que retienen la actividad meristemática (Gao et al., 2013). U. maydis «toma el control» de esta etapa de la célula primordial para reprogramar el destino celular hacia la formación de tumores en las anteras del maíz. En este órgano, activa la vía tumoral solo redirigiendo la proliferación celular intrínseca, sin actividad oncogénica. Después de 2 días de la infección (dpi), el hongo invade las células subepidérmicas para alterar los eventos de especificación del destino celular, los patrones de división celular en curso y la expansión celular según la etapa de desarrollo anterior y el tipo de célula. La formación de tumores en las anteras de maíz es el resultado de divisiones periclinales ectópicas dirigidas por el hongo en las células somáticas de las anteras, que inicialmente generan una capa celular adicional que da como resultado la alteración de la arquitectura del lóbulo de la antera. Las divisiones anticlinales y periclinales adicionales más frecuentes se observan en la capa media de las anteras infectadas. Las células de esta capa media suelen sufrir sólo unas pocas divisiones anticlinales antes de la muerte celular programada. Por lo tanto, en los tejidos florales masculinos del maíz, U. maydis reprograma el destino celular de las células de la capa media pero no actúa como un potente inductor general de la división celular (Gao et al., 2013).
Por el contrario, los tumores de las hojas son el resultado de un fenómeno diferente (Lin et al., 2021). El desarrollo de la hoja de maíz representa un gradiente lineal de división celular en el que la mayoría de las divisiones celulares ocurren en una zona estrecha en la base de la hoja adyacente a la lígula (Li et al., 2010). Las infecciones por U. maydis resultan de la división celular abundante y rápida en las células de las hojas subepidérmicas que ya están diferenciadas. La formación de tumores inducida por U. maydis en las hojas se inicia a nivel celular alrededor de 4 dpi y requiere la presencia local de hifas del hongo en la zona de desarrollo del tumor (Banuett y Herskowitz, 1996; Redkar et al., 2015). La formación de tumores foliares va acompañada de agrandamiento celular y división celular (Callow y Ling, 1973; Banuett y Herskowitz, 1996). Se observó que las células vegetales aumentan de tamaño con la maduración del tumor y las células fúngicas proliferan en esta zona y forman agregados rodeados por una capa mucilaginosa más grande que las células vegetales vecinas (Snetselaar y Mims, 1994; Banuett y Herskowitz, 1996; Doehlemann et al., 2008; Tollot et al., 2016). Aún no se tiene un conocimiento completo y exacto sobre cómo cambia el tejido de la hoja a nivel celular, así como el conocimiento del origen celular de las células tumorales.
..
- Ciclo de vida de Ustilago maydis. En este diagrama, la meiosis comienza poco después de la cariogamia, se detiene en el paquiteno (tercera subfase de la profase I en la meiosis) durante la dispersión de las teliosporas y la meiosis se reanuda durante la germinación de las teliosporas. Autor: Saville et al., 2012.
- Esquema representando el ciclo de vida de Ustilago maydis, agente causal del carbón del maíz. P! = plasmogamia; K! = kariogamia; M! = meiosis; n+ n = células dicarióticas; 1n = células haploides; 2n = células diploides.
.
Epidemiología
La mayoría de las agallas libera la mayor cantidad de teliosporas cuando el hospedante comienza su madurez. Las teliosporas, de paredes gruesas y pigmentadas pueden sobrevivir en el suelo aproximadamente 4 años y las infecciones pueden originarse a partir del inóculo en el suelo o rastrojos o a partir de teliosporas diseminadas por el viento. Se considera que las infecciones anuales resultan del inóculo que sobrevive de la estación previa. Esta enfermedad es prácticamente monocíclica, ya que al liberar las teliosporas al final del ciclo, la infección secundaria es nula o muy limitada. El incremento de siembras de segunda o tardías (fines de noviembre o diciembre) en algunas regiones maiceras de Argentina, permitiría que el inóculo proveniente de maíces de siembra de septiembre-octubre, afecte a estos cultivos en pleno crecimiento.
A veces el ganado puede ser útil en la dispersión del patógeno al alimentarse de rastrojo infestado y si bien es un patógeno que puede sobrevivir ocasionalmente sobre los granos, no se transmite por las semillas.
La infección puede ocurrir por penetración directa con formación de apresorio (Fernández-Alvarez et al., 2009; Castanheira y Pérez-Martín, 2015), por estomas y por heridas producidas por vientos fuertes, granizo, insectos u otros daños mecánicos (pulverizadoras terrestres) y por órganos florales.
La enfermedad es favorecida por ambiente seco y temperaturas entre 27 y 34°C y el stress hídrico incrementa la incidencia de la enfermedad. Años más secos podrían correlacionarse con mayor número de heridas e infección de meristemas. La ocurrencia de una polinización deficiente en períodos secos durante la aparición de estigmas (“barbas”) puede favorecer la infección porque los éstos aparecen susceptibles y receptivos por largos períodos.
Respecto a la nutrición, la fertilización nitrogenada se correlaciona positivamente con el incremento de la enfermedad por ser un organismo biotrófico y a mayores dosis de N aumenta la intensidad del ataque; contrariamente, con la aplicación de K se logra una disminución significativa de la enfermedad (Kostandi & Soliman, 1997) y podría suceder lo mismo con aplicaciones de Zn. Cuando los suelos presentan déficit de P, la aplicación de este macronutriente podría disminuir las podredrumbes de raíces y el carbón común (Huber & Graham, 1999; Dordas, 2008, Carmona y Sautua, 2011).
.
- Autor: Ed Sikora
- Autor: Madison Cartwright
- Autor: Madison Cartwright
- Autor: Madison Cartwright
- Autor: Madison Cartwright
.
Manejo de la enfermedad
* Uso de híbridos resistentes o tolerantes. No existen líneas de maíz inmunes a la infección por U. maydis. Las líneas de maíces dulces tienden a ser más susceptibles al carbón común que los otros maíces.
* Tratamiento de semilla con fungicidas (protección solamente en las primeras semanas).
* Mantener una fertilización balanceada y aplicar K, P y/o Zn en suelos deficientes.
* Controlar los insectos para reducir la ocurrencia de heridas.
* Minimizar los daños mecánicos.
* El riego reduce la enfermedad por que se mejora la condición hídrica del suelo.
* Las rotaciones no son efectivas, porque las teliosporas permanecen viables por muchos años en el suelo.
* Los fungicidas de aplicación foliar no dan resultados adecuados.
.
.
- Autor: Dirceu Gassen
- Autor: Dirceu Gassen
- Autor: Dirceu Gassen
- Autor: Dirceu Gassen
- Autor: Dirceu Gassen
- Autor: Dirceu Gassen
- Autor: Dirceu Gassen
- Autor: Dirceu Gassen
- Autor: Dirceu Gassen
- Autor: Dirceu Gassen
- Autor: Dirceu Gassen
- Autor: Dirceu Gassen
- Autor: Dirceu Gassen
- Autor: Claire Cooke
- 02 Gajo del Carbón de la espiga del maíz, causado por Ustilago maydis. Maryville, Missouri, Julio 2018. Autor: Ing. Mg. Francisco Sautua
- 03 Corte transversal de Gajo del Carbón de la espiga del maíz, con esporas de Ustilago maydis en formación. Maryville, Missouri, Julio 2018. Autor: Ing. Mg. Francisco Sautua
- 05 Corte transversal de Gajo del Carbón de la espiga del maíz, con esporas de Ustilago maydis en formación. Maryville, Missouri, Julio 2018. Autor: Ing. Mg. Francisco Sautua
- 07 Corte transversal de Gajo del Carbón de la espiga del maíz, con esporas de Ustilago maydis en formación. Maryville, Missouri, Julio 2018. Autor: Ing. Mg. Francisco Sautua
- 01 Síntomas del Carbón del maíz. Autores: Dra. Verónica Felipe, Ing. Francisco Sautua, Villa María, Córdoba, 2020.
- 02 Síntomas del Carbón del maíz. Autores: Dra. Verónica Felipe, Ing. Francisco Sautua, Villa María, Córdoba, 2020.
- 03 Síntomas del Carbón del maíz. Autores: Dra. Verónica Felipe, Ing. Francisco Sautua, Villa María, Córdoba, 2020.
- 04 Síntomas y Signo del Carbón del maíz. Autores: Dra. Verónica Felipe, Ing. Francisco Sautua, Villa María, Córdoba, 2020.
- Agallas Carbón maíz en Hoja Marzo 2019. Autor: Dra. Norma Formento
- Carbón del Maíz. Abril 2019. Autores: Norma Formento y Juan Carlos. Velazquez
- Carbón del maíz. Ustilago maydis Abril 2019. Autores: Norma Formento y Juan Carlos Velazquez.
- Carbón Maíz 11 febrero 2010 EEA Paraná. Autores: Norma Formento-JC Velazquez.
- Carbón Maíz de 1era. Enero de 2010. Autor: Dra. Norma Formento.
- Carbón Maíz en Hoja. Febrero 2020. EEA Paraná. Autor: Dra. Norma Formento
- Carbón Maíz, Venado Tuerto. 2012. Autores: Norma Formento- JC Velazquez.
- Carbón Maíz. Autores: Norma Formento – JC Velazquez
.
.
Bibliografía
Aguilar LR, Pardo JP, Lomelí MM, et al. (2017) Lipid droplets accumulation and other biochemical changes induced in the fungal pathogen Ustilago maydis under nitrogen-starvation. Archives of Microbiology 199(8): 1195–1209. doi: 10.1007/s00203-017-1388-8
Alfaro M, Oguiza JA, Ramírez L, Pisabarro AG (2014) Comparative analysis of secretomes in basidiomycete fungi. J Proteomics. 102: 28-43. doi: 10.1016/j.jprot.2014.03.001
Armijos-Jaramillo V, Espinosa N, Vizcaíno K, Santander-Gordón D (2021) A Novel In Silico Method for Molecular Mimicry Detection Finds a Formin with the Potential to Manipulate the Maize Cell Cytoskeleton. Mol Plant Microbe Interact. MPMI11200332R. doi: 10.1094/MPMI-11-20-0332-R
Banuett F, Herskowitz I (1988) Ustilago Maydis, Smut of Maize. Advances in Plant Pathology 6: 427-455. doi: 10.1016/B978-0-12-033706-4.50033-5
Begerow D, Stoll M, Bauer R (2006) A phylogenetic hypothesis of Ustilaginomycotina based on multiple gene analyses and morphological data. Mycologia 98(6): 906-16. doi: 10.1080/15572536.2006.11832620
Brefort T, Doehlemann G, Mendoza-Mendoza A, Reissmann S, Djamei A, Kahmann R (2009) Ustilago maydis as a Pathogen. Annual Review of Phytopathology 47: 423-445. doi: 10.1146/annurev-phyto-080508-081923
Cabrera-Ponce JL, León-Ramírez CG, Verver-Vargas A, Palma-Tirado L, Ruiz-Herrera J (2012) Metamorphosis of the Basidiomycota Ustilago maydis: transformation of yeast-like cells into basidiocarps. Fungal Genetics and Biology 49(10): 765–771. doi: 10.1016/j.fgb.2012.07.005
Castanheira S, Pérez-Martín J (2015) Appressorium formation in the corn smut fungus Ustilago maydis requires a G2 cell cycle arrest. Plant Signal Behav.10(4): e1001227. doi: 10.1080/15592324.2014.1001227. Erratum for: doi: 10.1242/dev.113415
Chavan S, Smith SM (2014) A rapid and efficient method for assessing pathogenicity of Ustilago maydis on maize and teosinte lines. J Vis Exp. (83): e50712. doi: 10.3791/50712
Cheung HYK, Donaldson ME, Storfie ERM, et al. (2021), Zfp1, a putative Zn(II)2Cys6 transcription factor, influences Ustilago maydis pathogenesis at multiple stages. Plant Pathology 70: 1626-1639. doi: 10.1111/ppa.13398
Depotter JRL, Zuo W, Hansen M, et al. (2021) Effectors with Different Gears: Divergence of Ustilago maydis Effector Genes Is Associated with Their Temporal Expression Pattern during Plant Infection. Journal of Fungi 7(1): 16. doi: 10.3390/jof7010016
Doebley J (2004) The genetics of maize evolution. Rev. Genet 38: 37-59. doi: 10.1146/annurev.genet.38.072902.092425
Doyle CE, Kitty Cheung HY, Spence KL, Saville BJ (2016) Unh1, an Ustilago maydis Ndt80-like protein, controls completion of tumor maturation, teliospore development, and meiosis. Fungal Genetics and Biology 94: 54‐68. doi: 10.1016/j.fgb.2016.07.006
Farquharson KL (2018) The Shifting Transcriptional Response of Corn Smut Fungus. The Plant Cell Advance Publication. doi: 10.1105/tpc.18.00094
Fernández-Alvarez A, Elías-Villalobos A, Ibeas JI (2009) The O-mannosyltransferase PMT4 is essential for normal appressorium formation and penetration in Ustilago maydis. Plant Cell 21(10): 3397-412. doi: 10.1105/tpc.109.065839
Gao L, Kelliher T, Nguyen L, Walbot V (2013) Ustilago maydis reprograms cell proliferation in maize anthers. Plant J 75: 903-914. doi: 10.1111/tpj.12270
Ghosh A (2015) Small heat shock proteins (HSP12, HSP20 and HSP30) play a role in Ustilago maydis pathogenesis. FEMS Microbiol Lett. 361(1): 17-24. doi: 10.1111/1574-6968.12605
Goulet KM, Saville BJ (2017) Carbon acquisition and metabolism changes during fungal biotrophic plant pathogenesis: insights from Ustilago maydis. Canadian Journal of Plant Pathology 39(3): 247-266. doi: 10.1080/07060661.2017.1354330
Guimarães SC, Kilaru S, Schrader M, Schuster M (2017) Labeling of Peroxisomes for Live Cell Imaging in the Filamentous Fungus Ustilago maydis. In: Schrader M. (eds) Peroxisomes. Methods in Molecular Biology, vol 1595. Humana Press, New York, NY. doi: 10.1007/978-1-4939-6937-1_13
Hussnaetter KP, Philipp M, Müntjes K, et al. (2021) Controlling Unconventional Secretion for Production of Heterologous Proteins in Ustilago maydis through Transcriptional Regulation and Chemical Inhibition of the Kinase Don3. Journal of Fungi 7(3): 179. 10.3390/jof7030179
Kämper J, Kahmann R, et al. (2006) Insights from the genome of the biotrophic fungal plant pathogen Ustilago maydis. Nature 444: 97-101. doi: 10.1038/nature05248
Kahmann R, Steinberg G, Basse C, et al. (2000) Ustilago maydis, the Causative Agent of Corn Smut Disease. In: Kronstad, J.W. (eds) Fungal Pathology. Springer, Dordrecht. doi: 10.1007/978-94-015-9546-9_12
Keon JPR, White GA, Hargreaves JA (1991) Isolation, characterization and sequence of a gene conferring resistance to the systemic fungicide carboxin from the maize smut pathogen, Ustilago maydis. Curr Genet 19: 475–481. doi: 10.1007/BF00312739
Kijpornyongpan T, Aime MC (2021) Comparative transcriptomics reveal different mechanisms for hyphal growth across four plant-associated dimorphic fungi. Fungal Genetics and Biology 152: 103565. doi: 10.1016/j.fgb.2021.103565
Klosterman SJ, Perlin MH, Garcia-Pedrajas M, et al. (2007) Genetics of morphogenesis and pathogenic development of Ustilago maydis. Adv Genet. 57: 1-47. doi: 10.1016/S0065-2660(06)57001-4
Kwon S, Rupp O, Brachmann A, et al. (2021) mRNA Inventory of Extracellular Vesicles from Ustilago maydis. Journal of Fungi 7(7):562. doi: 10.3390/jof7070562
La Greca M, Chen J-L, Schubert L, et al. (2022) The Photoreaction of the Proton-Pumping Rhodopsin 1 From the Maize Pathogenic Basidiomycete Ustilago maydis. Front. Mol. Biosci. 9: 826990. doi: 10.3389/fmolb.2022.826990
Lanver D, Tollot M, Schweizer G, et al. (2017) Ustilago maydis effectors and their impact on virulence. Nature Reviews Microbiology 15(7): 409-421. doi: 10.1038/nrmicro.2017.33
Lanver D, Müller AN, Happel P, et al. (2018) U. maydis transcriptome of biotrophic life cycle. The Plant Cell. doi: 10.1105/tpc.17.00764
Lanver D, Müller AN, Happel P, et al. (2018) The Biotrophic Development of Ustilago maydis Studied by RNA-Seq Analysis. Plant Cell. 30(2): 300-323. doi: 10.1105/tpc.17.00764
León-Ramírez CG, Sánchez-Arreguín JA, Ruiz-Herrera J (2014) Ustilago maydis, a Delicacy of the Aztec Cuisine and a Model for Research. Natural Resources 5. doi: 10.4236/nr.2014.56024
Li P, Ponnala L, Gandotra N, et al. (2010) The developmental dynamics of the maize leaf transcriptome. Nat Genet 42: 1060–1067. doi: 10.1038/ng.703
Lin J-S, Happel P, Kahmann R (2021) Nuclear status and leaf tumor formation in the Ustilago maydis–maize pathosystem. New Phytol 231: 399-415. doi: 10.1111/nph.17377
López-Martínez LX, Aguirre-Delgado A, Saenz-Hidalgo HK, et al. (2022) Bioactive ingredients of huitlacoche (Ustilago maydis), a potential food raw material. Food Chemistry: Molecular Sciences 4: 100076. doi: 10.1016/j.fochms.2022.100076
Ludwig N, Reissmann S, Schipper K, et al. (2021) A cell surface-exposed protein complex with an essential virulence function in Ustilago maydis. Nature Microbiology 6: 722–730. doi: 10.1038/s41564-021-00896-x
Ma LS, Wang L, Trippel C, Mendoza-Mendoza A, Ullmann S, Moretti M, Carsten A, Kahnt J, Reissmann S, Zechmann B, Bange G, Kahmann R (2018) The Ustilago maydis repetitive effector Rsp3 blocks the antifungal activity of mannose-binding maize proteins. Nature Communications 9, Article number: 1711. doi: 10.1038/s41467-018-04149-0
Marinelli A, Oddino C, Zuza M, Espósito G, Vinocur M, March G (2006) Incidencia del carbón común del maíz en el departamento de Río Cuarto – En: XII Jornadas Fitosanitarias Argentinas. Resúmenes. Página/s: 223.
Martinez-Soriano J, Avina-Padilla K (2009) Ustilago and the accidental domestication of maize. Nat Prec. doi: 10.1038/npre.2009.3240.1
Matei A, Ernst C, Günl M, Thiele B, Altmüller J, Walbot V, Usadel B, Doehlemann G (2018) How to make a tumour: cell type specific dissection of Ustilago maydis-induced tumour development in maize leaves. New Phytologist 217: 1681–1695. doi: 10.1111/nph.14960
, , , et al. (2023) Insight into the biochemical and cell biological function of an intrinsically unstructured heat shock protein, Hsp12 of Ustilago maydis. Molecular Plant Pathology 00: 1– 15. doi: 10.1111/mpp.13350
Moreno-Sánchez I, Pejenaute-Ochoa MD, Navarrete B, et al. (2021) Ustilago maydis Secreted Endo-Xylanases Are Involved in Fungal Filamentation and Proliferation on and Inside Plants. J Fungi (Basel) 7(12): 1081. doi: 10.3390/jof7121081
Navarrete F, Grujic N, Stirnberg A, Saado I, Aleksza D, Gallei M, et al. (2021) The Pleiades are a cluster of fungal effectors that inhibit host defenses. PLoS Pathog 17(6): e1009641. doi: 10.1371/journal.ppat.1009641
Navarrete F, Gallei M, Kornienko AE (2021) TOPLESS promotes plant immunity by repressing auxin signaling and is targeted by the fungal effector Naked1. Plant Communications 100269. doi: 10.1016/j.xplc.2021.100269
Ökmen B, Kemmerich B, Hilbig D, et al. (2018) Dual function of a secreted fungalysin metalloprotease in Ustilago maydis. New Phytologist. doi: 10.1111/nph.15265
Ökmen B, Jaeger E, Schilling L, et al. (2022) A conserved enzyme of smut fungi facilitates cell-to-cell extension in the plant bundle sheath. Nat Commun 13: 6003. doi: 10.1038/s41467-022-33815-7
Olicón-Hernández DR, Uribe-Alvarez C, Uribe-Carvajal S, et al. (2017) Response of Ustilago maydis against the Stress Caused by Three Polycationic Chitin Derivatives. Molecules 22(12): 1745. doi: 10.3390/molecules22121745
Paul JA, Wallen RM, Zhao C, et al. (2018) Coordinate regulation of Ustilago maydis ammonium transporters and genes involved in mating and pathogenicity. Fungal Biol. 122: 639–650. doi: 10.1016/j.funbio.2018.03.011
Pataky JK, Snetselaar KM (2006) Common smut of corn. The Plant Health Instructor. doi: 10.1094/PHI-I-2006-0927-01
Pérez Díaz MC, et al. (2017) Inducción de infección en Teosinte (Zea diploperennis) con el fitopatógeno Ustilago maydis. JONNPR.2017;2(1):1-40. doi: 10.19230/jonnpr.1154
Redkar A, Hoser R, Schilling L, et al. (2015) A Secreted Effector Protein of Ustilago maydis Guides Maize Leaf Cells to Form Tumors. The Plant Cell 27(4): 1332-1351. doi: 10.1105/tpc.114.131086
Redkar A, Hoser R, Schilling L, et al. (2015) A secreted effector protein of Ustilago maydis guides maize leaf cells to form tumors. Plant Cell 27: 1332–1351. doi: 10.1105/tpc.114.131086
Redkar A, Doehlemann G (2016) Ustilago maydis Virulence Assays in Maize. Bio-protocol 6(6): e1760. doi: 10.21769/BioProtoc.1760.
Redkar A, Matei A, Doehlemann G (2017) Insights into Host Cell Modulation and Induction of New Cells by the Corn Smut Ustilago maydis. Front. Plant Sci. 8: 899. doi: 10.3389/fpls.2017.00899
Redkar A, Di Pietro A (2018) Adapt your shuttling proteins for virulence: a lesson from the corn smut fungus Ustilago maydis. New Phytologist 220: 353-356. doi: 10.1111/nph.15429
Saado I, Chia KS, Betz R, et al. (2022) Effector-mediated relocalization of a maize lipoxygenase protein triggers susceptibility to Ustilago maydis. Plant Cell. 34(7): 2785-2805. doi: 10.1093/plcell/koac105
Saville BJ, Donaldson ME, Doyle CE (2012) Investigating Host Induced Meiosis in a Fungal Plant Pathogen, Meiosis – Molecular Mechanisms and Cytogenetic Diversity, Andrew Swan, IntechOpen. doi: 10.5772/30032
Schirawski J, Mannhaupt G, Münch K, et al. (2010) Pathogenicity determinants in smut fungi revealed by genome comparison. Science 330: 1546-8. doi: 10.1126/science.1195330
Schuster M, Schweizer G, Kahmann R (2018) Comparative analyses of secreted proteins in plant pathogenic smut fungi and related basidiomycetes. Fungal Genet Biol. 112: 21-30. doi: 10.1016/j.fgb.2016.12.003
Seitner D, Uhse S, Gallei M, Djamei A (2018) The Core Effector Cce1 is Required for Early Infection of Maize by Ustilago maydis. Molecular Plant Pathology. doi: 10.1111/mpp.12698
Snetselaar K, McCann M (2017) Ustilago maydis, the corn smut fungus, has an unusual diploid mitotic stage. Mycologia 109(1): 140-152. doi: 10.1080/00275514.2016.1274597
Soto DM, Ruiz-Herrera J (2016) Infection of Zea mays by Haploid Strains of Ustilago maydis. Fungal Genomics & Biology 6:141. doi: 10.4172/2165-8056.1000141
Tollot M, Assmann D, Becker C, et al. (2016) The WOPR protein Ros1 is a master regulator of sporogenesis and late effector gene expression in the maize pathogen Ustilago maydis. PLoS Pathog 12: e1005697. doi: 10.1371/journal.ppat.1005697
Ullmann L, Wibberg D, Busche T, et al. (2022) Seventeen Ustilaginaceae High-Quality Genome Sequences Allow Phylogenomic Analysis and Provide Insights into Secondary Metabolite Synthesis. J Fungi (Basel) 8(3): 269. doi: 10.3390/jof8030269
Van Der Linde K, Timofejeva L, Egger RL, et al. (2018) Pathogen Trojan horse delivers bioactive host protein to alter maize (Zea mays) anther cell behavior in situ. The Plant Cell (in press). doi: 10.1105/tpc.17.00238
Vijayakrishnapillai LMK, Desmarais JS, Groeschen MN, Perlin MH (2018) Deletion of ptn1, a PTEN/TEP1 Orthologue, in Ustilago maydis Reduces Pathogenicity and Teliospore Development. J Fungi (Basel). 5(1): 1. doi: 10.3390/jof5010001
Xia W, Yu X, Ye Z (2020) Smut fungal strategies for the successful infection. Microbial Pathogenesis 142: 104039. doi: 10.1016/j.micpath.2020.104039
, , , (2023) Progress in pathogenesis research of Ustilago maydis, and the metabolites involved along with their biosynthesis. Molecular Plant Pathology 00: 1– 15. doi: 10.1111/mpp.13307
Zuo W, Ökmen B, Depotter JRL, et al. (2019) Molecular Interactions Between Smut Fungi and Their Host Plants. Annual Review of Phytopathology 57: 411-430. doi: 10.1146/annurev-phyto-082718-100139
Zuo W, Depotter JRL, Gupta DK, et al. (2021), Cross-species analysis between the maize smut fungi Ustilago maydis and Sporisorium reilianum highlights the role of transcriptional change of effector orthologs for virulence and disease. New Phytol, 232: 719-733. doi: https://doi.org/10.1111/nph.17625
Zuo W, Depotter JRL, Stolze SC, et al. (2023) A transcriptional activator effector of Ustilago maydis regulates hyperplasia in maize during pathogen-induced tumor formation. bioRxiv 2023.03.06.531288. doi: 10.1101/2023.03.06.531288