.
Condición fitosanitaria: Presente
Grupo de cultivos: Cereales
Especie hospedante: Cebada (Hordeum vulgare; Hordeum vulgare var. distichon (L.) Hook.f., 1896)
Rango de hospedantes: Rhynchosporium incluye varias especies que causan escaldaduras de las hojas en hospedantes cereales y gramíneas, y expresan un alto nivel de especificidad por su hospedante: R. graminicola (infecta Hordeum glaucum, H. leporinum, H. murinum, H. spontaneum, H. vulgare y Bromus diandrus), R. agropyri (Elymus caninus y E. repens) y R. secalis (Secale cereale y × Triticosecale) (King et al., 2013).
Etiología: Hongo. Necrotrófico
Agente causal:
Rhynchosporium secalis (Oudem.) J.J. Davis
Rhynchosporium commune Zaffarano et al., 2011
Rhynchosporium graminicola Heinsen, 1897 (propuesto, Crous et al. 2021)
.
Taxonomía: Fungi > Dikarya > Ascomycota > Pezizomycotina > Leotiomycetes > Helotiales > Helotiales incertae sedis > Rhynchosporium
.
.
Rhynchosporium agropyri, R. graminicola y R. secalis están filogenéticamente muy estrechamente relacionadas. La especie se puede distinguir hasta cierto punto en función de la secuencia del ITS.
.
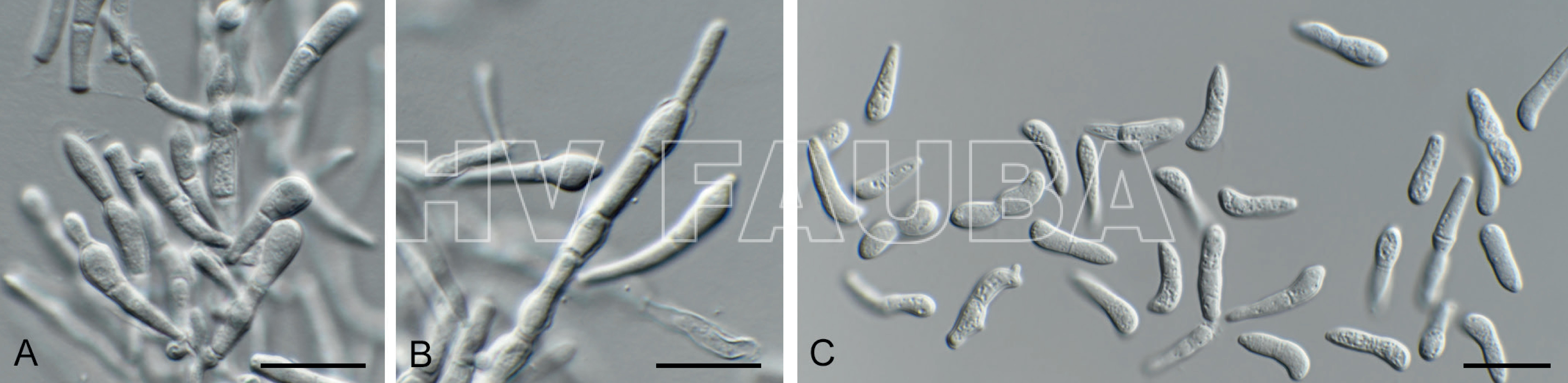
- Rhynchosporium secalis. (A, B) Hifas con células conidiógenas que dan lugar a conidios. (C) Conidios. Barras de escala = 10 µm. Autor: Crous et al., 2021
- Rhynchosporium graminicola. (A) Síntomas de la enfermedad en Hordeum vulgaris. (B – D) Hifas con grupos de células conidiógenas que dan lugar a conidios. (E) Conidio. (F – I). (F – H) Hifas con células conidiógenas que dan lugar a conidios. (I) Conidios. (J – M). (J – L) Hifas con células conidiógenas que dan lugar a conidios. (M) Conidio. (N – R). (N – Q) Hifas con células conidiógenas que dan lugar a conidios. (R) Conidio. Barras de escala = 10 µm. Autor: Crous et al., 2021.
.
.
.
Daños
En nuestro país esta enfermedad puede causar daños de hasta 10-15% aunque su presencia está limitada al sur de la región pampeana y casi exclusivamente hasta encañazón. Sin embargo, en años fríos y en variedades susceptibles la escaldadura puede crecer hasta la hoja bandera.
.
Síntomas
Las lesiones son típicamente elongadas, de centro grisáceo, blanco o pálido y con bordes pardos frecuentemente ondulados. Las lesiones jóvenes tienen apariencia húmeda de color verde-azulado. En nuestro país aparecen principalmente en las vainas y en las hojas inferiores durante el macollaje.
.
- Autor: Field Crop Diseases Victoria, Australia
- Autor: Field Crop Diseases Victoria, Australia
- Autor: Field Crop Diseases Victoria, Australia
.
.
Epidemiología
Esta enfermedad es muy importante en regiones de climas fríos a templados como Chile, y región pampeana sur de Argentina. Ocurre en regiones húmedas y frescas. Requiere temperaturas de 10-18Cº, alta humedad relativa y lluvias. Aparece desde inicios hasta el final del macollaje, dado que con el aumento de temperatura (por encima de 20 -25 ºC), la enfermedad detiene su desarrollo. Si bien Rhynchosporium secalis es patógeno de semilla, la principal fuente de inóculo para nuestro país es el rastrojo infectado. Otra fuente de inóculo importante lo constituyen las malezas susceptibles. En Argentina se detectó la enfermedad sobre Lolium sp. (rye grass) y Hordeum leporinum. El transporte del inóculo se produce por salpicaduras de gotas de lluvia llevados por el viento a corta distancia. La diseminación a grandes distancias ocurre a través de semillas infectadas. El patrón de distribución en el lote puede ser generalizado y uniforme o en manchones, según el salpicado de lluvia y la cercanía a ciertas malezas enfermas.
.
Factores de riesgo
* La siembra de semillas infectadas introduce la enfermedad en campos nuevos o bajo rotación. En Argentina ha sido recientemente detectado en semillas (Rios, et al 2007)
* El monocultivo asegura la presencia indefinida del patógeno en el cultivo. Resulta más grave si se trata de siembra directa.
* La posibilidad de infección aumenta con temperaturas templado-cálidas y disminuye con niveles térmicos inferiores. La zona de menor riesgo climático en Argentina es el norte de la región pampeana y la de mayor el sur: (Tandil, Cnel. Suárez y Tres Arroyos)
* Temperatura 10-18 ºC, humedad relativa elevada y lluvias en el ciclo de cultivo.
* Uso de cultivares susceptibles
* Siembras muy tempranas
* Presencia de malezas susceptibles (Lolium, Hordeum)
.
Manejo Integrado
* Rotación de cultivos (sin incluir centeno, susceptible)
* Siembra de semillas sanas
* Eliminación de malezas susceptibles (Lolium y Hordeum) y plantas guachas
* Tratamiento de semillas (se deberá estar atento a su detección)
* Aplicación de fungicidas foliares (Sólo si la enfermedad sigue progresando desde encañazón en adelante).
* Resistencia varietal: La mayoría de los cultivares de cebada cervecera son susceptibles a la escaldadura. Se han encontrado fuentes de resistencia a la enfermedad (Hofmann et al., 2013; Coulter et al., 2019; Daba et al., 2019; Xi et al., 2019; Zhang et al., 2019; Büttner et al., 2020; Zhang et al., 2020; Hiddar et al., 2021; Rehman et al., 2021; Wallwork et al., 2022; Wondimu et al., 2022).
.
.
.
.
.
.
Bibliografía
Avrova A, Knogge W (2012) Rhynchosporium commune: a persistent threat to barley cultivation. Mol Plant Pathol. 13(9): 986-97. doi: 10.1111/j.1364-3703.2012.00811.x
Büttner B, Draba V, Pillen K, et al. (2020) Identification of QTLs conferring resistance to scald (Rhynchosporium commune) in the barley nested association mapping population HEB-25. BMC Genomics 21: 837. doi: 10.1186/s12864-020-07258-7
Cooke LR, Locke T, Lockley KD, et al. (2004) The effect of fungicide programmes based on epoxiconazole on the control and DMI sensitivity of Rhynchosporium secalis in winter barley. Crop Protection 23: 393-406. doi: 10.1016/j.cropro.2003.09.009
Cope JE, Norton GJ, George TS, et al. (2021) Identifying potential novel resistance to the foliar disease ‘Scald’ (Rhynchosporium commune) in a population of Scottish Bere barley landrace (Hordeum vulgare L.). J Plant Dis Prot 128: 999–1012. https://doi.org/10.1007/s41348-021-00470-x
Coulter M, Büttner B, Hofmann K, et al. (2019) Characterisation of barley resistance to rhynchosporium on chromosome 6HS. Theoretical and Applied Genetics 132(4): 1089-1107. doi: 10.1007/s00122-018-3262-8
Crous PW, Braun U, McDonald BA, et al. (2021) Redefining genera of cereal pathogens: Oculimacula, Rhynchosporium and Spermospora. Fungal Syst Evol. 7: 67-98. doi: 10.3114/fuse.2021.07.04
Daba SD, Horsley R, Brueggeman R, et al. (2019) Genome-wide Association Studies and Candidate Gene Identification for Leaf Scald and Net Blotch in Barley (Hordeum vulgare L.). Plant Disease 103(5): 880-889. doi: 10.1094/PDIS-07-18-1190-RE
Grønnerød S, Marøy A, MacKey J, et al. (2002) Genetic analysis of resistance to barley scald (Rhynchosporium secalis) in the Ethiopian line `Abyssinian’ (CI668). Euphytica 126: 235–250. doi: 10.1023/A:1016368503273
Hautsalo J, Novakazi F, Jalli M, et al. (2021) Pyramiding of scald resistance genes in four spring barley MAGIC populations. Theor Appl Genet 134: 3829–3843. doi: 10.1007/s00122-021-03930-y
Hiddar H, Rehman S, Lakew B, et al. (2021) Assessment and modeling using machine learning of resistance to scald (Rhynchosporium commune) in two specific barley genetic resources subsets. Sci Rep 11: 15967. doi: 10.1038/s41598-021-94587-6
Hofmann K, Silvar C, Casas AM, et al. (2013) Fine mapping of the Rrs1 resistance locus against scald in two large populations derived from Spanish barley landraces. Theoretical and Applied Genetics 126(12): 3091–3102. doi: 10.1093/gbe/evy087
Karjalainen R, Jokinen K (1993) Influence of Barley Scald Disease on Yield and Competition in Barley-Oat Mixtures. Journal of Agronomy and Crop Science 171: 314-320. doi: 10.1111/j.1439-037X.1993.tb00146.x
King KM, West JS, Brunner PC, et al. (2013) Evolutionary relationships between Rhynchosporium lolii sp. nov. and other Rhynchosporium species on grasses. PLoS ONE 8: e72536. doi: 10.1371/journal.pone.0072536
King KM, Eyres GJ, West JS, et al. (2021) Novel multiplex and loopmediated isothermal amplification (LAMP) assays for rapid species and mating-type identification of Oculimacula acuformis and O. yallundae (causal agents of cereal eyespot), and application for detection of ascospore dispersal and in planta use. Phytopathology. doi: 10.1094/PHYTO-04-20-0116-R
Looseley ME, Newton AC, Atkins SD, et al. (2012) Genetic basis of control of Rhynchosporium secalis infection and symptom expression in barley. Euphytica 184(1): 47–56. doi: 10.1007/s10681-011-0485-z
McLean MS, Hollaway GJ (2018) Suppression of scald and improvements in grain yield and quality of barley in response to fungicides and host-plant resistance. Australasian Plant Pathol. 47: 13–21. doi: 10.1007/s13313-017-0529-5
Penselin D, Münsterkötter M, Kirsten S, et al. (2016) Comparative genomics to explore phylogenetic relationship, cryptic sexual potential and host specificity of Rhynchosporium species on grasses. BMC Genomics 17(1): 1–32. doi: 10.1186/s12864-016-3299-5
Rehman S, Amouzoune M, Hiddar H, et al. (2021) Traits discovery in Hordeum vulgare sbsp. spontaneum accessions and in lines derived from interspecific crosses with wild Hordeum species for enhancing barley breeding efforts. Crop Science 61(1): 219–233. doi: 10.1002/csc2.20360
Ríos MO, Fernández P, Carmona M (2007) Detection of Rhynchosporium secalis in barley seeds from Argentina through polymerase chain reaction technique. Fitopatologia Brasileira 32: 415-418. doi: 10.1590/S0100-41582007000500007
Sayed H, Baum m (2018) Marker-assisted selection for scald (Rhynchosporium commune L. ) resistance gene(s) in Barley breeding for dry areas. Journal of Plant Protection Research 58(4): 335-344. doi: 10.24425/jppr.2018.124642
Seifollahi E, Sharifnabi B, Javan‐Nikkhah M, Linde CC (2018) Low genetic diversity of Rhynchosporium commune in Iran, a secondary centre of barley origin. Plant Pathology 67: 1725-1734. doi: 10.1111/ppa.12886
Shoaib A, Aldaoude A, Arabi MIE, et al. (2018) Transcriptome profiling reveals distinct gene activations in barley responding to scald and spot blotch. Cereal Research Communications 46: 490–498. doi: 10.1556/0806.46.2018.034
SMITH NJG (1937) Leaf-scald of barley in south Africa. South African Journal of Science XXXIV: 286-290. Link
, , , (2022) The population genetics of adaptation through copy number variation in a fungal plant pathogen. Molecular Ecology: 00, 1– 0. doi: 10.1111/mec.16435
Taggart PJ, Cooke LR, Mercer PC (1998) Effects of fungicides used to control Rhynchosporium secalis where benzimidazole resistance is present. Crop Protection 17: 727-734. doi: 10.1016/S0261-2194(98)00081-7
Vahamidis P, Stefopoulou A, Lagogianni CS, et al. (2020) Pyrenophora teres and Rhynchosporium secalis Establishment in a Mediterranean Malt Barley Field: Assessing Spatial, Temporal and Management Effects. Agriculture 10(11): 553. doi: 10.3390/agriculture10110553
Wallwork H, Butt M, Grcic M, Garrard T (2022) The Use of Pathotype Data for the Selection and Development of Barley Lines with Useful Resistance to Scald. Plants. 11(19): 2501. doi: 10.3390/plants11192501
Wondimu SE, Heyie AC, Legesse NH (2022) Evaluation of malt barley cultivars for resistance against leaf scald (Rhynchosporium secalis) (Oudem JJ. Davis) and for yield and yield traits in North Shewa, Central high lands of Ethiopia. Archives of Phytopathology and Plant Protection 55: 1045-1061. https://doi.org/10.1080/03235408.2022.2065446
Xi K, Turkington TK, Juskiw P, et al. (2019) Field Screening is Effective for Identifying Genetic Resistance to Scald of Barley. Crop Science 59: 1479-1493. doi: 10.2135/cropsci2018.09.0536
CC (2011) Two new species of Rhynchosporium. Mycologia 103: 195-202. doi: 10.3852/10-119
Zhan J, Fitt BDL, Pinnschmidt HO, et al. (2008) Resistance, epidemiology and sustainable management of Rhynchosporium secalis populations on barley. Plant Pathology 57: 1-14. doi: 10.1111/j.1365-3059.2007.01691.x
Zhang Q, Webster RK, Crandall BA, et al. (1992) Race Composition and Pathogenicity Associations of Rhynchosporium secalis in California. Phytopathology 82: 798-803. doi: 10.1094/Phyto-82-798
Zhang X, Ovenden B, Orchard BA, et al. (2019) Bivariate analysis of barley scald resistance with relative maturity reveals a new major QTL on chromosome 3H. Sci Rep 9: 20263. doi: 10.1038/s41598-019-56742-y
, , (2020) Recent insights into barley and Rhynchosporium commune interactions. Molecular Plant Pathology 21: 1111– 1128. doi: 10.1111/mpp.12945