.
Condición fitosanitaria: Presente
Grupo de cultivos: Hortícolas
Especie hospedante: Remolacha / Acelga (Beta vulgaris)
Rango de hospedantes: amplio, la mayoría de las especies del género Beta. Se ha reportado como patógeno en otros miembros de Chenopodiaceae (p. ej., Chenopodium album, espinacas) así como miembros de Acanthaceae (p. ej., Acanthus mollis), Apiaceae (p. ej., Apium), Asteraceae (p. ej., Crisantemo, lechuga, cártamo), Brassicaceae (p. ej., mostaza silvestre), Malvaceae (p. ej., Malva), Plumbaginaceae (p. ej., Limonium) y Polygonaceae (p. ej., Rumex obtusifolius).
Etiología: Hongo. Hemibiotrófico
Agente causal: Cercospora beticola Saccardo, 1876
Taxonomía: Fungi > Dikarya > Ascomycota > Pezizomycotina > Dothideomycetes > Capnodiales > Mycosphaerellaceae > Cercospora
.
.
.
Antecedentes
La mancha foliar por Cercospora, causada por el hongo patógeno Cercospora beticola, es la enfermedad foliar más destructiva de la remolacha azucarera en todo el mundo.
.
Síntomas y signos
En hojas se observan manchas circulares, de borde pardo rojizo y centro pardo claro a grisáceo que llega a desprenderse. Las manchas de expanden en tamaño abarcando zonas extensas de la lamina foliar. Sobre las lesiones se presentan grupos de conidióforos y conidios que aparecen como puntuaciones oscuras. Las hojas más viejas a menudo muestran síntomas primero y las hojas más jóvenes se infectan a medida que avanza la enfermedad.
.
- Autor: Pethybridge et al., 2017.
.
.
Condiciones predisponentes
Alta humedad relativa (90%), temperaturas diurnas entre 25-35 ºC y en la noche no inferiores a 16 ºC.
.
Ciclo de la enfermedad
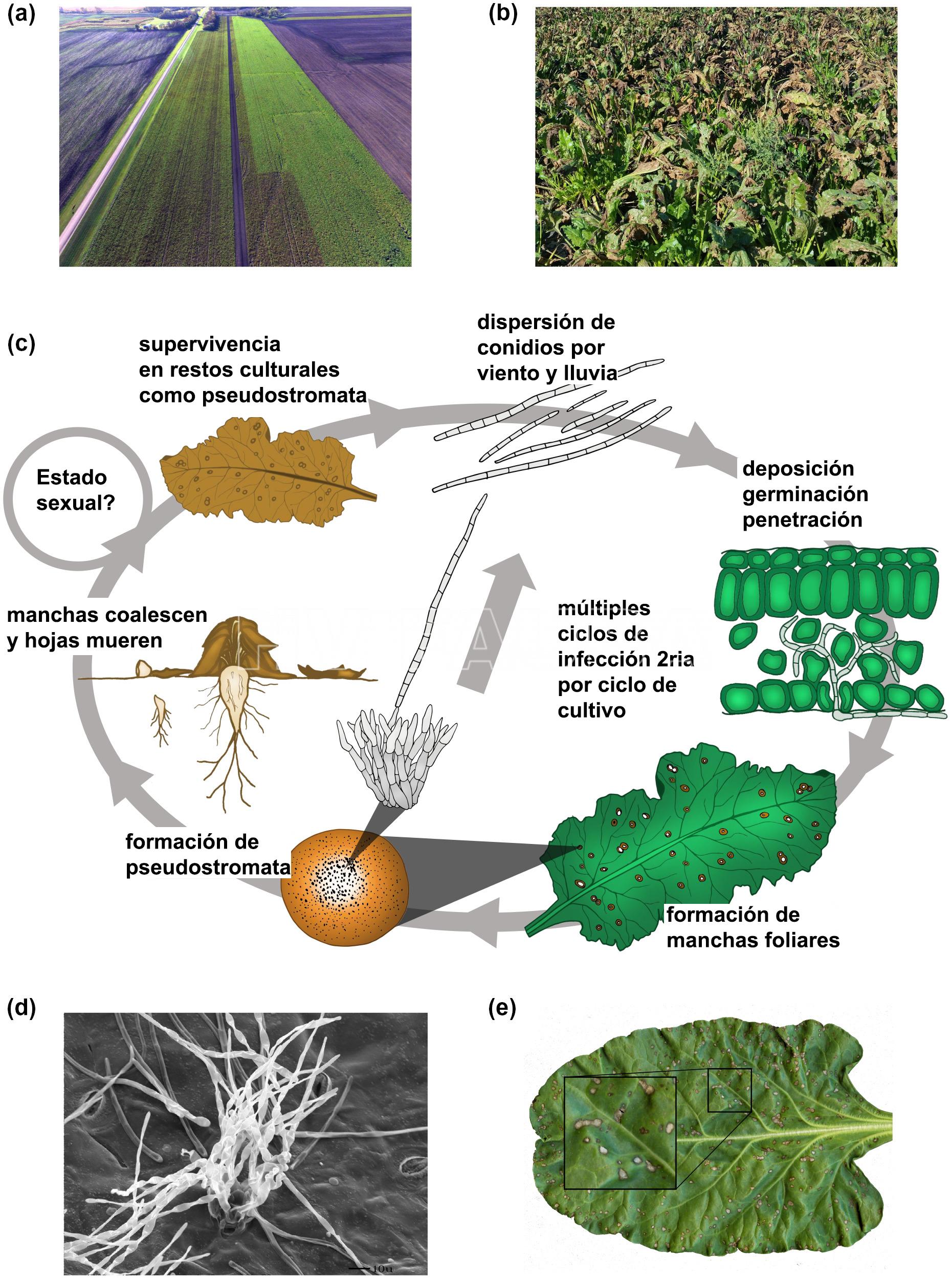
El patógeno sobrevive en restos culturales, semillas o en malezas. Las esporas son dispersadas principalmente por el agua de riego y por el viento. Se produce la infección en el cultivo, y la aparición de síntomas y signos. La penetración en las hojas sólo se realiza a través de estomas. Se producen sucesivas infecciones.
.
- (a) Imagen tomada desde un dron: en el lado izquierdo del campo una interrupción abrupta en la aplicación de fungicidas finalmente resultó en un aumento de la enfermedad, observese el color marrón. (b) Elevado nivel de intensidad de la mancha foliar por Cercospora en un campo de remolacha azucarera. (c) Ciclo de la enfermedad. La infección se inicia por conidios en el aire o dispersos por salpicaduras que penetran en la hoja de la remolacha azucarera a través de los estomas y dan lugar al crecimiento de hifas intercelulares. Las manchas foliares se forman en las hojas después del cambio a necrotrófico, que generalmente ocurre 7 días después de la infección. Los pseudoestromas se desarrollan en estas lesiones y producen esporas asexuales, lo que lleva a múltiples ciclos de infección secundaria durante la temporada de crecimiento del cultivo. Los pseudoestromas también son las estructuras en donde sobrevive el patógeno en los restos culturales al final de la temporada. Es posible que C. beticola pueda reproducirse sexualmente y producir ascosporas a campo, pero nunca se ha reportado. (d) Micrografía electrónica de barrido que muestra conidióforos de C. beticola que emergen de la remolacha azucarera. (e) Sintomatología en remolacha azucarera. Autor: Rangel et al., 2020.
.
Manejo
* Siembra de variedades resistentes (si las hubiera disponibles)
* Rotación de cultivos
* Uso de funguicidas.
* Control de hospedantes secundarios
.
- 01 Viruela de la Acelga, causada por Cercospora beticola
- 02 Viruela de la Acelga, causada por Cercospora beticola
- 03 Viruela de la Acelga, causada por Cercospora beticola
- 04 Viruela de la Acelga, causada por Cercospora beticola
- 05 Viruela de la Acelga, causada por Cercospora beticola
- 06 Viruela de la Acelga, causada por Cercospora beticola
- Autor: Tamara Alvarez
- Autor: Tamara Alvarez
- 01 Viruela de la Remolacha causada por Cercospora beticola. Autor: Ing. Agr. Eliana Fernandez
- 02 Viruela de la Remolacha causada por Cercospora beticola. Autor: Ing. Agr. Eliana Fernandez
- 03 Viruela de la Remolacha causada por Cercospora beticola. Autor: Ing. Agr. Eliana Fernandez
.
.
Bibliografía
Barreto A, Ispizua Yamati FR, Varrelmann M, et al. (2023) Disease Incidence and Severity of Cercospora Leaf Spot in Sugar Beet Assessed by Multispectral Unmanned Aerial Images and Machine Learning. Plant Dis. 107(1): 188-200. doi: 10.1094/PDIS-12-21-2734-RE
Birla K, Rivera-Varas V, Secor GA, et al. (2012) Characterization of cytochrome b from European field isolates of Cercospora beticola with quinone outside inhibitor resistance. European Journal of Plant Pathology 134(3): 475-488. doi: 10.1007/s10658-012-0029-y
Biró AF, Leader AJ, Hufnagl A, et al. (2024) Evaluation of Novel Picolinamide Fungicides (QiI) for Controlling Cercospora beticola Sacc. in Sugar Beet. Horticulturae 10(11): 1202. doi: 10.3390/horticulturae10111202
Bolton MD, Birla K, Rivera-Varas V, Rudolph KD, Secor GA (2012) Characterization of CbCyp51 from field isolates of Cercospora beticola. Phytopathology 102: 298-305. doi: 10.1094/PHYTO-07-11-0212
Bolton MD, Rivera-Varas V, del Río Mendoza LE, Khan MFR, Secor GA (2012) Efficacy of variable tetraconazole rates against Cercospora beticola isolates with differing in vitro sensitivities to DMI fungicides. Plant Disease 96: 1749-1756. doi: 10.1094/PDIS-03-12-0255-RE
Bolton MD, Rivera V, Secor G (2013) Identification of the G143A mutation associated with QoI resistance in Cercospora beticola field isolates from Michigan, United States. Pest Management Science 69(1): 35-39. doi: 10.1002/ps.3358
Bolton MD, Ebert MK, Faino L, Rivera-Varas V, de Jonge R, Van de Peer Y, Thomma BP, Secor GA (2016) RNA-sequencing of Cercospora beticola DMI-sensitive and -resistant isolates after treatment with tetraconazole identifies common and contrasting pathway induction. Fungal Genetics and Biology 92: 1-13. doi: 10.1016/j.fgb.2016.04.003
Carrión VJ, Perez-Jaramillo J, Cordovez V, et al. (2019) Pathogen-induced activation of disease-suppressive functions in the endophytic root microbiome. Science 366: 606–612. doi: 10.1126/science.aaw9285
, , , et al. (2023) GWAS reveals a rapidly evolving candidate avirulence effector in the Cercospora leaf spot pathogen. Molecular Plant Pathology 00: 1–13. doi: 10.1111/mpp.13407
de Jonge R, Ebert MK, Huitt-Roehl CR, Pal P, Suttle JC, Spanner RE, Neubauer JD, Jurick WM 2nd, Stott KA, Secor GA, Thomma BPHJ, Van de Peer Y, Townsend CA, Bolton MD (2018) Gene cluster conservation provides insight into cercosporin biosynthesis and extends production to the genus Colletotrichum. Proc Natl Acad Sci U S A. 115(24): E5459-E5466. doi: 10.1073/pnas.1712798115
, , , et al. (2020) Identification and characterization of Cercospora beticola necrosis‐inducing effector CbNip1. Molecular Plant Pathology 00: 1– 16. doi: 10.1111/mpp.13026
El Jarroudi M, Chairi F, Kouadio L, et al. (2021) Weather-Based Predictive Modeling of Cercospora beticola Infection Events in Sugar Beet in Belgium. Journal of Fungi. 7(9): 777. doi: 10.3390/jof7090777
Hendershot C, Ruth S, Bloomingdale C, et al. (2025) Cercospora Leaf Spot Impacts on Postharvest Disease and Respiration of Affected Sugarbeet Roots. Plant Dis. 109(2): 410-422. doi: 10.1094/PDIS-07-24-1478-RE
Karaoglanidis GS, Karadimos DA, Ioannidis PM (2003) Detection of resistance to sterol demethylation-inhibiting (DMI) fungicides in Cercospora beticola and efficacy of control of resistant and sensitive strains with flutriafol. Phytoparasitica 31(4): 373-380. doi: 10.1007/BF02979809
Kayamori M, Zakharycheva A, Saito H, et al. (2021) Resistance to demethylation inhibitors in Cercospora beticola, a pathogen of sugar beet in Japan, and development of unique cross-resistance patterns. Eur J Plant Pathol 160: 39–52. doi: 10.1007/s10658-021-02219-6
Kiniec A, Pieczul K, Piszczek J (2022) The first detection of multiple resistant (MBC and QoI) strains of Cercospora beticola Sacc. in Poland. Crop Protection 158: 106006. doi: 10.1016/j.cropro.2022.106006
Kirk WW, Hanson LE, Franc GD, et al. (2012) First report of strobilurin resistance in Cercospora beticola in sugar beet (Beta vulgaris) in Michigan and Nebraska, USA. New Disease Reports 26: 3. doi: 10.5197/j.2044-0588.2012.026.003
Kumar R, Mazakova J, Ali A, et al. (2021) Characterization of the Molecular Mechanisms of Resistance against DMI Fungicides in Cercospora beticola Populations from the Czech Republic. Journal of Fungi. 7(12): 1062. doi: 10.3390/jof7121062
Liu Q, Dong G, Qi H, et al. (2022) A new method for single spore isolation and fungicide resistance monitoring of Cercospora beticola, and the first report of QoI-resistant isolates with G143A or F129L mutations of the CbCyt b gene in China. Journal of Phytopathology 00, 1– 8. doi: 10.1111/jph.13137
Matsuzaki Y, Uda Y, Kurahashi M, Iwahashi F (2021) Microtiter plate test using liquid medium is an alternative method for monitoring metyltetraprole sensitivity in Cercospora beticola. Pest Manag Sci 77: 1226-1234. doi: 10.1002/ps.6133
Muellender MM, Mahlein A-K, Stammler G, Varrelmann M (2021) Evidence for the association of target-site resistance in cyp51 with reduced DMI sensitivity in European Cercospora beticola field isolates. Pest Manag Sci, 77: 1765-1774. doi: 10.1002/ps.6197
Pethybridge SJ, Vaghefi N, Kikkert JR (2017) Horticultural Characteristics and Susceptibility of Table Beet Cultivars to Cercospora Leaf Spot in New York. HortTechnology hortte 27(4): 530-538. doi: 10.21273/HORTTECH03743-17
JR (2020) Improving fungicide-based management of Cercospora leaf spot in table beet in New York, USA. Canadian Journal of Plant Pathology 42: 353-366. doi: 10.1080/07060661.2019.1690048
Piszczek J, Pieczul K, Kiniec A (2017) First report of G143A strobilurin resistance in Cercospora beticola in sugar beet (Beta vulgaris) in Poland. Journal of Plant Diseases and Protection: 1-3. doi: 10.1007/s41348-017-0119-3
Rangel LI, Spanner RE, Ebert MK, et al. (2020) Cercospora beticola: The intoxicating lifestyle of the leaf spot pathogen of sugar beet. Molecular Plant Pathology 21: 1020–1041. doi: 10.1111/mpp.12962
Rangel LI, Wyatt N, Courneya I, et al. (2024) CbCyp51-Mediated Demethylation Inhibitor Resistance Is Modulated by Codon Bias. Phytopathology: PHYTO01240034R. doi: 10.1094/PHYTO-01-24-0034-R
Spanner R, Taliadoros D, Richards J, et al. (2021) Genome-Wide Association and Selective Sweep Studies Reveal the Complex Genetic Architecture of DMI Fungicide Resistance in Cercospora beticola. Genome Biology and Evolution 13: evab209. doi: 10.1093/gbe/evab209
Spanner R, Neubauer J, Heick TM, et al. (2021) Seed-Borne Cercospora beticola can Initiate Cercospora Leaf Spot from Sugar Beet (Beta vulgaris L.) Fruit Tissue. Phytopathology. doi: 10.1094/PHYTO-03-21-0113-R
Trkulja N, Ivanović Ž, Pfaf-Dolovac E, et al. (2013) Characterisation of benzimidazole resistance of Cercospora beticola in Serbia using PCR-based detection of resistance-associated mutations of the β-tubulin gene. European Journal of Plant Pathology 135(4): 889-902. doi: 10.1007/s10658-012-0135-x
Trkulja NR, Milosavljević AG, Mitrović MS, et al. (2017) Molecular and experimental evidence of multi-resistance of Cercospora beticola field populations to MBC, DMI and QoI fungicides. European Journal of Plant Pathology 149(4): 895–910. doi: 10.1007/s10658-017-1239-0