.
Condición fitosanitaria: Presente
Grupo de cultivos: Cereales
Especie hospedante: Maíz (Zea mays subsp. mays)
Transmisión: chicharritas vectoras (Dalbulus maidis DeLong, 1923) de forma persistente propagativa
Etiología: Bacteria sin pared celular (Clase Mollicutes). Limitada al floema. Considerada Biotrófica. Bacteria fastidiosa (dificultad en ser cultivada in vitro). (*)
Agente causal: Spiroplasma kunkelii Whitcomb et al. 1986
Taxonomía: Bacteria > Terrabacteriagroup > Tenericutes > Mollicutes > Entomoplasmatales > Spiroplasmataceae > Spiroplasma
.
Los Spiroplasmas son procariotes sin pared celular, pertenecientes a la clase Mollicutes. Tienen forma helicoidal, y se pueden cultivar in vitro en medios especiales, produciendo colonias llamadas tipo «huevo frito». Invaden el floema y se transmiten por chicharritas vectoras. Los fitoplasmas fueron descubiertos por el microbiólogo veterinario Kaoru Koshimizu después de observar cuerpos pleomorfos de tamaño mitocondrial en células del floema de morera infectadas, que se parecían mucho a las células de aves infectadas con micoplasmas similares, con las que estaba trabajando.
Spiroplasma kunkelii es un procariota motil sin paredes celulares. Los espiroplasmas parecen ser helicoidales o pleomorfos en células vegetales. Es un anaeróbico facultativo y su área de hábitat en la planta está limitada al floema pero puede ser cultivado en algunos medios artificiales (Lee y Davis, 1988). Las células de espiroplasma están limitadas por una membrana unitaria sin pared celular.
Las bacterias no flageladas como el mollicute Spiroplasma nadan sin el uso de estos grandes apéndices. Las estrategias que utilizan estos organismos para nadar siguen sin estar claras. Estas eubacterias gram positivas diminutas, que miden aproximadamente 150 nm de ancho por unos pocos micrones de largo, infectan un amplio rango de plantas e insectos. Son únicas entre las bacterias sin paredes de la clase Mollicute en su capacidad para mantener una forma helicoidal y nadar en medios líquidos. La morfología distintiva se define por los filamentos citoesqueléticos internos de una proteína de 55 kDa que se ensamblan en una cinta helicoidal, denominada cinta de fibrillas. Resultados recientes usando tomografía crioelectrónica revelan una organización intracelular complicada que involucra la cinta de fibrillas así como otra estructura helicoidal, posiblemente el homólogo de actina MreB. Se cree que la natación surge de las ondulaciones de células completas provocadas por movimientos contráctiles del citoesqueleto (Shaevitz et al., 2005).
(*) Spiroplasma kunkelii es una de varias especies de Spiroplasma que se han aislado de plantas. De los que se ha demostrado o se sospecha que son fitopatógenos, S. kunkelii es el más exigente en sus requisitos para el crecimiento in vitro. S. kunkelii se aisló por primera vez en cultivo in vitro en 1975 (Chen y Liao, 1975; Williamson y Whitcomb, 1975), unos cuatro años después del aislamiento de S. citri (Fudl-Allah et al., 1971, 1972; Saglio et al. , 1971) y el descubrimiento del achaparramiento del maíz (Davis et al., 1972).
El diagnóstico de este agente causal se realiza con la técnica ELISA (acrónimo del inglés: Enzyme-Linked ImmunoSorbent Assay, = ‘ensayo por inmunoabsorción ligado a enzimas’), PCR (acrónimo del inglés: Polymerase Chain Reaction, = ‘reacción en cadena de la polimerasa’) (Barros et al., 2001) o visualmente con microscopio electrónico.
Davis et al. (2005) secuenciaron el plásmido de S. kunkelii denominado pSKU146, de 14615 pb, y detectaron varias regiones codificantes de proteínas que codifican para proteínas que muestran similitud con las proteínas asociadas a la virulencia, involucradas en la adhesión de célula a célula, y ADN de conjugación bacteriana. Un ORF (del inglés: open reading frame = ‘marco abierto de lectura o marco de lectura abierta’) codifica una proteína de 96 kDa, SkARP1, que es muy similar a la adhesina SARP1 involucrada en la unión de Spiroplasma citri a la membrana intestinal de un insecto. Cinco ORF codifican proteínas similares a TraE y Mob en bacterias que poseen pared celular, y similar a un ORF que se encuentran en el elemento conjugativo integrado (ICEF, integrative, conjugative element) de Mycoplasma fermentans, respectivamente. La presencia de dominios similares a las proteínas del sistema de secreción tipo IV en bacterias patógenas sugiere que el espiroplasma posee un sistema de translocación relacionado.
.
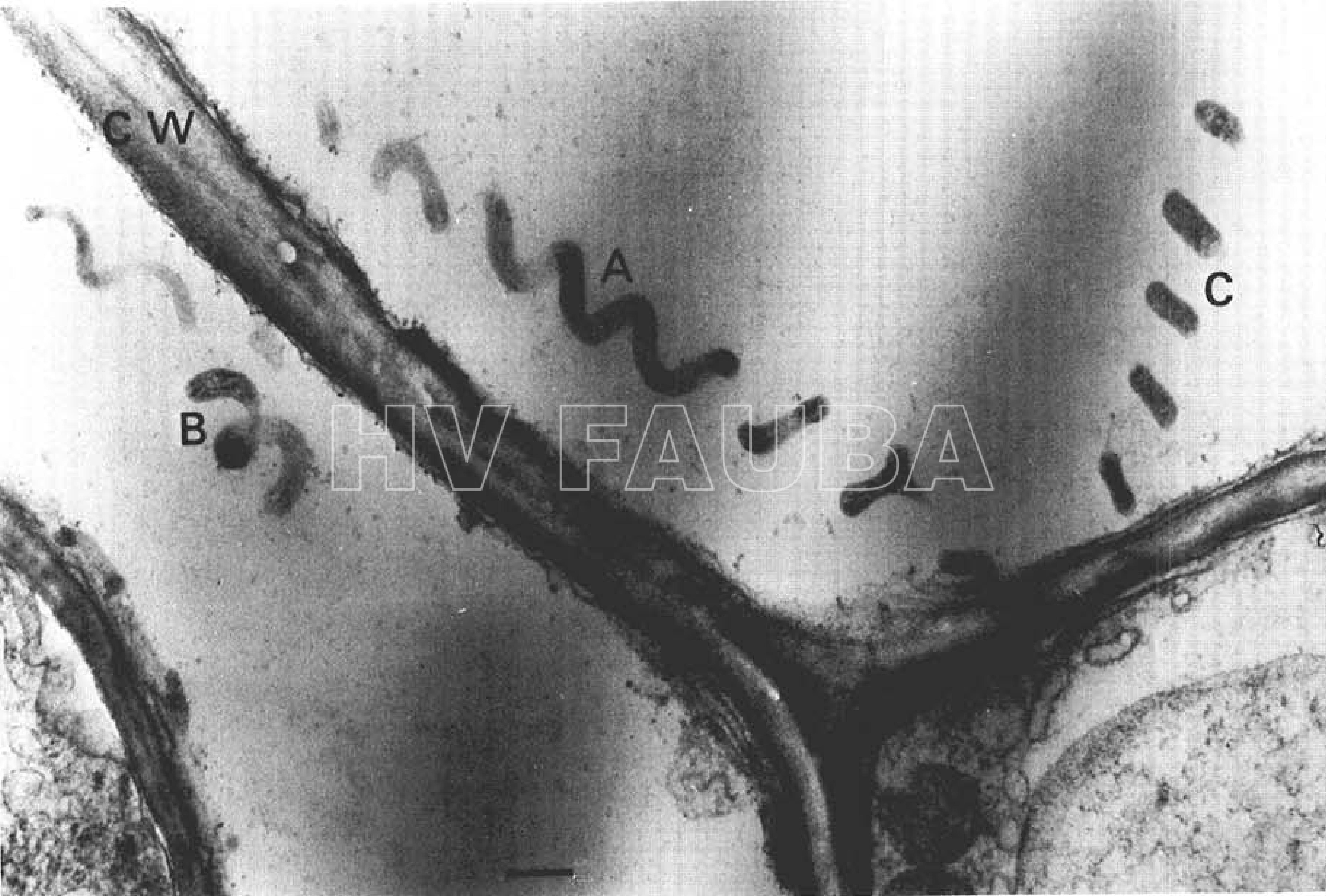
- Micrografía electrónica de una sección de ultramicrotoma gruesa (corte de aproximadamente 0,3 µm) de tejido del floema de una planta de maíz infectada con Spiroplasma kunkelii. CW = pared celular (cell wall). A = filamento enrollado helicoidalmente del microorganismo asociado sistemáticamente con la enfermedad Achaparramiento del maíz. Observese la regularidad de la longitud de onda y la amplitud de la espiral. B = porción de un filamento helicoidal. C = porciones de un solo filamento cortado en un plano que incluye solo las crestas de giros adyacentes La barra representa aproximadamente 0.5 μm. Autor: Davis & Worley, 1972.
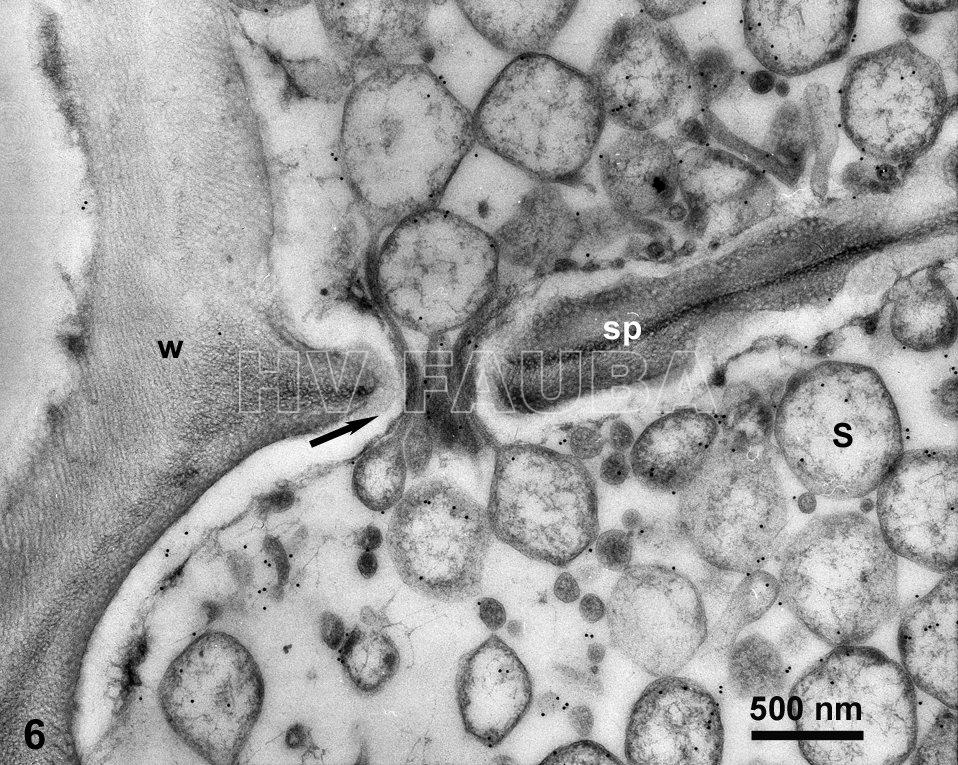
- Marcado de S. kunkelii (CSS) con inmuno-oro en tubos cribosos y otras células del floema del tejido de la raíz de maíz infectado. En esta imagen, CSS parece estar cruzando un poro de tamiz en la placa de tamiz de floema (tubo criboso). Autor: Ammar & Hogenhout, 2005;
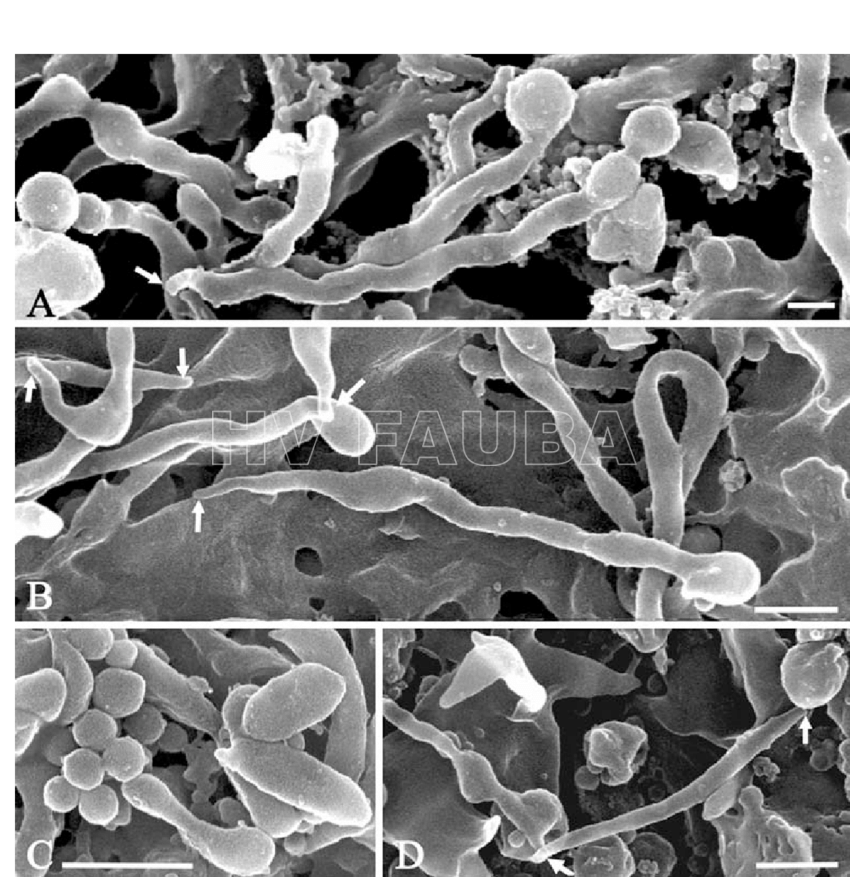
- Preparaciones de microscopía electrónica de barrido (SEM, del Inglés: Scanning electron microscopy) de (A) Spiroplasma kunkelii, (B) Spiroplasma melliferum, (C) Spiroplasma citri y (D) Spiroplasma floricola, cultivadas. Observese las estructuras de la punta (flechas), las partes globulares de la hélice (A, B), un grupo de yemas (C) y las formas irregulares (C, D). Barras de escala: 500 nm. Autor:Ammar et al., 2004
.
.
Antecedentes
El Achaparramiento del maíz (CSS, del inglés: Corn Stunt Spiroplasma) fue citada por primera vez en Estados Unidos (Alstatt, 1945) y está presente principalmente en áreas tropicales o subtropicales del Continente Americano, México (Cervantes et al,. 1958), Nicaragua, El Salvador, Venezuela, Colombia y Honduras (Smith & Niederhauser, 1958) Perú (Castillo & Nault, 1982), Bolivia y Brasil (Costa et al., 1971; Costa & Kitajima, 1973), Argentina (Lenardon et al., 1992; 1993; Laguna et al., 1996) y Paraguay (Lezcano Roman & Machado, 1997).
En Argentina la primera detección de Spiroplasma kunkelii la realizaron Lenardon et al. (1993). Desde entonces la
enfermedad se ha observado en zonas subtropicales durante la década del 1990 con una incidencia de hasta 7% en muestreos de lotes comerciales y hasta 30% en ensayos comparativos de rendimiento (Laguna et al., 1996; Giménez Pecci et al., 1997). La bacteria S. kunkelii afecta al maíz principalmente en el norte del país desde al menos dos décadas, donde es endémica. Su incidencia fue disminuyendo hacia 2005 y se mantuvo baja hasta 2017, cuando comenzó a crecer nuevamente hasta el presente. Desde diciembre 2023 se observó un incremento significativo en la presencia de la chicharrita en el centro y norte de Argentina, transmitiendo la bacteria Spiroplasma kunkelii. En el 2024 se registró un incremento alarmante en la presencia de la chicharrita, llegando incluso a la región pampeana núcleo (Pergamino, Bs. As.).
Se han reportado daños de rendimiento de hasta 70%. En Tucumán, Virla et al. (2004) determinaron que la enfermedad disminuye en promedio el 70% de la producción, con un rango entre 50 y 90% en función de la intensidad de la reacción serológica del grupo de plantas evaluadas; y en plantas severamente afectadas la producción fue nula.
.
Síntomas
* Enanismo, deformaciones fisiológicas, mazorcas deformadas y no bien desarrolladas;
* Infecciones tempranas causan más daños;
.
- Autor: Martín Marcelino. Ubicación: Santiago del Estero 2024
- Autor: Martín Marcelino. Ubicación: Santiago del Estero 2024
- Autor: Martín Marcelino. Ubicación: Santiago del Estero 2024
.
El patógeno una vez presente en la planta produce síntomas característicos como enanismo de las plantas, estrías cloróticas en la base de las láminas, acortamiento de entrenudos, proliferación de mazorcas y enrojecimiento de márgenes de hojas adultas, lo que lleva a una disminución notable en los rendimientos de este cultivo en lotes afectados. La sintomatología varía según las condiciones climáticas y el híbrido sembrado.
Los primeros síntomas se muestran como clorosis en los márgenes de las hojas más jóvenes y después manchas rojizas o púrpuras, amarillentas en las hojas más viejas. Las hojas jóvenes comúnmente forman rayas cloróticas en sus bases, que después se vuelven púrpuras en las puntas de las hojas. En general los síntomas se presentan cerca de la floración masculina. Las plantas infectadas se ven enanas y mal desarrolladas por la reducción de entrenudos. Aparecen numerosas mazorcas estériles, macollamiento y enraizamiento excesivos.
Las flores masculinas comúnmente son completamente infecundas. Las plantas pueden ser totalmente estériles o
sufrir de mal establecimiento de semillas y tener mazorcas muy pequeñas. En condiciones de infecciones graves las plantas pueden morir de manera prematura.
Con temperaturas bajas la clorosis y la coloración purpúrea se restringe a la base de las hojas superiores. Los síntomas muestran diferencias dependiendo del genotipo de maíz.
.
- Autor: Clemson University, USDA Cooperative Extension
- Autor: Loladze et al., 2016
- Autor: Giménez Pecci et al., 2002.
- Autor: Giménez Pecci et al., 2002.
- Autor: Loladze et al., 2016
.
Transmisión, Ciclo de la enfermedad y Epidemiología
* Sobrevive en chicharras infectadas;
* Tiene muchos hospedantes aparte del maíz;
El patógeno Spiroplasma kunkelii es transmitido en forma persistente por cicadélidos (chicharritas) pertenecientes a la familia Cicadellidae, subfamilia Deltocephaline: Dalbulus maidis (DeLong & Wolcott), Dalbulus elimatus Ball, Dalbulus tripsacoides De Long & Nault, Dalbulus gelbus De Long, Dalbulus guevarai De Long, Dalbulus quinquenotatus De Long & Nault, Baldulus tripsaci Kramer & Whitcomb, Exitianus exitiosus Uhler, Stirellus bicolor Van Duzze y Graminella nigrifrons Forbes, (Maramorosch et al., 1968; Ramírez et al., 1975; Maden & Nault, 1983). D. maidis es el principal vector de Spiroplasma kunkelii en las regiones productoras de maíz en América Latina (Nault, 1990); Lenardon y colaboradores en 1993, comprobaron la capacidad de esta especie de trasmitir el espiroplasma presente en la Argentina. El vector fue señalado por primera vez en Argentina en la provincia de Tucumán en cultivos de remolacha azucarera (Beta vulgaris L. var. rapacea) (Koch) Allen (Oman, 1948). Posteriormente se registró en Jujuy, Salta,Tucumán, Chaco, Catamarca, Santiago del Estero, Santa Fe y Buenos Aires sobre cultivosde maíz, teosinte y malezas aledañas (Virla etal., 1990/1991; Gimémez Pecci et al.,1997; Paradell, et al., 2000). En Salta y Buenos Aires su presencia resultó coincidente con el área de introducción de las especies vegetales hospederas (Remes Lenicov & Virla, 1993). El vector adquiere al patógeno desde una planta enferma principalmente de los géneros de plantas anuales: Zeacomo teosintes, Euchlaena mexicana (Shrader) y Zea luxurians (Durieu & Asch.) Mck.Bird y perennes: Zea perennis (Hitchcok) y Zea diploperennis Iltis, Sorghum bicolor (L)Moench y Sorghum halepense L. que han sido citados como reservorios naturales del patógeno.
La enfermedad transmite por chicharritas vectoras, entre las cuales la especie principal es Dalbulus maidis. Esta chicharrita transmite al patógeno de forma persistente propagativa, es decir, una vez adquirida el spiroplasma puede transmitirlo toda su vida. Posee un periodo de latencia de 2 a 3 semanas para que la misma sea infectiva. Es un vector muy eficiente, pudiendo infectar una planta con tan solo una hora de alimentación. No todas las chicharritas son infectivas, ya que la proporción de individuos con capacidad de inocular la enfermedad generalmente es inferior al 10%. Por lo tanto, la probabilidad de transmisión aumenta en la medida que se incremente la densidad poblacional del vector. S. kunkelii se multiplica en células del hospedante vegetal (maíz) y en las células de los insectos vectores, y se transmite con secreciones salivales durante la alimentación del vector en nuevas plantas hospedantes. Los sitios de distribución y replicación de S. kunkelii en su vector D. maidis sugieren que los espiroplasmas helicoidales invaden las capas de células epiteliales (Özbek et al., 2003).
El período de incubación de la enfermedad es de alrededor de 30 días.
.
- Dalbulus maidis, Insecto vector del Achaparramiento del maíz. Autor: Ing. Agr. (Esp.) Javier Barontini, IPAVE-CIAP-INTA.
.
- Chicharrita Dalbulus maidis vector transmisor de Spiroplasma kunkelii. Autor: Lolazde et al., 2016.
- Chicharrita Dalbulus maidis vector transmisor de Spiroplasma kunkelii. Autor: James Turner, National-Museum-Wale
- Chicharritas vectoras de Spiroplasma kunkelii alimentándose sore hojas de maíz.
.
Los datos obtenidos demuestran que el desarrollo de la enfermedad está ligado a la presencia de su principal vector, D. maidis, que en conjunto con los hospedantes alternativos presentes en las áreas afectadas favorecen la difusión de la enfermedad. Carloni et al. (2013) relevaron 140 localidades de la Argentina durante 2 campañas agrícolas (2005/2006 y 2006/2007), entre R3 (grano lechoso) y R5 (grano duro o indentado), para determinar la presencia de S. kunkelii y su vector Dalbulus maidis. La mayor prevalencia de S. kunkelii y los niveles de incidencia se encontraron en el área de transición de la región templada a la subtropical, relacionada con la mayor prevalencia de D. maidis y los insectos muestreados por ubicación. Los adultos de D. maidis se encontraron en plantas de maíz voluntarias y vegetación espontánea en los meses de otoño e invierno, que fueron inoculadores del patógeno S. kunkelii. Esta capacidad de hibernación se relacionó con la detección de insectos de D. maidis en cultivos de maíz en etapas tempranas de crecimiento en la siguiente temporada de crecimiento.
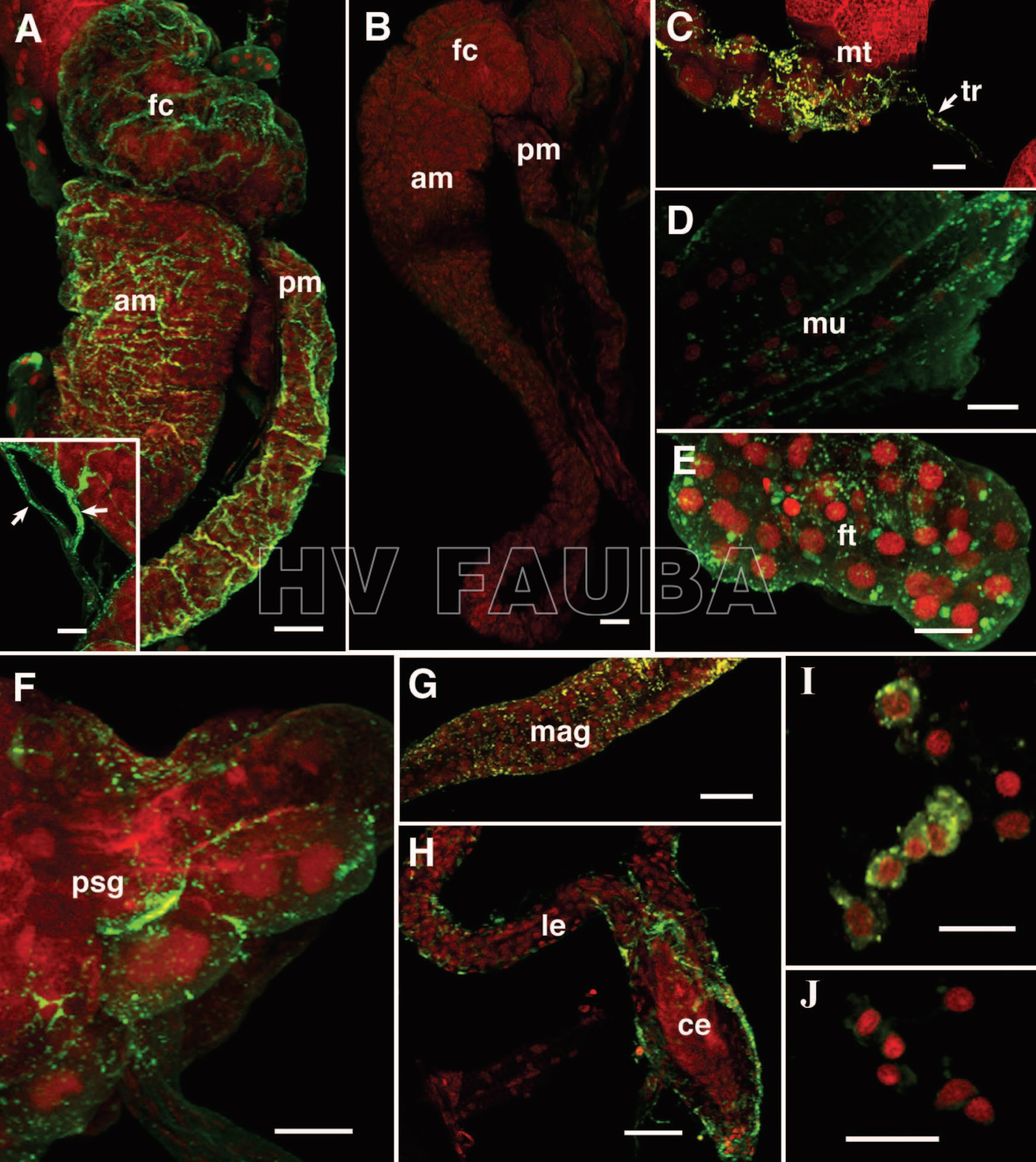
- Imágenes confocales (AH) de órganos de montaje de todo el vector D. maidis, 2 a 3 semanas después de la exposición a plantas infectadas con CSS durante 1 semana, inmunomarcadas para CSS con Alexa Fluor (fluorescencia verde) y teñidas para núcleos con yoduro de propidio (rojo). Infectado (A) y control (B). Localización de CSS en la cámara de filtro (fc, filter chamber), intestino medio anterior (am, anterior midgut), intestino medio posterior (pm, posterior midgut) y tráqueas del intestino medio (recuadro, flechas). (CH) Localización de CSS en túbulos de Malpighi (mt, Malpighian tubules) y tráqueas asociadas (tr, associated tracheae), tejido muscular (mu, muscle tissue), tejido adiposo (ft, fat tissue), glándula salival principal (psg, principle salivary gland), glándula accesoria masculina (mag, male accessory gland), Conductos eyaculatorios laterales (le) y comunes (ce). (I y J) Hemocito de fluido corporal de D. maidis infectados (I) y de control (J) teñidos para los núcleos (rojo) e inmunomarcados para CSS (fluorescencia verde). Barras de escala, 50 uM (A, B, F, G y H) y 20 uM (A, recuadro; C, D, E, I y J). Autor: Ammar & Hogenhout, 2005
.
- Chicharrita del maíz sobre hoja de maíz. Autor: Martín Marcelino. Ubicación: Santiago del Estero 2024
.
.
Manejo Integrado y Preventivo de la Enfermedad
La siembra de materiales tolerantes al CSS es la práctica de mayor impacto para el manejo de esta enfermedad. Se ha comprobado que existe variabilidad en la respuesta frente a S. kunkelii entre los diferentes materiales, debiéndose consultar a cada semillero sobre el nivel de tolerancia de sus híbridos para éste patógeno (Druetta et al., 2018).
Escapar al pico poblacional del vector. Mediante el manejo de la fecha de siembra se puede evitar exponer al cultivo en su periodo más susceptible (los primeros 30 días desde la emergencia) a una alta presión del vector, y por ende escapar o mitigar los efectos negativos de la enfermedad. Hay que tener presente que donde se realizan siembras de primavera, se genera un ambiente favorable para la multiplicación del vector y la enfermedad, exponiendo a los cultivos de verano a una alta presión de inóculo. Un proceso similar ocurre cuando se extiende el periodo de siembra durante el periodo diciembre – enero, exponiendo a los cultivos sembrados tardíamente a una elevada densidad poblacional de la chicharrita y en consecuencia a mayor incidencia de CSS.
Control de plantas voluntarias de maíz. Teniendo presente que en Argentina el CSS tiene como único hospedante al maíz, y que su vector solo se alimenta y reproduce en este cultivo, la presencia de maíz guacho genera un ambiente favorable para la permanencia de ambos. Su eliminación contribuye a reducir la presión de la enfermedad en las primeras fechas de siembra.
Tratamiento de semilla con insecticidas. Es un buen complemento acompañando a las demás prácticas. Los curasemillas sistémicos sufren un efecto dilución a medida que la planta crece, requiriendo mayor tiempo de alimentación por parte del vector para ser eficaces. Dado el corto periodo de tiempo que puede requerir D. maidis para transmitir la enfermedad, el curasemilla puede no evitar la infección, pero contribuirá a mantener bajas las poblaciones por un mayor periodo de tiempo.
.
.
Video
Spiroplasma en Maíz CSS – Actualización y manejo de la enfermedad (PIONEER)
Spirochetes seen through a compound microscope
.
Bibliografía
Pioneer (2019) Spiroplasma (CSS). Actualización y manejo de la enfermedad.
Doenças causadas por molicutes e por vírus. EMBRAPA
Ammar el-D, Fulton D, Bai X, Meulia T, Hogenhout SA (2004) An attachment tip and pili-like structures in insect- and plant-pathogenic spiroplasmas of the class Mollicutes. Archives of Microbiology 181(2): 97–105. doi: 10.1007/s00203-003-0630-8
Ammar ED, Hogenhout SA (2005) Use of Immunofluorescence Confocal Laser Scanning Microscopy to Study Distribution of the Bacterium Corn Stunt Spiroplasma in Vector Leafhoppers (Hemiptera: Cicadellidae) and in Host Plants. Annals of the Entomological Society of America 98(6): 820-826. doi: 10.1603/0013-8746(2005)098[0820:UOICLS]2.0.CO;2
Barros TSL, Davis RE, Resende RO, Dally EL (2001) Design of a polymerase chain reaction for specific detection of corn stunt spiroplasma. Plant Disease 85: 475-480. doi: 10.1094/PDIS.2001.85.5.475
Carloni E, Carpane P, Paradell S, Laguna I, Pecci MP (2013) Presence of Dalbulus maidis (Hemiptera: Cicadellidae) and of Spiroplasma kunkelii in the Temperate Region of Argentina. Journal of Economic Entomology 106(4): 1574-1581. doi: 10.1603/EC12323
Chen TA, Liao CH (1975) Cornstunt spiroplasma: Isolation, cultivation, and proof of pathogenicity. Science 188: 1015–17.
Chen TA, Davis RE (1979) Cultivation of spiroplasmas. In: The Mycoplasmas, Whitcomb RF, Tully JG, 3: 65–82. New York/San Francisco/London: Academic. Press, pp. 351.
Cisak E, Wójcik-Fatla A, Zając V, Sawczyn A, Sroka J, Dutkiewicz J (2015) Spiroplasma – an emerging arthropod-borne pathogen?. Ann Agric Environ Med. 22(4): 589-593. doi: 10.5604/12321966.1185758
da Costa RV, de Almeida REM, Cota LV, et al. (2023) Corn stunt disease complex increases charcoal rot (Macrophomina phaseolina) under field conditions. Trop. plant pathol. 48: 283–292. doi: 10.1007/s40858-023-00570-z
Davis RE, Worley JF, Whitcomb RF, et al. (1972) Helical filaments produced by a mycoplasma-1ike organism associated with corn stunt disease. Science 176: 521–23.
Davis RE, Worley JF (1973) Spiroplasma: motile, helical microorganism associated with corn stunt disease. Phytopathology 63: 403–408. doi: 10.1094/Phyto-63-403
Davis RE, Worley JF, Whitcomb RF, Ishijima T, Steere RL (1972) Helical filaments produced by a mycoplasmalike organism associated with corn stunt disease. Science 176: 521–523. doi: 10.1126/science.176.4034.521
Davis RE, Dally EL, Jomantiene J, Zhao Y, Roe B, Lin SP, Shao J (2005) Cryptic plasmid pSKU146 from the wall-less plant pathogen Spiroplasma kunkelii encodes an adhesin and components of a type IV translocation-related conjugation system. Plasmid 53(2): 179-190. doi: 10.1016/j.plasmid.2004.09.002
Davis RE, Shao J, Dally EL, Zhao Y, Gasparich GE, Gaynor BJ, et al. (2015) Complete genome sequence of Spiroplasma kunkelii strain CR2-3x, causal agent of corn stunt disease in Zea mays L. Genome Announce 3, e01216–e01215. doi: 10.1128/genomeA.0121
Druetta M, Luna I, Gimenez Pecci M (2018) El Achaparramiento del maíz por Corn Stunt Spiroplasma (CSS). INTA EEA Quimili. Link
Druetta M, Uhart S, Giménez Pecci MP (2019) Aspectos a considerar al evaluar el comportamiento de germoplasmas de maíz frente a Spiroplasma kunkelii bajo infección natural de Dalbulus maidis. Estación Experimental Agropecuaria Quimilí – Santiago del Estero. Link
Fletcher J, Melcher U, Wayadande A (2006) The Phytopathogenic Spiroplasmas. In: Dworkin M., Falkow S., Rosenberg E., Schleifer KH., Stackebrandt E. (eds) The Prokaryotes. Springer, New York, NY. doi: 10.1007/0-387-30744-3_30
Fudl-Allah AEA, Calavan EC, Igwegbe ECK (1971) Culture of a mycoplasma-like organism associated with stubborn disease of citrus. Phytopathology 61: 1321. (Abstr.).
Fudl-Allah AES, Calavan EC, Igwegbe ECK (1972) Culture of a mycoplasma-like organism associated with stubborn disease. Phytopathology 62: 729–31. (Abstr.).
Giménez Pecci MP, Laguna IG, Avila AO, De Remes Lenicov AMM, Virla E, Borgogno C, Nome CF, Paradell S (2002) Difusión del Corn Stunt Spiroplasma del maíz (Spiroplasma kunkelii) y del vector (Dalbulus maidis) en la República Argentina. Revista de la Facultad de Agronomía, La Plata 105(1): 1-8. ISSN 0041-8676
Haas ICR, Canale MC, Lopes JRS, et al. (2023) Biochemical modifications and corn stunt progression is dependent on maize susceptibility to Spiroplasma kunkelii infection. Trop. plant pathol. 48: 556–563. doi: 10.1007/s40858-023-00598-1
Jones TL, Medina RF (2020) Corn Stunt Disease: An Ideal Insect-Microbial-Plant Pathosystem for Comprehensive Studies of Vector-Borne Plant Diseases of Corn. Plants (Basel) 9(6): 747. doi: 10.3390/plants9060747
Koch A.L. (2007) Spirochetes and Spiroplasma and the Special Strategies for CWD (Cell Wall Deficient) Cells. In: The Bacteria: Their Origin, Structure, Function and Antibiosis. Springer, Dordrecht. doi: 10.1007/978-1-4020-3206-6_15
Konai M, Clark E, Camp M, et al. (1996) Temperature Ranges, Growth Optima, and Growth Rates of Spiroplasma (Spiroplasmatac
Lee IM, Davis RE (1988) New Developments in the Culture of Spiroplasma Kunkelii, The Corn Stunt Spiroplasma. In: Maramorosch K, Raychaudhuri SP (eds) Mycoplasma Diseases of Crops. Springer, New York, NY. doi: 10.1007/978-1-4612-3808-9_7
Lenardon SL, Laguna IG, Truol GA, Gordon DL, Bratfute OE, Gómez G (1992) Corn stunt spiroplasma en el cultivo de maíz del N.O. Argentino. V Congreso Nacional de Maíz y II Reunión Sudamericana. 11-13 Noviembre 1992. Pergamino, Argentina. IV: 10-17.
Lenardon SL, Laguna IG, Gordon DL, Truol GA, Gomez G, Bratfute OE (1993) Identification of corn stunt spiroplasma in maize from Argentina. Plant Disease 77(1): 100. doi: 10.1094/PD-77-0100C
Liao CH, Chen TA (1975) Inhibitory effect of corn stem extract on the growth of corn stunt spiroplasma. Proc. Am. Phytopathol. Soc. 2: 53. (Abstr.).
Liao CH, Chen TA (1997) Culture of Corn Stunt Spiroplasma in a Simple Medium. Phytopathology 67: 802-807. doi: 10.1094/Phyto-67-802
Liao CH, Chen TA (1977) Presence of spiroplasma—inhibitory substances in plant tissue extracts. Can. J. Microbiol. 26: 807–11.
Liao CH, Chen TA (1982) Media and methods for culture of spiroplasmas. In: Plant and Insect Mycoplasma Techniques. Daniels, M.J., Marhan, P.G., (eds.) pp. 174–200. London: Croom Helm. pp. 369.
Liu P, Zheng H, Meng Q, Terahara N, Gu W, Wang S, Zhao G, Nakane D, Wang W and Miyata M (2017) Chemotaxis without Conventional Two-Component System, Based on Cell Polarity and Aerobic Conditions in Helicity-Switching Swimming of Spiroplasma eriocheiris. Frontiers in Microbiology 8: 58. doi: 10.3389/fmicb.2017.00058
McNeil CJ, Araujo K, Godfrey K, Slupsky CM (2023) Metabolite Signature and Differential Expression of Genes in Washington Navel Oranges (Citrus sinensis) Infected by Spiroplasma citri. Phytopathology 113(2): 299-308. doi: 10.1094/PHYTO-05-22-0177-R
Oliveira CM, Lopes JRS, Nault LR (2013) Survival strategies of Dalbulus maidis during maize off-season in Brazil. Entomol Exp Appl, 147: 141-153. doi: 10.1111/eea.12059
Oliveira CM, de Oliveira Sabato E, Barros BA (2023) Natural infectivity of Dalbulus maidis populations and incidence of corn stunt and virus diseases in maize over time. Trop. plant pathol. 48: 575–580. doi: 10.1007/s40858-023-00599-0
Ozbek E, Miller SA, Meulia T, Hogenhout SA (2003) Infection and replication sites of Spiroplasma kunkelii (Class: Mollicutes) in midgut and Malpighian tubules of the leafhopper Dalbulus maidis. Journal of Invertebrate Pathology 82(3): 167-175. doi: 10.1016/S0022-2011(03)00031-4
Perilla-Henao LM and Casteel CL (2016) Vector-Borne Bacterial Plant Pathogens: Interactions with Hemipteran Insects and Plants. Frontiers in Plant Science 7: 1163. doi: 10.3389/fpls.2016.01163
Pinto CB, Carmo DdGd, Santos JLd, et al. (2023) Sampling Methodology of a Key Pest: Technique and Sampling Unit for Evaluation of Leafhopper Dalbulus maidis Populations in Maize Crops. Agriculture 13(7): 1391. doi: 10.3390/agriculture13071391
Saglio P, Laflèche D, Bonissol C, Bove JM (1971) Isolement, culture et observation au microscope electronique des structures de type mycoplasme associees a la maladie due stubborn des agrumes et leur comparaison avec les structures observees dans le cas de la maladie du greening des agrumes. Physiol. Veg. 9: 569–82.
SENASICA (2014) Protocolo de Diagnóstico de Spiroplasma kunkelii mediante técnicas de biología molecular (PCR).
Shaevitz JW, Lee JY, Fletcher DA (2005) Spiroplasma swim by a processive change in body helicity. Cell 122(6): 941-945. doi: 10.1016/j.cell.2005.07.004
Virla EG, Díaz CG, Carpane P, Laguna IG, Ramallo J, Gómez LG, Giménez-Pecci MP (2004) Evaluación preliminar de la disminución en la producción de maíz causada por el “Corn stunt spiroplasma” (CSS) en Tucumán, Argentina. Bol . San. Veg. Plagas 30: 257-267. Link
Williamson DC, Whitcomb RF (1975) Plant mycoplasmas: A cultivable spiroplasma causes corn stunt disease. Science 188: 1018–20.
Whitcomb RF, Tully JG (1979) The Mycoplasmas V3: Plant and Insects Mycoplasmas. Academic Press