.
Condición fitosanitaria: Presente
Grupo de cultivos: Cereales
Especie hospedante: Cebada (Hordeum vulgare; Hordeum vulgare var. distichon (L.) Hook.f., 1896)
Rango de hospedantes: Además de infectar cebada, R. collo-cygni también se ha sido aislado de trigo, avena, maíz y una serie de pastos no cultivados, como Agropyron repens, lo que sugiere un amplio rango de hospedantes (Salamati y Reitan, 2006). Las interacciones compatibles con muchas de estas gramíneas son microscópicamente similares a la infección de la cebada (Kaczmarek et al., 2017).
Epidemiología: considerada monocíclica (enfermedad oligocíclica). Subaguda.
Etiología: Hongo. Hemibiotrófico
Agente causal: Ramularia collo-cygni B. Sutton & J. M. Waller, 1988 (Synonyms: Ophiocladium hordei Cav.; Ovularia hordei (Cav.) R. Sprague; Ramularia hordeicola U. Braun)
Taxonomía: Fungi > Dikarya > Ascomycota > Pezizomycotina > Dothideomycetes > Capnodiales > Mycosphaerellaceae > Ramularia
.
.
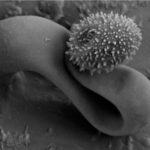
- 12 Clusters (racimos) de esporas (conidios) de Ramularia collo-cygni en la superficie de hoja de cebada. Observación con micrografía electrónica de barrido (Scanning Electron Microscopy, SEM). Fuente: BASF
- 13 Espora (conidio) de Ramularia collo cygni con el distintivo conidióforo curvado con forma de «cuello de cisne». Observación con micrografía electrónica de barrido (Scanning Electron Microscopy, SEM). Fuente: BASF
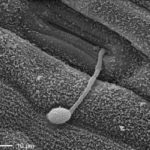
- 14 Espora (conidio) germinado, donde se observa que el tubo germinativo del cóndilo crece directamente hacia el poro estomático e infesta la hoja. Autores: Stabentheiner et al., 2009
.
- Esporulación (conidios en conidióforos libres) en la superficie abaxial de una hoja de cebada (izquierda: microscopio óptico; derecha: microscopio electrónico de barrido ambiental). Autor: Zamani-Noor, 2011.
.
.
.
Antecedentes
Esta enfermedad fue detectada por primera vez en Argentina en el año 2001 (Khier et al., 2002). En esa oportunidad todas las variedades fueron atacadas incluyendo a la actual y ampliamente sembrada Scarlett. Su presencia fue detectada en Bragado, Coronel Dorrego, Coronel Suárez, Guisasola, Puán y Tres Arroyos a partir del estado de espigazón en lotes con diferentes antecesores y tipos de labranza. En estos campos la incidencia foliar fue del 100% y la severidad del 60 al 100%. Luego en 2002, la enfermedad se presentó en plantas guachas de cebada y en raygrass (Tres arroyos), pero su intensidad fue menor al igual que en los años posteriores.
En la campaña 2012, muestras de cebada en estado de inicio de grano lechoso provenientes de lotes de Piamonte, provincia de Santa Fe, se confirmó la enfermedad a través de la incubación y observación de las fructificaciones típicas del patógeno. Muestras con síntomas similares con aproximadamente 40-60% de severidad también fueron recolectadas en Las Parejas, Piamonte, Vicuña Makena y zonas aledañas.
.
Sintomatología
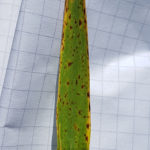
En los estados iniciales del desarrollo de la enfermedad el diagnóstico es difícil. Se observan sobre las hojas pequeñas lesiones irregulares (salpicado) y marrones. Estos síntomas también se encuentran en el tallo y en las vainas foliares que lo recubren, y a veces en las espigas, glumas y aristas. Al comienzo las lesiones apenas son visibles al ojo humano, siendo pequeñas y muy separadas una de otras; miden entre 1 y 3 mm de largo por 0.5 mm de ancho.
.
- Sintomas iniciales de manchas por Ramularia. Autor: Olga Lastovetsky
.
Estas pequeñas manchas pueden ser confundidas con síntomas producidos por otros patógenos, como por ejemplo Drechslera teres (comienzo de la mancha en red), Bipolaris sorokiniana (mancha borrosa) o Rhynchosporium secalis (escaldadura), enfermedades fisiológicas y deficiencias nutricionales. Sin embargo, algunos aspectos inequívocos para diferenciarla de las manchas fisiológicas son que las manchas por Ramularia son visibles en ambos lados de las hojas y generalmente presentan un halo clorótico, a diferencia de las manchas fisiológicas que son superficiales y sin halo clorótico.
Otro aspecto diferencial es la ubicación de las lesiones de Ramularia en tallos, hojas y vainas; las de origen fisiológico casi siempre están sólo en las hojas. Asimismo, Ramularia ataca a todas las variedades de cebada, mientras que las lesiones fisiológicas están asociadas a algunas variedades.
Luego las lesiones se desarrollan en típicas manchas marrón oscuro, de forma rectangular de alrededor de 2 x 0,5 mm de tamaño. Estas lesiones se unifican y se desarrollan a lo largo de la hoja, siguiendo la disposición de los estomas. El centro de las lesiones se oscurece, y los bordes están rodeados por un halo clorótico, rodeado a su vez por tejido verde.
El hongo se observa más fácilmente sobre el tejido muerto o necrótico. A medida que la planta crece, el hongo coloniza generando la toxina denominada rubelina (toxina hospedante no específica), que acelera la senescencia. En estadios avanzados de la enfermedad el tejido foliar comienza a morir observándose clorosis generalizada y posteriormente senescencia, provocando una “entrega” anticipada del cultivo.
En el envés de las hojas, bajo lupa se observan conidióforos hialinos en fascículos dispuestos en líneas, generalmente a lo largo de las nervaduras y emergen a través de los estomas. Los conidióforos son curvados con un aspecto de «cuello de cisne» que le ha dado el origen al nombre de su especie. Presenta conidios hialinos pequeños (esporas translucidas) fácilmente dispersados por el viento. Estas esporas de origen asexual (conidios) no están asociados con las manchas negras rectangulares.
Condiciones de elevada humedad hacia el final del ciclo puede llevar a coloración rojiza alrededor de las típicas manchas rectangulares sobre tejido muerto.
Las manchas también pueden observarse sobre vainas y aristas.
Hacia macollaje Ramularia se desarrolla en las hojas inferiores que mueren en forma natural o como consecuencia de estrés (deficiencia nutricional, condiciones climáticas adversas, fitotoxicidad, etc.). Es inusual encontrar síntomas de Ramularia en hojas nuevas recién emergidas. Hacia floración se produce un importante estrés natural para las plantas, y los síntomas de Ramularia son más evidentes en las hojas superiores. No es posible detectar las lesiones en semillas, por lo que su presencia debe ser diagnosticada por métodos moleculares.
.
- Evolución de síntomas de Ramulariosis. Autor: Zamani-Noor, 2011
.
Daños
La Ramulariosis acelera la senescencia y afecta el número, peso y tamaño de los granos de cebada. Los daños promedio en el rendimiento son de alrededor del 20%, disminuyendo el número y el peso de los granos.
.
Epidemiología
La dispersión e introducción del patógeno en nuevas áreas es principalmente a través de la semilla infectada. Otras fuentes de inóculo son el rastrojo infectado, plantas guachas y hospedantes alternativos (avena, trigo, centeno) infectados.
Si bien parece haber siempre inóculo en la región pampeana, como la presencia de la enfermedad es esporádica, es necesario investigar más acerca de las variables ambientales que desencadenan la dispersión, esporulación e infección por parte de Ramularia collo-cygni. En relación a los factores de riesgo y epidemiológicos, si bien no están del todo comprendidos estarían relacionados con la siembra de variedades susceptibles, monocultivo y un ciclo característicamente lluvioso que aseguren las horas de mojado.
El viento lleva a grandes distancias las esporas pequeñas y livianas. Se estima además que existe un componente abiótico acompañante del hongo. Los rayos ultravioleta y el ozono están probablemente vinculados con la enfermedad.
La enfermedad posee una fase inicial de latencia muy prolongada, en la cual el hongo vive en el interior de las plantas asintomáticas como endófito y recién luego de la floración y en presencia de luz, emergen súbitamente las lesiones sobre el tejido foliar. Durante la fase endofítica el hongo vive dentro de la planta sin producir daños. Aún hay una falta de conocimiento sobre la transición de la fase endofítica a la etapa patogénica. Actualmente, estudios moleculares están siendo llevados a cabo en Europa para poder elucidar los mecanísmos involucrados en esta transición.
La enfermedad causa una rápida senescencia y “entrega” del cultivo y está asociada la producción de la toxina fúngica del grupo de las rubelinas que se activa en presencia de luz. El ataque y la severidad, están estrechamente asociados al stress oxidativo y a la caída de las defensas de la planta a partir de floración.
Las lluvias juegan un rol muy importante en la dispersión de las esporas y en proporcionar las horas de mojado foliar necesarias para la germinación de las esporas, penetración del hongo y establecimiento de la infección. El hongo esporula muy abundantemente y de acuerdo con Minihofer (2003) se calcula una masa de 3 ×10exp12 conidios/ha desde un campo severamente afectado por la enfermedad.
Los conidios son secos, pequeños y livianos por lo que el viento los puede llevar a grandes distancias. La esporulación ocurre fundamentalmente sobre tejido necrótico. La duración del mojado foliar está asociado a la severidad final alcanzada por la enfermedad. En rastrojos se ha observado en Europa la formación de fructificaciones denominadas asteromella, pero aún no se conocen sus implicancias epidemiológicas.
.
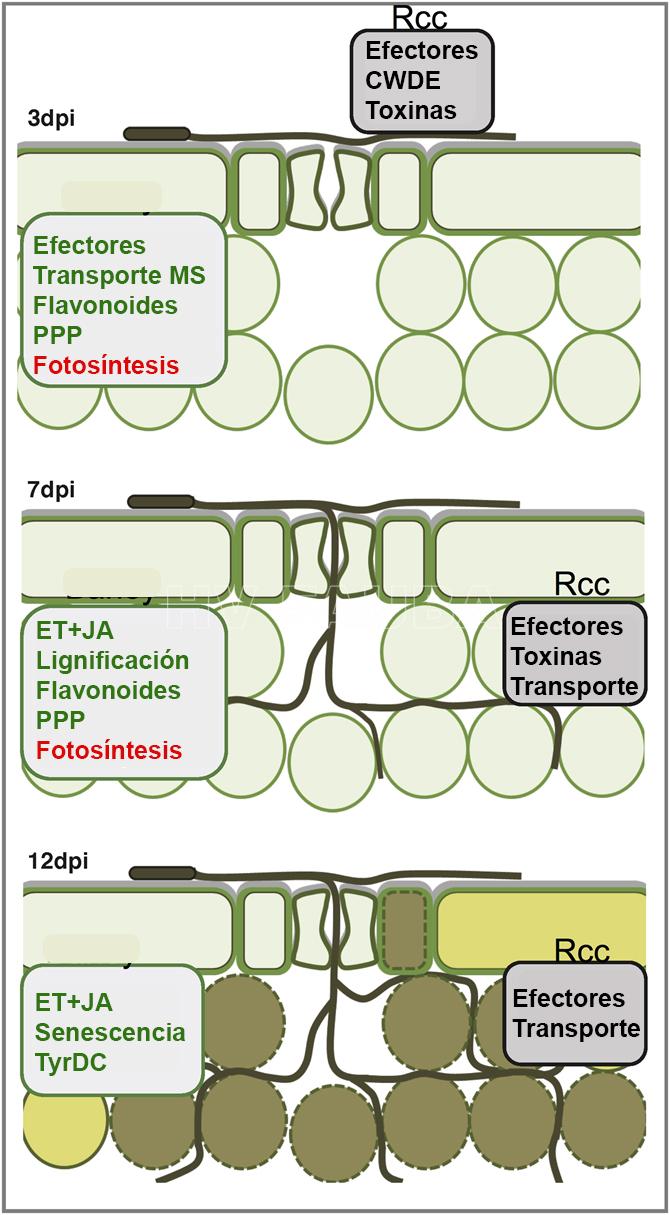
- Representación esquemática de la infección de cebada por Ramularia collo-cygni (Rcc) y los principales componentes moleculares asociados identificados como inducidos o regulados a la baja en los tres puntos de tiempo (3, 7 y 12 días post infección [dpi]) en R. collo-cygni y cebada. A los 3 dpi, hay crecimiento del hongo patógeno en la superficie de la hoja y las células de cebada están vivas; a los 7 dpi, hay crecimiento de hifas en el mesófilo y las células de cebada están vivas; a los 12 dpi, hay crecimiento de hifas en el mesófilo y se observa clorosis en las hojas de cebada y necrosis (muerte celular). CWDE = enzimas que degradan la pared celular, MS = metabolitos secundarios, PPP = vía fenilpropanoide, ET = señalización de etileno, JA = señalización de ácido jasmónico y TyrDC = tirosina descarboxilasa. Autor: Sjokvist et al.,, 2019.
.
Factores de riesgo
* Variedades susceptibles y monocultivo es una de las combinaciones que más predisponen a epidemias, en conjunto con el resto de los factores predisponentes.
* La infección está muy relacionada con las horas de mojado, frecuencia e intensidad de las lluvias. Los anegamientos son un factor de estrés muy importante en lotes de cebada que predispone al ataque por Ramularia.
* Cultivos con balance nutricional desfavorable (ej. falta de fertilización nitrogenada en variedades malteras cervecera) fertilizantes limitados mostrarán síntomas foliares Ramularia antes que los cultivos de cebada de alimentación donde el nitrógeno es menos limitante.
* El stress sufrido por las plantas (nutricional, fisiológico, etc) parece ser un desencadenante crucial, especialmente el stress por anegamiento.
.
Medidas de manejo integrado
* La medida ideal sería contar con variedades resistentes o al menos tolerantes (actualmente todas las variedades son susceptibles).
* Control químico: al ser una enfermedad de muy difícil diagnóstico, ante años climáticamente predisponentes a epidemias, se debe realizar un test de diagnóstico molecular desde macollaje. Hay dos test posibles: ELISA serológico y PCR Molecular.
* Es importante conocer el grado de infección de las semillas, particularmente en regiones donde la enfermedad nunca estuvo presente o no es una amenaza importante. En regiones donde la enfermedad aún no se ha establecido se recomienda utilizar semillas con menos de 1pg de DNA cada 100 ng de DNA total. En Europa, no se han logrado experiencias de buen control con tratamientos de semilla con fungicidas.
* Eliminación de plantas guachas, hospedantes susceptibles (Lolium).
.
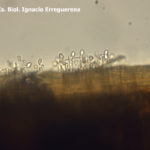
- 01 Síntomas de Ramulariosis (Ramularia collo-cygni) en cebada al inicio de floración. Autor: Lic. Cs. Biol. Ignacio Erreguerena, Laboratorio de Patología Vegetal, Unidad Integrada Balcarce INTA-FCA.
- 02 Síntomas de Ramulariosis (Ramularia collo-cygni) en cebada durante el llenado de grano, variedad Aliciana. Autor: Lic. Cs. Biol. Ignacio Erreguerena, Laboratorio de Patología Vegetal, Unidad Integrada Balcarce INTA-FCA.
- 03 Síntomas de Ramulariosis (Ramularia collo-cygni) en cebada, tercio superior del canopeo . Autor: Lic. Cs. Biol. Ignacio Erreguerena, Laboratorio de Patología Vegetal, Unidad Integrada Balcarce INTA-FCA.
- 04 Síntomas de Ramulariosis (Ramularia collo-cygni) en cebada, tercio medio del canopeo . Autor: Lic. Cs. Biol. Ignacio Erreguerena, Laboratorio de Patología Vegetal, Unidad Integrada Balcarce INTA-FCA.
- 05 Síntomas de Ramulariosis (Ramularia collo-cygni) en cebada, estrato medio marchito, año 2012. Autor: Lic. Cs. Biol. Ignacio Erreguerena, Laboratorio de Patología Vegetal, Unidad Integrada Balcarce INTA-FCA.
- 06 Síntomas leves de Ramulariosis (Ramularia collo-cygni) en variedad de cebada Andreia. Autor: Lic. Cs. Biol. Ignacio Erreguerena, Laboratorio de Patología Vegetal, Unidad Integrada Balcarce INTA-FCA.
- 07 Diferentes Síntomas de Ramulariosis (Ramularia collo-cygni) en cebada. Autor: Lic. Cs. Biol. Ignacio Erreguerena, Laboratorio de Patología Vegetal, Unidad Integrada Balcarce INTA-FCA.
- 08 Puntos necróticos de Ramulariosis (Ramularia collo-cygni) en estadios iniciales de cebada. Autor: Lic. Cs. Biol. Ignacio Erreguerena, Laboratorio de Patología Vegetal, Unidad Integrada Balcarce INTA-FCA.
- 09 Signo (conidios en conidióforos) de Ramularia collo-cygni en cebada. Autor: Lic. Cs. Biol. Ignacio Erreguerena, Laboratorio de Patología Vegetal, Unidad Integrada Balcarce INTA-FCA.
- 10 Signo (conidios en conidióforos) de Ramularia collo-cygni en cebada. Autor: Lic. Cs. Biol. Ignacio Erreguerena, Laboratorio de Patología Vegetal, Unidad Integrada Balcarce INTA-FCA.
- 11 Conidios con típico «cuello de cisne» en conidióforos libres de Ramularia collo-cygni en cebada, observación al microscopio. Autor: Lic. Cs. Biol. Ignacio Erreguerena, Laboratorio de Patología Vegetal, Unidad Integrada Balcarce INTA-FCA.
- 12 Clusters (racimos) de esporas (conidios) de Ramularia collo-cygni en la superficie de hoja de cebada. Observación con micrografía electrónica de barrido (Scanning Electron Microscopy, SEM). Fuente: BASF
- 13 Espora (conidio) de Ramularia collo cygni con el distintivo conidióforo curvado con forma de «cuello de cisne». Observación con micrografía electrónica de barrido (Scanning Electron Microscopy, SEM). Fuente: BASF
- 14 Espora (conidio) germinado, donde se observa que el tubo germinativo del cóndilo crece directamente hacia el poro estomático e infesta la hoja. Autores: Stabentheiner et al., 2009
- 01 Síntomas folaires de Ramularia en cebada variedad Danielle, Fontezuela, 2017/2018.
- 02 Síntomas folaires de Ramularia en cebada variedad Danielle, Fontezuela, 2017/2018.
- 03 Síntomas folaires de Ramularia en cebada variedad Danielle, Fontezuela, 2017/2018.
- 04 Síntomas folaires de Ramularia en cebada variedad Danielle, Fontezuela, 2017/2018.
- 05 Síntomas folaires de Ramularia en cebada variedad Danielle, Fontezuela, 2017/2018.
- 06 Síntomas folaires de Ramularia en cebada variedad Danielle, Fontezuela, 2017/2018.
- 07 Síntomas folaires de Ramularia en cebada variedad Danielle, Fontezuela, 2017/2018.
- 08 Síntomas folaires de Ramularia en cebada variedad Danielle, Fontezuela, 2017/2018.
- 09 Síntomas folaires de Ramularia en cebada variedad Danielle, Fontezuela, 2017/2018.
- 10 Síntomas folaires de Ramularia en cebada variedad Danielle, Fontezuela, 2017/2018.
- 11 Síntomas folaires de Ramularia en cebada variedad Danielle, Fontezuela, 2017/2018.
.
.
.
.
Bibliografía
Assinger T, Fountaine J, Torriani S, et al. (2022) Detection of Ramularia collo-cygni DMI- and SDHI-resistant field populations in Austria and the effect of fungicides on the population and genetic diversity. Eur J Plant Pathol. 162: 575–594. doi: 10.1007/s10658-021-02422-5
Beukes I, Jensen T, Coertze S (2016) First report of Ramularia collo-cygni infecting barley in South Africa. Journal of Plant Pathology 98(2): 369-377. doi: 10.4454/JPP.V98I2.043
Erreguerena IA, Havis ND, Heick TM, et al. (2022) Characterization of DMI, QoI and SDHI fungicides sensitivity of Ramularia collo-cygni isolates in Argentina. J Plant Dis Prot. doi: 10.1007/s41348-022-00645-0
, , , et al (2024) Comparative analysis of Argentinian and European populations of Ramularia collo-cygni on barley. Plant Pathology 00: 1–9. doi: 10.1111/ppa.13872
Frei P, Gindro K, Richter H, Schürch S (2007) Direct-PCR Detection and Epidemiology of Ramularia collo-cygni Associated with Barley Necrotic Leaf Spots. Journal of Phytopathology, 155: 281–288. doi: 10.1111/j.1439-0434.2007.01228.x
Harvey I (2002) Epidemiology and control of leaf and awn spot of barley caused by Ramularia collo-cygni. N Z Plant Prot 55: 331-335. doi: 10.30843/nzpp.2002.55.3901
Harvey (2002) Epidemiology and control of leaf and awnspot of barley caused by Ramulariacollo-cygni. New Zealand Plant Protection 55: 331-335. Link
Havis ND, Nyman M, Oxley SJP (2014) Evidence for seed transmission and symptomless growth of Ramularia collo-cygni in barley (Hordeum vulgare). Plant Pathology 63: 929–936. doi: 10.1111/ppa.12162
Havis ND, Gorniak K, Carmona MA, et al. (2014) First Molecular Detection of Ramularia Leaf Spot (Ramularia collo-cygni) in Seeds and Leaves of Barley in Argentina. Plant Disease 98(2): 277. doi: 10.1094/PDIS-04-13-0416-PDN
Havis ND, Brown JKM, Clemente G, et al. (2015) Ramularia collo-cygni—An emerging pathogen of barley crops. Phytopathology 105: 895-904. doi: 10.1094/PHYTO-11-14-0337-FI
Hjortshøj RL, Ravnshøj AR, Nyman M, et al. (2013) High levels of genetic and genotypic diversity in field populations of the barley pathogen Ramularia collo-cygni. European Journal of Plant Pathology 136(1): 51-60. doi: 10.1007/s10658-012-0137-8
Hoheneder F, Hofer K, Groth J, et al. (2021) Ramularia leaf spot disease of barley is highly host genotype-dependent and suppressed by continuous drought stress in the field. J Plant Dis Prot. doi: 10.1007/s41348-020-00420-z
Kaczmarek M, Piotrowska MJ, Fountaine JM, et al. (2017) Infection strategy of Ramularia collo-cygni and development of ramularia leaf spot on barley and alternative graminaceous hosts. Plant Pathology 66: 45–55. doi: 10.1111/ppa.12552
Kiiker R, Juurik M, Mäe A (2021) Fungicide Resistance Evolving in Ramularia collo-cygni Population in Estonia. Microorganisms 9(7): 1514. doi: 10.3390/microorganisms9071514
Knight NL, Moslemi A, Begum F, et al. (2022) Detection of Ramularia collo-cygni from barley in Australia using triplex quantitative and droplet digital PCR. Pest Manag Sci. 78: 1367-1376. doi: 10.1002/ps.6753
Leisova-Svobodova L, Matusinsky P, Kucera L (2012) Variability of the Ramularia collo-cygni Population in Central Europe. Journal of Phytopathology 160: 701–709. doi: 10.1111/jph.12017
Lemcke R, Sjökvist E, Visentin S, et al. (2021) Deciphering Molecular Host-Pathogen Interactions During Ramularia collo-cygni Infection on Barley. Front. Plant Sci. 12: 747661. doi: 10.3389/fpls.2021.747661
Makepeace JC, Oxley SJP, Havis ND, et al. (2007) Associations between fungal and abiotic leaf spotting and the presence of mlo alleles in barley. Plant Pathology 56: 934–942. doi: 10.1111/j.1365-3059.2007.01680.x
Makepeace JC, Havis ND, Burke JI, et al. (2008) A method of inoculating barley seedlings with Ramularia collo-cygni. Plant Pathology 57: 991–999. doi: 10.1111/j.1365-3059.2008.01892.x
Matusinsky P, Svobodova-Leisova L, Mariks P, et al. (2010) Frequency of a mutant allele of cytochrome b conferring resistance to Ool fungicides in the Czech population of Ramularia collo-cygni. Journal of Plant Diseases and Protection 117(6): 248–252. doi: 10.1007/BF03356369
Matzen N, Weigand S, Bataille C, et al. (2024) EuroBarley: control of leaf diseases in barley across Europe. J Plant Dis Prot. doi: 10.1007/s41348-023-00852-3
Matusinsky P, Leisova-Svobodova L, Gubis J, et al. (2011) Impact of the seed-borne stage of Ramularia collo-cygni in barley seed. Journal of Plant Pathology 93(3): 679-689.
Matušinsky P, Hanusová M, Stemberková L, et al. (2013) Response of spring barley cultivars to Ramularia leaf spot in conditions of the Czech Republic. Cereal Research Communications 41: 126-132. doi: 10.1556/CRC.2012.0023
McGrann GRD, Stavrinides A, Russell J, et al. (2014) A trade off between mlo resistance to powdery mildew and increased susceptibility of barley to a newly important disease, Ramularia leaf spot. Journal of Experimental Botany 65(4): 1025–1037. doi: 10.1093/jxb/ert452
McGrann GRD, Steed A, Burt C, et al. (2015) Contribution of the drought tolerance-related Stress-responsive NAC1 transcription factor to resistance of barley to Ramularia leaf spot. Molecular Plant Pathology 16: 201–209. doi: 10.1111/mpp.12173
McGrann GR, Andongabo A, Sjökvist E, et al. (2016) The genome of the emerging barley pathogen Ramularia collo-cygni. BMC Genomics 17: 584. doi: 10.1186/s12864-016-2928-3
McGrann GR, Havis ND (2017) Ramularia leaf spot: a newly important threat to barley production. Outlooks Pest Manag 28(2): 65–69. doi: 10.1564/v28_apr_05
McGrann GRD, Brown JKM (2018) The role of reactive oxygen in the development of Ramularia leaf spot disease in barley seedlings. Ann Bot. 121(3): 415-430. doi: 10.1093/aob/mcx170
McGrann GRD, Miller S, Havis ND (2020) The ENHANCED MAGNAPORTHE RESISTANCE 1 locus affects Ramularia leaf spot development in barley. Eur J Plant Pathol 156: 123–132. doi: 10.1007/s10658-019-01869-x
Miethbauer S, Heiser I, Liebermann B (2003) The Phytopathogenic Fungus Ramularia collo-cygni Produces Biologically Active Rubellins on Infected Barley Leaves. Journal of Phytopathology 151: 665–668. doi: 10.1046/j.1439-0434.2003.00783.x
Mulhare J, Creissen HE, Kildea S (2021) Effectiveness of varietal resistance and risk prediction for the control of ramularia leaf spot of barley under Irish growing conditions. Crop Protection 139: 105317. doi: 10.1016/j.cropro.2020.105317
Nyman M, Havis ND, Oxley SJP (2009) Importance of seed-borne infection of Ramularia collo-cygni. Asp. Appl. Biol. 92:91-96.
Oxley SJP, Havis ND (2009) Understanding Ramularia collo-cygni in the past, present and future. Asp. Appl. Biol. 92:141-146.
Oxley SJP, Havis ND (2010) Managing Ramularia collo-cygni through varietal resistance, seed health and forecasting. HGCA Project Rep. 463. Online publication.
Peraldi A, Griffe LL, Burt C, et al. (2014) Brachypodium distachyon exhibits compatible interactions with Oculimacula spp. and Ramularia collo-cygni, providing the first pathosystem model to study eyespot and Ramularia leaf spot diseases. Plant Pathology 63: 554–562. doi: 10.1111/ppa.12114
Piotrowska MJ (2015) Evaluating the risk of fungicide resistance evolution to succinate dehydrogenase inhibitors in Ramularia collo-cygni. Doctorate Thesis, University of Edinburgh. 261 p.
Piotrowska MJ, Fountaine JM, Ennos RA, et al. (2017) Characterisation of Ramularia collo-cygni laboratory mutants resistant to succinate dehydrogenase inhibitors. Pest Management Science 73: 1187–1196. doi: 10.1002/ps.4442
Piotrowska MJ, Ennos RA, Fountaine JM, et al. (2016) Development and use of microsatellite markers to study diversity, reproduction and population genetic structure of the cereal pathogen Ramularia collo-cygni. Fungal Genetics and Biology 87: 64–71. doi: 10.1016/j.fgb.2016.01.007
Minihofer T (2003) Untersuchungen an Ramularia collo-cygni – einem parasitischen Pilz auf Gerste. pp. 96. Diplomarbeit, Institut für Pflanzenphysiologie der Universität Graz.
Rehfus A, Matusinsky P, Strobel D, et al. (2019) Mutations in Target Genes of Succinate Dehydrogenase Inhibitors and Demethylation Inhibitors in Ramularia Collo-Cygni in Europe. J. Plant Dis. Prot. 126: 447–459. doi: 10.1007/s41348-019-00246-4
Sachs E (2006) The history of research into Ramularia leaf spot on barley. Nachrichtenbl. Deut. Pflanzenschutzd. 58 (7): S. 186–189.
Salamati S, Reitan L (2006) Ramularia collo-cygni on spring barley, an overview of its biology and epidemiology. Pages 19-35 in: Proc. First Eur. Ramularia Workshop, B. Koopmann, S. Oxley, A. Schützendübel, and A. von Tiedemann, eds. Georg-August-University, Göttingen, Germany.
Schützendübel A, Stadler M, Wallner D, Von Tiedemann A (2008) A hypothesis on physiological alterations during plant ontogenesis governing susceptibility of winter barley to Ramularia leaf spot. Plant Pathology, 57: 518–526. doi: 10.1111/j.1365-3059.2007.01820.x
Sjokvist E, Lemcke R, Kamble M, et al. (2019) Dissection of Ramularia Leaf Spot Disease by Integrated Analysis of Barley and Ramularia collo-cygni Transcriptome Responses. Mol Plant Microbe Interact. 32(2): 176-193. doi: 10.1094/MPMI-05-18-0113-R
Sooväli P, Tikhonova M, Matušinsky P (2014) First Report of Ramularia Leaf Spot Caused by Ramularia collo-cygni on Leaves and Seeds of Barley in Estonia. Plant Disease 98: 7: 997-997. doi: 10.1094/PDIS-10-13-1035-PDN
Stabentheiner E, Minihofer T, Huss H (2009) Infection of Barley by Ramularia collo-cygni: Scanning Electron Microscopic Investigations. Mycopathologia 168: 135. doi: 10.1007/s11046-009-9206-8
Stam R, Sghyer H, Münsterkötter M, et al. (2017) The evolutionary history of the current global Ramularia collo-cygni epidemic. bioRxiv 215418. doi: 10.1101/215418
Stam R, Sghyer H, Tellier A, et al. (2019) The Current Epidemic of the Barley Pathogen Ramularia collo-cygni Derives from a Population Expansion and Shows Global Admixture. Phytopathology 109(12): 2161-2168. doi: 10.1094/PHYTO-04-19-0117-R
Taylor JMG, Paterson LJ, Havis ND (2010) A quantitative real-time PCR assay for the detection of Ramularia collo-cygni from barley (Hordeum vulgare). Letters in Applied Microbiology 50: 493–499. doi: 10.1111/j.1472-765X.2010.02826.x
Thirugnanasambandam A, Wright KM, Havis N, et al. (2011) Agrobacterium-mediated transformation of the barley pathogen Ramularia collo-cygni with fluorescent marker tags and live tissue imaging of infection development. Plant Pathology 60: 929–937. doi: 10.1111/j.1365-3059.2011.02440.x
Videira SI, Groenewald JZ, Verkley GJ, et al. (2015) The rise of Ramularia from the Mycosphaerella labyrinth. Fungal Biology 119(9): 823-43. doi: 10.1016/j.funbio.2015.06.003
Videira SIR, Groenewald JZ, Braun U, et al. (2016) All that glitters is not Ramularia. Studies in Mycology 83: 49-163. doi: 10.1016/j.simyco.2016.06.001
Walters DR, Havis ND, Oxley SJP (2008) Ramularia collo-cygni: The biology of an emerging pathogen of barley. FEMS Microbiol. Lett. 279: 1-7. doi: 10.1111/j.1574-6968.2007.00986.x
Walters DR, Avrova A, Bingham IJ, et al. (2012) Control of foliar diseases in barley: Towards an integrated approach. European Journal of Plant Pathology 133: 33-73. doi: 10.1007/s10658-012-9948-x
Zamani-Noor N (2011) Studies on Ramularia leaf spots on barley—Resistance phenotyping, epidemiology and pathogenicity. Ph.D. thesis, Georg-August-University Göttingen, Germany.