.
Condición fitosanitaria: Plaga no cuarentenaria reglamentada
Grupo de cultivos: Hortícolas
Especie hospedante: Papa (Solanum tuberosum)
Rango de hospedantes: infecta papa, tomate y otras Solanáceas silvestres y cultivadas.
Transmisión: áfidos, NO persistente.
Etiología: Virus (biotrófico como todos los virus)
Agente causal: Potato virus Y (PVY)
Taxonomía: Viruses > Riboviria > Orthornavirae > Pisuviricota > Stelpaviricetes > Patatavirales > Potyviridae > Potyvirus
ICTV: Positive Sense RNA Viruses > PVY
Baltimore classification: Group IV: ssRNA(+) Baltimore, 1971
.
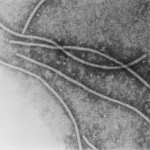
- Representación de la superficie del filamento PVY. Autor: Kežar et al., 2019.
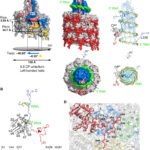
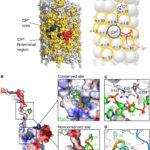
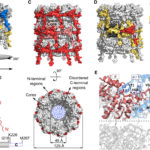
- Representación esquemática de la estructura del virión PVY. Autor: Kežar et al., 2019.
- Representación esquemática de la estructura del virión PVY. Autor: Kežar et al., 2019.
.
.
Antecedentes
Junto con PLRV, PVY es considerado la principal causa de la degeneración de la papa. Las pérdidas pueden llegar al 40%. Presenta dos razas: Yº (es la más perjudicial en papa) y Yn (necrótica en tabaco). Esta virosis está presente en todas las zonas productoras de papa en Argentina. El virus Y de la papa (PVY) es uno de los agentes patógenos más comunes de la producción de papa en todo el mundo. El PVY es ubicuo en las áreas de cultivo de papa y esta expansión probablemente se deba a la diseminación de inóculos a través de cultivares de papa asintomáticos (Piche et al. 2004). Este virus vegetal, transmitido por áfidos, es el miembro tipo del género Potyvirus (Familia Potyviridae) (De Bokx y Huttinga 1981). Se especula que el PVY probablemente se llevó por primera vez a Europa desde América del Sur en el siglo XVI, al ser diseminado en tubérculos (Fuentes et al., 2019).
.
Síntomas
Esta enfermedad causa necrosis a nivel de los tallos y de las nervaduras en la cara inferior de las hojas en el primer año de infección y un severo mosaico, a partir del segundo. Las hojas se desecan y quedan adheridas a la planta.
Ocasiona graves daños: tubérculos pequeños y deformados, y reduce drásticamente los rendimientos.
El virus Y de la papa posee varias razas. Éstas se caracterizan de acuerdo con los síntomas sistémicos o locales que el aislado induce sobre tabaco (Nicotiana tabacum) y sobre papa (Solanum tuberosum). Los síntomas que producen pueden ser mosaico leve a severo y anillos necróticos en los tubérculos dependiendo de la raza. Originalmente, Singh et al. (2008) describieron cinco cepas diferentes PVYC, PVYO, PVYN, PVYZ y PVYE basadas en la resistencia hipersensible o respuesta de hipersensibilidad (HR) en cultivares de papa que albergan genes N específicos y por sus diferentes síntomas en Nicotiana tabacum cv. Samsun: PVYN se caracterizó por producir necrosis de las venas (NV) en hojas de N. tabacum, donde PVYC, PVYO, PVYZ y PVYE inducen síntomas de mosaico. La caracterización genómica de los aislados de PVY reveló que muchos de ellos tienen genomas recombinantes compuestos por fragmentos de secuencias de PVYO y PVYN (Lorenzen et al. 2006, 2008; Karasev y Gray 2013). Lorenzen y col. (2006) describieron las regiones del genoma donde la recombinación tiene lugar con frecuencia, y las denominaron regiones de puntos calientes (HSR, del inglés: Hot Spot Regions). Los tres recombinantes mejor estudiados son PVYNTN (que contiene de tres a cuatro uniones de recombinación), PVYN-Wi y PVYN:O, que tienen dos y una uniones recombinantes, respectivamente (Glais et al.2002; Nie et al.2004; Lorenzen et al. al.2006; Singh et al.2008). PVYNTN es capaz de inducir la necrosis de la tuberculos, y este síntoma a menudo se conoce como enfermedad de la mancha anular necrótica de la papa (PTNRD) (Le Romancer et al. 1994). Se supuso que PVYN-Wi era un aislado más virulento y agresivo de PVYN, pero relacionado serológicamente con PVYO (Chrzanowska, 1994). Desde entonces, se reportaron aislamientos con las mismas características en Canadá (McDonald y Singh 1996), España (Blanco-Urgoiti et al. 1998) y Francia (Kerlan et al., 1999). En Canadá y EE. UU., Los aislamientos que presentaban características similares a PVYN-Wi se denominaron PVYN:O (Singh et al. 2003). Además, los aislamientos de los grupos de cepas PVYZ y PVYE presentaron genomas recombinantes, y se encontró que algunos de ellos no eran necróticos en tabaco (Hu et al. 2009; Kerlan et al., 2011; Galvino-Costa et al. 2011). En América del Sur, se ha reportado la cepa PVYNTN en Perú, donde no causa anillos necróticos en cultivares nativos andinos, pero induce síntomas que pueden confundirse con los causados por otros patógenos (Salazar et al. 2000). La presencia de las variantes PVYNTN también se ha confirmado en campos comerciales de papa en México (Hernández de la Cruz et al. 2007; Quintero-Ferrer y Karasev 2013), en Brasil (De Ávila et al. 2009; GalvinoCosta et al. 2012). y Colombia (Gil et al. 2011). En los campos de producción de papa de Argentina, las cepas PVYN y PVYO han coexistido, siendo la cepa PVYN la que tuvo una prevalencia histórica (Butzonitch et al. 1996). Desde 1996, evaluaciones visuales en tubérculos provenientes de diferentes áreas del país mostraron síntomas de PTNRD, y se relacionaron con PVY mediante pruebas serológicas (Colavita et al., 2007). La presencia de aislados de la cepa PVYNTN se confirmó posteriormente mediante amplificación con primers específicos diseñados por Schubert et al. (2007), (Colavita 2010). Históricamente no se llevó a cabo un estudio sistemático de los aislados de PVY de papa en Argentina. Además, no se dispuso de información completa sobre los aislamientos de PVY presentes en Argentina, ni una caracterización sistemática utilizando indicadores biológicos como pruebas de patogenicidad sobre tabaco o cultivares de papa susceptibles, combinados con herramientas moleculares modernas. Recientemente, Colavita et al. (2017) caracterizaron 46 aislamientos de PVY de diferentes regiones productoras de papa de Argentina, tanto biológica como serológicamente, seleccionando cinco de ellos para realizar análisis genómicos adicionales. De cada aislamiento se secuenciaron cuatro fragmentos genómicos que contenían cuatro regiones claves de recombinación (HSR) reportadas previamente y se compararon con los genomas de referencia PVYN (CS434575.1) y PVYO (U09509.1) en busca de recombinaciones genómicas. Entre estas, se identificaron aislamientos con uno, dos o tres puntos de recombinación, incluyendo en las dos razas consideradas típicas, PVYN (RCA5b) y PVYO (SSF18), usadas como controles. Este es el primer reporte en Argentina de la presencia de cepas de PVY recombinantes. Estas investigaciones revelaron la diversidad genética existente de la población de virus PVY en Argentina.
La mayor parte de la diversidad actual del PVY surgió en la segunda mitad del siglo XIX, después de que las epidemias del tizón tardío de la papa de mediados del siglo XIX, causadas por el pseudohongo Phytophthora infestans, destruyeran la cosecha europea, estimulando el mejoramiento genético de la papa. De esta manera, se compartieron líneas de reproducción importadas y no hubo cuarentena. A la población temprana de PVYO se unieron más tarde los aislamientos del filogrupo PVYN y sus recombinantes generaron las poblaciones R1 y R2 de cepas necrógenas dañinas (Fuentes et al., 2019). Actualmente se están empezando a descubrir los mecanismo moleculares de la expresión y regulación de genes asociados a la muerte celular programada en la necrosis sistémica de tubérculos de papa susceptibles a PVYNTN (Sedlar et al., 2017).
Li et al. (2013) estudiaron los efectos in vitro causado por los virus del enrollamiento de la hoja de la papa (PLRV) y el virus Y de la papa (PVY) sobre el crecimiento vegetativo, el metabolismo fisiológico y la producción de microtuberculos. Los resultados mostraron que el crecimiento de los brotes, incluido el porcentaje de brotación, la longitud de los brotes y el número y la longitud de los nudos, se redujeron notablemente en los brotes enfermos. Los síntomas fueron mucho más pronunciados en los brotes coinfectados con PLRV y PVY que en los infectados individualmente con PLRV o PVY. Los efectos inhibidores sobre el desarrollo de raíces medidos por el número de raíces y la longitud se observaron solo en brotes coinfectados con PLRV y PVY. Se encontraron contenidos significativamente menores de clorofila (chl-a, chl-b y chl total) en los brotes infectados por virus que en los sanos. El contenido de azúcar soluble total fue más alto en los brotes coinfectados con PLRV y PVY, y más bajo en los brotes sanos. Los brotes coinfectados con PLRV y PVY produjeron el menor número de microtubérculos, y los brotes sanos produjeron el mayor tamaño de microtubérculos. Por lo tanto, la gravedad del mosaico severo (daños y pérdidas) se acrecienta sensiblemente con coinfecciones de PLRV.
.
- Lote de papa infectado con Potato virus Y. Autor:: S. R. Menasha, Extensión Cooperativa de Cornell – Condado de Suffolk.
- Síntomas leves comúnmente causados por PVYNTN en varias variedades de papa. Las plantas afectadas se atrofian con hojas que se ven arrugadas y son más gruesas que las de las plantas sanas. Autor: Long Island Horticultural Research & Extension Center Riverhead, Cornell University.
- Planta de papa King Edward infectada con PVY, mostrando un leve moteado y distorsión de las hojas. Autor: wa.gov.au
- Síntomas foliares del Potato virus Y en papa. Izquierda: superficies superiores de las hojas. Derecha: superficies inferiores de las hojas. Autor: Long Island Horticultural Research & Extension Center Riverhead, Cornell University.
- Síntomas foliares del Potato virus Y en papa. Izquierda: superficies superiores de las hojas. Derecha: superficies inferiores de las hojas. Autor: Long Island Horticultural Research & Extension Center Riverhead, Cornell University.
- Síntomas en tubérculos de papa. Mancha anular necrótica causada por PVYNTN. Autor: Dr. Steve Johnson, University of Maine Cooperative Extension.
- Síntomas en tubérculos de papa. Mancha anular necrótica causada por PVYNTN. Autor: Sandra R. Menasha, Cornell Cooperative Extension – Suffolk County.
- Cepas más nuevas del Potato virus Y transmitidas por pulgones causan daños en los tejidos de los tubérculos. Autor: Washington State University
.
.
Transmisión
La dispersión del virus se realiza a través de más de setenta especies de áfidos alados. Los vectores más eficientes son: Myzus persicae y Macrosiphum euphorbiae. Es un virus NO PERSISTENTE en el vector (no puede transmitirlo por más de 1 a 2 horas de haber sido adquirido, lo lleva en el estilete).
- Aphis gossypii (Glover, 1877) (áfido) vector del PVY de manera no persistente.
.
Diagnóstico
El PVY y sus distintas razas o cepas se diagnostíca mediante técnicas serológicas y moleculares (PCR). Los síntomas exhibidos por plantas doblemente inoculadas varian, principalmente dependiendo de los aislamientos involucrados y de la genética de la variedad de papa sembrada, por lo que el diagnóstico por síntomas visuales a campo es extremadamente dificultoso (Jones y Vincent, 2017; Grupa et al., 2018).
.
Manejo Integrado
Como en toda enfermedad de origen virósico, el manejo debe apuntar a la prevención.
En forma ideal, el manejo integrado consiste en:
* Selección de variedades resistentes o tolerantes (cuando estén disponibles). Se han encontrado varias fuentes de resistencia, observándose todo un contínuo desde variedades totalmente susceptibles, variedades tolerantes, variedades con cierto grado de resistencia y variedades extremadamente resistentes (inmunes) (Tamisier et al., 2019; Baebler et al., 2020). Se ha demostrado que la muerte celular programada (HR) como respuesta de defensa no es suficiente para la restricción de la propagación del PVY en variedades de papa que poseen resistencia conferida por la respuesta hipersensible (Lukan et al., 2018). En Argentina, mediante técnicas de biotecnología se ha logrado desarrollar un cultivar resistente a esta virosis la variedad Spunta TICAR®, desarrollada en forma conjunta entre SIDUS-INGEBI-CONICET. Se sabe que la respuesta de defensa puede estar influida por la temperatura en ciertas interacciones cepa PVY-variedad de papa. Por ejemplo, Ohki et al. (2018) encontraron que las altas temperaturas debilitan la resistencia conferida por el gen Rychc. (la incidencia de la infección sistémica y el título de virus en cultivares resistentes a 28°C fueron menores que en un cultivar susceptible).
* Plantar solo semillas certificadas que se sabe que tienen poco o preferiblemente sin PVY detectable según la prueba de virus posterior a la cosecha.
* Desinfectar todo el equipo utilizado para cortar y plantar entre lotes de semillas, ya que el PVY se puede transmitir mecánicamente.
* Destrucción de montones de desechos que podrían servir como fuente de PVY y papas voluntarias infectadas.
* Limitar la transmisión del virus por pulgones. La mayoría de los insecticidas que controlan los pulgones tienen un beneficio limitado para el manejo de PVY porque muchos pulgones pueden contraer y también transmitir este virus muy rápidamente, más rápido de lo que puede actuar un insecticida (transmisión no persistente que toma segundos). Los insecticidas que pueden resultar beneficiosos son: aceites minerales y Aphoil, que interfieren con la transmisión no persistente al eliminar el virus del estilete del pulgón mientras se alimenta. Los compuestos anti-alimento o bloqueadores selectivos de la alimentación, como Fulfill o Beleaf, se aplican cuando se sabe que los pulgones están ingresando a los campos de papa.
.
Norma de Semilla Fiscalizada de Papa. INSTITUTO NACIONAL DE SEMILLAS.
.
.
- Resultados de la interacción papa-virus Y (PVY). Los resultados dependen del genotipo del hospedante, la cepa viral y las condiciones ambientales, y se manifiestan como respuestas diferentes en términos de multiplicación del virus y desarrollo de síntomas de la enfermedad (de izquierda a derecha, variedades de papa extremadamente resistentes (ER), resistencia con reacción de hipersensibilidad (HR), tolerancia y susceptibilidad. Las fotografías presentan síntomas que aparecen en las hojas inoculadas 6 días después de la inoculación en cultivares seleccionados de papa en condiciones ambientales óptimas. Se muestran ejemplos de cepas virales que dan el mismo resultado para cada cultivar. Escala = 1 cm. Autor: Baebler et al., 2020.
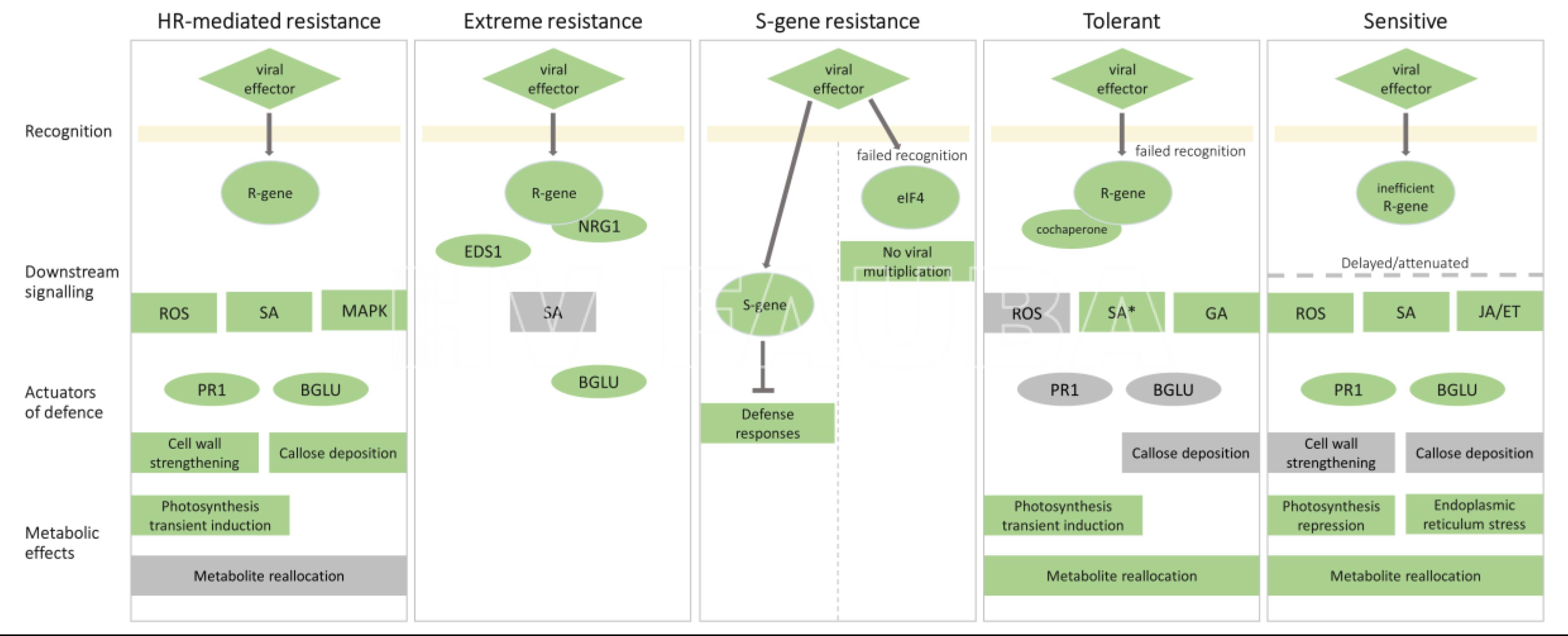
- Comparación de respuestas moleculares a PVY que resultan en diferentes resultados. Se muestran los eventos moleculares involucrados en el reconocimiento de virus, la señalización posterior, las respuestas de defensa y los efectos metabólicos en los resultados resistentes y susceptibles. Autor: Baebler et al., 2020.
.
.
Bibliografía
Aramburu J, Galipienso L, Matas M (2006) Characterization of potato virus Y isolates from tomato crops in northeast Spain. Eur J Plant Pathol 115, 247–258. doi: 10.1007/s10658-006-9003-x
Arseneault T, Pieterse CM, Gérin-Ouellet M, et al. (2014) Long-term induction of defense gene expression in potato by pseudomonas sp. LBUM223 and streptomyces scabies. Phytopathology 104(9): 926-32. doi: 10.1094/PHYTO-11-13-0321-R
Baebler Š, Witek K, Petek M, et al. (2014) Salicylic acid is an indispensable component of the Ny-1 resistance-gene-mediated response against Potato virus Y infection in potato. Journal of Experimental Botany 65(4): 1095-109. doi: 10.1093/jxb/ert447
Baebler Š, Coll A, Gruden K (2020) Plant Molecular Responses to Potato Virus Y: A Continuum of Outcomes from Sensitivity and Tolerance to Resistance. Viruses 12, 217. doi: 10.3390/v12020217
Blanco-Urgoiti B, Tribodet M, Leclere S, et al. (1998) Characterization of Potato potyvirus Y (PVY) isolates from seed potato batches. Situation of the NTN, Wilga and Z isolates. European Journal of Plant Pathology 104: 811–819. doi: 10.1023/A:1008698719645
, , , (2022) Impact of the potato inoculation date on potato virus Y load and viral distribution in daughter tubers at harvest. Plant Pathology 71: 1323– 1334. doi: 10.1111/ppa.13573
Butzonitch I, Colavita M, Capezio S, Huarte M (1996) Comportamiento de aislamientos locales de PVX y PVYN en el tamizado para resistencia a los virus X e Y de la papa, La Plata. Revista de la Facultad de Agronomía 101(2):127–132.
Chrzanowska, Maria (1994) Differentiation of Potato virus Y (PVY) isolates. Phytopathologia Polonica 8:15–20.
Colavita ML, Massa GA, Feingold SE (2007) In the search of recombinant PVY strains. 13th European Association for Potato Research (EAPR) Virology Section Meeting, Coylumbridge, Aviemore, Scotland, United Kingdom pp. 58.
Colavita ML (2010) Caracterización de Aislamientos del Virus Y de la papa. Tesis de Maestría, Universidad de Mar del Plata, Facultad de Ciencias Agrarias pp. 73.
Colavita ML, Lancia M, Feingold SE, et al. (2017) Evidence of Recombinant Isolates of Potato Virus Y (PVY) in Argentina. Am. J. Potato Res. 94: 275–282. doi: 10.1007/s12230-016-9564-y
De Ávila D, Antônio C, Melo PE, et al. (2009) Ocorrência de vírus em batata em sete estados do Brasil. Horticultura Brasileira 27: 490–497. doi: 10.1590/S0102-05362009000400015
De Bokx JA,Huttinga H (1981) Potato Virus Y. Descriptions of plants virus, N° 242. CommouN-Wi Agric Bureaux/Assoc Appl Biol, Kew, England. 6p
Duellman KM, Whitworth JL, Lent MA, et al. (2022) Mechanical Transmission of Potato Virus Y in Potato Due to Seed Cutting Is Not a Contributing Factor to Increased Virus in Field Production. Plant Health Progress 23: 381-387. doi: 10.1094/PHP-02-22-0011-RS
, , , et al. (2021) Role of the methionine cycle in the temperature‐sensitive responses of potato plants to potato virus Y. Molecular Plant Pathology 22: 77– 91. doi: 10.1111/mpp.13009
Fuentes S, Jones RAC, Matsuoka H, et al. (2019) Potato virus Y; the Andean connection. Virus Evolution 5: vez037. doi: 10.1093/ve/vez037
Galvino‐Costa SBF, dos Reis Figueira A, Camargos VV, et al. (2011) A novel type of Potato virus Y recombinant genome, determined for the genetic strain PVYE. Plant Pathology 61: 388-398. doi: 10.1111/j.1365-3059.2011.02495.x
Galvino-Costa SBF, Figueira AR, Rabelo-Filho FAC, et al. (2012) Molecular and serological typing of Potato virus Y isolates from Brazil reveals a diverse set of recombinant strains. Plant Disease 96:1451–1458. doi: 10.1094/PDIS-02-12-0163-RE
Gil FJ, Cotes JM, Marín M (2011) Incidence of potyvirus and molecular characterization of PVY in potato (Solanum tuberosum L.) growing regions of Colombia. Revista Colombiana de Biotecnología 8(1):85–93. Link
Glais L, Tribodet M, Kerlan C (2002) Genomic variability in Potato potyvirus Y (PVY): Evidence that PVYN-WI and PVYNTN variants are single to multiple recombinants between PVYO and PVYN isolates. Archives of Virology 147:363–378. doi:
Green KJ, Funke CN, Chojnacky J, et al. (2020) Potato Virus Y (PVY) Isolates from Solanum betaceum Represent Three Novel Recombinants Within the PVYN Strain Group and Are Unable to Systemically Spread in Potato. Phytopathology 110(9): 1588-1596. doi: 10.1094/PHYTO-04-20-0111-R
Grupa A, Otulak‐Kozieł K, Syller J (2018) Serological, molecular and immunofluorescent evidence for interference competition between isolates of Potato virus Y. Plant Pathology 67: 1997-2012. doi: 10.1111/ppa.12892
Hernández-de la Cruz M, Gómez-Leyva JF, López-Muraira IG, et al. (2007) Detección Serológica y Molecular del Virus PVYN y su variante PVYNTN en Papa (Solanum tuberosum L.) y Hospedantes Alternos en Tapalpa, México. Revista Mexicana de Fitopatología, vol. 25, núm. 2, julio-diciembre, 2007, pp. 167–172, Sociedad Mexicana de Fitopatología, A.C. México
Hu X, Meacham T, Ewing L, et al. (2009) A novel recombinant strain of Potato virus Y suggests a new viral genetic determinant of vein necrosis in tobacco. Virus Research 143:68–76. doi: 10.1016/j.virusres.2009.03.008
, , , et al. (2021) Identification of viral particles in the apoplast of Nicotiana benthamiana leaves infected by potato virus X. Mol Plant Pathol. 00: 1– 9. doi: 10.1111/mpp.13039
Jacquot E, Tribodet M, Croizat F, et al. (2005) A single nucleotide polymorphism-based technique for specific characterization of YO and YN isolates of Potato virus Y (PVY). J Virol Methods. 125(1): 83-93. doi: 10.1016/j.jviromet.2005.01.003
Jones RAC, Vincent SJ (2018) Strain-Specific Hypersensitive and Extreme Resistance Phenotypes Elicited by Potato virus Y Among 39 Potato Cultivars Released in Three World Regions Over a 117-Year Period. Plant Disease 102(1): 185-196. doi: 10.1094/PDIS-06-17-0901-RE
Karasev AV, Nikolaeva OV, Hu X, et al. (2010) Serological properties of ordinary and necrotic isolates of Potato virus Y: a case study of PVYN misidentification. American Journal of Potato Research 87: 1–9. doi: 10.1007/s12230-009-9110-2
Karasev AV, Hu X, Brown CJ, et al. (2011) Genetic Diversity of the Ordinary Strain of Potato virus Y (PVY) and Origin of Recombinant PVY Strains. Phytopathology 101(7): 778–785. doi: 10.1094/PHYTO-10-10-0284
Karasev AV, Gray SM (2013) Continuous and emerging challenges of Potato virus Y in potato. Annual Review of Phytopathology 51:571–586. doi: 10.1146/annurev-phyto-082712-102332
Kerlan C, Tribodet M, Glais L, Guillet M (1999) Variability of Potato virus Y in potato crops in France. Journal of Phytopathology 147:643–651. doi: 10.1046/j.1439-0434.1999.00441.x
Kerlan C, Nikolaeva OV, Hu X, et al. (2011) Identification of the molecular make-up of the Potato virus Y strain PVYZ: Genetic typing of PVYZ-NTN. Phytopathology 101:1052–1060. doi: 10.1094/PHYTO-11-10-0317
Kežar A, Kavčič L, Polák M, et al. (2019) Structural basis for the multitasking nature of the potato virus Y coat protein. Science Advances 5(7): eaaw3808. doi: 10.1126/sciadv.aaw3808
(2022) Mineral oil interferes with potato virus Y in aphid stylets. Plant Pathology 00: 1– 9. doi: 10.1111/ppa.13639
, , , (2016) Potato virus Y (PVY) detection in a single aphid by one-step RT-PCR with boiling technique. Entomological Research 46: 278– 285. doi: 10.1111/1748-5967.12170
Le Romancer M, Kerlan C (1991) La maladie des nécroses annulaires superficielles des tubercules: une affection de la pomme de terre, due a virus Y. Agronomie 11:889–900 Elsevier INRA.
Le Romancer M, Kerlan C, Nedellec M (1994) Biological characterization of various geographical isolates of Potato virus Y inducing superficial necrosis on potato tubers. Plant Pathology 43: 138–144. doi: 10.1111/j.1365-3059.1994.tb00563.x
Li J, Wang B, Song X, et al. (2013) Potato leafroll virus (PLRV) and Potato virus Y (PVY) influence vegetative growth, physiological metabolism, and microtuber production of in vitro-grown shoots of potato (Solanum tuberosum L.). Plant Cell Tiss Organ Cult 114: 313–324. doi: 10.1007/s11240-013-0327-x
Lorenzen JH, Meacham T, Berger PH, et al. (2006) Whole genome characterization of Potato virus Y isolates collected in the western USA and their comparison to isolates from Europe and Canada. Archives of Virology 151: 1055–1074. doi: 10.1007/s00705-005-0707-6
Lorenzen JH, Nolte P, Martin D, et al. (2008) NE-11 represents a new strain variant class of Potato virus Y. Archives of Virology 153:517–525. doi: 10.1007/s00705-007-0030-5
Lukan T, Baebler Š, Pompe-Novak M, et al. (2018) Cell Death Is Not Sufficient for the Restriction of Potato Virus Y Spread in Hypersensitive Response-Conferred Resistance in Potato. Frontiers in Plant Science 9: 168. doi: 10.3389/fpls.2018.00168
McDonald JG, Singh RP (1996) Host range, symptomology, and serology of isolates of Potato virus Y (PVY) that share properties with both the PVYN and PVY0 strain groups. American Journal of Potato Research 73:309–315. doi: 10.1007/BF02855210
Moyo L, Ramesh SV, Kappagantu M, et al. (2017) The effects of potato virus Y-derived virus small interfering RNAs of three biologically distinct strains on potato (Solanum tuberosum) transcriptome. Virol J. 14(1): 129. doi: 10.1186/s12985-017-0803-8
Nie X, Singh RP, Singh M (2004) Molecular and pathological characterization of N:O isolates of the Potato virus Y from Manitoba. Canadian Journal of Plant Pathology 26:573–583. doi:
Ohki T, Sano M, Asano K, et al. (2018) Effect of temperature on resistance to Potato virus Y in potato cultivars carrying the resistance gene Rychc. Plant Pathology 67: 1629-1635. doi: 10.1111/ppa.12862
Onditi J, Nyongesa M, van der Vlugt R (2022) Prevalence, distribution and control of potato virus Y (PVY) strains in Kenyan potato cultivars. Trop. plant pathol. 47: 659–671. doi: 10.1007/s40858-022-00520-1
Petrov N, Stoyanova M, Andonova R, Teneva A (2015) Induction of resistance to potato virus Y strain NTN in potato plants through RNAi. Biotechnol Biotechnol Equip. 29(1): 21-26. doi: 10.1080/13102818.2014.984968
Piche LM, Singh RP, Nie X, Gudmestad NC (2004) Diversity among Potato virus Y isolates obtained from potatoes in the United States. Phytopathology 94: 1368–1375. doi: 10.1094/PHYTO.2004.94.12.1368
Pinheiro PV, Wilson JR, Xu Y, et al. (2019) Plant Viruses Transmitted in Two Different Modes Produce Differing Effects on Small RNA-Mediated Processes in Their Aphid Vector. Phytobiomes Journal 3: 71-81. doi: 10.1094/PBIOMES-10-18-0045-R
Quintero-Ferrer A, Karasev AV (2013) First report of Potato virus Y in potato in Jalisco, Mexico. Plant Disease 97: 430. doi: 10.1094/PDIS-10-12-0919-PDN
Salazar, Luis, Bartolini I, Flores V (2000) Evidence for the existence of PVYNTN in The Andes and a hypothesis towards its origin. Fitopatologia 3(2): 87–90. doi:
Sawazaki HE, de Souza-Dias JAC, Lorenzen JH, et al. (2009) Potato Virus YNTN: A Coat and P1 Protein Sequences Analysis of a Brazilian Isolate. Potato Research 52: 379–392. doi: 10.1007/s11540-009-9141-6
Schubert J, Fomitcheva V, Sztangret-Wiśniewska J (2007) Differentiation of Potato virus Y using improved sets of diagnostic PCR primers. Journal of Virological Methods 140: 66–74. doi: 10.1016/j.jviromet.2006.10.017
Sedlar A, Gerič Stare B, Mavrič Pleško I, et al. (2018) Expression and regulation of programmed cell death‐associated genes in systemic necrosis of PVYNTN susceptible potato tubers. Plant Pathology 67: 1238-1252. doi: 10.1111/ppa.12818
Sertkaya E, Sertkaya G (2005) Aphid Transmission of Two Important Potato Viruses, PVY and PLRV by Myzus persicae (Sulz.) and Aphis gossypii (Glov.) in Hatay Province of Turkey. Pakistan Journal of Biological Sciences 8: 1242-1246. doi: 10.3923/pjbs.2005.1242.1246
Singh MN, Paul Khurana SM, Nagaich BB, et al. (1988) Environmental factors influencing aphid transmission of potato virus Y and potato leafroll virus. Potato Res 31: 501–509. doi: 10.1007/BF02357888
Singh RP, McLaren DL, Nie X, Singh M (2003) Possible escape of a recombinant isolate of Potato virus Y by serological indexing and methods of its detection. Plant Disease 87(6):679–685. doi: 10.1094/PDIS.2003.87.6.679
Singh RP, Valkonen JPT, Gray SM, et al. (2008) Discussion paper: The naming of Potato virus Y strains infecting potato. Archives of Virology 153: 1–13. doi: 10.1007/s00705-007-1059-1
Slater AT, Schultz L, Lombardi M, et al. (2020) Screening for Resistance to PVY in Australian Potato Germplasm. Genes 2020, 11, 429. doi: 10.3390/genes11040429
Sun H, Jiao WB, Krause K, et al. (2022) Chromosome-scale and haplotype-resolved genome assembly of a tetraploid potato cultivar. Nat Genet. doi: 10.1038/s41588-022-01015-0
Tamisier L, Szadkowski M, Nemouchi G, et al. (2020) Genome-wide association mapping of QTLs implied in potato virus Y population sizes in pepper: evidence for widespread resistance QTL pyramiding. Molecular Plant Pathology 21(1): 3-16. doi: 10.1111/mpp.12874
Wagemans J, Holtappels D, Vainio E, et al. (2022) Going Viral: Virus-Based Biological Control Agents for Plant Protection. Annu Rev Phytopathol. 60: 21-42. doi: 10.1146/annurev-phyto-021621-114208
, (2023) The mystery remains: How do potyviruses move within and between cells? Molecular Plant Pathology 24: 1560–1574. doi: 10.1111/mpp.13383
, , , et al. (2024) A natural substitution of a conserved amino acid in eIF4E confers resistance against multiple potyviruses. Molecular Plant Pathology 25: e13418. doi: 10.1111/mpp.13418