.
Grupo de cultivos: Frutícolas
Especie hospedante: Banano (Musa x paradisiaca). Descripción del cultivo: link
Rango de hospedantes: específico / estrecho
Etiología: Bacteria. Gram negativa
Agente causal: Xanthomonas vasicola pv. musacearum (Xvm) (Yirgou and Bradbury 1968) Studholme et al. 2020
homotypic synonym: Xanthomonas campestris pv. musacearum (Yirgou and Bradbury 1968) Dye 1978
Taxonomía: Bacteria > Proteobacteria > Gammaproteobacteria > Xanthomonadales > Xanthomonadaceae > Xanthomonas
.
.
.
Antecedentes
La enfermedad se conoce en el mundo por sus siglas en inglés Banana Xanthomonas Wilt (BXW), or Banana Bacterial Wilt (BBW). El patógeno se describió por primera vez como un patógeno causante de marchitez en un pariente cercano del banano (Ensente ventricosum) en Etiopía en la década de 1930 (Castellani, 1939) y se denominó en ese momento como Xanthomonas musacearum (Yirgou y Bradbury, 1968). Posteriormente se confirmó que la misma bacteria causaba una enfermedad similar en el banano cultivado y posteriormente se reclasificó como X. campestris pv. musacearum (Young et al., 1978). Posteriormente, en 2008, los estudios moleculares demostraron que estaba más estrechamente relacionado con Xanthomonas vasicola (Aritua et al., 2008). Recientemente fue reclasificada como Xanthomonas vasicola pv. musacearum por Studholme et al. 2020.
.
Importancia económica
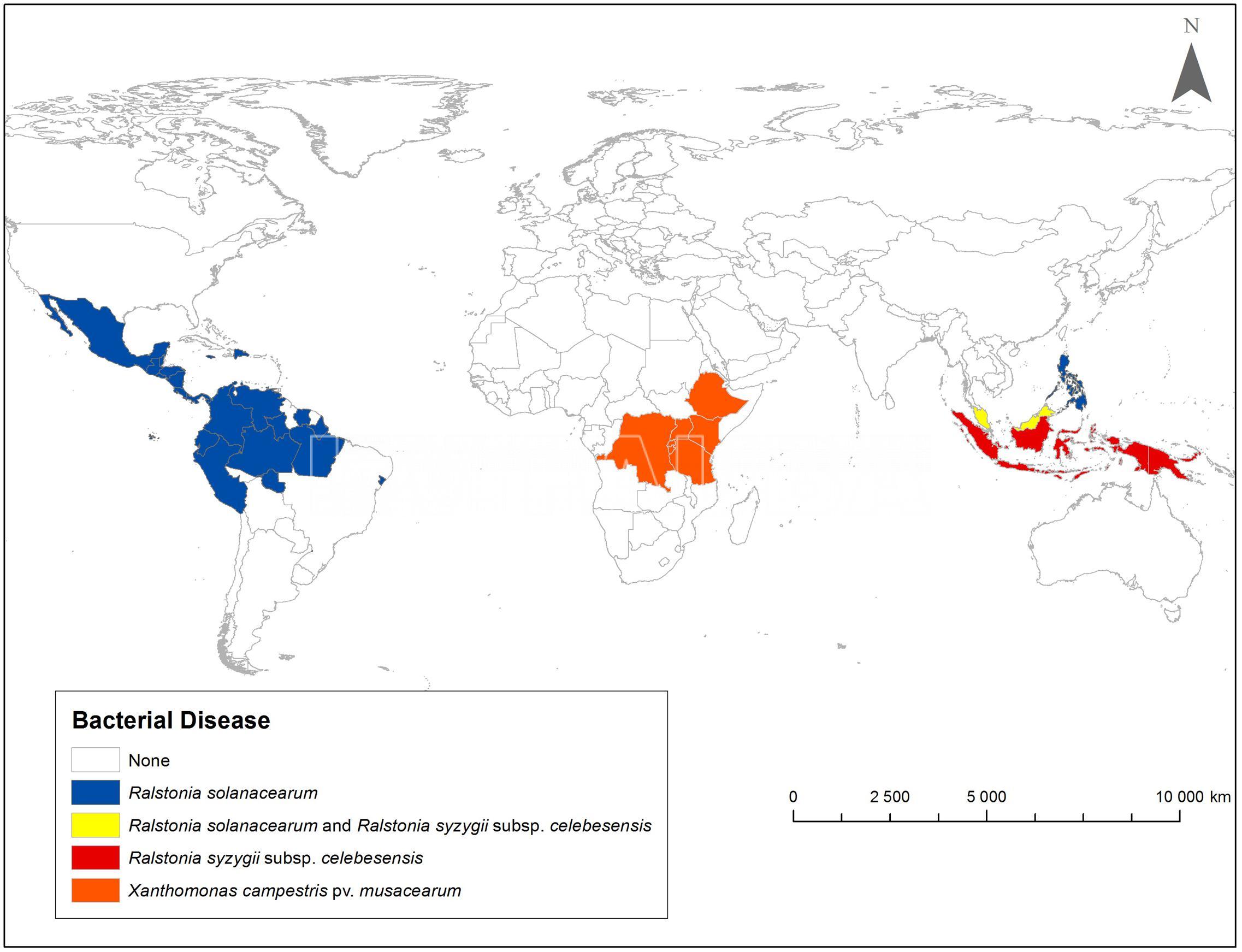
Los marchitamientos bacterianos del banano tienen una frecuencia cada vez mayor en diferentes regiones del mundo, lo que reduce el rendimiento y aumenta los costos de manejo de cultivos (Blomme et al., 2017). El marchitamiento por Xanthomonas se ha convertido en la enfermedad más importante y extendida de Musa en África oriental y central. La enfermedad se ha confirmado en Uganda, Ruanda, la República Democrática del Congo, Burundi, Kenia y Tanzania, y continúa propagándose.
Su infección no discriminada de todos los cultivares de Musa en esta región (Ssekiwoko et al., 2006) y su capacidad para causar hasta un 100% de pérdida de rendimiento, especialmente en bananos de tipo ABB, compromete gravemente la seguridad alimentaria y los medios de vida de los hogares agrícolas de banano (Tushemereirwe et al., 2003, 2004; Kagezi et al., 2006; Ssekiwoko et al., 2006). De hecho, la baja fertilidad del suelo y el marchitamiento por Xanthomonas se consideran actualmente las dos principales amenazas para la productividad del banano en la región de los Grandes Lagos de África Oriental (Kalyebara et al., 2007).
.
- Distribución geográfica del marchitamiento bacteriano causadro por Ralstonia solanacearum, R. syzygii subsp. celebesensis y el marchitamiento bacteriano por Xanthomonas (Xanthomonas vasicola pv. musacearum). La presencia o ausencia de una enfermedad se presenta a nivel de país. Fuente: Blomme et al., 2017.
.
Sintomatología
Los síntomas consisten en rápido amarilleo y marchitamiento de las hojas más jóvenes, decoloración de los vasos vasculares internos, ocasionalmente una muerte regresiva (dieback) que se inicia en las partes florales masculinas con pudrición interna de los frutos del banano. Estos síntomas pueden a veces confundirse con los síntomas de la enfermedad de Moko causada por Ralstonia solanacearum.
El signo consiste en exudado amarillo cargado de bacterias y EPS (zooglea), característico del marchitamiento por Xanthomonas.
.
Histopatologia
Los primeros estudios sobre la infección sistémica causada por Xvm se realizaron en plantas con flores infectadas para determinar la eficiencia de cortar el tallo enfermo al nivel del suelo en lugar de arrancar toda la estera. En un estudio realizado en Uganda, se tomaron muestras del tallo aéreo y el rizoma de las plantas para detectar la presencia de bacterias y los resultados se correlacionaron con el progreso de los síntomas: brácteas arrugadas, raquis en descomposición, maduración prematura de frutos y pudrición / secado de racimos. Los resultados mostraron que las bacterias estaban restringidas a la parte superior del tallo floral solo en la etapa de bráctea arrugada, lo que sugiere que cortar la planta infectada en esa etapa de la enfermedad evitaría que la bacteria invade el rizoma (Ssekiwoko et al., 2006). Por el contrario, se detectaron bacterias en el rizoma de un tercio de las plantas de banano de las tierras altas de África oriental que se encontraban en la etapa de brácteas marchitas, lo que sugiere que, en el caso de una variedad EAHB infectada, eliminar solo la planta infectada no sería eficaz para prevenir que la enfermedad entre en el rizoma. Un estudio posterior realizado en el bosque de Kifu, en Uganda central, encontró que ninguno de los rizomas de ‘Kayinja’ y de un cultivar EAHB sin nombre tenía bacterias 21 días después de la inoculación, pero que siete días después el rizoma del 55% de las plantas EAHB y el 17% de los ‘Kayinja’ tenían bacterias (Ocimati et al., 2013).
Los experimentos de varios años llevados a cabo en el bosque de Kifu fueron fundamentales para demostrar que la bacteria Xvm no invade sistemáticamente todos los chupones en una estera infectada. En uno de los experimentos, se inocularon cuatro puntos de entrada en la inflorescencia de las plantas de banano (‘Kayinja’ y un cultivar EAHB) y se monitorearon las esteras a lo largo del tiempo. Solo entre el 6 y el 37% de los chupones desarrollaron la enfermedad (la mayor incidencia se observó en las plantas de EAHB). Se realizaron pruebas para detectar infecciones latentes (chupones asintomáticos pero infectados que pueden desarrollar la enfermedad). Se evaluó la presencia de bacterias en los chupones que estaban asintomáticos 40 meses después del establecimiento del ensayo mediante una prueba de PCR. Se detectaron trazas de bacterias hasta en un 53% de las plantas ‘Kayinja’ muestreadas y hasta en un 33% de las plantas EAHB. En otro tratamiento en el que el racimo se cosechó con una herramienta de corte contaminada, se detectaron infecciones latentes 24 meses después de la inoculación en hasta el 45% de los chupones ‘Kayinja’ y hasta el 25% de los chupones EAHB.
Por otro lado, la capa de la corteza del rizoma parece actuar como una barrera para el movimiento de bacterias. Cuando se inyectaron bacterias directamente en la corteza del rizoma, ninguna de las plantas de Mbwazirume desarrolló síntomas de enfermedad y solo el 21% de las plantas de Kayinja lo hicieron (Nakato et al., 2014). Según los autores del estudio, el movimiento de las bacterias podría verse obstaculizado por el bajo número de vasos del xilema en la capa de la corteza.
.
- Marchitez bacteriana por Xanthomonas del banano causada por X. vasicola pv. musacearum. Las fotos muestran el amarillamiento y el marchitamiento de las hojas, exudación de exudado bacteriano, maduración prematura de la fruta y decoloración de la fruta. Las fotos fueron tomadas en Uganda por Guy Blomme (Blomme et al., 2017).
- Marchitez bacteriana por Xanthomonas del enset causada por X. campestris pv. musacearum. Las fotos muestran hojas amarillentas y marchitas, y bolsas de exudado bacteriano en el pecíolo de una hoja. Las fotos fueron tomadas en Etiopía por Guy Blomme (Blomme et al., 2017).
- Un cogollo macho arrugado y una maduración desigual son síntomas característicos del marchitamiento por Xanthomonas, una enfermedad bacteriana devastadora que solo se encuentra en África oriental. Fuente: ProMusa
- La enfermedad bacteriana marchitamiento del banano por Xanthomonas pudre la fruta. Fuente: ProMusa
- Las plantas infectadas con las bacterias que causan el marchitamiento por Xanthomonas, producen exudados cargados de bacterias que están implicados en la transmisión de la enfermedad mediante herramientas de corte. Autor: Blomme, Guy / Bioversity International
- El pedúnculo (el tallo que sostiene el racimo) muestra el exudado amarillo cargado de bacterias característico del marchitamiento por Xanthomonas. Autor: Lepoint, Pascale / Bioversity International
- Cuando solo el tallo ‘verdadero’ en el centro del pseudotallo está infectado, significa que las bacterias ingresaron a través de la inflorescencia. Autor: Blomme, Guy / Bioversity International
- Cuando solo se infectan las vainas de las hojas, significa que las bacterias ingresaron a través de una herida (en el rizoma, el pseudotallo o una hoja), o que la planta madre a la que estaba adherida estaba infectada. Autor: Blomme, Guy / Bioversity International
.
Ciclo de la enfermedad
El agente causal sobrevive en rastrojos y en el suelo (Mwebaze et al., 2006). Los niveles de humedad afectan la supervivencia, que es más baja en los suelos más secos. La supervivencia también es menor en suelos no estériles (simulando condiciones de campo) que en suelos estériles. Los resultados experimentales mostraron que incluso en las mejores condiciones (suelos estériles donde las bacterias estaban libres de competencia con otros microorganismos), las bacterias no sobrevivieron más de 90 días en suelo húmedo y 30 días en suelos secos. El corto período de supervivencia sugiere que la bacteria carece de una etapa saprofita o inactiva en el suelo y los restos de plantas.
.
- Las bacterias pueden entrar a través de una herida o abertura en cualquier parte de la planta. Las bacterias que ingresan a la planta a través de la yema masculina viajan a lo largo del pedúnculo y el tallo aéreo y luego regresan a las hojas a través de su punto de inserción en el tallo aéreo y en el rizoma (en rojo). La línea roja punteada indica que una vez en el rizoma, las bacterias pueden llegar o no a los chupones en cantidad suficiente para provocar el desarrollo de la enfermedad. Fuente: ProMusa.
.
Diagnóstico
Generalmente se utilizan herramientas de diagnóstico molecular. Los primeros primers de PCR patovar-específicos se diseñaron para amplificar una región de 265 pb del gen que codifica la vía de secreción general de la proteína D (gspD) (Adriko et al., 2012). Posteriormente se demostró que la secuencia objetivo no era exclusiva del agente causal y se reemplazó por primers o cebadores de PCR basados en cinco secuencias codificantes específicas (Nakato et al., 2018).
.
Manejo Integrado
Las prácticas de manejo deben adoptarse de acuerdo con los aspectos epidemiológicos, y con acciones específicas a cada sitio para manejar las infecciones / erradicar las plantas infectadas y minimizar la propagación de patógenos (Blomme et al., 2014). Sin embargo, el éxito de las estrategias de control depende en gran medida del desarrollo de capacidades y las actividades sistemáticas de erradicación y saneamiento (Blomme et al., 2017).
Siempre que se eviten infecciones nuevas, se ha demostrado en la República Democrática del Congo que la práctica de eliminar solo los tallos infectados reduce la incidencia de la enfermedad a medida que las esteras se recuperan bajo los efectos combinados de las infecciones latentes y con sistémica incompleta (ProMusa, 2014).
.
.
Bibliografía
Rehabilitating banana fields ravaged by Xanthomonas wilt in InfoMus@’s News and analysis, 30 May 2014.
, , , , , (2011) Development of a specific molecular tool for detecting Xanthomonas campestris pv. musacearum. Plant Pathology 60, 443– 52. doi: 10.1111/j.1365-3059.2010.02419.x
Adriko J, Aritua V, Mortensen CN, Tushemereirwe WK, Kubiriba J, Lund OS (2012) Multiplex PCR for specific and robust detection of Xanthomonas campestris pv. musacearum in pure culture and infected plant material. Plant Pathology 61(3): 489-497. doi: 10.1111/j.1365-3059.2011.02534.x
Alvarez-Martinez CE, Sgro GG, Araujo GG, Paiva MRN, Matsuyama BY, Guzzo CR, Andrade MO, Farah CS (2020) Secrete or perish: The role of secretion systems in Xanthomonas biology. Computational and Structural Biotechnology Journal 19: 279-302. doi: 10.1016/j.csbj.2020.12.020
Aritua V. et al. (2008) Characterization of the Xanthomonas sp. causing wilt of enset and banana and its proposed reclassification as a strain of X. vasicola. Plant Pathology 57(1): 170-177. doi: 10.1111/j.1365-3059.2007.01687.x
Blomme G, Jacobsen K, Ocimati W, Beed F, Ntamwira J, Sivirihauma C, et al. (2014) Fine-tuning banana Xanthomonas wilt control options over the past decade in East and Central Africa. European Journal of Plant Pathology 139: 265–281. doi: 10.1007/s10658-014-0402-0
Blomme G, Dita M, Jacobsen KS, Pérez Vicente L, Molina A, Ocimati W, Poussier S and Prior P (2017) Bacterial Diseases of Bananas and Enset: Current State of Knowledge and Integrated Approaches Toward Sustainable Management. Frontiers in Plant Science 8: 1290. doi: 10.3389/fpls.2017.01290
Carter BA, Reeder R, Mgenzi SR, Kinyua ZM, Mbaka JN, Doyle K, Nakato V, Mwangi M, Beed F, Aritua V, Lewis Ivey ML, Miller SA, Smith JJ (2010) Identification of Xanthomonas vasicola (formerly X. campestris pv. musacearum), causative organism of banana Xanthomonas wilt, in Tanzania, Kenya and Burundi. Plant Pathol 59(2):403. doi: 10.1111/j.1365-3059.2009.02124.x
Castellani E (1939) Su un marciume dell’ ensete. L’Agric. Coloniale Firenze 33, 297–300.
Catara V, Cubero J, Pothier JF, et al. (2021) Trends in Molecular Diagnosis and Diversity Studies for Phytosanitary Regulated Xanthomonas. Microorganisms 9(4): 862. doi: 10.3390/microorganisms9040862
Costa J, Pothier JF, Boch J, et al. (2021) Integrating science on Xanthomonadaceae for sustainable plant disease management in Europe. Mol Plant Pathol. 22(12): 1461-1463. doi: 10.1111/mpp.13150
Domingo-Calap ML, Bernabéu-Gimeno M, Aure MC, et al. (2022) Comparative Analysis of Novel Lytic Phages for Biological Control of Phytopathogenic Xanthomonas spp. Microbiol Spectr. e0296022. doi: 10.1128/spectrum.02960-22
Jogo W, Karamura E, Tinzaara W, Kubiriba J, Rietveld A (2013) Determinants of farm-level adoption of cultural practices for banana Xanthomonas wilt control in Uganda. J Agric Sci 5(7):70–81. doi: 10.5539/jas.v5n7p70
Kagezi GH, Kangire A, Tushmereirwe W, Bagamba F, Kikulwe E, Muhangi J, et al. (2006) Banana bacterial wilt incidence in Uganda. Afr. Crop Sci. J. 14, 83–91. doi: 10.4314/acsj.v14i2.27914
Kalyebara R, Wood S, Abodi PM (2007) Assessing the potential impact of selected technologies on the banana industry in Uganda, in An Economic Assessment of Banana Genetic Improvement and Innovation in the Lake Victoria Region of Uganda and Tanzania. IFPRI Research Report 155, eds M. Smale and W. K. Tushemereirwe (Washington, DC: IFPRI), 141–156.
Kubiriba J, Tushemereirwe W (2014) Approaches for the control of banana Xanthomonas wilt in East and Central Africa. African J Plant Sci 8(8):398–404. doi: 10.5897/AJPS2013.1106
Kubiriba J, Erima R, Tugume AK, et al. (2023) Changing Dynamics in the Spread and Management of Banana Xanthomonas Wilt Disease in Uganda Over Two Decades. Phytobiomes Journal 7: 29-41. doi: 10.1094/PBIOMES-06-22-0038-RVW
McCampbell M, Schut M, Van den Bergh I, Van Schagen B et al (2018) Xanthomonas wilt of banana (BXW) in Central Africa: opportunities, challenges, and pathways for citizen science and ICT-based control and prevention strategies. NJAS Wagen J Life Sc 86-87: 89–100. doi: 10.1016/j.njas.2018.03.002
, , , , , , , The Arabidopsis immune receptor EFR increases resistance to the bacterial pathogens Xanthomonas and Xylella in transgenic sweet orange.
Mustafa AS, Tugume B, Ssenku JE, et al. (2022) Xanthomonas campestris pv. musacearum Bacterial Infection Induces Organ-Specific Callose and Hydrogen Peroxide Production in Banana. PhytoFrontiers™ 2: 202-217. doi: 10.1094/PHYTOFR-11-21-0073-R
Mwangi M, William T, Ndungo V, Flora N, Philip R, Ranajit B (2006) Comparative study of banana Xanthomonas wilt spread in mid and high altitudes of the Great Lakes region of Africa. Conference on international Agricultural Research for Development, Bonn. doi: 10.13140/RG.2.1.3874.7765
Mwebaze JM, Tushme G, Tushemereirwe W, Kubiriba J (2006) The survival of Xanthomonas campestris pv musacearum in soil and plant debris. African Crop Science Journal 14(2): 121-127. doi: 10.4314/acsj.v14i2.46166
Mwangi M, Nakato V (2009) Key factors responsible for the Xanthomonas wilt epidemic on banana in east and central africa. Acta Hortic 828: 395–404. doi: 10.17660/ActaHortic.2009.828.41
Nakato GV, Ocimati W, Blomme G, Fiaboe KKM, Beed F (2014) Comparative importance of infection routes for banana Xanthomonas wilt and implications on disease epidemiology and management. Canadian Journal of Plant Pathology 36(4): 418-427. doi: 10.1080/07060661.2014.959059
Nakato GV, Wicker E, Coutinho TA, Mahuku G, Studholme DJ (2018) A highly specific tool for identification of Xanthomonas vasicola pv. musacearum based on five Xvm-specific coding sequences. Heliyon 4(12): e01080. doi: 10.1016/j.heliyon.2018.e01080
, , , et al. (2020) SNP‐based genotyping and whole‐genome sequencing reveal previously unknown genetic diversity in Xanthomonas vasicola pv. musacearum, causal agent of banana xanthomonas wilt, in its presumed Ethiopian origin. Plant Pathology 00: 1– 10. doi: 10.1111/ppa.13308
Night G, Gaidashova S, Nyirigira A, Mugiraneza T et al. (2013) Distribution, incidence and farmer knowledge of banana Xanthomonas wilt in Rwanda. In: Banana systems in the humid highlands of sub-Saharan Africa. CABI, London, pp 131–137. doi: 10.1079/9781780642314.0131
Nkuba J, Tinzaara W, Night G, Niko N et al (2015) Adverse impact of Banana Xanthomonas wilt on farmers livelihoods in eastern and Central Africa. African J Plant Sci 9(7):279–286. doi: 10.5897/AJPS2015.1292
Ocimati W, Ssekiwoko F, Karamura EB, Tinzaara W, Blomme G (2013) Does Xanthomonas campestris pv. musacearum Colonize Banana Cord Root Tissue? In: Proceedings of International ISHS-Promusa Symposium on Bananas and Plantains: Towards sustainable global production and improved use, Salvador, Brazil, 10-14 October 2011. Van den Bergh, I., Amorim, E.P. and Johnson, V. (eds). Acta Horticulturae 986:103-109.
Ocimati W, Ssekiwoko F, Karamura E, Tinzaara W, Eden-Green S, Blomme G (2013) Systemicity of Xanthomonas campestris pv. musacearum and time to disease expression after inflorescence infection in East African highland and Pisang Awak bananas in Uganda. Plant Pathology 62(4):777-785. doi: 10.1111/j.1365-3059.2012.02697.x
, ,
Shimwela MM, Ploetz RC, Beed FD, Jones JB, Blackburn JK, Mkulila SI, Van Bruggen AH (2016) Banana Xanthomonas wilt continues to spread in Tanzania despite an intensive symptomatic plant removal campaign: an impending socio-economic and ecological disaster. Food Secur 8(5): 939–951. doi: 10.1007/s12571-016-0609-3
Ssekiwoko, F., Taligola, H. K., and Tushmereirwe, W. K. (2006a). Xanthomonas campestris pv. musacearum host range in Uganda. Afric. Crop Sci. J. 14, 111–120. doi: 10.4314/acsj.v14i2.27917
Ssekiwoko F, Turyagyenda LF, Mukasa H, Eden-Green S, Blomme G (2006) Systemicity of Xanthomonas campestris pv. musacearum in flower-infected banana plants, in Proceedings of the XVII ACORBAT International Meeting: Banana: A Sustainable Business. Joinville, Santa Catarina.
Ssekiwoko F, Turyagyenda LF, Mukasa H, Eden-Green SJ, Blomme G (2006) Systemicity of Xanthomonas campestris pv musacearum in flower-infected banana plants. p. 789-793 in the Proceedings of the XVII ACORBAT International Meeting held in Brazil.
Ssekiwoko, F., Tushemereirwe, W., Batte, M., Ragama, P. E., and Kumakech, A. (2006). Reaction of banana germplasm to inoculation with Xanthomonas campestris pv. musacearum. Afric. Crop. Sci. J. 14: 151–155. doi: 10.4314/acsj.v14i2.46165
Studholme DJ, Wicker E, Abrare SM, et al. (2020) Transfer of Xanthomonas campestris pv. arecae and X. campestris pv. musacearum to X. vasicola (Vauterin) as X. vasicola pv. arecae comb. nov. and X. vasicola pv. musacearum comb. nov. and Description of X. vasicola pv. vasculorum pv. nov. Phytopathology 110(6): 1153-1160. doi: 10.1094/PHYTO-03-19-0098-LE
Teper D, White FF, Wang N (2023) The Dynamic Transcription Activator-Like Effector Family of Xanthomonas. Phytopathology 113(4): 651-666. doi: 10.1094/PHYTO-10-22-0365-KD
Tinzaara W, Karamura E, Blomme G, Jogo W, Ocimati W, Rietveld A, Kubiriba J, Opio F (2011) Why sustainable management of Xanthomonas wilt of banana in East and Central Africa has been elusive. Acta Hortic 986: 157–164. doi: 10.17660/ActaHortic.2013.986.16
Tripathi L, Mwangi M, Abele S, Aritua V, Tushemereirwe WK, Bandyopadhyay R (2009) Xanthomonas wilt: a threat to banana production in East and Central Africa. Plant Disease 93(5): 440–451. doi: 10.1094/PDIS-93-5-0440
Tushemereirwe W, Kangire A, Smith J, Ssekiwoko F, Nakyanzi M, Kataama D, et al. (2003) An outbreak of bacterial wilt on banana in Uganda. InfoMusa 12, 6–8. Link
Tushemereirwe W, Kangire A, Ssekiwoko F, Offord LC, Crozier J, Boa E, et al. (2004) First report of Xanthomonas campestris pv. musacearum on banana in Uganda. Plant Pathology 53: 802. doi: 10.1111/j.1365-3059.2004.01090.x
Tushemereirwe W, Benin S, Blomme G, Eden Green S, Markham R, Karamura E, Kayobyo G (2008) Assessing the impacts of banana bacterial wilt disease on banana (Musa spp.) productivity and livelihoods of Ugandan farm households. Acta Hortic 879:749–755. doi: 10.17660/ActaHortic.2010.879.81
Uwamahoro F, Berlin A, Bylund H, et al. (2019) Management strategies for banana Xanthomonas wilt in Rwanda include mixing indigenous and improved cultivars. Agron. Sustain. Dev. 39: 22. doi: 10.1007/s13593-019-0569-z
Vieira PS, Bonfim IM, Araujo EA, et al. (2021) Xyloglucan processing machinery in Xanthomonas pathogens and its role in the transcriptional activation of virulence factors. Nat Commun 12: 4049. doi: 10.1038/s41467-021-24277-4
Wasukira A, Tayebwa J, Thwaites R, Paszkiewicz K, Aritua V, Kubiriba J, Smith J, Grant M, Studholme DJ (2012) Genome-wide sequencing reveals two major sub-lineages in the genetically monomorphic pathogen Xanthomonas campestris pathovar musacearum. Genes (Basel) 3(3): 361-77. doi: 10.3390/genes3030361
Yemataw Z, Borrell JS, Biswas MK, White O, Mengesha W, Muzemil S, Darbar JN, Ondo I, Heslop Harrison PJS, Blomme G, Wilkin P (2020) The Distribution of Enset Pests and Pathogens and a Genomic Survey of Enset Xanthomonas Wilt. bioRxiv 2020.06.18.144261; doi: 10.1101/2020.06.18.144261
Yirgou, D. and Bradbury, J.F. 1968. Bacterial wilt of enset (Ensete ventricosum) incited by Xanthomonas musacearum) sp. n. Phytopathology 58:111-112.
Yirgou D, Bradbury J (1974) A note on wilt of banana caused by the enset wilt organism Xanthomonas musacearum. East Afr Agric For J 40(1):111–114. doi: 10.1080/00128325.1974.11662720
Young JM et al. (1978) A proposed nomenclature and classification for plant pathogenic bacteria. New Zealand Journal of Agricultural Research 21(1): 153-177. doi: 10.1080/00288233.1978.10427397