.
Condición fitosanitaria: Plaga no cuarentenaria reglamentada
Grupo de cultivos: Hortícolas
Especie hospedante: Papa (Solanum tuberosum)
Rango de hospedantes: papa, tomate y otras Solanáceas silvestres y cultivadas, y especies de otras familias como Amaranthaceae, Cruciferae, Nolanaceae, Portulacaceae (Thomas et al., 2002). El rango de hospedadores naturales de PLRV es limitado y los hospedantes más conocidos (alrededor de 20 especies) pertenecen a la familia de las Solanáceas cultivadas (papa, tomate) o especies no cultivadas (Physalis floridana, Datura stramonium) que constituyen un reservorio de virus). Especies no Solanáceas incluyen: Amaranthus caudatus, Celosia argentea, Gomphrena globosa and Capsella bursa-pastoris.
Transmisión: áfidos, persistente (circulativa) no propagativa.
Etiología: Virus (biotrófico como todos los virus)
Agente causal: Potato leafroll virus (PLRV)
Taxonomía: Viruses > Riboviria > Orthornavirae > Kitrinoviricota > Tolucaviricetes > Tolivirales > Luteoviridae > Polerovirus
ICTV: Positive Sense RNA Viruses > PLRV
Baltimore classification: Group IV: ssRNA(+) Baltimore, 1971
.
Barrios Barón et al. (2017) secuenciaron el genoma completo de aislados de PLRV de Argentina. Los investigadores determinaron que el aislado argentino de PLRV-AR tenía una identidad de secuencia de nucleótidos entre 94,4 y 97,3% con varios aislados de PLRV conocidos en todo el mundo. El genoma de PLRV-AR contiene 5.881 nucleótidos. El genoma tiene 10 ORF que codifican las proteínas P0, P1, Rap1, P1-P2, P3a, P3, P4, P3-P5, P6 y P7. La secuencia de nucleótidos completa se encuentra disponible en GenBank.
Barrios Barón et al. (2020) dilucidaron a partir de aislados argentinos que la proteína PO del PLRV (P0PL), que es un supresor del silenciamiento del ARN, se diferencia de otras proteínas PO de polerovirus previamente caracterizados. P0PL‐Ar parece tener una actividad dual, según los hallazgos de este estudio. Esta proteína actuaría tanto en un paso corriente arriba como en un paso corriente abajo de la vía de silenciamiento del ARN: corriente arriba de la producción de siARN primario mediada por la enzima Dicer (DCL) y corriente abajo en el nivel del complejo de silenciamiento inducido por ARN (RISC).
.
- Micrografía electrónica de partículas purificadas de PLRV. Autor: Roberts et al., 1980.
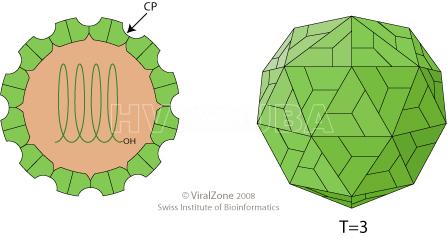
- Esquema de virion de PLRV. Autor: www.viralzone.expasy.org
Virión esférico sin envoltura de aproximadamente 23 nm de diámetro con simetría icosaédrica T = 3, compuesto por 180 proteínas CP.
.
.
.
Antecedentes
Junto con el virus PVY, PLRV es considerando la principal causa de degeneración de la papa en Argentina. Es uno de los virus más destructivos del cultivo de esta Solanácea. Está presente en todas las regiones de cultivo. Las plantas enfermas disminuyen drásticamente su producción de tubérculos. Puede producir 60% de pérdidas.
.
Síntomas
Esta enfermedad produce síntomas primarios y secundarios.
Síntomas primarios: son los que se manifiestan en la misma estación o período vegetativo en que las plantas han contraído la infección. Las hojas superiores presentan una coloración más clara (amarillenta) y son más rígidas y erectas que las hojas normales. Los folíolos presentan un leve doblez de los bordes inferiores. Si la infección es tardía (en plantas adultas; después del período de floración) los síntomas pueden pasar inadvertidos.
En algunas variedades susceptibles aparece el floema necrosado. Se manifiesta en la parte del tubérculo que va unida al estolón y puede penetrar profundamente en el tubérculo.
Síntomas secundarios: Son los síntomas que presentan las plantas a partir del segundo año de infección. Es el estado de la enfermedad más común y destructiva en papa.
Se caracteriza por el enrollamiento y espesamiento de los folíolos de las hojas inferiores de las plantas. Los bordes de las hojas se doblan hacia arriba y adentro. Estas hojas son más gruesas que las sanas, se las nota coriáceas al tacto y al moverlas producen ruido debido a su rigidez. La planta enferma se desarrolla menos que la sana. Se produce necrosis del floema, lo que al impedir el normal movimiento de la savia elaborada, provoca enrollamiento y engrosamiento de la lámina foliar. Los tubérculos son pequeños (30-100 gr.) y los estolones más cortos.
.
- Fuente: Western Australian Agriculture Authority (WAAA)
- Fuente: Western Australian Agriculture Authority (WAAA)
- Fuente: Western Australian Agriculture Authority (WAAA)
.
Histología patológica
Los tubos cribosos pierden su función, se necrosan. Las paredes de las células se engrosan y en parte se lignifican. Esto tiende a cerrar el lumen de los tubos cribosos. En las hojas, se acumula almidón en las células del parénquima esponjoso; de esta forma por la presión ejercida, se expande el tejido; mientras que el parénquima en empalizada, se mantiene rígido y no se distienda.
.
Fisiopatología
El floema está muy afectado. Los tubos cribosos pierden su función. El transporte de hidratos de carbono desde las hojas no se produce o está muy disminuido. El transporte de las hojas a los tubérculos durante la noche está muy reducido en las plantas infectadas y en la mañana siguiente, cuando comienza la fotosíntesis las hojas están todavía llenas de almidón. El almidón se acumula en las hojas en lugar de hacerlo en los tubérculos. Los hidratos de carbono, que no son capaces de migrar desde las hojas enfermas, están sometidos a un corto metabolismo cíclico: almidón, hexosa, sacarosa, almidón. A pesar de la disminución en la fotosíntesis y al notable aumento de la respiración, el almidón continúa acumulándose en las hojas. Esto coincide con el hecho de que muy pocos hidratos de carbono consiguen migrar a los tejidos de reserva.
En las plantas sanas, la sacarosa es sustancia normalmente destinada a migrar a los tubérculos a través del floema. En pecíolos de hojas enfermas no se encontró nunca sacarosa. Esto significa que los hidratos de carbono que alcanzan a los tubérculos no migran en forma de sacarosa por floema sino como hexosa por parénquima.
Los tubérculos enfermos llevan muy lentamente a los nuevos brotes las sustancias que consiguen almacenar. Se mantienen turgentes y duros aún después de la germinación, mientras que los sanos quedan vacíos y fláccidos y contraídos, porque ceden su contenido a las nuevas plantas. Los brotes de tubérculos infectados crecen muy delgados y los efectos del hambre en los órganos de reserva de la planta se vuelven más irreparables cada año.
.
Condiciones predisponentes
El aumento de nitrógeno en las plantas infectadas reduce intensamente la manifestación de los síntomas y causa disminución de necrosis en floema.
El tiempo caluroso y seco aumenta generalmente la necrosis en floema en las plantas infectadas de la mayoría de las variedades.
La difusión de los áfidos o su migración en la naturaleza está estrechamente relacionada con las condiciones climáticas y muy especialmente con las temperaturas, que son el factor decisivo. Las temperaturas óptimas para la migración de las formas aladas están entre los 20 y 25ºC. La reproducción cesa a los 30ºC. Cuando se producen altas temperaturas prolongadas la población de áfidos desaparece. Se relaciona el escaso porcentaje de infección en los meses de diciembre, enero y febrero en el SE. de la Pcia. de Buenos Aires con la baja proporción de formas aladas que se encuentra en esa época. Es probable que esto se deba a las temperaturas que se registran. Durante la migración primaveral de octubre y principios de noviembre, los cultivos están recién implantados y las plantas no han emergido. La infección provocada por el virus en la papa está en relación directa con el número de formas aladas de los áfidos que caen en las trampas colocadas en los cultivos.
.
Dispersión – Vectores
El PLRV se transmite por insectos vectores. El virus se perpetúa en tubérculos y se transmite por áfidos. El vector más eficiente es Myzus persicae. El virus se transmite en forma persistente-circulativo no propagativo (no se replica dentro de los áfidos vectores) (Nault, 1997; Sylvester, 1980; Mowry y Ophus, 2006; Pinheiro et al., 2019). Se ha demostrado (en múltiples hospedantes) que el PLRV induce señales de olor que son atractivas y/o llamativas a los pulgones vectores y también pueden inducir otro tipo de señales como las de contacto o del gusto que favorecen el asentamiento del vector (Mauck et al., 2012).
.
Manejo integrado
La estrategia de manejo se basa en actuar sobre el inóculo inicial sembrando material certificado libre de virus y en controlar los vectores portadores del virus.
Para la producción de papa semilla certificada se deberían seguir los siguientes pasos:
1) Limpieza del material mediante técnicas de propagación in vitro
2) producción de papa semilla básica en invernaderos a prueba de áfidos
3) Multiplicación en campos aislados de las zonas de producción de papa para consumo
4) Monitoreo y control de vectores
5) Erradicación de plantas enfermas
6) Defoliación anticipada
7) Análisis virológico de tubérculos post cosecha
.
.
Videos
PLRV video (ver síntomas), Dr. Bhupendra S. Kharayat
.
.
Bibliografía
Almasi et al. (2013) Detection of Coat Protein Gene of the Potato Leafroll Virus by Reverse Transcription Loop-Mediated Isothermal Amplification. Journal of Plant Pathology & Microbiology 4:1. doi: 10.4172/2157-7471.1000156
Arseneault T, Pieterse CM, Gérin-Ouellet M, Goyer C, Filion M (2014) Long-term induction of defense gene expression in potato by pseudomonas sp. LBUM223 and streptomyces scabies. Phytopathology 104(9): 926-32. doi: 10.1094/PHYTO-11-13-0321-R
Barrios Barón MP, Agrofoglio YC, Delfosse VC, Nahirñak V, Gonzalez de Urreta M, Almasia NI, Vazquez Rovere C, Distéfano AJ (2017) First Complete Genome Sequence of Potato leafroll virus from Argentina. Genome Announc. 5(30): e00628-17. doi: 10.1128/genomeA.00628-17
, , , et al. (2020) Argentinian potato leafroll virus P0 protein: Novel activities for a previously known suppressor. Plant Pathology 00: 1– 16. doi: 10.1111/ppa.13290
DeBlasio SL, Xu Y, Johnson RS, Rebelo AR, MacCoss MJ, Gray SM, Heck M (2018) The Interaction Dynamics of Two Potato Leafroll Virus Movement Proteins Affects Their Localization to the Outer Membranes of Mitochondria and Plastids. Viruses 10(11): 585. doi: 10.3390/v10110585
Gil Ramírez JF, Cotes Torres JM, Montoya MM (2011) Incidencia y caracterización molecular del Potato Leafroll Virus (PLRV) en las principales regiones productoras de papa de Colombia. Fitosanidad, 15(1), 17-24. Link
González Pasayo RA, Huarte MA (2010) Efecto del ácido salicílico en la eliminación de PLRV y PVY en plantas de papa. Revista Latinoamericana de la Papa 16(1): 58-67. doi: 10.37066/ralap.v16i1.168
Kotzampigikis A, Hristova D, Tasheva-Terzieva E (2010) Virus-vector relationship between Potato leafroll virus (PLRV) and Myzus persicae Sulzer. Bulgarian Journal of Agricultural Science, 16 (No 4) 2010, 412-421. Link
Kumar RR, Ansar M, Rajani K, et al. (2020) First report on molecular basis of potato leaf roll virus (PLRV) aggravation by combined effect of tuber and prevailing aphid. BMC Res Notes 13: 523. doi: 10.1186/s13104-020-05370-1
Li J, Wang B, Song X, et al. (2013) Potato leafroll virus (PLRV) and Potato virus Y (PVY) influence vegetative growth, physiological metabolism, and microtuber production of in vitro-grown shoots of potato (Solanum tuberosum L.). Plant Cell Tiss Organ Cult 114: 313–324. doi: 10.1007/s11240-013-0327-x
Rashid MO, Wang Y, Han CG (2020) Molecular Detection of Potato Viruses in Bangladesh and Their Phylogenetic Analysis. Plants 9: 1413. doi: 10.3390/plants9111413
Iftikhar Y et al. (2020) Effect of Environmental Factors on Potato Leaf Roll Virus (PLRV) Infecting Potato Varieties and Myzus persicae (Sulzer). Pakistan Journal of Agricultural Research 33(3):473-479 Follow journal. doi: 10.17582/journal.pjar/2020/33.3.473.479
Mauck, K., Bosque‐Pérez, N.A., Eigenbrode, S.D., De Moraes, C.M. and Mescher, M.C. (2012), Transmission mechanisms shape pathogen effects on host–vector interactions: evidence from plant viruses. Funct Ecol, 26: 1162-1175. doi: 10.1111/j.1365-2435.2012.02026.x
Mondal S, Wenninger EJ, Hutchinson PJS, Whitworth JL, Shrestha D, Eigenbrode SD, Bosque-Pérez NA, Snyder WE (2017) Responses of Aphid Vectors of Potato leaf roll virus to Potato Varieties. Plant Dis. 101(10): 1812-1818. doi: 10.1094/PDIS-12-16-1811-RE
Mowry TM, Ophus JD (2006) Influence of the Potato leafroll virus and virus-infected plants on the arrestment of the aphid, Myzus persicae. J Insect Sci. 6: 1-8. doi: 10.1673/2006_06_22.1
Nault LR (1997) Arthropod transmission of plant viruses: a new synthesis. Annals of the Entomological Society of America 90: 521–541. doi: 10.1093/aesa/90.5.521
, , , , A polerovirus, Potato leafroll virus, alters plant–vector interactions using three viral proteins. Plant Cell Environ. 43: 387– 399. https://doi.org/10.1111/pce.13684
Robertson NL, Smeenk J, Anderson JM (2011) Molecular characterization of Potato leafroll virus, Potato virus A, and Potato virus X isolates from potatoes in Alaskan cities and villages. Online. Plant Health Progress. doi: 10.1094/PHP-2011-0209-01-BR
Rodríguez de Estrada Y, Ortega EC, Trujillo G (1995) Detección de los virus PLRV, PVY, PVX y PVS en brotes de tubérculos de papa por latécnica serológica de ELISA. Revista Latinoamericana de la Papa. 7/8: 94-101.
Rouzé-Jouan J, Terradot L, Pasquer F, Tanguy S, Giblot Ducray-Bourdin D (2001) The passage of Potato leafroll virus through Myzus persicae gut membrane regulates transmission efficiency. J Gen Virol. 82(Pt 1): 17-23. doi: 10.1099/0022-1317-82-1-17
Roberts IM, Tamada T, Harrison BD (1980) Relationship of Potato Leafroll Virus to Luteoviruses: Evidence from Electron Microscope Serological Tests. Journal of General Virology 47. doi:
Scholthof KBG et al. (2011) Top 10 plant viruses in molecular plant pathology. Molecular Plant Pathology 12: 938-954. doi: 10.1111/j.1364-3703.2011.00752.x
Sylvester ES (1980) Circulative and propagative virus transmission by aphids. Annual Review of Entomology 25: 257–286. doi: 10.1146/annurev.en.25.010180.001353
Sun H, Jiao WB, Krause K, et al. (2022) Chromosome-scale and haplotype-resolved genome assembly of a tetraploid potato cultivar. Nat Genet. doi: 10.1038/s41588-022-01015-0
Thomas PE, Hassan S (2002) First Report of Twenty-two New Hosts of Potato leafroll virus. Plant Dis. 86(5): 561. doi: 10.1094/PDIS.2002.86.5.561A
Wagemans J, Holtappels D, Vainio E, et al. (2022) Going Viral: Virus-Based Biological Control Agents for Plant Protection. Annu Rev Phytopathol. 60: 21-42. doi: 10.1146/annurev-phyto-021621-114208
Xu Y, Ju HJ, DeBlasio S, et al. (2018) A Stem-Loop Structure in Potato Leafroll Virus Open Reading Frame 5 (ORF5) Is Essential for Readthrough Translation of the Coat Protein ORF Stop Codon 700 Bases Upstream. J Virol. 92(11): e01544-17. doi: 10.1128/JVI.01544-17