.
Condición fitosanitaria: Presente
Grupo de cultivos: Ornamentales
Especie hospedante: Crisantemo (Chrysanthemum)
Rango de Hospedantes: Afecta especies de crisantemos y margaritas de los géneros Chrysanthemum y Ajania (Asteraceae), incluyendo crisantemos de jardín, plantas en maceta y para flor de corte. En la Argentina, Lindquist y Merlo (1970) citan por primera vez esta enfermedad sobre Chrysanthemum morifolium var. sinense y sus cultivares.
Epidemiología: policíclica, subaguda.
Ciclo: microcíclica, autoica. No se conoce ningún hospedante intermediario.
Etiología: Hongo. Biotrófico
Agente causal: Puccinia horiana Henn. 1901
Taxonomía: Fungi > Basidiomycota > Pucciniomycotina > Pucciniomycetes > Pucciniales > Pucciniaceae > Puccinia > P. horiana
.
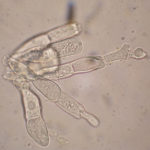
Es una roya microcíclica, autoica. Produce sólo teliosporas que normalmente germinan in situ y basidiosporas que re-infectan las hojas de crisantemo. P. horiana se distingue fácilmente de otras especies de Puccinia que se sabe infectan a Chrysanthemum spp. y especies hospedantes previamente clasificadas como crisantemo, por sus teliosporas hialinas lisas que siempre germinan in situ en la hoja viva.
.
.
Importancia económica
Esta enfermedad puede ocasionar severas pérdidas económicas, limitando el comercio internacional del crisantemo e imponiendo barreras cuarentenarias para su importación en países como Japón, Estados Unidos, Canadá, Inglaterra. Se producen pérdidas severas en camas de enraizamiento. En plantación la enfermedad puede causar la pérdida total de la producción. Las plantas adultas terminan por secarse prematuramente o su desarrollo es pobre, evidenciándose en algunos casos flores más pequeñas y sin abrir.
.
Distribución geográfica
Inicialmente la enfermedad aparece en Japón y de allí se disemina a China, Taiwán y Tailandia. Posteriormente se establece en África del Sur y países de Europa. En Latinoamérica se halla citada en Argentina, Brasil, Chile, Ecuador México, Colombia y Venezuela.
.
Sintomatología
En hojas: sobre el haz de las hojas aparecen manchas verde pálido a amarillas de hasta 4 mm de diámetro (no en el sentido de mancha necrótica). En correspondencia con estas manchas se producen en el envés de la lámina foliar pequeñas puntuaciones de color verde pálido para luego dar lugar a la formación de pústulas parduscas las que más tarde se tornan de color blanco o blanco grisáceo al producirse la germinación de las teliosporas (Palmucci y Wright, 1982). Posteriormente las pústulas toman una coloración gris oscura, la cual se debe según Lindquist y Merlo (1970) a la presencia de hongos de otros géneros, principalmente Alternaria sp. y Cladosporium cladosporioides. Generalmente, las pústulas aparecen sobre la cara inferior de las hojas. Severas infecciones naturales creciendo bajo invernáculo, muestran la formación de pústulas sobre toda la superficie del haz foliar, nervaduras y pecíolos. El soro es prominente, particularmente al profundizarse las manchas ubicadas en el haz. Las pústulas se hallan agrupadas en círculos apretados.
.
.
- Autor: Jane Trolinger Syngenta
- Autor: Jane Trolinger Syngenta
- Autor: Jane Trolinger Syngenta
- Autor: Jane Trolinger Syngenta
.
.
En tallos, brácteas e inflorescencias: Se han observado diferencias en la susceptibilidad de los cultivares comerciales. Si bien en la mayoría de los casos la sintomatología ha sido citada sólo en hojas, en variedades susceptibles, pueden aparecer soros sobre tallos, brácteas, en el pedúnculo floral y en las inflorescencias. Las pústulas se hallan dispersas sobre ambas caras de las flores liguladas, produciéndose desecación y amarillamiento a partir de sus extremos. Esa desecación no siempre está relacionada con la presencia de pústulas en las flores. En correspondencia con dichas pústulas se observa generalmente una coloración lila.
.
- Superficie superior de la hoja de crisantemo, mostrando manchas cloróticas. Autor: Laboratorio Central de Ciencias, York (GB) – Corona británica. Base de Datos Global de la EPPO.
- Superficie inferior de la hoja de crisantemo, mostrando teliosoros color rosa beige. Autor: Laboratorio Central de Ciencias, York (GB) – Corona británica. Base de Datos Global de la EPPO.
- Superficie inferior de la hoja de crisantemo, mostrando teliosoros que se han vuelto blancos debido a la presencia de esporidios. Autor: Central Science Laboratory, York (GB) – Corona británica. EPPO Global Database.
- Durante las primeras etapas de la infección, se pueden observar manchas de color verde claro a amarillo en la superficie superior de la hoja. Autor: EPPO Global Database
- Se forman pústulas cerosas (telia) de color blanco elevado, a menudo ligeramente rosado, en la superficie inferior de la hoja correspondiente, rara vez en la superficie superior. Son de 2-4 mm de diámetro, solitarios o agregados. Autor: EPPO Global Database
- Las pústulas viejas eventualmente son colonizadas por organismos saprofitos y se vuelven de color marrón sucio. En casos severos pueden ocurrir infecciones de pecíolos, tallos y flores. Autor: EPPO Global Database
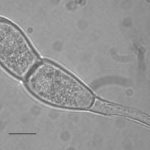
- Las teliosporas son hialinas, cilíndricas, fusiformes y claviformes oblongas a oblongas (rara vez elípticas) con una pared celular lisa de color amarillo pálido (1–2 µm de espesor, 3–10 µm de espesor en el ápice). Predominantemente, las teliosporas están ligeramente constreñidas en un solo tabique, raramente biseptadas, 32–45 × 12–18 µm (excluyendo el pedicelo). El pedicelo es hialino, persistente y de hasta 45 µm de largo. Autor: EPPO Global Database
- A partir de una o ambas células, las teliosporas germinan in situ para producir un promicelio, con una a cuatro (a menudo dos) basidiosporas en forma de riñón adheridas. P. horiana se distingue fácilmente de otras especies por sus teliosporas hialinas lisas que siempre germinan in situ en la hoja viva. Autor: EPPO Global Database
.
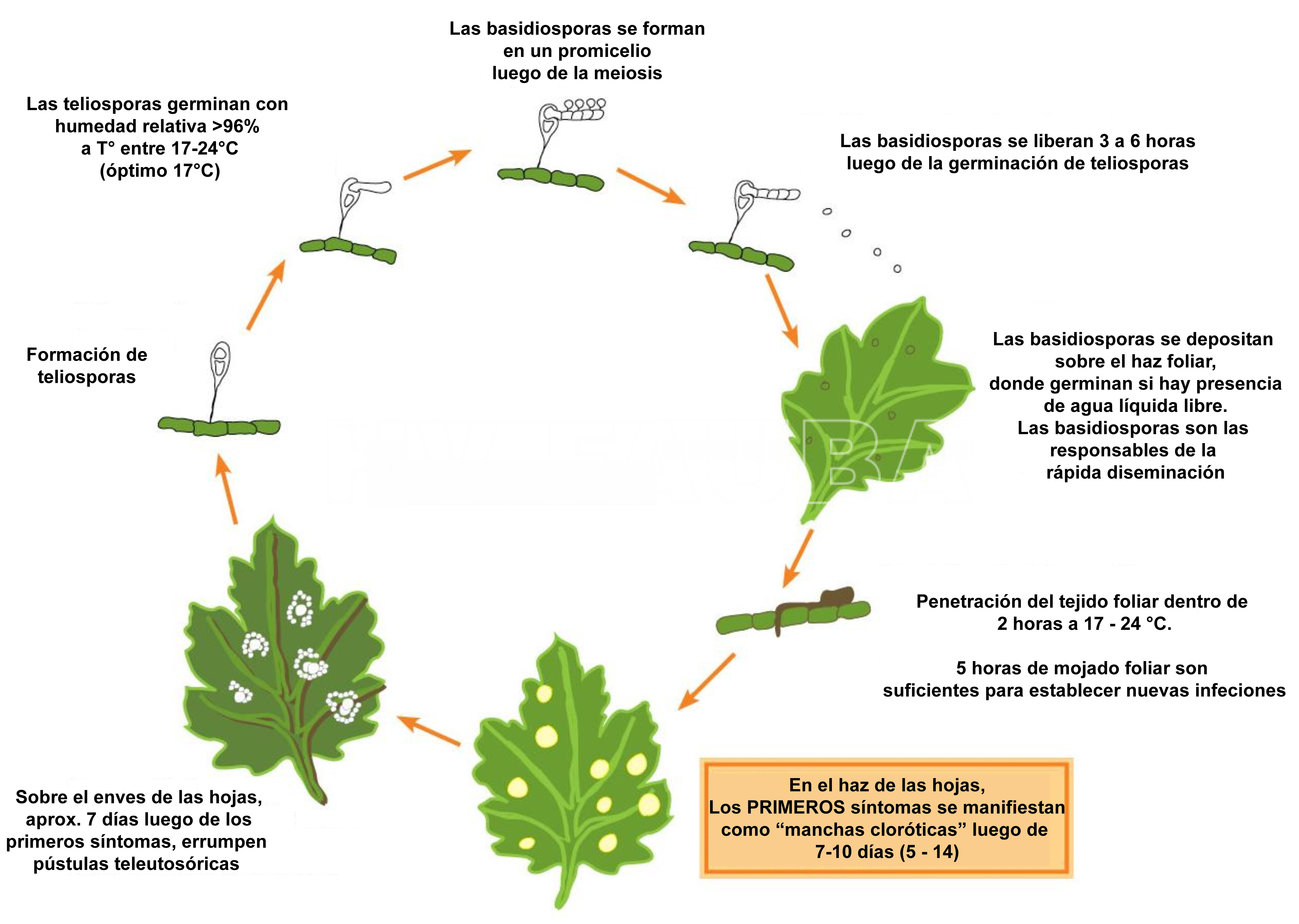
Ciclo de la enfermedad
A fines de invierno y principios de primavera, cuando comienzan las condiciones favorables, las teliosporas que permanecieron durante el invierno en crisantemos perennes enfermos y restos de vegetación infectados sobre las estructuras de invernáculos y en el suelo, germinan dando lugar a la formación de basidiosporas. Estas germinan inmediatamente en presencia de una película de agua produciendo la infección en plantas sanas. Algunos autores han observado que las teliosporas pueden formar un tubo germinativo largo y hialino que se orienta hacia los estomas a través de los cuales penetra en el hospedante. Además, los gajos infectados constituyen una importante fuente de inóculo. Bajo condiciones de invernadero, los síntomas aparecen a los 9-10 días. Estos ciclos se repiten durante la primavera y el otoño sobre las plantas infectadas. Durante el verano con temperaturas mayores de 25ºC no se observa infección. Las plantas infectadas pueden no mostrar los síntomas externos durante condiciones de clima cálido y seco.
Las principales vías de dispersión son los esquejes, las plantas infectadas y las flores cortadas. Además, el viento, las salpicaduras de agua, la lluvia, el suelo contaminado con restos vegetales, las herramientas, el calzado o la vestimenta y las manos constituyen otras formas de dispersión del inóculo. La dispersión de las basidiosporas por viento puede alcanzar desde 500-700 metros o más, siendo efectiva sólo en tiempo húmedo.
.
- Ciclo de la roya del crisantemo, causada por Puccinia horiana. Autor: Jane Trolinger, Syngenta
.
Condiciones predisponentes
La temperatura óptima para la germinación de las teliosporas es 17°C. La germinación de las basidiosporas se produce entre 10-20ºC y su penetración entre 17-24ºC. A temperaturas mayores a 25ºC no hay infección. La severidad de la enfermedad es mayor en días cortos y en hojas jóvenes. Para que se produzcan las infecciones se requiere alta humedad relativa ambiente y presencia de agua libre sobre la superficie foliar (no menos de 5 horas). El período de incubación a 17-21C° es de 6 días, hasta 13 días con temperaturas lejos del óptimo.
.
Medidas de manejo
* Plantaciones de esquejes sanos y medidas preventivas.
* Monitoreo semanal del cultivo para detectar la aparición de los síntomas.
* Inspección minuciosa de los gajos antes de su plantación, sobre todo del material importado.
* Selección adecuada de las prácticas culturales para evitar ambientes con alta humedad relativa y, densidad de plantación, ventilación).
* Recolección y películas de agua sobre las hojas (tipo de riego, horario de las aplicaciones de plaguicidas o fertilizantes destrucción de los residuos de plantas infectadas.
* Aplicación de fungicidas en forma preventiva (Mancozeb y Chlorothalonyl) o curativa (triazoles y estrobirulinas) alternando los diferentes mecanismos de acción. Existe evidencia sobre el desarrollo de tolerancia o resistencia a diferentes productos químicos.
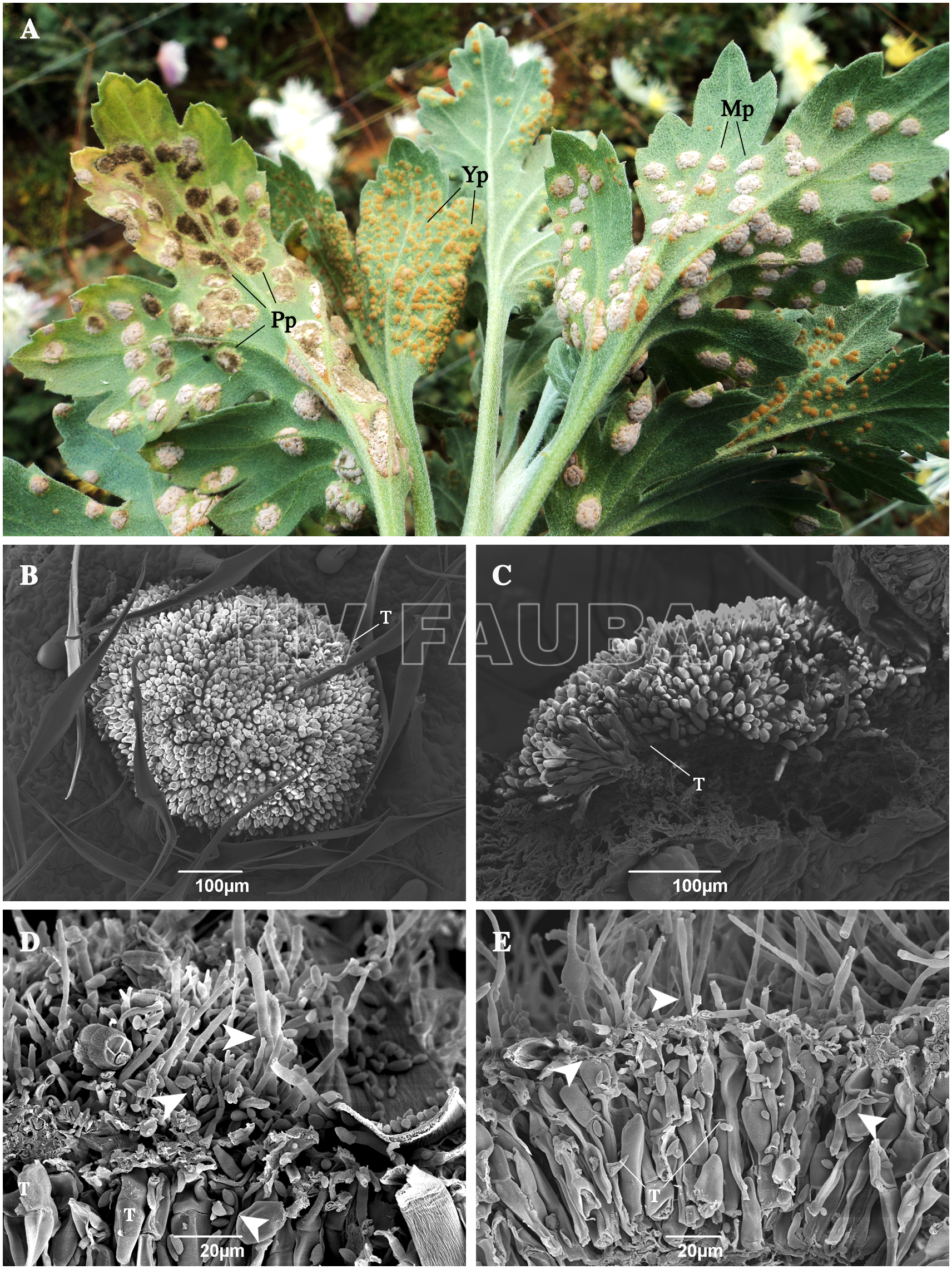
* Control biológico: se ha reportado el posible antagonismo fúngico de Cladosporium cladosporioides and Cladosporium pseudocladosporioides contra Puccinia horiana (Torres et al., 2017).
.
- Telia de Puccinia horiana parasitada por hongos en el campo. (A) Hojas recolectadas del campo. Pp: pústula parasitada; Yp: pústula joven; Pf: pústula madura. (B-C) Pústulas no dañadas. (D-E) Pústulas dañadas con hongos morfológicamente similares al género Cladosporium. Las puntas de flecha indican estructuras que se asemejan a Cladosporium sp. T: teliosporas de P. horiana. Autor: Torres et al., 2017.
.
.
Bibliografía
Alaei H, De Backer M, Nuytinck J, et al. (2009) Phylogenetic relationships of Puccinia horiana and other rust pathogens of Chrysanthemum × morifolium based on rDNA ITS sequence analysis. Mycol. Res. 113: 668–683. doi: 10.1016/j.mycres.2009.02.003
Bi M, Li X, Yan X, et al. (2021) Chrysanthemum WRKY15-1 promotes resistance to Puccinia horiana Henn. via the salicylic acid signaling pathway. Horticulture Research 8: 6. doi: 10.1038/s41438-020-00436-4
Bonde MR, Murphy CA, Bauchan GR, et al. (2015) Evidence for Systemic Infection by Puccinia horiana, Causal Agent of Chrysanthemum White Rust, in Chrysanthemum. Phytopathology 105(1): 91-8. doi: 10.1094/PHYTO-09-13-0266-R
Cook RTA (2001) First report in England of changes in the susceptibility of Puccinia horiana, the cause of chrysanthemum white rust, to triazole and strobilurin fungicides. Plant Pathol. 50: 792.
De Backer M, Alaei H, Van Bockstaele E, et al. (2011) Identification and characterization of pathotypes in Puccinia horiana, a rust pathogen of Chrysanthemum x morifolium. Eur J Plant Pathol 130: 325–338. doi: 10.1007/s10658-011-9756-8
De Jong J, Rademaker W (1986) The reaction of chrysanthemum cultivars to Puccinia horiana and the inheritance of resistance. Euphytica 35: 945–952.
Dickens JSW (1968) The resistance of various cultivars and species of chrysanthemum to white rust (Puccinia horiana Henn.). Plant Pathol. 17: 19–22.
Dong L, et al. (2018) Transcriptome analysis of chrysanthemum in responses to white rust. Sci. Hortic. 233: 421–430. doi:
EPPO (2020) PM 7/027 (2) Puccinia horiana. EPPO Bull, 50: 207-216. doi: 10.1111/epp.12658
Firman ID, Martin PH (1968) White rust of chrysanthemums. Ann. Appl. Biol. 62: 429–442.
Gunta SB, Régulo R, Raquel N (1992) Roya blanca del crisantemo en Venezuela. Fitopatología 27: 90-92.
Hirakawa H, Sumitomo K, Hisamatsu T, et al. (2019) De novo whole-genome assembly in Chrysanthemum seticuspe, a model species of Chrysanthemums, and its application to genetic and gene discovery analysis. DNA Research 26: 195–203. doi: 10.1093/dnares/dsy048
Li P, Song A, Gao C, et al. (2015) Chrysanthemum WRKY gene CmWRKY17 negatively regulates salt stress tolerance in transgenic chrysanthemum and Arabidopsis plants. Plant Cell Rep. 34, 1365–1378. doi: 10.1007/s00299-015-1793-x
Lintz J, Dubrulle G, Cawston E, et al. (2022) A Short Review of Anti-Rust Fungi Peptides: Diversity and Bioassays. Front. Agron. 4: 966211. doi: 10.3389/fagro.2022.966211
, , Amino acid substitutions responsible for different QoI and SDHI sensitivity patterns in Puccinia horiana, the causal agent of chrysanthemum white rust. Plant Pathology 00: 1– 10. https://doi.org/10.1111/ppa.13298
Mekapogu M, Jung J-A, Kwon O-K, et al. (2021) Recent Progress in Enhancing Fungal Disease Resistance in Ornamental Plants. International Journal of Molecular Sciences. 22(15): 7956. doi: 10.3390/ijms22157956
O’Keefe G, Davis DD (2015) Morphology of Puccinia horiana, causal agent of chrysanthemum white rust, sampled from naturally infected plants. Plant Disease 99: 1738–1743. doi: 10.1094/PDIS-02-15-0239-RE
Palmer CL, Bonde MR, Nester SE, et al. (2015) Fungicide Impact on in vitro Germination of Basidiospores of Puccinia horiana, the Causal Agent of Chrysanthemum White Rust. Plant Health Progress 16: 73-76. doi: 10.1094/PHP-RS-14-0032
Palmucci HE, Wright ER (1985) La roya blanca del crisantemo (Puccinia horiana Henn.). Actas 2º Congreso Latinoamericano de Fitopatología: 84-89.
Park SK, Lim JH, Shin HK, et al. (2014) Identification of chrysanthemum genetic resources resistant to white rust caused by Puccinia horiana. Plant Breed. Biotechnol. 2: 184–193. doi: 10.9787/PBB.2014.2.2.184
Song A, et al. (2014) Phylogenetic and transcription analysis of chrysanthemum WRKY transcription factors. Int. J. Mol. Sci. 15, 1442–1455.
Sumitomo K, Shirasawa K, Isobe SN, et al. (2021) DNA marker for resistance to Puccinia horiana in chrysanthemum (Chrysanthemum morifolium Ramat.) «Southern Pegasus». Breed Sci. 71(2): 261-267. doi: 10.1270/jsbbs.20063
Takatsu Y, Ohishi K, Tomita Y, et al. (2000) Use of chrysanthemum plantlets grown in vitro to test cultivar susceptibility to white rust, Puccinia horiana P. Hennings. Plant Breed. 119: 528–530. doi: 10.1046/j.1439-0523.2000.00540.x
Torres DE, Rojas-Martínez RI, Zavaleta-Mejía E, Guevara-Fefer P, Márquez-Guzmán GJ, Pérez-Martínez C (2017) Cladosporium cladosporioides and Cladosporium pseudocladosporioides as potential new fungal antagonists of Puccinia horiana Henn., the causal agent of chrysanthemum white rust. PLoS ONE 12(1): e0170782. doi: 10.1371/journal.pone.0170782
Vencescontreras C, Vázquezgarcía LM (2008) Inoculation in vitro of the white rust (Puccinia horiana Hennings) in chrysanthemum (Dendranthema grandiflora Tzvelev). Agron. Mesoam. 19: 81–85.
Water J (1981) Chrysanthemum White Rust. EPPO Bulletin, 11: 239-242. doi: 10.1111/j.1365-2338.1981.tb01930.x
Whipps JM (1993) A review of white rust (Puccinia horiana Henn.) disease on chrysanthemum and the potential for its biological control with Verticillium lecanii (Zimm.) Viégas. Ann. Appl. Biol. 122: 173–187. doi: 10.1111/j.1744-7348.1993.tb04025.x
Zeng J, Sun J, Xu Y, et al. (2013) Variation for resistance to white rust (Puccinia horiana) among Ajania and Chrysanthemum species. HortScience 48: 1231–1234. doi: 10.21273/HORTSCI.48.10.1231
Zhu PF, Zhao NL, Qi D, et al. (2011) Optimization on identification standards and artificial inoculation methods in vitro on resistance to chrysanthemum white rust. Agric. Sci. Technol. 12: 1640–1644.