.
Condición fitosanitaria: Plaga Cuarentenaria Ausente
Grupo de cultivos: Frutícolas
Especie hospedante: Banano (Musa x paradisiaca). Descripción del cultivo: link
Rango de hospedantes: específico / estrecho
Aunque Musa spp. son los hospedantes principales de M. fijiensis, la planta ornamental Heliconia psittacorum ha sido reportada como hospedante alternativo (Gasparotto et al., 2005). Recientemente, se han reportado varias plantas no relacionadas como hospedantes alternativos de P. fijiensis: Heliconia psittacorum, Heliconiaceae; Wedelia trilobata, Asteracea; Xantosoma robustum Araceae; y Digitaria sp., Poaceae, en México (Vázquez-Euán et al., 2019).
Etiología: Hongo. Necrotrófico (Hemibiotrófico)
Agente causal: Pseudocercospora fijiensis (M. Morelet) Deighton (anamorfo) / Mycosphaerella fijiensis (M. Morelet) Deighton (teleomorfo)
Taxonomía: Fungi > Ascomycota > Pezizomycotina > Dothideomycetes > Mycosphaerellaceae > Pseudocercospora
.
Mycosphaerella fijiensis es un hongo sexual heterotálico que tiene a Pseudocercospora fijiensis como estadio anamorfo. Es un ascomicete haploide, hemibiotrófico dentro de la clase Dothideomycetes, orden Capnodiales y familia Mycosphaerellaceae. Su ubicación taxonómica se basa en la filogenia del ADN, análisis morfológicos y características culturales.
Mycosphaerella fijiensis (anamorfo Pseudocercospora fijiensis) se considera el miembro más destructivo del «complejo de la enfermedad de Sigatoka», que incluye M. musicola (anamorfo P. musae), el agente causal de la enfermedad de la mancha foliar de Sigatoka (también llamada mancha foliar de Sigatoka amarilla) y M. eumusae (anamorfo P. eumusae), que causa la enfermedad de la mancha foliar de Eumusae (anteriormente llamada enfermedad de la mancha foliar por Septoria). Musa spp. son los hospedantes principales de M. fijiensis y presentan una variedad de síntomas que dependen de los niveles de resistencia de los hospedantes individuales.
Se han aislado más de 60 cepas distintas con diferentes capacidad patogénica (JGI, 2013). Arango et al. (2016) han secuenciado, ensamblado y comenzado a caracterizar el genoma de P. fijiensis utilizando la secuenciación completa del genoma de dos aislados de P. fijiensis diferentes.
.
.
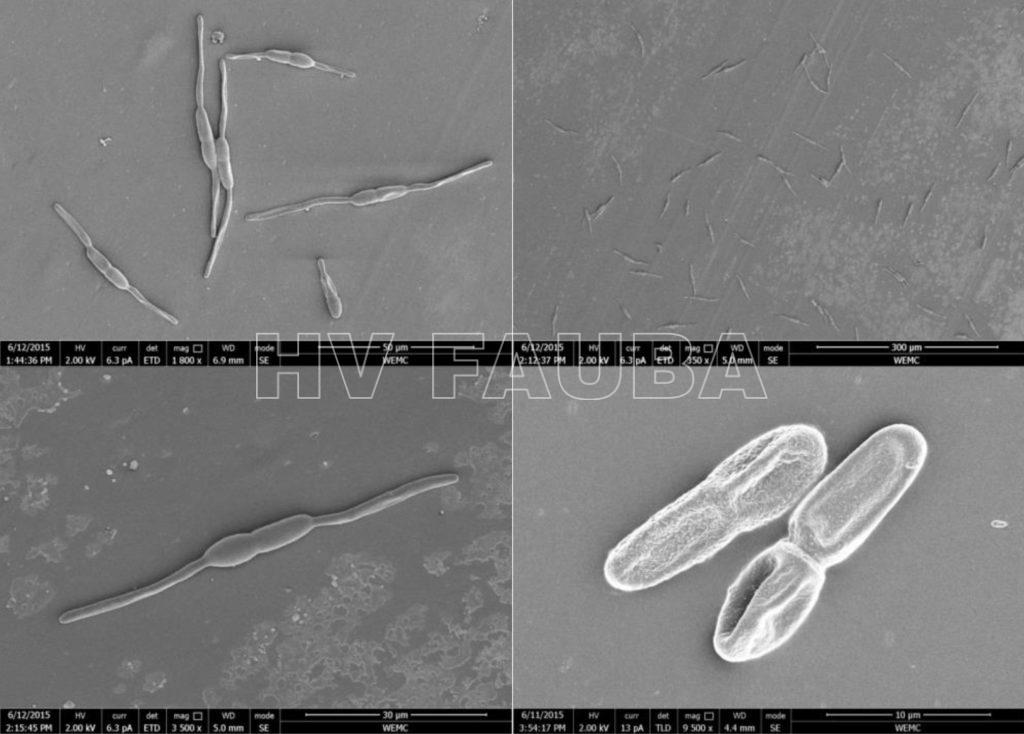
- Conidióforos y conidios de Pseudocercospora fijiensis. Autor: Dr Jose R. Liberato DPI&F
- Ascosporas de Pseudocercospora fijiensis en microscopio electrónico de barrido criogénico (CRY-SEM). Autor: Chong Aguirre, 2016.
.
.
Importancia económica y antecedentes
La Sigatoka negra representa la principal limitante en la producción de musáceas (plátano y banano) a nivel mundial (Marín et al., 2003; Friesen, 2016; Strobl y Mohan, 2020). Históricamente fue una enfermedad destructiva en las áreas tropicales de América, en países productores de banana como Islas del Caribe, Cuba, República Dominicana y Jamaica; y en África. Desde 1902, los patógenos del banano Pseudocercospora fijiensis, P. musae y P. eumusae, han surgido como importantes limitaciones a la producción del banano y el plátano. A pesar de los esfuerzos conjuntos para contrarrestar estos patógenos, siguen aún teniendo un impacto negativo en el rendimiento del banano.
Las estimaciones de pérdidas de rendimiento en bananos de postre y plátanos están en el rango de 20 a 80% cuando no se aplican fungicidas (Maciel Cordeiro y Pires de Matos, 2003).
.
.
Sintomatología
M. fijiensis causa rayas de color marrón rojizo que corren paralelas a las nervaduras de las hojas, y que se agregan para formar rayas compuestas más grandes, de color marrón oscuro a negro. Estas rayas eventualmente forman lesiones fusiformes o elípticas que se fusionan, forman un borde empapado de agua con un halo amarillo y, eventualmente, se fusionan para causar una extensa necrosis foliar. La enfermedad no mata las plantas inmediatamente, sino que las debilita al disminuir la capacidad fotosintética de las hojas, provocando una reducción en la cantidad y calidad de la fruta e induciendo la maduración prematura de la fruta recolectada de las plantas infectadas.
.
- Una inspección minuciosa de las lesiones revela la producción de esporas.
..
.
- https://bananaresearch.org
- https://bananaresearch.org
- https://bananaresearch.org
- https://bananaresearch.org
.
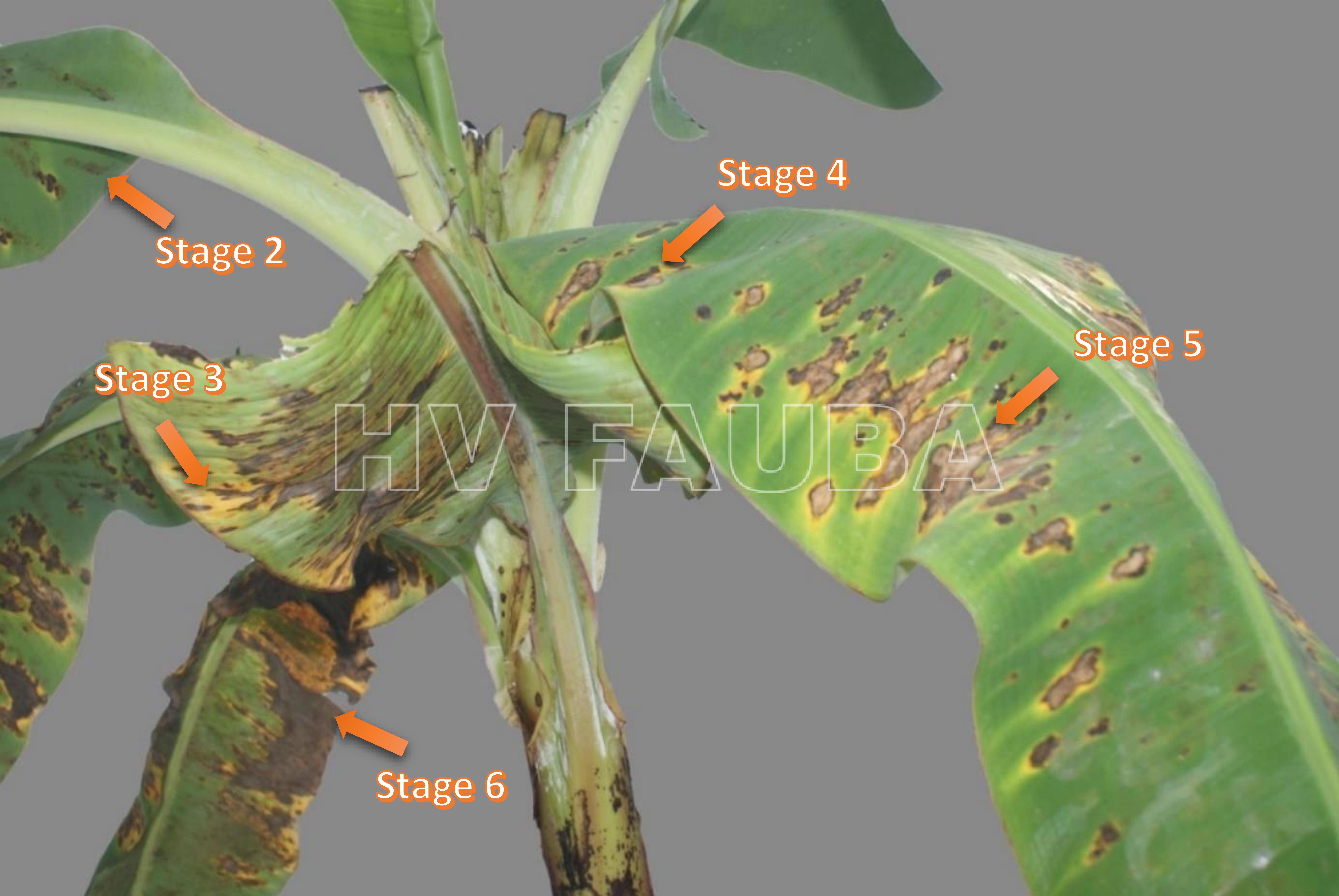
Fouré (1985) clasificó los síntomas de la Sigatoka negra de acuerdo con la siguiente escala:
* Estado 1. Pequeñas lesiones o puntos de color blanco-amarillento a marrón, de 1 mm de longitud, denominadas pizcas, apenas visibles en el envés de las hojas.
* Estado 2. Rayas o estrías cloróticas de 3–4 mm de longitud por 1 mm de ancho, de color marrón.
* Estado 3. Las rayas o estrías se alargan y amplían dando la impresión de haber sido pintadas con pincel, sin bordes definidos y de color café, que pueden alcanzar hasta 2 cm de longitud.
* Estado 4. Manchas ovaladas de color café en el envés y negro en el haz.
* Estado 5. Manchas negras rodeadas de un anillo negro y a veces un halo amarillento y centro seco y semihundido.
* Estado 6. Manchas con centro seco y hundido, de coloración marrón clara, rodeadas de tejido clorótico.
.
- Planta de banano infectada con Pseudocercospora fijiensis en un experimento de invernadero. La planta presenta los síntomas típicos de la enfermedad, estrías, lesiones necróticas elípticas con borde empapado de agua y un halo amarillo clorótico y necrosis extensa. Las marcas en flechas son algunas de las etapas de la enfermedad según la descripción de Fouré (Fouré 1985). Autor: Chong Aguirre, 2016.
.
Asimismo, Meredith y Lawrence (1969) describieron las etapas de desarrollo de la Sigatoka negra del banano (Meredith y Lawrence, 1969) de la siguiente manera: la etapa 1 es la “etapa inicial de pequeñas manchas” en la que las manchas de menos de 0.25 mm son levemente visibles en la superficie de la hoja abaxial. Las siguientes etapas se muestran en la figura a continuación: (A) La etapa 2 es la «etapa de la primera estría». (B) La etapa 3 es la «etapa de la segunda estría «. (C) La etapa 4 es la «primera etapa de manchas». (D) La etapa 5 es la «segunda etapa de manchas «. (E) Etapas 5 y 6, donde la última es la «tercera etapa o etapa madura». (F) Coalescencia de rayas o estrías y manchas en una hoja gravemente enferma. (G) Todas las etapas del desarrollo de rayas y manchas suelen estar presentes en una sola planta u hoja. (H) Lesiones redondeadas, no rayadas, encontradas en hojas de chupones de «agua» de banano jóvenes. (I) Lesiones angostas en las rayas de las hojas en la hoja 2 de la ventosa «espada». (J – L) Evolución temporal del desarrollo de los síntomas en una planta «Grande Naine» incubada en una cámara de crecimiento en el norte del estado de Nueva York.
.
- Etapas de desarrollo de la Sigatoka negra de acuerdo con Meredith y Lawrence (1969). Autor: Churchill, 2011.
.
Epidemiología
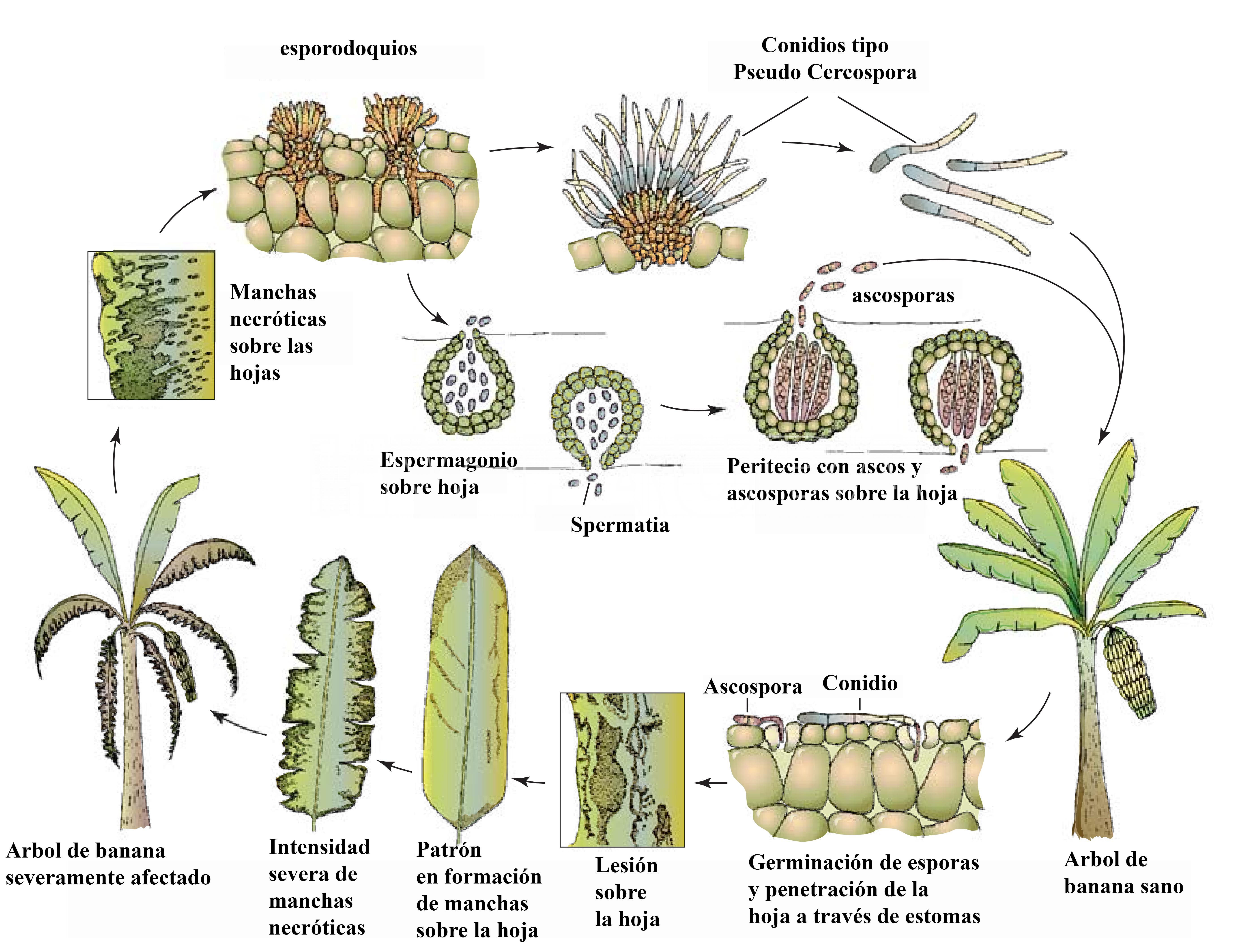
M. fijiensis se reproduce tanto sexual como asexualmente, y tanto los conidios como las ascosporas son importantes en su dispersión. Los conidios se transmiten principalmente por el agua a cortas distancias, mientras que las ascosporas son transportadas por el viento a lugares más remotos (las distancias están limitadas por su susceptibilidad a la luz ultravioleta). El hongo produce conidios multicelulares a partir de conidióforos que surgen de estomas principalmente en la superficie abaxial (inferior) de las hojas infectadas. Los conidióforos surgen de las hifas presentes en la cámara substomática y pueden producir múltiples conidios a partir de un solo conidióforo. Los conidióforos se forman en grupos densos (esporodochia) en estromas oscuros.
.

https://bananaresearch.org
.
El desarrollo epidemiológico de la enfermedad dependerá de la interacción de los componentes del triángulo del patosistema, el que se encuentra directamente influenciado por las condiciones climáticas, la susceptibilidad de la variedad plantada, el nivel o grado de patogenicidad y virulencia de las cepas predominantes en la región y la actividad antrópica (manejo del cultivo). La elevada precipitación (> 1.400 mm anuales), humedad relativa >80% y temperatura promedio entre 23 a 28ºC son las condiciones ambientales más predisponentes al desarrollo de epidemias de la enfermedad. Períodos con abundantes lluviosas favorecen la dispersión e infección, debido a la presencia continua de una lámina de agua libre sobre la superficie de las hojas, lo que favorece los procesos de liberación e infección de las esporas.
.
- Ciclo de desarrollo de la Sigatoka del banano causada por Mycosphaerella musicola o M. fijiensis. Autor: Agrios, 2005.
.
.
Manejo Integrado
** Resistencia genética:
Plantar variedades resistentes (algunas variedades poseen tolerancia a la enfermedad).
Se han encontrado fuentes de resistencia (ej. Kimunye et al., 2021).
.
** Control cultural:
* Usar material de siembra certificado libre de enfermedad.
* Construir drenajes para evitar saturación de agua en el suelo.
* Sembrar cultivos asociados como maíz y café.
* Aplicar fertilizante mineral que aporte especialmente Fósforo (P), Potasio (K) y Calcio (Ca) y suplementar con la aplicación de materia
orgánica, lixiviados de raquis de plátano y biofertilizantes.
* Deshoje: Se recomienda si la hoja está afectada en su totalidad o en más del 50%. En caso contrario haga cirugía, es decir, remueva fragmentos de la hoja afectados con estados 3 a 6, cada 15 días en época de lluvias y 20 a 30 días en épocas secas. Las hojas deben
ser trozadas para acelerar su degradación en el suelo.
* Manejo de malezas, plagas, nematodos fitoparásitos y otras enfermedades del cultivo.
* Deshije, desguasque, desbellote, desmane y embolsado del racimo.
** Control químico:
Aplicación de fungicidas. Se deben seguir las medidas anti-resistencia enmarcadas dentro de un programa de manejo integrado de la enfermedad. Ya se ha reportado resistencia a fungicidas de M. fijiensis (Romero y Sutton, 1998; Amil et al., 2007; Cañas‐Gutíerrez et al., 2006; Cañas‐Gutíerrez et al., 2009).
Utilizar sistemas de pronóstico de la enfermedad (Ganry et al., 2008).
.
- https://bananaresearch.org
- https://bananaresearch.org
- https://bananaresearch.org
.
.
.
.
Bibliografía
Aguilar-Barragan A, García-Torres AE, Odriozola-Casas O, et al. (2014) Chemical management in fungicide sensitivity of Mycosphaerella fijiensis collected from banana fields in México. Braz J Microbiol. 45(1): 359-64. doi: 10.1590/s1517-83822014000100051
Alakonya AE, Kimunye J, Mahuku G, et al. (2018) Progress in understanding Pseudocercospora banana pathogens and the development of resistant Musa germplasm. Plant Pathol, 67: 759-770. doi: 10.1111/ppa.12824
, , (2007) Dynamics of QoI sensitivity in Mycosphaerella fijiensis in Costa Rica during 2000 to 2003. Phytopathology, 97, 1451–1457. doi: 10.1094/PHYTO-97-11-1451
Arango R, Diaz-Trujillo C, Dhillon B, et al. (2016) Combating a global threat to a clonal crop: banana black Sigatoka pathogen Pseudocercospora fijiensis (synonym Mycosphaerella fijiensis) genomes reveal clues for disease control. PLoS Genet 12(8): e1005876. doi: 10.1371/journal.pgen.1006234
Arcila-Galvis JE, Arango RE, Torres-Bonilla JM, Arias T (2021) The Mitochondrial Genome of a Plant Fungal Pathogen Pseudocercospora fijiensis (Mycosphaerellaceae), Comparative Analysis and Diversification Times of the Sigatoka Disease Complex Using Fossil Calibrated Phylogenies. Life. 11(3): 215. doi: 10.3390/life11030215
Arzanlou M (2008) Phylogeny, detection, and mating behaviour of Mycosphaerella spp. occurring on banana. Doctoral thesis, van Wageningen Universiteit. Link
Arzanlou M, Groenewald JZ, Fullerton RA, et al.l (2008) Multiple gene genealogies and phenotypic characters differentiate several novel species of Mycosphaerella and related anamorphs on banana. Persoonia 20: 19-37. doi: 10.3767/003158508X302212
Balint-Kurti PJ, May GD, Churchill AC (2001) Development of a transformation system for Mycosphaerella pathogens of banana: a tool for the study of host/pathogen interactions. FEMS Microbiol Lett. 195(1): 9-15. doi: 10.1111/j.1574-6968.2001.tb10490.x
Balint Kurti PJ (2004) Towards a molecular understanding of mycosphaerella/banana interactions. Book Chapter. p.147-160. Link
Bean TP, Cools HJ, Lucas JA, et al. (2009) Sterol content analysis suggests altered eburicol 14α‐demethylase (CYP51) activity in isolates of Mycosphaerella graminicola adapted to azole fungicides. FEMS Microbiol. Lett. 296: 266–273. doi: 10.1111/j.1574-6968.2009.01645.x
Becker P, Esker P, Umaña G (2021) Incorporation of microorganisms to reduce chemical fungicide usage in black sigatoka control programs in Costa Rica by use of biological fungicides. Crop Protection 146: 105657. doi: 10.1016/j.cropro.2021.105657
, , (2006) Molecular characterization of benomyl‐resistant isolates of Mycosphaerella fijiensis, collected in Colombia. J. Phytopathol. 154: 403–409. doi: 10.1111/j.1439-0434.2006.01113.x
Cañas-Gutiérrez GP, Angarita-Velásquez MJ, Restrepo-Flórez JM, et al. (2009) Analysis of the CYP51 gene and encoded protein in propiconazole-resistant isolates of Mycosphaerella fijiensis. Pest Manag Sci. 65(8): 892-9. doi: 10.1002/ps.1770
Chong Aguirre PA (2016) The origin, versatility and distribution of azole fungicide resistance in the banana black Sigatoka pathogen Pseudocercospora fijiensi. Doctoral thesis, Wageningen University. Link
Chong P, Vichou A-E, Schouten HJ, et al. (2019) Pfcyp51 exclusively determines reduced sensitivity to 14α-demethylase inhibitor fungicides in the banana black Sigatoka pathogen Pseudocercospora fijiensis. PLoS ONE 14(10): e0223858. doi: 10.1371/journal.pone.0223858
Chong P, Essoh JN, Arango Isaza RE, et al. (2021) A world-wide analysis of reduced sensitivity to DMI fungicides in the banana pathogen Pseudocercospora fijiensis. Pest Manag Sci, 77: 3273-3288. doi: 10.1002/ps.6372
Churchill A (2011) Mycosphaerella fijiensis, the black leaf streak pathogen of banana: progress towards understanding pathogen biology and detection, disease development, and the challenges of control. Mol Plant Pathol. 12(4): 307-28. doi: 10.1111/j.1364-3703.2010.00672.x
, , , (2009) Integrated pest management approaches developed in the French West Indies to reduce pesticide use in banana production systems. Acta Hortic. 828: 375–382. doi: 10.17660/ActaHortic.2009.828.38
Diaz‐Trujillo C, Chong P, Stergiopoulos I, et al. (2018) A new mechanism for reduced sensitivity to demethylation‐inhibitor fungicides in the fungal banana black Sigatoka pathogen Pseudocercospora fijiensis. Molecular Plant Pathology 19: 1491-1503. doi: 10.1111/mpp.12637
Fouré E (1985) Black leaf streak disease of banana and plantains (Mycosphaerella fijiensis Morelet). Study of the symptoms and stage of the disease in Gabon. IRFA-CIRAD, París
Friesen TL (2016) Combating the Sigatoka Disease Complex on Banana. PLoS Genet 12(8): e1006234. doi: 10.1371/journal.pgen.1006234
Fullerton RA, Olsen TL (1995) Pathogenic variability in Mycosphaerella fijiensis Morelet, cause of black Sigatoka in banana and plantain, New Zealand Journal of Crop and Horticultural Science 23: 39-48. doi: 10.1080/01140671.1995.9513866
Ganry J, De Lapeyre De Bellaire L, Mourichon X (2008) A biological forecasting system to control Sigatoka disease of bananas and plantains. Fruits 63(6): 381-387. doi: 10.1051/fruits:2008038
Gasparotto L, Pereira JCR, Urben AF, et al. (2005) Heliconia psittacorum: hospedeira de Mycosphaerella fijiensis, agente causal da Sigatoka‐negra da bananeira. Fitopatol. Bras. 30> 423–425. doi: 10.1590/S0100-41582005000400016
JGI (2013) «Mycosphaerella fijiensis v2.0″. Joint Genome Institute, U.S. Department of Energy. 2013. Archived from the original on 28 February 2014. Retrieved 13 August 2013.
Kema GHJ (2021) New study shows decreasing effectiveness of fungicides to control the devastating Black Sigatoka disease of banana. Wageningen University & Research. Link
, , , , Sources of resistance to Pseudocercospora fijiensis, the cause of black Sigatoka in banana. Plant Pathology 70: 1651– 1664. doi: 10.1111/ppa.13408
, , , (2009) Black sigatoka of banana (Mycosphaerella fijiensis). Available at Pest and Diseases Image Library.
Maciel Cordeiro ZJ, Pires de Matos A (2003) Impact of Mycosphaerella spp. in Brazil. In: Mycosphaerella Leaf Spot Diseases of Bananas: Present Status and Outlook. Proceedings of the Workshop on Mycosphaerella Leaf Spot Diseases, San José, Costa Rica, 20–23 May 2002 (Jacome, L., Lepoivre, P., Marin, D., Ortiz, R., Romero, R. and Escalant, J.V., eds), pp. 91–97. Montpellier: The International Network for the Improvement of Banana and Plantain.
, , (2003) Black Sigatoka: an increasing threat to banana cultivation. Plant Disease 87: 208–222. doi: 10.1094/PDIS.2003.87.3.208
Ngando JE, Rieux A, Nguidjo O, et al. (2015) A novel bioassay to monitor fungicide sensitivity in Mycosphaerella fijiensis. Pest Manag Sci. 71(3): 441-51. doi: 10.1002/ps.3825
Romero RA, Sutton TB (1998) Characterization of Benomyl Resistance in Mycosphaerella fijiensis, Cause of Black Sigatoka of Banana, in Costa Rica. Plant Disease 82(8): 931-934. doi: 10.1094/PDIS.1998.82.8.931
Silva TC, Moreira SI, de Souza DM, et al. (2024) Resistance to Site-Specific Succinate Dehydrogenase Inhibitor Fungicides Is Pervasive in Populations of Black and Yellow Sigatoka Pathogens in Banana Plantations from Southeastern Brazil. Agronomy 14(4): 666. doi: 10.3390/agronomy14040666
Strobl E, Mohan P (2020) Climate and the Global Spread and Impact of Bananas’ Black Leaf Sigatoka Disease. Atmosphere. 11(9): 947. doi: 10.3390/atmos11090947
Vázquez-Euán R, Chi-Manzanero B, Hernández-Velázquez I, et al. (2019) Identification of New Hosts of Pseudocercospora fijiensis Suggests Innovative Pest Management Programs for Black Sigatoka Disease in Banana Plantations. Agronomy 9(10): 666. doi: 10.3390/agronomy9100666