.
Condición fitosanitaria: Presente solo en algunas áreas del país
Grupo de cultivos: Forestales
Especie hospedante: pináceas (Pinaceae, Lindley, 1836)
Etiología: Pseudohongo. Necrotrófico
Agente causal: Phytophthora spp., Pythium spp.
Phytophthora austrocedri Gresl. & E.M. Hansen 2007
.
Taxonomía:
Eukaryota > Stramenopiles > Oomycetes > Peronosporales > Peronosporaceae > Phytophthora
Eukaryota > Stramenopiles > Oomycetes > Pythiales > Pythiaceae > Pythium
.
.
Síntomas
Los síntomas aéreos de los árboles incluyen marchitamiento, clorosis, necrosis, adelgazamiento de la corona, crecimiento raquítico, lesiones de corteza en la base con exudaciones resinosas y extensas necrosis del tejido del xilema subyacente, y la muerte eventual de plántulas, especialmente en áreas bajas y húmedas, cuando los ataques ocurren en etapas tempranas del crecimiento de las plantas. El cambium es rojo-marrón o caramelo-coloreado particularmente en el collar de la raíz. Las raíces se tornan negras y finas, y eventualmente mueren. Las raíces leñosas de dos árboles desarraigados exhiben necrosis de la corteza y destrucción de una alta proporción de raíces finas. Los árboles con pudrición de raíz se vuelven de color amarillo-rojo y mueren, a veces de repente. Las raíces de árboles infectados con Phytophthora cinnamomi muestran «gomosis» (hemorragia fuerte). Estos árboles infectados tienen raíces que son mínimas, a menudo marrones y podridas. El deterioro de las raíces hace que los árboles de repente se marchitan, se vuelven amarillos, pierden hojas, se derrumban y mueren. El estrés, como la sequía, el calor, también puede debilitar las raíces y hacerlas susceptibles a la infección. Phytophthora no produce cuerpos fructíferos o esporas fácilmente reconocibles en el tejido infectado, y el diagnóstico sólo puede confirmarse aislando el organismo en medio de cultivo puro. Las especies de Phytophthora son a menudo difíciles de aislar porque son frecuentemente cubiertas por otros hongos, especialmente especies de Pythium.
- 01 Mal de las coníferas
- 02 Mal de las coníferas
- 03 Mal de las coníferas
- 04 Mal de las coníferas
- 05 Mal de las coníferas
- 06 Mal de las coníferas
- 07 Mal de las coníferas
.
Epidemiología
Todas las especies de Phytophthora spp. pueden sobrevivir en el suelo durante varios años. Producen oosporas, de origen sexual, con una estructura de supervivencia microscópicas de paredes gruesas, y clamidosporas en el tejido infectado del hospedante. Sin embargo, hay variabilidad entre especies en cuanto a la presencia o ausencia de estas esporas y también a su tamaño y forma. El método más confiable de identificación de Phytophthora spp. es el hallazgo de la fase de esporulación con esporangios, los cuales se producen comúnmente en el tejido infectado y se pueden examinar con microscópico a partir de aislamientos realizados en medios específicos. Las zoosporas nadan a través del agua hasta hacer contacto con las raíces o el tejido del tronco inferior de los hospedantes potenciales, donde germinan e infectan estos tejidos. El pseudohongo crece en el tejido del hospedante, rodeando la raíz infectada o el tronco y matando eventual el árbol. A medida que el hospedante muere, el pseudohongo produce las estructuras de supervivencia en tejidos en descomposición. Si se retira el árbol, estas oosporas permanecen, a través del tejido hospedante podrido, en el suelo, donde permiten que el hongo sobreviva en ausencia de un hospedante.
.
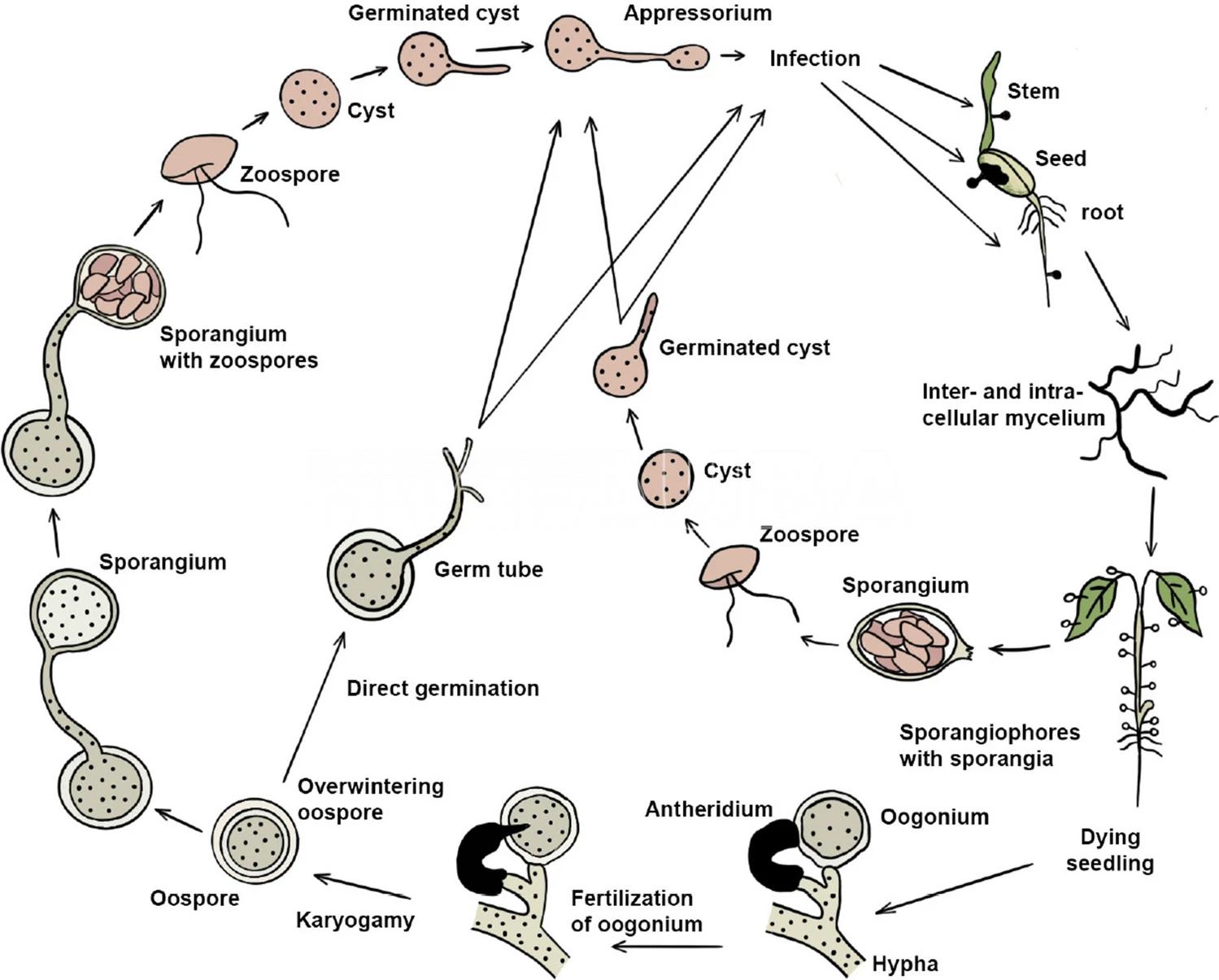
- Ciclo biológico de Pythium spp. El ciclo agronómico se considera monocíclico. Autores: West et al. 2003; Jayawardena et al., 2020.
.
Manejo Integrado
* Evitar situaciones de estrés para los árboles.
* Evitar la compactación del suelo.
* Aplicación foliar o con jeringa en tejidos de conducción de los árboles de activadores de las defensas de las plantas como por ejemplos los fosfitos.
.
.
Bibliografía
Avila-Quezada GD, Rai M (2023) Novel nanotechnological approaches for managing Phytophthora diseases of plants. Trends Plant Sci.: S1360-1385(23)00102-4. doi: 10.1016/j.tplants.2023.03.022
Bourret TB, Fajardo SN, Frankel SJ, Rizzo DM (2023) Cataloging Phytophthora Species of Agriculture, Forests, Horticulture, and Restoration Outplantings in California, U.S.A.: A Sequence-Based Meta-Analysis. Plant Dis. 107(1): 67-75. doi: 10.1094/PDIS-01-22-0187-RE
Brasier C, Scanu B, Cooke D, Jung T (2022) Phytophthora: an ancient, historic, biologically and structurally cohesive and evolutionarily successful generic concept in need of preservation. IMA Fungus 13(1): 12. doi: 10.1186/s43008-022-00097-z
, , , et al. (2020) Towards a best practice methodology for the detection of Phytophthora species in soils. Plant Pathology 00: 1– 11. doi: 10.1111/ppa.13312
Ferrarini E, De Roo V, Geudens N, et al. (2022) Altering in vivo membrane sterol composition affects the activity of the cyclic lipopeptides tolaasin and sessilin against Pythium. Biochim Biophys Acta Biomembr.: 184008. doi: 10.1016/j.bbamem.2022.184008
Gao RF, Wang JY, Liu KW, et al. (2021) Comparative analysis of Phytophthora genomes data. Data Brief. 39: 107663. doi: 10.1016/j.dib.2021.107663
Ginetti B, Uccello A, Bracalini M, et al. (2012) Root Rot and Dieback of Pinus pinea Caused by Phytophthora humicola in Tuscany, Central Italy. Plant Disease 96(11): 1694. DOI: 10.1094/PDIS-05-12-0451-PDN
Jayawardena RS, Hyde KD, Chen YJ, et al. (2020) One stop shop IV: taxonomic update with molecular phylogeny for important phytopathogenic genera: 76–100. Fungal Diversity 103: 87–218 (2020). doi: 10.1007/s13225-020-00460-8
Kato F, Ando Y, Tanaka A, et al. (2022) Synthesis of aglycones, structure-activity relationships, and mode of action of lycosides as inhibitors of the asexual reproduction of Phytophthora. Biosci Biotechnol Biochem. : zbac179. doi: 10.1093/bbb/zbac179
Kronmiller BA, Feau N, Shen D, et al. (2023) Comparative Genomic Analysis of 31 Phytophthora Genomes Reveals Genome Plasticity and Horizontal Gene Transfer. Mol Plant Microbe Interact. 36(1): 26-46. doi: 10.1094/MPMI-06-22-0133-R
Legrifi I, Al Figuigui J, El Hamss H, et al. (2022) Potential for Biological Control of Pythium schmitthenneri Root Rot Disease of Olive Trees (Olea europaea L.) by Antagonistic Bacteria. Microorganisms 10(8): 1635. doi: 10.3390/microorganisms10081635
Lin X, Torres Ascurra YC, Fillianti H, et al. (2023) Recognition of Pep-13/25 MAMPs of Phytophthora localizes to an RLK locus in Solanum microdontum. Front Plant Sci. 13: 1037030. doi: 10.3389/fpls.2022.1037030
Liu Y, He P, He P, et al. (2022) Potential biocontrol efficiency of Trichoderma species against oomycete pathogens. Front Microbiol. 13: 974024. doi: 10.3389/fmicb.2022.974024
Neupane K, Ghimire B, Baysal-Gurel F (2022) Efficacy and Timing of Application of Fungicides, Biofungicides, Host-Plant Defense Inducers, and Fertilizer to Control Phytophthora Root Rot of Flowering Dogwoods in Simulated Flooding Conditions in Container Production. Plant Disease. doi: 10.1094/PDIS-02-22-0437-RE
Hunter S, Williams N, McDougal R, et al. (2018) Evidence for rapid adaptive evolution of tolerance to chemical treatments in Phytophthora species and its practical implications. PLoS One 13(12): e0208961. doi: 10.1371/journal.pone.0208961
Nguyen HDT, Dodge A, Dadej K, et al. (2022) Whole genome sequencing and phylogenomic analysis show support for the splitting of genus Pythium. Mycologia 6:1-15. doi: 10.1080/00275514.2022.2045116
Panda A, Sen D, Ghosh A, et al. (2018) EumicrobeDBLite: a lightweight genomic resource and analytic platform for draft oomycete genomes. Molecular Plant Pathology 19: 227–237. doi: 10.1111/mpp.12505
Pilbeam RA, Colquhoun IJ, Shearer B, Hardy GEStJ (2000) Phosphite concentration: Its effect on phytotoxicity symptoms and colonisation by Phytophthora cinnamomi in three understorey species of Eucalyptus marginata forest. Australasian Plant Pathology 29(2):86-95.
Scott PM, Dell B, Shearer BL, et al. (2013) Phosphite and nutrient applications as explorative tools to identify possible factors associated with Eucalyptus gomphocephala decline in South-Western Australia. Australasian Plant Pathology 42: 701. DOI: 10.1007/s13313-013-0243-x
Scott P, Friedrich Bader MK, Williams NM (2016) Foliar phosphite application has minor phytotoxic impacts across a diverse range of conifers and woody angiosperms. Physiologia Plantarum 158( 2): 124–134. doi: 10.1111/ppl.12442
Situ J, Xi P, Lin L, et al. (2022) Signal and regulatory mechanisms involved in spore development of Phytophthora and Peronophythora. Front Microbiol. 13: 984672. doi: 10.3389/fmicb.2022.984672
Tu CK, Wang PH, Lee MH (2022) The endophytic bacterium Lysobacter firmicutimachus strain 5-7 is a promising biocontrol agent against rice seedling disease caused by Pythium arrhenomanes in nursery trays. Plant Dis. doi: 10.1094/PDIS-05-22-1195-RE
van West P, Appiah AA, Gow NA (2003) Advances in research on oomycete root pathogens. Physiological and Molecular Plant Pathology 62: 99–113. doi: 10.1016/S0885-5765(03)00044-4
Wang N, Yin Z, Wu Y, et al. (2023) A Pythium myriotylum Small Cysteine-Rich Protein Triggers Immune Responses in Diverse Plant Hosts. Mol Plant Microbe Interact.: MPMI09220187R. doi: 10.1094/MPMI-09-22-0187-R