.
Condición fitosanitaria: Plaga Cuarentenaria Ausente
Grupo de cultivos: Frutícolas
Especie hospedante: Banano (Musa x paradisiaca). Descripción del cultivo: link
Rango de hospedantes: específico / estrecho. Las especies de Fusarium oxysporum causan marchitamiento en más de 150 hospedantes y varían con formae speciales específicas (Bertoldo et al., 2015; Jangir et al., 2021).
Etiología: Hongo. Necrotrófico
Agente causal: Fusarium oxysporum f. sp. cubense (Foc) W. C. Snyder & H. N. Hansen 1940
Taxonomía: Fungi > Ascomycota > Pezizomycotina > Sordariomycetes > Hypocreales > Nectriaceae > Fusarium > Fusarium oxysporum species complex > Fusarium oxysporum
.
Fusarium oxysporum es un hongo «habitante» del suelo, que produce dos tipos de esporas asexuales: macroconidios, microconidios y estructuras de resistencia, las clamidosporas.
Los macroconidios son rectos a ligeramente curvados, delgados y de paredes delgadas, generalmente con tres o cuatro septos, una célula basal en forma de pie y una célula apical cónica y curva. Generalmente se producen a partir de fialidas sobre conidióforos por división basípeta. Son importantes en la infección secundaria.
Los microconidios son elipsoidales y no tienen tabique o tienen uno solo. Se forman a partir de fialidas en falsas cabezas por división basípeta. Son importantes en la infección secundaria.
Las clamidosporas son globosas y tienen paredes gruesas. Se forman a partir de hifas o, alternativamente, mediante la modificación de células de hifas. Son importantes como órganos de resistencia en suelos donde actúan como inóculos en la infección primaria.
Se desconoce el teleomorfo o etapa reproductiva sexual de F. oxysporum.
A pesar de que las especies de Fusarium tienen un amplio rango de hospedantes, las especies individuales a menudo se asocian con solo una o unas pocas plantas hospedantes (Li et al., 2020). Así por ejemplo, las poblaciones de F. solani patógenas en plantas se han dividido en 12 formae speciales y dos razas (Šišić et al., 2018). Por su parte, en el caso de F. oxysporum f. sp. ciceris se han reportado hasta ocho razas en todo el mundo (Haware y Nene, 1982; Sharma et al., 2012). Fusarium oxysporum es la especie de Fusarium de mayor importancia económica y más común. Se sabe que este hongo del suelo alberga cepas patógenas (de vegetales, animales y humanos) y no patógenas. Sin embargo, en su concepto actual, F. oxysporum es un complejo de especies que consta de numerosas especies crípticas. La identificación y el nombre de estas especies crípticas se complica por los múltiples sistemas de clasificación subespecíficos y la falta de material vivo de tipo ex que sirva como punto de referencia básico para la inferencia filogenética. Por lo tanto, para avanzar y estabilizar la posición taxonómica de F. oxysporum como especie y permitir el nombramiento de las múltiples especies crípticas reconocidas en este complejo de especies, Lombard et al. (2019) designaron un epitipo para F. oxysporum. Utilizando la inferencia filogenética de múltiples locus y las diferencias morfológicas sutiles con el epitipo recién establecido de F. oxysporum como punto de referencia, pudieron resolver 15 taxones crípticos, descriptos como especies.
Las cepas patógenas de Foc se clasifican en razas según la respuesta diferencial de los cultivares. Tradicionalmente se reconocen cuatro razas, aunque determinadas situaciones sugieren que pueden existir más razas. Se necesitan extensos estudios de inoculación para definir claramente los diversos patotipos, pero estos son costosos y laboriosos (requieren mucho tiempo). Los resultados también pueden ser equívocos debido a la variabilidad en las condiciones de crecimiento y / o en el material de siembra. El concepto de raza ha sido criticado por ser una clasificación imperfecta de la diversidad patogénica y por no reflejar las relaciones genéticas, pero, no obstante, se considera útil para describir la reacción del hospedante y los brotes de nuevas enfermedades.
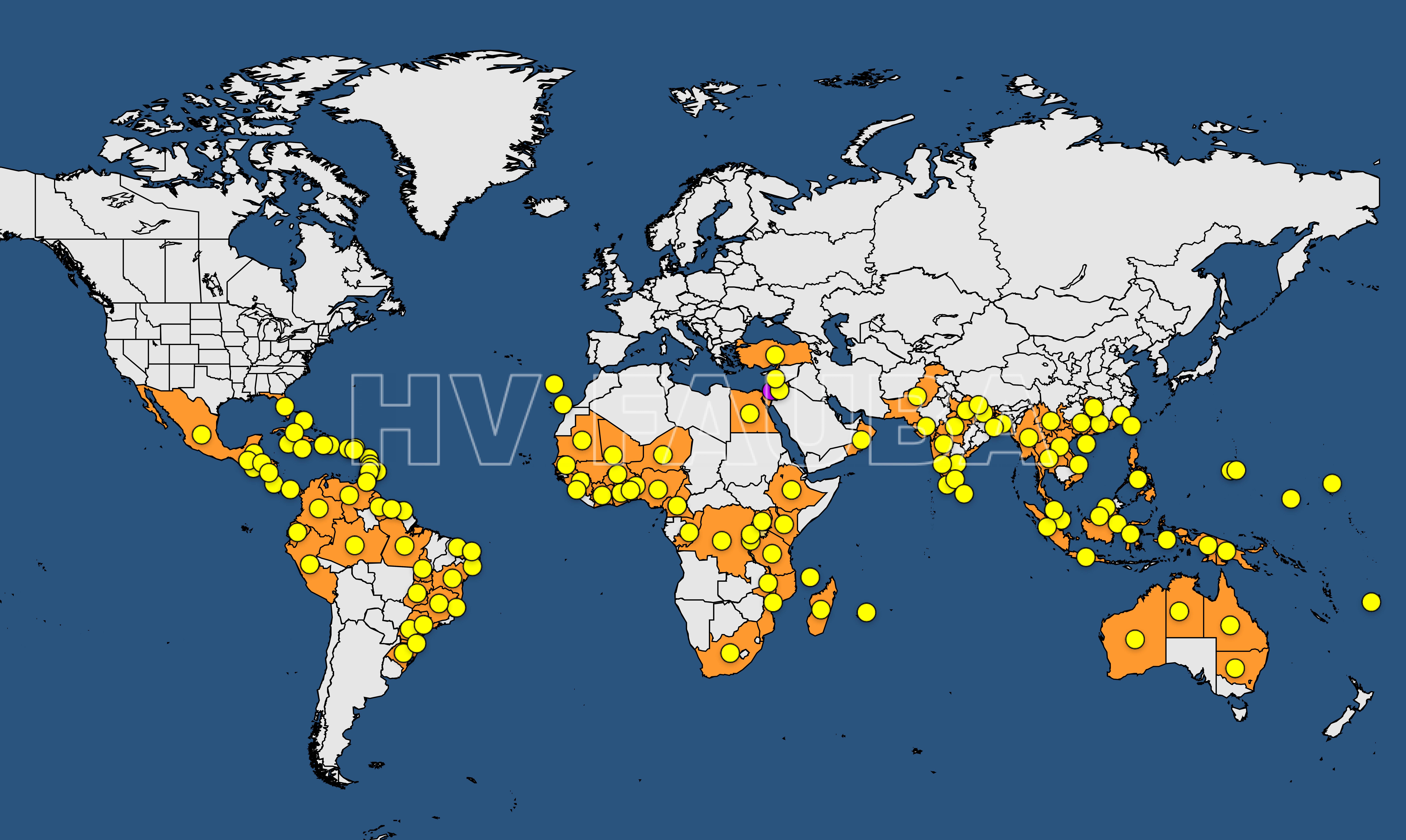
Actualmente existen 24 Grupos de Compatibilidad Vegetativa (VCG) de Foc distribuidos en linajes clonales (Ordonez et al., 2015); y tres razas patógenas bien diferenciadas que se encuentran en todo el mundo (Fourie et al., 2009). Los VCG sirven como un medio natural para subdividir una especie fúngica sobre la base de la premisa de que los aislados en el mismo VCG pueden anastomosarse para formar un heterocarión estable y se presume que son idénticos en todos los loci de la víctima (Leslie, 1990). Entre todos los VCG, VCG-01213/16 comprende el grupo de cepas denominadas raza Tropical 4 (TR4). Se cree que esta población evolucionó con su hospedante, el banano, en la región indo-malaya (Ploetz y Pegg, 1999). Esta raza está poniendo en peligro toda la industria de exportación basada en cultivares del subgrupo Cavendish, así como, y de igual relevancia, una amplia gama de otras variedades susceptibles en Oceanía, Asia, India, África y América Latina (Perrier, 2009). TR4 se diferencia de las razas 1, 2 y subtropical 4 (STR4), porque puede afectar a un rango más amplio de cultivares de banano y causar enfermedades a Cavendish en ambientes tropicales, en ausencia de condiciones predisponentes (Fourie et al., 2009). Desde su aparición en 1990 en el sudeste asiático, TR4 se ha extendido a Asia occidental, África y, más recientemente, América del Sur. A partir de ahora, TR4 se reporta en todos los continentes, y específicamente en los siguientes países: Taiwán, Indonesia, Malasia, China, Australia, Filipinas, Omán, Jordania, Mozambique, India, Pakistán, Líbano, Israel, Vietnam, Myanmar, Laos, Inglaterra, Colombia, Turquía y la isla de Mayotte (Francia) (Ordonez et al., 2015; Ploetz, 2015; Zheng et al., 2018; Damodaran et al., 2018; Maymon et al., 2018; García-Bastidas et al., 2019; Özarslandan y Akgül, 2020; Thangavelu et al., 2021).
.
.
.
.
Antecedentes
Los bananos (Musa spp.) se cultivan ampliamente en más de 135 países en regiones tropicales y subtropicales y están clasificados como uno de los cultivos más importantes del mundo (Brown et al., 2017). Solo 3 de los 50 subgrupos reconocidos de banano representan el 75% de la producción mundial actual. Esto incluye los cultivares AAA Cavendish, el subgrupo de plátano AAB y los bananos ABB East African Highland (Ploetz y Evans, 2015).
Actualmente, el marchitamiento del banano por Fusarium es la amenaza más grave para la industria bananera en todo el mundo. Este riesgo global se ve agravado por muchos factores, incluyendo el monocultivo de banano y su uniformidad genética que crea escenarios adecuados para el desarrollo de epidemias. Además, factores socioeconómicos, incluidos organismos y reglamentos fitosanitarios nacionales débiles, sistemas de vigilancia deficientes, falta de conciencia y asignación de fondos para programas nacionales de investigación, planes de contingencia no articulados, leyes restrictivas para la adopción de nuevas tecnologías de mejoramiento, etc., son obstáculos adicionales que impiden el progreso en el manejo del problema fitosanitario (Magdama et al., 2020).
.
- Mapa de la distribución mundial de la marchitez del banano por Fusarium. Fuente: EPPO; https://gd.eppo.int/taxon/FUSACB.
.
.
Sintomatología
.
- (A) Síntomas externos típicos del marchitamiento por Fusarium del banano Cavendish (cv. «Grande Naine») causado por Fusarium oxysporum f. sp. cubense (raza TR4) en una plantación infectada en Shfeya, llanura costera de Carmel, Israel. (B) Corte transversal de la vasculatura infectada de los vasos del xilema infectados. Autor: Maymon et al., 2020.
.
- Síntomas y signos asociados con la marchitez por Fusarium del banano: (a) Amarilleo y marchitamiento de las hojas. (b) Rollo de hojas tiernas. (c) Agrietamiento del pseudo tallo. (d) Invasión fúngica de las venas. (e) Rizoma infectado. (f) Etapa temprana de la infección vascular. (g) Características morfológicas y tipos de esporas de Fusarium oxysporum f. sp. cubense. (h, i) Etapas avanzadas de infección vascular con decoloración marrón rojiza típica. Autor: Magdama et al., 2020.
.
.
Bibliografía
Altimira F, Godoy S, Arias-Aravena M, et al. (2022) Genomic and Experimental Analysis of the Biostimulant and Antagonistic Properties of Phytopathogens of Bacillus safensis and Bacillus siamensis. Microorganisms 10(4): 670. doi: 10.3390/microorganisms10040670
Ayukawa Y, Asai S, Gan P, et al. (2021) A pair of effectors encoded on a conditionally dispensable chromosome of Fusarium oxysporum suppress host-specific immunity. Commun Biol 4: 707. doi: 10.1038/s42003-021-02245-4
Bartholomew ES, Xu S, Zhang Y, et al. (2022) A chitinase CsChi23 promoter polymorphism underlies cucumber resistance against Fusarium oxysporum f. sp. cucumerinum. New Phytol. doi: 10.1111/nph.18463
, , , et al (2023) The PTI-suppressing Avr2 effector from Fusarium oxysporum suppresses mono-ubiquitination and plasma membrane dissociation of BIK1. Molecular Plant Pathology 24: 1273–1286. doi: 10.1111/mpp.13369
Brown A. et al. (2017) Bananas and Plantains (Musa spp.). In: Genetic Improvement of Tropical Crops. Springer, Cham. doi: 10.1007/978-3-319-59819-2_7
Cannon S, Kay W, Kilaru S, et al. (2022) Multi-site fungicides suppress banana Panama disease, caused by Fusarium oxysporum f. sp. cubense Tropical Race 4. PLoS Pathog. 18(10): e1010860. doi: 10.1371/journal.ppat.1010860
Castillo AG, Puig CG, Cumagun CJR (2019) Non-Synergistic Effect of Trichoderma harzianum and Glomus spp. in Reducing Infection of Fusarium Wilt in Banana. Pathogens. 8(2): 43. doi: 10.3390/pathogens8020043
Constantin ME, Fokkens L, de Sain M, et al. (2021) Number of Candidate Effector Genes in Accessory Genomes Differentiates Pathogenic From Endophytic Fusarium oxysporum Strains. Front. Plant Sci. 12: 761740. doi: 10.3389/fpls.2021.761740
Cook DC, Taylor AS, Meldrum RA, Drenth A (2015) Potential economic impact of Panama disease. (Tropical race 4) on the Australian banana industry. J. Plant Dis. Prot. 122: 229–237. doi: 10.1007/BF03356557
Damodaran T, Rajan S, Mishra VK, et al. (2018) First report of Fusarium wilt in banana caused by Fusarium oxysporum f. sp. cubense Tropical race 4 in India. Plant. Dis. Notes. 103: 1022. doi: 10.1094/PDIS-07-18-1263-PDN
Deacon JW (1984) Panama disease of bananas in south africa. Hortic. Sci. 1: 29–31.
EPPO (2020) First report of Fusarium oxysporum f. sp. cubense Tropical race 4 in Mayotte. Link
Fourie G, Steenkamp ET, Gordon TR, Viljoen A (2009) Evolutionary relationships among the Fusarium oxysporum f. sp. cubense vegetative compatibility groups. Appl Environ Microbiol. 75(14): 4770-81. doi: 10.1128/AEM.00370-09
García-Bastidas FA, Van der Veen AJT, Nakasato-Tagami G, et al. (2019) An Improved Phenotyping Protocol for Panama Disease in Banana. Front. Plant Sci. 10: 1006. doi: 10.3389/fpls.2019.01006
García-Bastidas FA, Quintero-Vargas J-C, Ayala-Vasquez M, et al. (2020) First Report of Fusarium Wilt Tropical Race 4 in Cavendish Bananas Caused by Fusarium odoratissimum in Colombia. Plant Dis. Notes 104: 994-994. doi: 10.1094/PDIS-09-19-1922-PDN
García-Bastidas FA, Arango-Isaza R, Rodriguez-Cabal HA, et al. (2022) Induced resistance to Fusarium wilt of banana caused by Tropical Race 4 in Cavendish cv Grand Naine bananas after challenging with avirulent Fusarium spp. PLoS One 17(9): e0273335. doi: 10.1371/journal.pone.0273335
Gonzalez M, Gonzalez D, Winter Heck D, et al. (2024) Spatiotemporal dynamics of Fusarium wilt of banana caused by subtropical race 4. agriRxiv. doi: 10.31220/agriRxiv.2024.00229
Jangir P, Mehra N, Sharma K, Singh N, Rani M and Kapoor R (2021) Secreted in Xylem Genes: Drivers of Host Adaptation in Fusarium oxysporum. Front. Plant Sci. 12: 628611. doi: 10.3389/fpls.2021.628611
Ji HM, Mao HY, Li SJ, et al. (2021) Fol-milR1, a pathogenicity factor of Fusarium oxysporum, confers tomato wilt disease resistance by impairing host immune responses. New Phytol. 232(2): 705-718. doi: 10.1111/nph.17436
Jing T, Zhou D, Zhang M, et al. (2020) Newly Isolated Streptomyces sp. JBS5-6 as a Potential Biocontrol Agent to Control Banana Fusarium Wilt: Genome Sequencing and Secondary Metabolite Cluster Profiles. Front. Microbiol. 11: 602591. doi: 10.3389/fmicb.2020.602591
Krishnan SV, Anaswara PA, Nampoothiri KM, et al. (2025) Biocontrol Activity of New Lactic Acid Bacteria Isolates Against Fusaria and Fusarium Mycotoxins. Toxins 17(2): 68. doi: 10.3390/toxins17020068
Leslie JF (1990) Genetic exchange within sexual and asexual populations of the genus Fusarium. In Fusarium Wilt of Banana, 2nd ed.; Ploetz, R., Ed.; APS Press: St. Paul, MN, USA, pp. 37–48. ISBN 0890541124.
, , , (2021) Target of rapamycin controls hyphal growth and pathogenicity through FoTIP4 in Fusarium oxysporum. Molecular Plant Pathology 00, 1– 17. doi: 10.1111/mpp.13108
, , A single gene in Fusarium oxysporum limits host range. Molecular Plant Pathology 22: 108– 116. doi: 10.1111/mpp.13011
, , , Related mobile pathogenicity chromosomes in Fusarium oxysporum determine host range on cucurbits. Molecular Plant Pathology 21: 761– 776. doi: 10.1111/mpp.12927
Lombard L, Sandoval-Denis M, Lamprecht SC, Crous PW (2019) Epitypification of Fusarium oxysporum – clearing the taxonomic chaos. Persoonia 43: 1-47. doi: 10.3767/persoonia.2019.43.01
, , , et al. (2024) Development and application of a droplet digital PCR assay for the detection of Fusarium oxysporum f. sp. cubense tropical race 4 from different biological samples. Plant Pathology 73: 342–354. doi: 10.1111/ppa.13813
Magdama F, Monserrate-Maggi L, Serrano L, et al. (2020) Genetic Diversity of Fusarium oxysporum f. sp. cubense, the Fusarium Wilt Pathogen of Banana, in Ecuador. Plants 9(9): 1133. doi: 10.3390/plants9091133
Maryani N, Lombard L, Poerba YS, et al.(2019) Phylogeny and genetic diversity of the banana Fusarium wilt pathogen Fusarium oxysporum f. sp. cubense in the Indonesian centre of origin. Studies in Mycology 92: 155-194. doi: 10.1016/j.simyco.2018.06.003
Maymon M, Shpatz U, Harel YM, et al. (2018) First report of Fusarium oxysporum f. sp. cubense tropical race 4 causing Fusarium wilt of Cavendish bananas in Israel. Plant Dis. Notes. 102, 2655. doi: 10.1094/PDIS-05-18-0822-PDN
Maymon M, Sela N, Shpatz U, et al. (2020) The origin and current situation of Fusarium oxysporum f. sp. cubense tropical race 4 in Israel and the Middle East. Sci Rep 10: 1590. doi: 10.1038/s41598-020-58378-9
Modrzewska M, Bryła M, Kanabus J, Pierzgalski A (2022) Trichoderma as a biostimulator and biocontrol agent against Fusarium in the production of cereal crops: opportunities and possibilities. Plant Pathol. doi: 10.1111/ppa.13578
Mohandas S, Manjula R, Rawal RD, et al. (2010) Evaluation of arbuscular mycorrhiza and other biocontrol agents in managing Fusarium oxysporum f. sp. cubense infection in banana cv. Neypoovan. Biocontrol. Sci. Technol. 20: 165–181. doi: 10.1080/09583150903438439
, (2023) Constitutive activation of TORC1 signalling attenuates virulence in the cross-kingdom fungal pathogen Fusarium oxysporum. Molecular Plant Pathology 24: 289– 301. doi: 10.1111/mpp.13292
O’Donnell K, Kistler HC, Cignelnik E, Ploetz RC (1998) Multiple evolutionary origins of the fungus causing Panama disease of banana: concordant evidence from nuclear and mitochondrial gene genealogies. PNAS 95(5): 2044–49. doi: 10.1073/pnas.95.5.2044
O’Donnell K, Whitaker BK, Laraba I, et al. (2022) DNA Sequence-Based Identification of Fusarium: A Work in Progress. Plant Disease 106(6): 1597-1609. doi: 10.1094/PDIS-09-21-2035-SR
Ordonez N, Seidl MF, Waalwijk C, et al. (2015) Worse Comes to Worst: Bananas and Panama Disease—When Plant and Pathogen Clones Meet. PLoS Pathog 11(11): e1005197. doi: 10.1371/journal.ppat.1005197
Orr R, Nelson PN (2021) Eucalyptus cloeziana mulch suppresses Fusarium wilt of banana. Crop Protection 105694. doi: 10.1016/j.cropro.2021.105694
Özarslandan M, Akgül DS (2020) First Report of Fusarium oxysporum f. sp. cubense Race 4 Causing Fusarium Wilt Disease of Banana in Turkey. Plant Dis. Notes 104: 974-974. doi: 10.1094/PDIS-09-19-1881-PDN
Pegg KG, Coates LM, O’Neill WT, Turner DW (2019) The Epidemiology of Fusarium Wilt of Banana. Front. Plant Sci. 10: 1395. doi: 10.3389/fpls.2019.01395
Perrier X (2009) Combining biological approaches to shed light on the evolution of edible bananas. Ethnobot. Res. Appl. 7: 199–216. Link
Ploetz RC, Pegg KG (1999) “Fusarium Wilt,” in Diseases of Banana, Abacá and Enset. Ed. Jones., D. (Wallingford: CABI Publishing), 143–159.
Ploetz RC (2006) Fusarium wilt of banana is caused by several pathogens referred to as Fusarium oxysporum f. sp. cubense. Phytopathology 96: 653-656. doi: 10.1094/PHYTO-96-0653
Ploetz RC (2015) Fusarium Wilt of Banana. Phytopathology 105: 1512–1521. doi: 10.1094/PHYTO-04-15-0101-RVW
Ploetz RC, Evans EA (2015) The Future of Global Banana Production. In Horticultural Reviews, 1st ed.; Jules, J., Ed.; Wiley-Blackwell: Hoboken, NJ, USA, 2015; Volume 43, pp. 311–351. ISBN 9781119107781.
Rebouças TA, Rocha AJ, Cerqueira TS, et al.(2021) Pre-selection of banana somaclones resistant to Fusarium oxysporum f. sp. cubense, subtropical race 4. Crop Protection 105692. doi: 10.1016/j.cropro.2021.105692
Redkar A, Sabale M, Schudoma C, et al. (2022) Conserved secreted effectors contribute to endophytic growth and multi-host plant compatibility in a vascular wilt fungus. Plant Cell.: koac174. doi: 10.1093/plcell/koac174
, , , et al (2024) Diagnostics of Fusarium wilt in banana: Current status and challenges. Plant Pathology 00: 1–17. doi: 10.1111/ppa.13863
Sampaio DB, Mendes PF, Mascena AM, et al. (2012) Colonisation of arbuscular mycorrhiza and tolerance to Panama disease in seedlings of the maca banana. Rev. Cienc. Agron. 42: 462–469. doi: 10.1590/S1806-66902012000300007
Scheerer L, Pemsl D, Dita M, et al. (2016) A quantified approach to projecting losses caused by Fusarium wilt Tropical race 4. Acta Hortic. 1196: 211–218. doi: 10.17660/ActaHortic.2018.1196.26
Sharma M, Babu KT, Gaur PM, Ghosh R, Rameshwar T, Chaudhary RG, et al. (2012) Identification and multi-environment validation of resistance to Fusarium oxysporum f. sp. ciceris in chickpea. Field Crops Research 135: 82–88. doi: 10.1016/j.fcr.2012.07.004
Sharma M, Nagavardhini A, Thudi M, Ghosh R, Pande S, Varshney RK, et al. (2014) Development of DArT markers and assessment of diversity in Fusarium oxysporum f. sp. ciceris, wilt pathogen of chickpea (Cicer arietinum L.). BMC Genomics 15: 454. doi: 10.1186/1471-2164-15-454
Sharma M, Sengupta A, Ghosh R, Agarwal G, Tarafdar A, Nagavardhini A, Pande S, Varshney RK (2016) Genome wide transcriptome profiling of Fusarium oxysporum f sp. ciceris conidial germination reveals new insights into infection-related genes. Scientific Reports 6: 37353. doi: 10.1038/srep37353
Sharma M, Ghosh R, Tarafdar A, Rathore A, Chobe DR, Kumar AV, Gaur PM, Samineni S, Gupta O, Singh NP, Saxena DR, Saifulla M, Pithia MS, Ghante PH, Mahalinga DM, Upadhyay JB and Harer PN (2019) Exploring the Genetic Cipher of Chickpea (Cicer arietinum L.) Through Identification and Multi-environment Validation of Resistant Sources Against Fusarium Wilt (Fusarium oxysporum f. sp. ciceris). Frontiers in Sustainable Food Systtems 3: 78. doi: 10.3389/fsufs.2019.00078
Šišić A, Baćanović-Šišić J, Al-Hatmi AMS, et al. (2018) The ‘forma specialis’ issue in Fusarium: A case study in Fusarium solani f. sp. pisi. Scientific Reports 8: 1252. doi: 10.1038/s41598-018-19779-z
Solórzano R, Ramírez Maguiña HA, Johnson L, et al. (2025) Current Progress in Microbial Biocontrol of Banana Fusarium Wilt: A Systematic Review. Agronomy 15(3): 619. doi: 10.3390/agronomy15030619
Teixeira L, Heck D, Nomura E, et al. (2021) Soil attributes, plant nutrition, and Fusarium wilt of banana in São Paulo, Brazil. Trop. plant pathol. 46: 443–454. doi: 10.1007/s40858-021-00428-2
Thangavelu R, Gopi M (2015) Field suppression of Fusarium wilt disease in banana by the combined application of native endophytic and rhizospheric bacterial isolates possessing multiple functions. Phytopathol. Mediterr. 54, 241–252. doi: 10.14601/Phytopathol_Mediterr-15160
Thangavelu R, Muthukathan G, Pushpakanth P, et al. (2021) First report of Fusarium oxysporum f. sp. cubense VCG 0125 and VCG 01220 of Race 1 infecting Cavendish bananas(Musa sp. AAA) in India. Plant Disease. doi: 10.1094/PDIS-09-20-2052-PDN
TR4 Present in UK. Link: http://www.promusa.org/blogpost580-TR4-present-in-the-UK
Umesha M, Sowmya H, Usharani T, et al. (2022) Fusarium wilt of banana: sustainable management through deployment of antiapoptotic genes into the susceptible genomes. Trop. plant pathol. 47: 470–484. doi: 10.1007/s40858-022-00500-5
Vicente I, Quaratiello G, Baroncelli R, et al. (2022) Insights on KP4 Killer Toxin-like Proteins of Fusarium Species in Interspecific Interactions. Journal of Fungi. 8(9): 968. doi: 10.3390/jof8090968
Wang L, Calabria J, Chen HW, Somssich M (2022) Overview: The Arabidopsis thaliana – Fusarium oxysporum strain 5176 pathosystem. Journal of Experimental Botany: erac263. doi: 10.1093/jxb/erac263
Warman NM and Aitken EAB (2018) The movement of Fusarium oxysporum f.sp. cubense (sub-tropical race 4) in susceptible cultivars of banana. Front. Plant Sci. 9: 1748. doi: 10.3389/fpls.2018.01748
, (2022) Back to the roots: Understanding banana below-ground interactions is crucial for effective management of Fusarium wilt. Plant Pathology 00: 1– 20. doi: 10.1111/ppa.13641
Zheng S-J, García-Bastidas FA, Li X (2018) New Geographical Insights of the Latest Expansion of Fusarium oxysporum f. sp. cubense Tropical Race 4 Into the Greater Mekong Subregion. Front. Plant Sci. 9: 457. doi: 10.3389/fpls.2018.00457