.
Condición fitosanitaria: Presente
Grupo de cultivos: Frutales
Especie hospedante: pecán (Carya illinoinensis)
Rango de hospedantes: pecán (C. illinoinensis) y otras especies de Carya, incluida la nuez amarga (C. aquatica), el nogal bitternut (C. cordiformis), el nogal pignut (C. glabra), el nogal shagbark (C. ovata) y el nogal común (C. tomentosa).
Etiología: Hongo. Necrotrófico (considerado hemibiotrófico en una fase inicial)
Agente causal:
Teleomorfo: Venturia effusa (G. Winter) Rossman & W.C. Allen 2016
Anamorfo: Fusicladium effusum G. Winter, 1885 (nombres anteriores: Fusicladosporium effusum, Fusicladium caryigenum, Cladosporium caryigenum, Cladosporium effusum)
Taxonomía: Fungi > Ascomycota > Pezizomycotina > Dothideomycetes > Pleosporomycetidae > Venturiales > Venturiaceae > Venturia
.
.
Antecedentes
La sarna del pecán está muy extendida en el sureste de los Estados Unidos, pero también se ha informado en otras partes de los Estados Unidos y en Canadá, México, América Central, América del Sur y Nueva Zelanda. La enfermedad está ampliamente difundida en diferentes zonas de Argentina, pero tiene mayor incidencia en zonas con altas temperaturas y elevado número e intensidad de precipitaciones (durante la estación de crecimiento del pecán).
.
Síntomas
Los síntomas de la infección son similares en todas las partes de la planta infectada. La sarna afecta hojas, brotes verdes, yemas, rueznos (cáscaras o corteza exterior del fruto) y ramitas de la planta infectada y se manifiesta como lesiones pequeñas (1 a 5 mm), circulares, negras o verde oliva. Las lesiones pueden fusionarse y formar áreas ennegrecidas más grandes. En las primeras etapas de la infección, las lesiones aparecen aterciopeladas, debido a la producción de conidios en su superficie. A medida que avanza la infección, las lesiones se endurecen y se vuelven de un color gris oscuro a marrón plateado, y pueden secarse, agrietarse y caerse de la hoja. Las lesiones en los brotes jóvenes aparecen hundidas debido a la hinchazón del tejido en los márgenes de las lesiones. Estas lesiones pueden persistir durante varias temporadas después de la infección inicial. Se producen lesiones similares en las cáscaras de las nueces. Estas lesiones pueden estar ligeramente elevadas. Una masa negra, aterciopelada, en forma de cojín llamada estroma (plural: estromata) que se forma en estas lesiones proporciona la base para la supervivencia, y da lugar a estructuras reproductivas llamadas conidióforos en la primavera siguiente.
.
.
- Síntomas (manchas negras) de la sarna del pecán. Autor: Professor Carolyn Young, Ph.D., Senior Research Associate Nikki Charlton, Ph.D., Noble Research Institute
- Autor: Hoefnagels Y Mason, 2016.
- Autor: Professor Carolyn Young, Ph.D., Senior Research Associate Nikki Charlton, Ph.D., Noble Research Institute
- Autor: Jessie Hoover, LSU
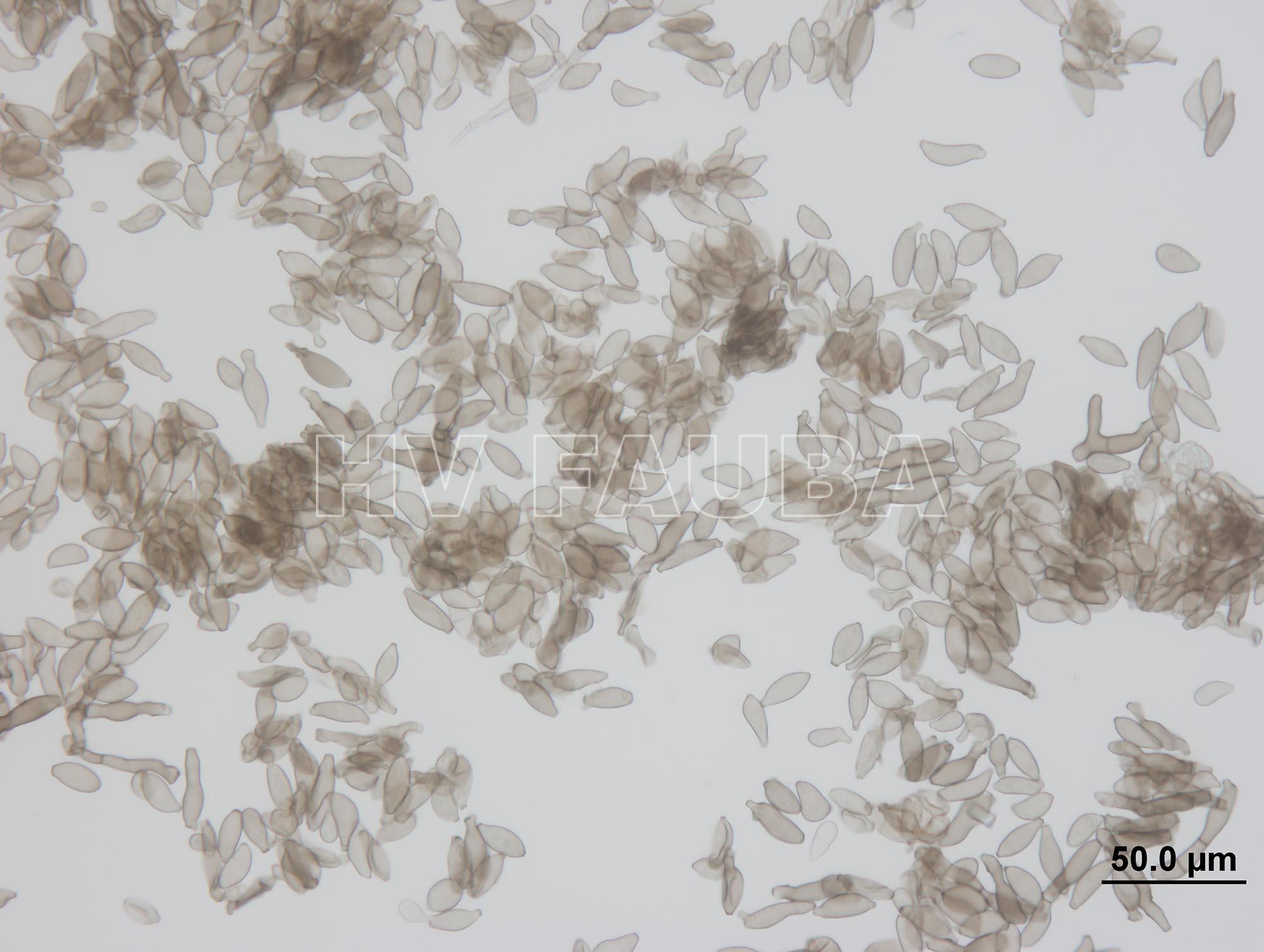
- Conidios de Fusicladium effusum. Autor: Professor Carolyn Young, Ph.D., Senior Research Associate Nikki Charlton, Ph.D., Noble Research Institute
.
Ciclo de la enfermedad y epidemiología
Fusicladium effusum sobrevive en lesiones en hojas, cáscaras y ramitas de la infección del año anterior. Estos sitios de «hibernación» sirven como la principal fuente de inóculo primario, mientras que las infecciones del año en curso producen lesiones que actúan como una fuente secundaria de inóculo y proporcionan la dimensión policíclica a la enfermedad. En primavera, los estromas de las lesiones invernales comienzan a producir conidióforos. La descarga de esporas es estimulada por la luz solar y una rápida disminución de la humedad relativa y el mojado de la superficie de los tejidos vegetales (horas de mojado). Las esporas se dispersan por el viento, siendo las concentraciones de esporas aéreas las más altas hacia fines de la primavera. Los conidios pueden depositarse (inocularse) en nueces en desarrollo, hojas recién emergidas y ramitas.
La humedad de la superficie es crítica para la infección, y el rango de temperatura óptimo para la infección es de 20-30°C. En condiciones favorables, la germinación de los conidios ocurre dentro de las 3-24 h posteriores a la inoculación. A las 36 h posteriores a la inoculación, el tubo germinativo ha penetrado típicamente en la epidermis. Una vez que penetra la cutícula del tejido, se produce un crecimiento de hifas lateralmente dentro del tejido vegetal. Las lesiones aparecen 7-9 días después de la inoculación (enfermedad subaguda) y el número de lesiones aumenta con la humedad más prolongada de la superficie de la hoja (hojas de mojado). Los conidióforos crecen hacia arriba desde la masa micelial debajo de la superficie del tejido y penetran en la epidermis. Estos conidióforos producen los conidios que actúan como inóculo secundario durante la temporada de crecimiento.
El patógeno infecta principalmente hojas y brotes jóvenes en expansión. Las lesiones resultantes permanecen visibles en las hojas más viejas; una vez que las hojas están completamente expandidas, sin embargo, son efectivamente resistentes a una nuevas infecciones. Los frutos permanecen susceptibles a lo largo de su desarrollo y maduración. Por lo tanto, las infecciones que se establecen a principios de la temporada de crecimiento de los árboles tienden a ser más graves y producen una mayor pérdida económica.
.
Daños
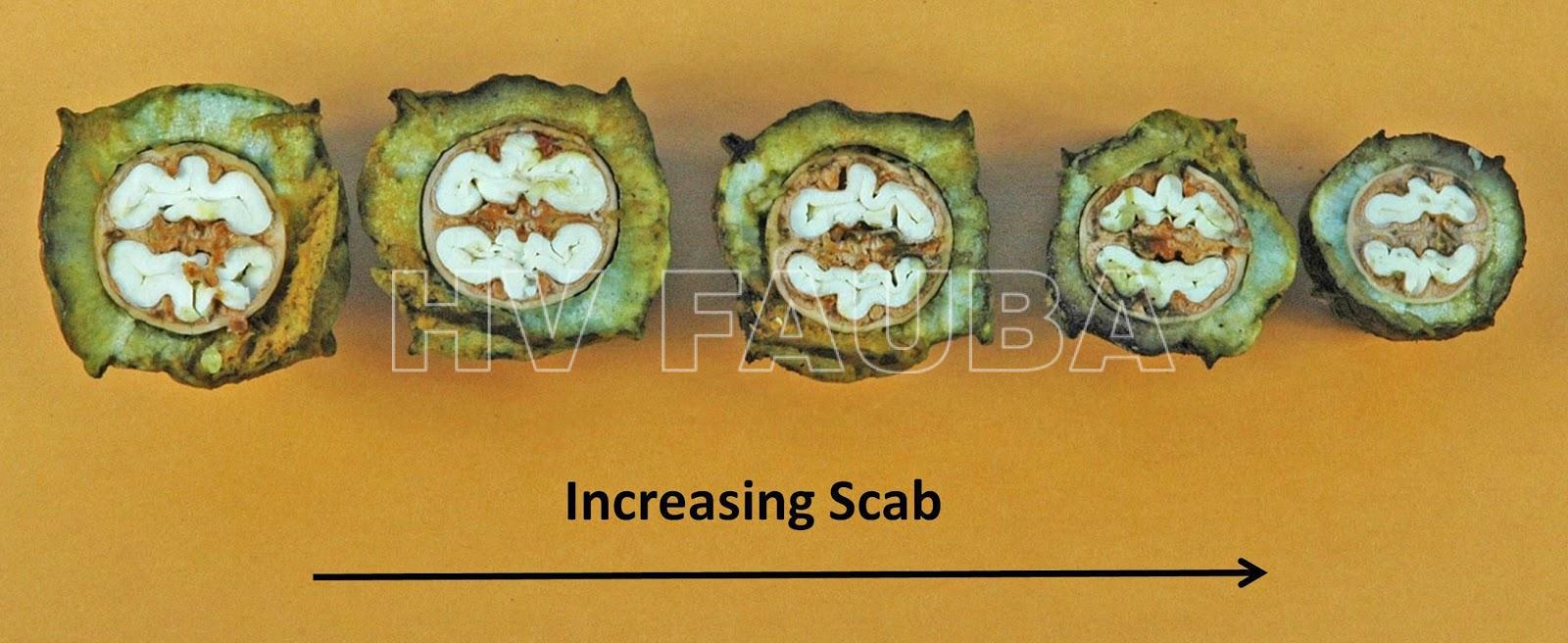
La sarna del pecan puede provocar una reducción de la fotosíntesis y la defoliación. La sarna que se produce en las cáscaras durante el desarrollo de la fruta puede afectar el tamaño de la nuez cosechada y el porcentaje de relleno del grano. El impacto en el rendimiento general variará según la intensidad de la sarna.
La sarna del pecan afecta a las nueces de varias maneras. Si es grave, la infección puede provocar defoliación y reducción del tamaño y la calidad de la nuez; si la infección ocurre temprano en el desarrollo de la nuez, las nueces abortarán. Además, si F. effusum alcanza tejidos profundos en la cáscara, puede hacer que la ésta se adhiera a la cáscara interna de la nuez (una condición llamada “pegado”). Separar la nuez de la cáscara es imposible, lo cual es problemático para el descascarado. La superficie de las nueces gravemente infectadas también puede agrietarse, dando un punto de entrada para infecciones secundarias. En particular, el hongo del moho rosado, Cephalothecium roseum, puede invadir viejas lesiones en las cáscaras.
Esta enfermedad puede tener un impacto económico significativo debido a la reducción del rendimiento de los cultivos y la pérdida de calidad. La enfermedad provoca la caída de las nueces, con una posible pérdida total de la cosecha en casos graves. Se produce una reducción del tamaño y la calidad de las nueces. Además, las lesiones de la sarna en el follaje reducen el área fotosintéticamente activa del árbol, provocando una reducción en la tasa de fotosíntesis de la planta. Esta reducción, a su vez, puede mejorar la producción alterna, que es la tendencia a producir una cosecha abundante en una temporada, seguida de uno o más años de poca o ninguna producción.
.
- Autor: Dr. Victor Ziegler, Dr. Francisco Sautua
- Autor: Dr. Victor Ziegler, Dr. Francisco Sautua
- Autor: Dr. Victor Ziegler, Dr. Francisco Sautua
- Autor: Dr. Victor Ziegler, Dr. Francisco Sautua
- Autor: Dr. Victor Ziegler, Dr. Francisco Sautua
- Autor: Dr. Victor Ziegler, Dr. Francisco Sautua
- Autor: Dr. Victor Ziegler, Dr. Francisco Sautua
.
.
Manejo Integrado
* Cultivares resistentes (cuando hubiera disponibles)
* Control químico (fungicidas)
* Control cultural: Al establecer nuevos montes frutales de pecan, el espaciado y la orientación de los árboles son consideraciones importantes porque la exposición adecuada a la luz solar y un buen flujo de aire son dos claves para mantener el follaje seco. También se recomienda la poda selectiva de las ramas dañadas durante la temporada de inactividad para promover la exposición al sol y la circulación del aire. Finalmente, se recomiendan buenas prácticas de saneamiento para limitar la cantidad de inóculo primario que puede causar infección.
.
- Autor: William Reid, Kansas State University
- Autor: William Reid, Kansas State University
.
.
Bibliografía
Cámara Argentina de productores de pecán
INTA (2013) Guía para la plantación y cuidado de árboles jóvenes de Pecán. Buenos Aires, Ediciones INTA. 25 p. ISBN Nº 1514-5638. Link
Acuña LE, Kornowski MV, Agostini JP, Haberle TJ, Haberle TJ (2011) Primeras experiencias en control de sarna del pecán en la provincia de Misiones. En: Libro de Resúmenes del 2º Congreso Argentino de Fitopatología. Mar del Plata, Buenos Aires, Argentina. Asociación Argentina de fitopatologos (AAF). p. 271. ISBN/ISSN: ISBN 978-987-544-389-1
Bock CH, Chen C, Yu F, et al. (2016) Draft genome sequence of Fusicladium effusum, cause of pecan scab. Stand in Genomic Sci 11: 36. doi: 10.1186/s40793-016-0161-y
Bock CH, Young CA, Stevenson KL, Charlton ND (2018) Fine-Scale Population Genetic Structure and Within-Tree Distribution of Mating Types of Venturia effusa, Cause of Pecan Scab in the United States. Phytopathology 108(11): 1326-1336. doi: 10.1094/PHYTO-02-18-0068-R
Bock CH, Hotchkiss MW, Shapiro-Ilan DI, et al. (2019) A comparison of organic fungicides: alternatives for reducing scab on pecan. Org. Agr. 9: 305–314. doi: 10.1007/s13165-018-0229-7
Bock CH, Alarcon Y, Conner PJ, et al. (2020) Foliage and fruit susceptibility of a pecan provenance collection to scab, caused by Venturia effusa. CABI Agric Biosci 1: 19. doi: 10.1186/s43170-020-00020-9
Bock CH, Young CA, Zhang M, et al. (2021) Mating Type Idiomorphs, Heterothallism, and High Genetic Diversity in Venturia carpophila, Cause of Peach Scab. Phytopathology 111(2): 408-424. doi: 10.1094/PHYTO-12-19-0485-R
Charlton ND, Yi M, Bock CH, Zhang M, Young CA (2020) First description of the sexual stage of Venturia effusa, causal agent of pecan scab. Mycologia 112: 711-721. doi:10.1080/00275514.2020.1759998
Dabul ME (2007) Enfermedades del nogal pecán presentes en Argentina y su control. En: Producción de pecán en Argentina. Frusso EA, Lavado RS (Eds). INTA. p. 311.
Hoefnagels MH, Mason BD (2016) Pecan Scab. The Plant Health Instructor. doi: 10.1094/PHI-I-2016-0620-01
Mantz G, Maiale S, Rollán C, Ronco L (2008) Occurrence of scab disease of pecan caused by Cladosporium carygenum in Argentina. En: New Disease Reports 18. p. 34. ISBN/ISSN: ISSN 2044-0588
, , , et al (2022) A new highly effective hybrid fungicide containing difenoconazole and tea tree oil for managing scab of apple, pecan and almond trees and as a tool in resistance management. Plant Pathology 71: 1774– 1783. doi: 10.1111/ppa.13610
Rocafort M, Arshed S, Hudson D, et al. (2021) CRISPR-Cas9 gene editing and rapid detection of gene-edited mutants using high-resolution melting in the apple scab fungus, Venturia inaequalis. bioRxiv 2021.02.04.428760; doi: 10.1101/2021.02.04.428760
Seyran M, Brenneman TB, Stevenson KL (2010) A rapid method to monitor fungicide sensitivity in the pecan scab pathogen, Fusicladium effusum. doi: 10.1016/j.cropro.2010.07.016
Standish JR, Brenneman TB, Bock CH, Stevenson KL (2021) Fungicide Resistance in Venturia effusa, Cause of Pecan Scab: Current Status and Practical Implications. Phytopathology 111(2): 244-252. doi: 10.1094/PHYTO-06-20-0221-RVW
Standish JR, Brenneman TB, Bock CH, Stevenson KL (2021) Spatial Variation and Temporal Dynamics of Fungicide Sensitivity in Venturia effusa Within a Pecan Orchard. Plant Disease 105(2): 377-383. doi: 10.1094/PDIS-04-20-0889-RE
Wells L, Brock J, Brenneman T (2014) Effects of Foliar Sulfur Sprays on Pecan Independent of Pecan Scab Control. HortScience horts 49(4): 434-437. doi: 10.21273/HORTSCI.49.4.434
Winter DJ, Charlton ND, Krom N, Shiller J, Bock CH, Cox MP, Young CA (2020) Chromosome-Level Reference Genome of Venturia effusa, Causative Agent of Pecan Scab. Mol Plant Microbe Interact. 33(2): 149-152. doi: 10.1094/MPMI-08-19-0236-A