.
Condición fitosanitaria: Plaga Cuarentenaria Ausente
Grupo de cultivos: Forestales
Rango de hospedantes: También se ha registrado en más de 30 especies de pinos, incluyendo P. halepensis, P. pinaster, P. strobus, P. densiflora, P. thunbergii.
Especie hospedante: Todas las especies de pino pueden ser infectadas (P. elliottii, P. palustris, P. patula, P. radiata, P. taeda, P. virginiana). Pinus radiata, es el hospedador más afectado.
Etiología: Hongo. Necrotrófico
Agente causal: Fusarium circinatum Nirenberg & O’Donnell, 1998
Taxonomía: Eukaryota > Fungi > Dikarya > Ascomycota > Pezizomycotina > Sordariomycetes > Hypocreales > Nectriaceae > Fusarium
.
.
Antecedentes
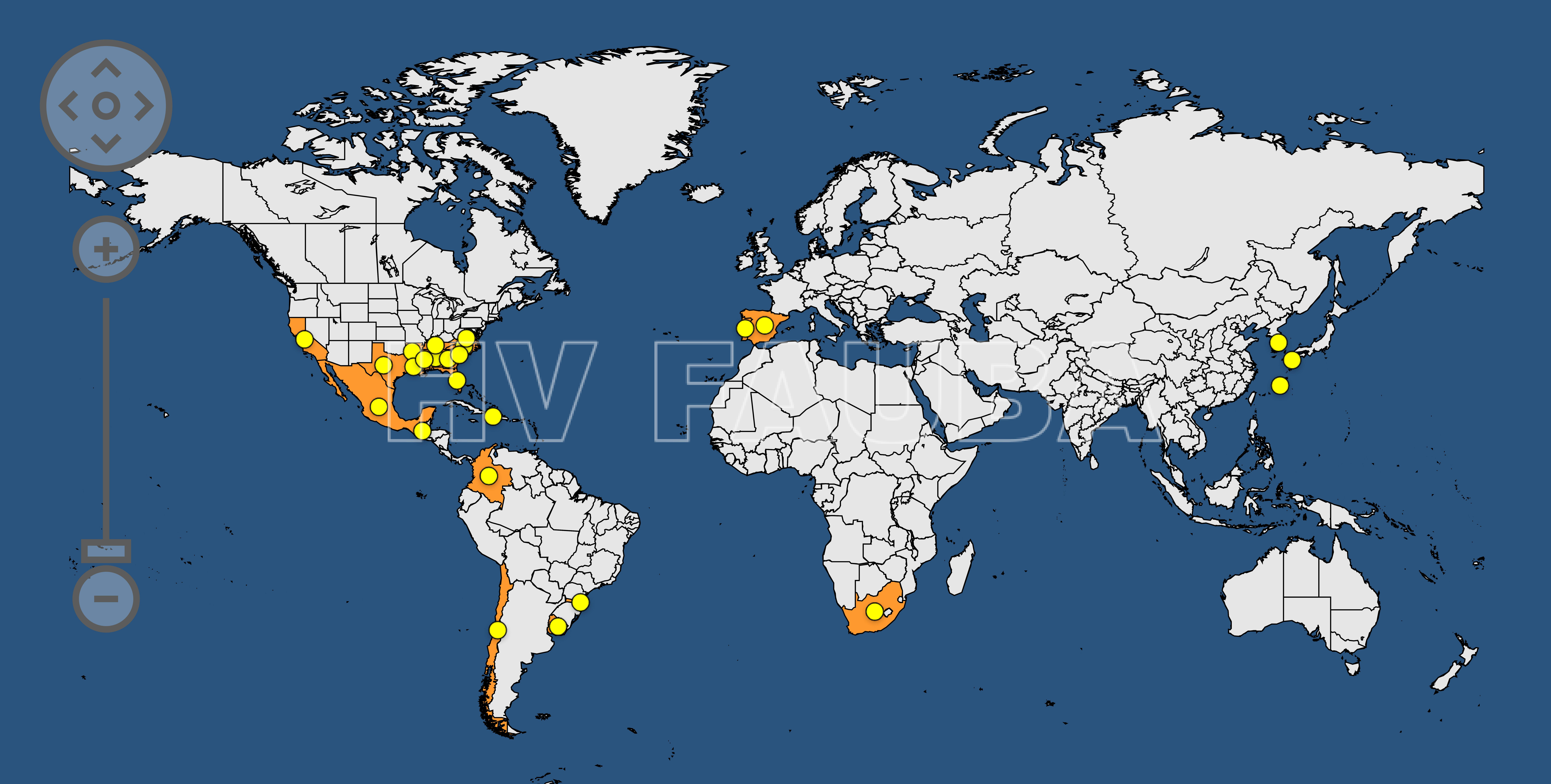
Se ha reportado la enfermedad en un amplio rango de especies de pinos en varios países del mundo. El cancro resinoso de los pinos se observó por primera vez en California en el condado de Santa Cruz en 1986. Desde entonces, la enfermedad se ha propagado rápidamente y ahora se presenta en 18 condados costeros. También ocurre en el sureste de los Estados Unidos y en México, Chile, Japón, Corea del Sur, Italia, Francia, España, Portugal y Sudáfrica. La evidencia indica que el patógeno puede haberse originado en México y su introducción en California se produjo a través del sureste de los Estados Unidos. También está presente en Haití y Chile. Se ha reportado en forma relativamente reciente en Europa, en viveros y bosques de Francia e Italia, de donde ahora se considera que ha sido erradicada, y en España y Portugal. En Brasil se ha reportado en 2014 (Pfenning et al., 2014).
.
- Distribución mundial de Fusarium circinatum. Fuente: https://gd.eppo.int/taxon/GIBBCI/distribution
.
Daños potenciales
El cancro resinoso de los pinos causa una gran cantidad de muertes de árboles, un crecimiento reducido y degradación de la calidad de la madera dondequiera que ocurra. Esta enfermedad representa un amenaza muy importante para los bosques nativos y plantaciones comerciales de pinos de Argentina.
.
Síntomas
El cancro resinoso en los pinos puede afectar todos los estados de desarrollo de la planta: semilla, plántula y plantas jóvenes. Al inicio de la infección y manifestación de síntomas se observa una decoloración ligeramente parda del tallo, primero sin manifestación en las acículas, pero luego a medida que avanza la enfermedad (colonización) la necrosis se hace evidente en las acículas y tallo. El período de incubación hasta la aparición de necrosis de tejidos en corteza y madera (cancro) y resinación, y en el follaje es variable y puede llegar a ser de hasta 3 años o más. Las infecciones de múltiples ramas pueden causar una muerte regresiva (dieback) extensa en la copa del árbol y pueden conducir a la mortalidad del árbol. El hongo agente causal es muy agresivo y también puede infectar de forma asintomática las semillas de pino y luego causar damping-off (muerte temprana de plántulas causada por una infección en condiciones de humedad).
No se sabe si el hongo se mueva dentro del árbol; por lo tanto, cada cancro o lesión se considera una infección separada y distinta. La resina (brea) se acumula en una rama en el sitio de la infección y la eliminación de la corteza revela madera «empapada» de resina de color miel. Los cancros aplanados o ligeramente hundidos en el tallo principal del árbol generalmente aparecen después de que el árbol ya tiene múltiples infecciones de ramas. El flujo de resina de las infecciones del tallo principal puede cubrir la corteza hasta varios pies por debajo del sitio de la infección. Los árboles infectados a menudo son atacados por escarabajos grabadores, que pueden causar la muerte de ramas adicionales, copas de los árboles o de todo el árbol.
.
Resumen de síntomas:
Vivero: marchitamiento; muerte regresiva (dieback) disparar; pudrición de la raíz y el cuello de plántulas y esquejes (Wingfield et al. 2008; Gordon et al. 2015)
Campo: muerte de ramas y puntas (señalización); se forman cancros resinosos en las ramas y tallos. En árboles más jóvenes (de 3 a 6 años), ocasionalmente se forman cancros en la base del árbol por encima de la línea del suelo y en las raíces expuestas. El patógeno también infecta los conos (estróbilos o piñas), que se atrofian y deforman (Wingfield et al. 2008; Gordon et al. 2015).
.
- Síntomas del cancro resinoso de los pinos en pinos maduros: (a) plantación de árboles infectados que muestran síntomas de muerte regresiva (dieback); (b) muerte regresiva de la punta del brote; (c) cancros resinosos en el tallo principal; (d) cancros resinosos en la primera rama; (e) rama infectada que presenta síntomas tanto externos como internos; y (f) rama infectada que muestra el “empapado” de resina de la madera de una rama afectada. Autor: Wingfield et al., 2008.
- Síntomas causados por Fusarium circinatum en plántulas de pino joven: (a) muerte de plántulas de Pinus patula germinadas; (b) plántulas de P. patula marchitas y muertas después de una infección natural; (c) plántulas de pino inoculadas que muestran síntomas de muerte regresiva (dieback); (d) árbol joven de P. radiata que muestra muerte regresiva de las puntas de las ramas; (e) rama que muestra síntomas de muerte regresiva; y (f) plántulas descartadas de P. radiata infectadas con F. circinatum. Autor: Wingfield et al., 2008.
- Síntomas del cancro resinoso en árboles de P. greggii en Sudáfrica. (a) Rama infectada, (b) Xilema empapado en resina y (c) Cancro resinoso del tallo principal de un árbol infectado. Autor: Fru et al., 2017.
.
- Autor: Terry S. Price, Georgia Forestry Commission, Bugwood.org
- Autor: Gordon et al., 2020.
- Marchitamiento en vivero. Autor: Darryl Herron
- Pudrición de raices. Autor: Darryl Herron
- Autor: Gordon et al., 2020.
- Autor: Darryl Herron
.
Manejo Integrado
* Medidas de manejo legal:
La Resolución 203/12 se crea el Programa Nacional de Sanidad de Material de Propagación, Micropropagación y/o Multiplicación Vegetal dependiente de la Dirección Nacional de Protección Vegetal (DNPV) del SENASA, cuyo objetivo es asegurar la condición fitosanitaria del eslabón producción de material vegetal de propagación y multiplicación en viveros, de acuerdo a las normas establecidas por la Convención Internacional de Protección Fitosanitaria, de la cual Argentina es parte signataria.
La Disposición DNPV 4/2013 es la normativa específica para el sector, que determina requisitos particulares para cada segmento de producción de plantas.
Área de Viveros de la Dirección de Información Estratégica Fitosanitaria del SENASA: viveros@senasa.gob.ar / (011) 4121- 5000 interno 6633 o 6634, de lunes a viernes de 9 a 17 horas.
.
* En los viveros de pinos, eliminar plántulas moribundas y aplicar fungicida.
* El cancro resinoso puede provocar daños importantes e incluso la muerte de los árboles infectados. Sin embargo, no todos los árboles infectados se enferman gravemente y, de los que sí, algunos se recuperan. Los experimentos en condiciones controladas muestran que los pinos susceptibles expuestos repetidamente al patógeno pueden ganar resistencia con el tiempo, y los estudios de campo han confirmado que los árboles en áreas donde la enfermedad ha estado presente durante 10 años o más tienden a ser más resistentes a la enfermedad que árboles en áreas donde el patógeno se ha establecido recientemente. Por lo tanto, los productores deben adoptar un enfoque conservador para eliminar los árboles enfermos (erradicación), porque existe la posibilidad de que se recuperen por completo.
.
.
.
Bibliografía
Carrasco A, Sanfuentes E, Durán A, Valenzuela S (2016) Cancro resinoso del pino: ¿una amenaza potencial para las plantaciones de Pinus radiata en Chile?. Gayana Botánica 73(2): 369-380. doi: 10.4067/S0717-66432016000200369
Dwinell LD, Barrows-Broaddus JB, Kuhlman EG (1985) Pitch canker: A disease complex of southern pines. Plant Dis. 69: 270-6. doi: 10.1094/PD-69-270
EPPO (2019) PM 7/91 (2) Fusarium circinatum (formerly Gibberella circinata). EPPO Bulletin 49: 228–247. doi: 10.1111/epp.12587
Erbilgin N, Ritokova G, Gordon TR, et al. (2008) Temporal variation in contamination of pine engraver beetles with Fusarium circinatum in native Monterey pine forests in California. Plant Pathol. 57: 1103-8. doi: 10.1111/j.1365-3059.2008.01887.x
Fru FF, Steenkamp ET, Wingfield MJ, et al. (2017) Unique clones of the pitch canker fungus, Fusarium circinatum, associated with a new disease outbreak in South Africa. Eur J Plant Pathol 148: 97–107.
García-Díaz SE, Aldrete A, Alvarado-Rosales D, et al. (2017) Efecto de Fusarium circinatum en la germinación y crecimiento de plántulas de Pinus greggii en tres sustratos. Agrociencia, 51(8): 895-908. Link
Gordon TR, Wikler KR, Clark SL, et al. (1998) Resistance to pitch canker disease, caused by Fusarium subglutinans f. sp. pini, in Monterey pine (Pinus radiata). Plant Pathol. 47: 706-11.
Gordon TR, Storer AJ, Wood DL (2001) The pitch canker epidemic in California. Plant Dis. 85: 1128-39. https://doi.org/10.1094/PDIS.2001.85.11.1128
Gordon TR, Kirkpatrick SC, Aegerter BJ, et al. (2011) Evidence for the occurrence of induced resistance to pitch canker, caused by Gibberella circinata (anamorph Fusarium circinatum), in populations of Pinus radiata. For Pathol. 41: 227-32. doi: 10.1111/j.1439-0329.2010.00678.x
Gordon TR, Swett CL, Wingfield MJ (2015) Management of Fusarium diseases affecting conifers. Crop Protection 73: 28-39. doi: 10.1016/j.cropro.2015.02.018
Gordon T, Reynolds G, Kirkpatrick S, Storer A, Wood D, Fernandez D, McPherson B (2020) Monterey pine forest made a remarkable recovery from pitch canker. Calif Agr 74(3): 169-173. doi: 10.3733/ca.2020a0019
Hepting GH, Roth ER (1946) Pitch canker, a new disease of some southern pines. J For. 44: 742-4. doi: 10.1093/jof/44.10.742
Hernandez-Escribano L, Visser EA, Iturritxa E, et al. (2020) The transcriptome of Pinus pinaster under Fusarium circinatum challenge. BMC Genomics 21: 28. doi:
Inman AR, Kirkpatrick SC, Gordon TR, et al. (2008) Limiting effects of low temperature on growth and spore germination in Gibberella circinata, the cause of pitch canker in pine species. Plant Dis. 92: 542-5. doi: 10.1094/PDIS-92-4-0542
Leslie JF, Summerell BA. 2006. The Fusarium laboratory manual. Blackwell, Iowa.
McCain AH, Koehler CS, Tjosvold SA (1987) Pitch canker threatens California pines. Calif Agr. 41: 22-3. doi: 10.3733/ca.v041n11p22
McNee WR, Wood DL, Storer AJ, et al. (2002) Incidence of the pitch canker pathogen and associated insects in intact and chipped Monterey pine branches. Can Ent. 134: 47-58. doi: 10.4039/Ent13447-1
O’Donnell K, Whitaker BK, Laraba I, et al. (2022) DNA Sequence-Based Identification of Fusarium: A Work in Progress. Plant Disease 106(6): 1597-1609. doi: 10.1094/PDIS-09-21-2035-SR
Pfenning LH. et al. (2014) First report and characterization of Fusarium circinatum, the causal agent of pitch canker in Brazil. Tropical Plant Pathology 39: 210-216. doi: 10.1590/S1982-56762014000300004
Sakamoto JM, Gordon TR, Storer AJ, et al. (2007) The role of Pityophthorus spp. as vectors of pitch canker affecting Pinus radiata. Can Ent. 139: 864-71. doi: 10.4039/n07-022
Schmale DG, Gordon TR (2003) Variation in susceptibility to pitch canker disease, caused by Fusarium circinatum, in native stands of Pinus muricata. Plant Pathol. 52: 720-5. doi: 10.1111/j.1365-3059.2003.00925.x
Storer AJ, Bonello P, Gordon TR, et al. (1999) Evidence of resistance to the pitch canker pathogen (Fusarium circinatum) in native stands of Monterey pine (Pinus radiata). For Sci. 45: 500-5. doi: 10.1093/forestscience/45.4.500
Storer AJ, Wood DL, Gordon TR (2002) The epidemiology of pitch canker of Monterey pine in California. For Sci. 48: 694-700. doi: 10.1093/forestscience/48.4.694
Storer AJ, Wood DL, Gordon TR (2004) Twig beetles, Pityophthorus spp. (Coleoptera:Scolytidae), as vectors of the pitch canker pathogen in California. Can Ent. 136: 685-94. doi: 10.4039/n03-118
Vicente I, Quaratiello G, Baroncelli R, et al. (2022) Insights on KP4 Killer Toxin-like Proteins of Fusarium Species in Interspecific Interactions. Journal of Fungi. 8(9): 968. doi: 10.3390/jof8090968
Viljoen A, Wingfield MJ, Marasas WFO (1994) First report of Fusarium subglutinans f. sp. pini on pine seedlings in South Africa. Plant Disease 78: 309-312. doi: 10.1094/PD-78-0309
Wikler K, Gordon TR (2000) An initial assessment of genetic relationships among populations of Fusarium circinatum in different parts of the world. Can J Bot. 78: 709-17. doi: 10.1139/b00-044
Wikler KR, Storer AJ, Newman W, et al. (2003) The dynamics of an introduced pathogen in a native Monterey pine (Pinus radiata) forest. For Ecol Man. 179: 209-21. doi: 10.1016/S0378-1127(02)00524-8
Wingfield MJ, Hammerbacher A, Ganley RJ, et al. (2008) Pitch canker caused by Fusarium circinatum — a growing threat to pine plantations and forests worldwide. Australasian Plant Pathology 37: 319–334. doi: 10.1071/AP08036