.
Grupo de cultivos: Cereales
Especie hospedante: Maíz (Zea mays)
Etiología: Hongo. Necrotrófico
Agente causal: La etiología de la enfermedad responde a un complejo de hongos. Entre los principales se encuentran: Fusarium graminearum – (forma asexual) Giberella zeae (forma sexual); Fusarium verticillioides (Syn F. moniliforme); Stenocarpella spp. (Diplodia spp.) y Colletotrichum graminicola.
.
.
Síntomas
* pudrición blanca de la base de la espiga
* pudrición rosada de la espiga
* decoloración de granos
* granos chuzos
.
Daños
* reducción en la productividad de granos
* reducción de calidad de granos
* presencia de granos quemados
.
Factores predisponentes
* semilla infectada
* monocultura
* alta población de plantas
* presencia de plantas voluntarias
* presencia de hospedantes intermediarios
* desequilibrio nutricional
* mal emparejamiento de la espiga
* daño causado por oruga
.
Medidas de manejo integrado
* rotación de cultivos
* tratamiento de semilla con fungicida
* específico para hongos de semilla
* evitar sucesión con gramíneas
* mantener equilíbrio nutricional (N y K)
* evitar estrés hídrico
* evitar población de plantas por encima de lo indicado para cada híbrido
* buen emparejamiento de la espiga
* control de oruga
* híbrido resistente para carbón
.
.
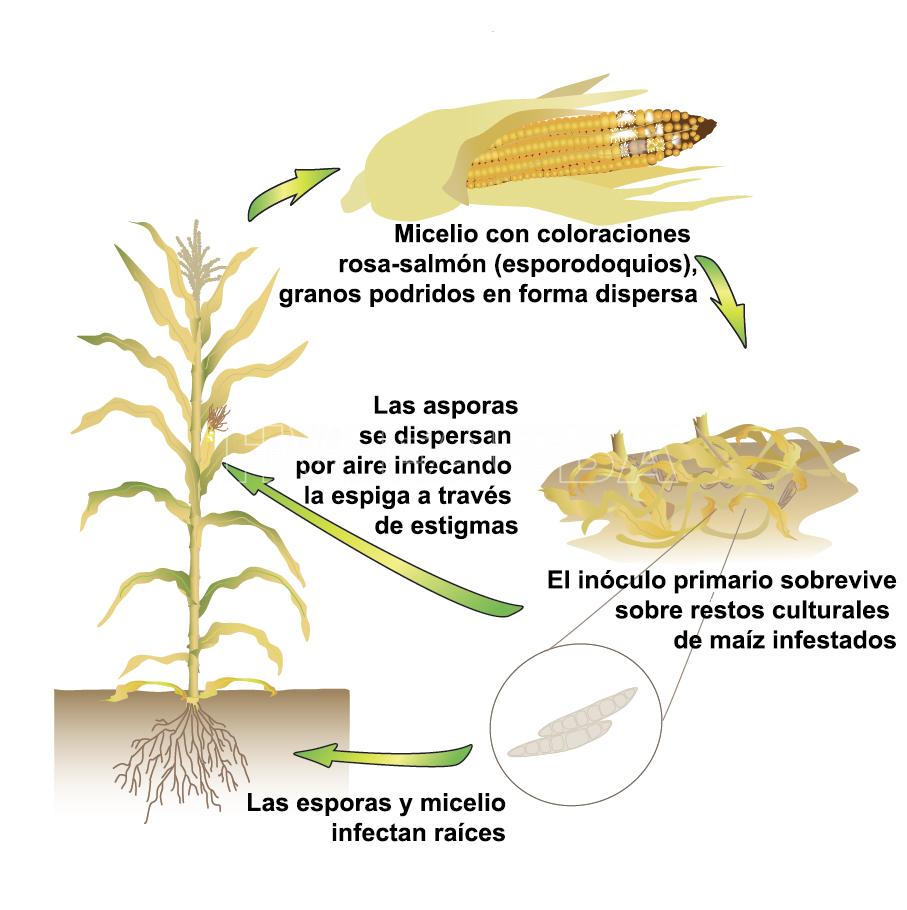
- Ciclo de la pudrición de la espiga por Fusarium. Autor: www.cropprotectionnetwork.org
.
.
* Giberela o pudrición por giberela – Fusarium graminearum
Se encuentra difundida en la región pampeana y NOA. Los primeros signos de la infección son la formación de micelios blancos, que van descendiendo desde la punta de la espiga y dan una coloración rojiza y rosada a los granos infectados. Los granos colonizados se localizan, en la mayoría de los casos, en la punta de la espiga. Cuando la infección ocurre temprano, la pudrición puede desarrollarse en toda la espiga. Las brácteas también pueden ser colonizadas y compactadas a la espiga. Sobre los tejidos colonizados pueden formarse peritecios del patógeno. Normalmente, los peritecios no producen ascosporas hasta la primavera siguiente. En algunos casos, la pudrición ocurre en la base de la espiga y prosigue hacia la punta, dificultando el diagnóstico de la pudrición causada por F. verticillioides. El hongo produce micotoxinas (deoxinivalenol, zearalenona y zearalenol).
.
Manejo de la enfermedad
Híbridos resistentes/tolerantes, rotación de cultivos, control de insectos, monitoreo/eventual cosecha anticipada, mejorar las condiciones de cosecha y almacenamiento de los granos.
.
* Fusariosis o pudrición por fusarium – Fusarium verticillioides
Es probablemente el patógeno mas común de la espiga del maíz en todo el mundo (CIMMYT 2004). Es el principal agente causal de podredumbre de espiga en Argentina (Presello et al., 2006). Los síntomas de la enfermedad pueden ser observados, principalmente, en la base de la espiga (Figuras 46 e 47), pero pueden manifestarse en granos aislados (Figura 48) o en grupos de granos infectados (Figura 49). La distribución de estos granos infectados puede estar relacionada con la infección del hongo por el canal de los estigmas o asociada a daños provocados por insectos, principalmente por la oruga de la espiga, u otros daños mecánicos. Sobre los granos infectados se puede verificar las señales del hongo, en la forma de micelio (moho algodonoso) y esporas, de color rosa-salmón, típico de F. verticillioides. El hongo produce micotoxinas como fumonisinas.
.
Manejo de la enfermedad
* híbridos resistentes/tolerantes
* rotación de cultivos
* control de insectos
* monitoreo/eventual cosecha anticipada
* mejorar las condiciones de cosecha
* almacenamiento de los granos
.
- Granos de maíz con estrías de Fusarium verticillioides. Autor: Dra. Maria Cecilia Perez Piza
.
.
* Diplodia o pudrición blanca de la base de la espiga – Stenocarpella macrospora e S. maydis
Los síntomas de la Diplodia se inician, principalmente, en la base de la espiga (Figura 50), luego de la fecundación. Las brácteas de la espiga muestran un crecimiento característico de áreas cloróticas irregulares. Luego estas áreas se ensanchan y secan completamente las brácteas (las que se tornan despigmentadas y de coloración parda), cuando la planta está todavía verde. Cuando la infección ocurre dos semanas después de la polinización, toda la espiga puede tornarse podrida (Figura 51), presentando coloración pardo-gris a blanquecina, arrugada y leve, con las brácteas internas fuertemente adheridas unas a otras o a los granos, debido al crecimiento del micelio del hongo. Si se desprenden las brácteas, las mazorcas están disecadas y blanquecinas, con moho blanco algodonoso entre los granos. Luego se forma un gran número de pequeños picnidios negros. Estos pueden formarse sobre brácteas, brácteas florales y granos. Los granos infectados presentan color ceniza débil a marrón. Las espigas infectadas hacia el final de la estación de crecimiento no muestran síntomas externos, y cuando son cosechadas (y los granos asintomáticos removidos) el micelio blanco puede ser visto creciendo entre los granos. Algunos aislamientos de S. maydis inducen a viviparidad, o sea, a la germinación prematura de los granos. S. maydis produce la toxina conocida como diplodiatoxina, y S. macrospora produce diplodiol.
.
Manejo de la enfermedad
híbridos resistentes/tolerantes, rotación de cultivos, control de insectos, monitoreo/eventual cosecha anticipada, mejorar las condiciones de cosecha y almacenamiento de los granos.
.
Fotos
- 01 Estallido inicial de infección de espiga de maiz por Fusarium. Autor: Professor Doug Jardine, Kansas State University.
- Pudrición de espiga por Diplodia. Autor: Tom Allen
- Pudrición de espiga por Diplodia. Autor: Tom Allen
- Pudrición de espiga por Diplodia. Autor: Tom Allen
.
.
.
Bibliografía
, , , et al. (2024) Comparison of four inoculation methods and three Fusarium species for phenotyping stalk rot resistance among 22 maize hybrids (Zea mays). Plant Pathology 00: 1–12. doi: 10.1111/ppa.13874
Bakker MG, Brown DW, Kelly AC, et al. (2018) Fusarium mycotoxins: a trans-disciplinary overview. Canadian Journal of Plant Pathology 40(2): 161-171. doi: 10.1080/07060661.2018.1433720
Battilani P, Lanubile A, Scala V, Reverberi M, Gregori R, Falavigna C, Dall’asta C, Park Y, Bennett J, Borrego EJ, Kolomiets MV (2018) Oxylipins from both pathogen and host antagonize jasmonic acid‐mediated defence via the 9‐lipoxygenase pathway in Fusarium verticillioides infection of maize. Molecular Plant Pathology 19: 2162-2176. doi: 10.1111/mpp.12690
Cavinder B, Sikhakolli U, Fellows KM, Trail F (2012) Sexual development and ascospore discharge in Fusarium graminearum. J Vis Exp. (61): 3895. doi: 10.3791/3895
Czembor E, Waśkiewicz A, Piechota U, Puchta M, Czembor JH and Stȩpień (2019) Differences in Ear Rot Resistance and Fusarium verticillioides-Produced Fumonisin Contamination Between Polish Currently and Historically Used Maize Inbred Lines. Frontiers in Microbiology 10:449. doi: 10.3389/fmicb.2019.00449
Del Ponte EM, Moreira GM, Ward TJ, et al. (2022) Fusarium graminearum Species Complex: A Bibliographic Analysis and Web-Accessible Database for Global Mapping of Species and Trichothecene Toxin Chemotypes. Phytopathology 112(4): 741-751. doi: 10.1094/PHYTO-06-21-0277-RVW
Desjardins AE, Plattner RD (2000) Fumonisin B1-nonproducing strains of Fusarium verticillioides cause maize (Zea mays) ear infection and ear rot. Journal of Agricultural and Food Chemistry 48: 5773–5780. doi: 10.1021/jf000619k
Dinango VN, Dhouib H, Wakam LN, et al. (2024) Bacterial endophytes inhabiting desert plants provide protection against seed rot caused by Fusarium verticillioides and promote growth in maize. Pest Manag Sci, 80: 1206-1218. doi: 10.1002/ps.7850
, , , et al. (2022) Genetic variability and pathogenicity of Fusarium verticillioides isolates from the summer-sown maize regions in China. Plant Pathology: 1– 11. doi: 10.1111/ppa.13673
El-Ganainy SM, Mosa MA, Ismail AM, Khalil AE (2023) Lignin-Loaded Carbon Nanoparticles as a Promising Control Agent against Fusarium verticillioides in Maize: Physiological and Biochemical Analyses. Polymers 15(5): 1193. doi: 10.3390/polym15051193
Gai X, Dong H, Wang S, Liu B, Zhang Z, Li X, et al. (2018) Infection cycle of maize stalk rot and ear rot caused by Fusarium verticillioides. PLoS ONE 13(7): e0201588. doi: 10.1371/journal.pone.0201588
Giomi GM, Sampietro DA, Velazco JG, et al. (2021) Map overlapping of QTL for resistance to Fusarium ear rot and associated traits in maize. Euphytica 217: 81. doi: 10.1007/s10681-021-02814-y
Jiménez C, Álvarez H, Ballari M, et al. (2021) Antifungal activity of Euphorbia species against moulds responsible of cereal ear rots. J Appl Microbiol, 130: 1285-1293. doi: 10.1111/jam.14860
Krishnan SV, Anaswara PA, Nampoothiri KM, et al. (2025) Biocontrol Activity of New Lactic Acid Bacteria Isolates Against Fusaria and Fusarium Mycotoxins. Toxins 17(2): 68. doi: 10.3390/toxins17020068
Lanubile A, Maschietto V, Borrelli VM, Stagnati L, Logrieco AF and Marocco A (2017) Molecular Basis of Resistance to Fusarium Ear Rot in Maize. Frontiers in Plant Science 8:1774. doi: 10.3389/fpls.2017.01774
Lofgren LA, LeBlanc NR, Certano AK, et al. (2018) Fusarium graminearum: pathogen or endophyte of North American grasses?. New Phytologist 217: 1203-1212. doi: 10.1111/nph.14894
Martínez-Fraca J, de la Torre-Hernández ME, Meshoulam-Alamilla M, Plasencia J (2022) In Search of Resistance Against Fusarium Ear Rot: Ferulic Acid Contents in Maize Pericarp Are Associated With Antifungal Activity and Inhibition of Fumonisin Production. Front. Plant Sci. 13: 852257. doi: 10.3389/fpls.2022.852257
Nerbass FR, Casa RT, Kuhnem PR, et al. (2016) Evaluation of Fusarium graminearum inoculation methods in maize ears and hybrid reaction to Gibberella ear rot under southern Brazilian environmental conditions. European Journal of Plant Pathology 144, 45–53 (2016). doi: 10.1007/s10658-015-0746-0
O’Donnell K, Whitaker BK, Laraba I, et al. (2022) DNA Sequence-Based Identification of Fusarium: A Work in Progress. Plant Disease 106(6): 1597-1609. doi: 10.1094/PDIS-09-21-2035-SR
Omotayo OP, Babalola OO (2023) Fusarium verticillioides of maize plant: Potentials of propitious phytomicrobiome as biocontrol agents. Front. Fungal Biol. 4: 1095765. doi: 10.3389/ffunb.2023.1095765
Otaiza-González SN, Mary VS, Arias SL et al. (2022) Cell death induced by fumonisin B1 in two maize hybrids: correlation with oxidative status biomarkers and salicylic and jasmonic acids imbalances. Eur J Plant Pathol. doi: 10.1007/s10658-022-02469-y
Presello D, Iglesias J, Botta G, Eyhérabide G (2007) Severity of Fusarium ear rot and concentration of fumonisins in grain of Argentinian maize hybrids. Crop protection 26: 852-855. doi: 10.1016/j.cropro.2006.08.004
Rauwane ME, Ogugua UV, Kalu CM, et al. (2020) Pathogenicity and Virulence Factors of Fusarium graminearum Including Factors Discovered Using Next Generation Sequencing Technologies and Proteomics. Microorganisms 8, 305. doi: 10.3390/microorganisms8020305
Reed H, Mueller B, Groves CL, Smith DL (2022) Presence and Correlation of Fusarium graminearum and Deoxynivalenol Accumulation in Silage Corn Plant Parts. Plant Dis. 106(1): 87-92. doi: 10.1094/PDIS-03-21-0641-RE
Rogério F, Taati A, García-Rodríguez P, et al. (2023) First Report of Colletotrichum graminicola Causing Maize Anthracnose in Galicia, Northwestern Spain. Plant Disease. doi: 10.1094/PDIS-04-23-0729-PDN
Sampietro DA, Belizana MM, Baptista ZP, et al. (2014) Essential oils from Schinus species of northwest Argentina: Composition and antifungal activity. Nat Prod Commun. 9(7): 1019-22. doi: 10.1177/1934578X1400900734
Vicente I, Quaratiello G, Baroncelli R, et al. (2022) Insights on KP4 Killer Toxin-like Proteins of Fusarium Species in Interspecific Interactions. Journal of Fungi 8(9): 968. doi: 10.3390/jof8090968
, , , et al. (2023) Integrative transcriptome and proteome analysis reveals maize responses to Fusarium verticillioides infection inside the stalks. Molecular Plant Pathology 00: 1– 18. doi: 10.1111/mpp.13317
Zhou D, Wang X, Chen G, Sun S, Yang Y, Zhu Z, Duan C (2018) The Major Fusarium Species Causing Maize Ear and Kernel Rot and Their Toxigenicity in Chongqing, China. Toxins (Basel) 10(2):90. doi: 10.3390/toxins10020090