.
Condición fitosanitaria: Plaga no cuarentenaria reglamentada
Grupo de cultivos: Hortícolas
Especie hospedante: Papa (Solanum tuberosum)
Rango de hospedantes: infecta papa, tomate y otras Solanáceas silvestres y cultivadas. El hospedante principal es la papa, pero infecta un ampliao rango de dicotiledóneas. Las plantas indicadoras para el diagnóstico incluyen Datura stramonium y Nicotiana tabacum.
Etiología: Virus (biotrófico como todos los virus)
Agente causal: Potato virus X (PVX)
Taxonomía: Viruses > Riboviria > Orthornavirae > Kitrinoviricota > Alsuviricetes > Tymovirales > Alphaflexiviridae > Potexvirus
ICTV: Positive Sense RNA Viruses > Alphaflexiviridae > PVX
Baltimore classification: Group IV: ssRNA(+) Baltimore, 1971
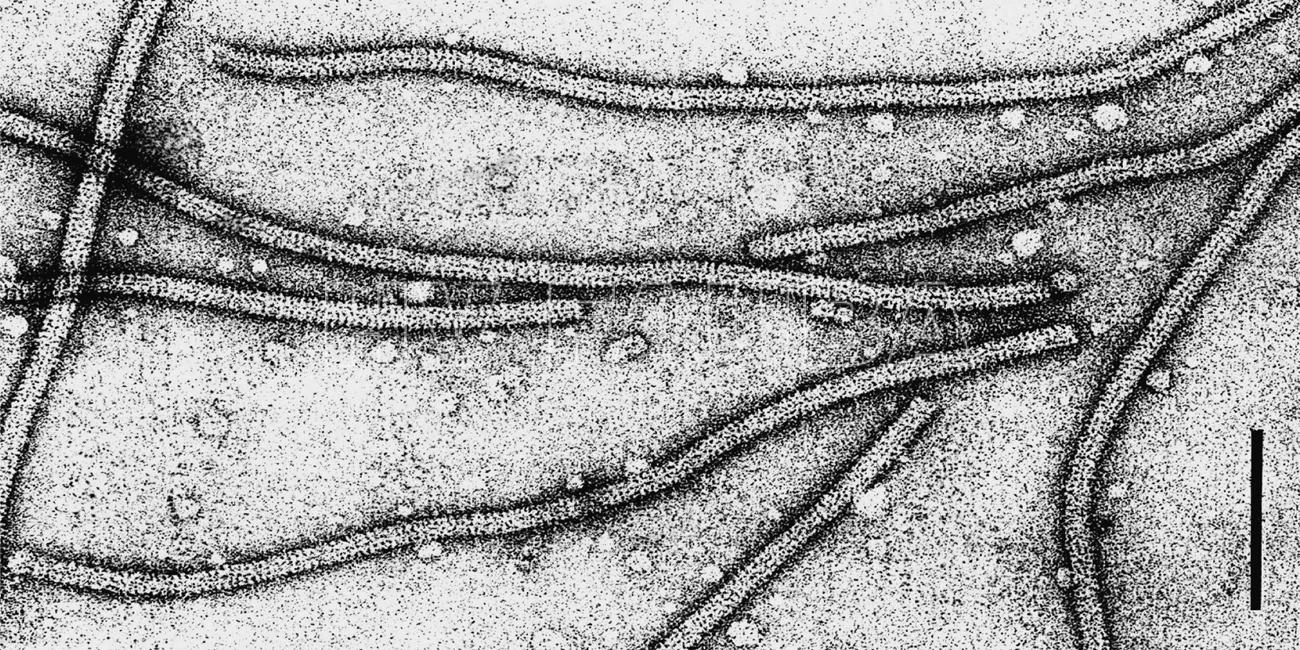
- Micrografía electrónica de contraste negativo de partículas de un aislado del virus X de la papa (PVX). La barra representa 100 nm. Autor: D.-E. Lesemann
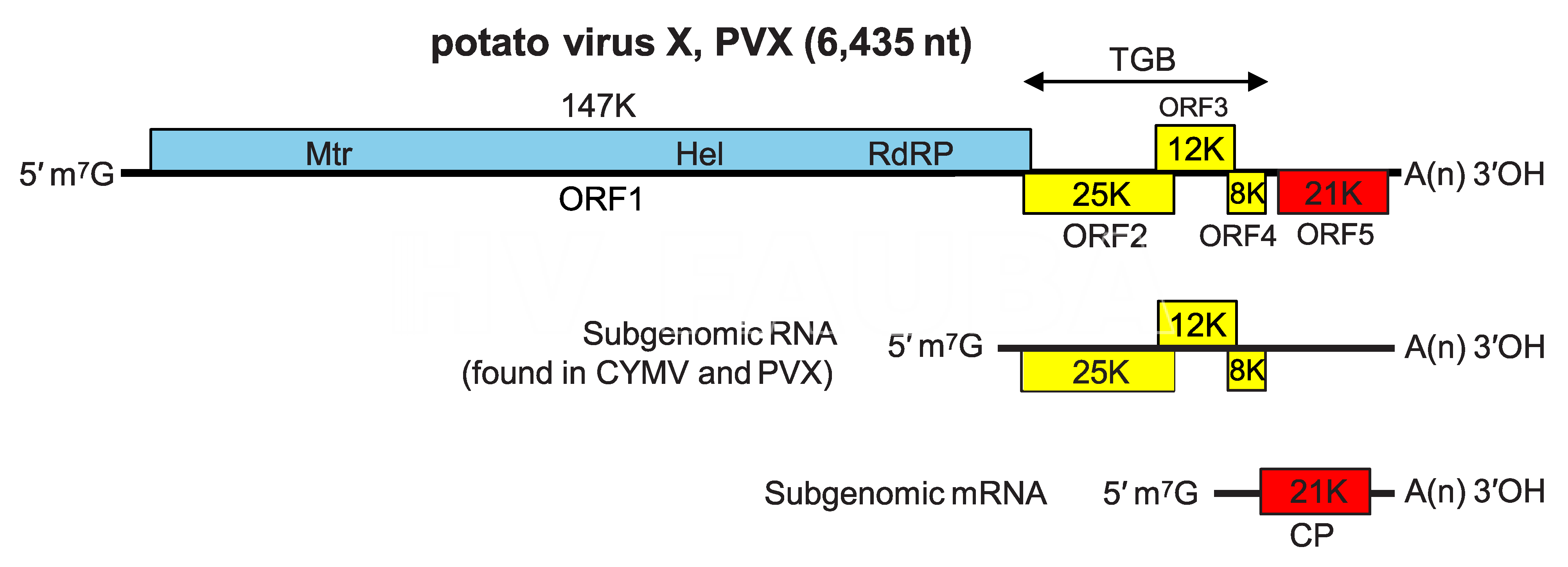
El ARN genómico de los potexvirus, ejemplificado por el virus X de la papa (PVX), tiene típicamente cinco ORF: ORF1, en el extremo 5 ‘, codifica la proteína asociada a la replicación (Rep) y ORF5, ubicado en el extremo 3’, es el gen CP. Entre ORF1 y ORF5 se encuentra el bloque de triple gen (TGB) de tres ORF superpuestos, cuyos productos (25, 12 y 8 kDa) están implicados en el movimiento de célula a célula. La proteína de 25 kDa contiene un dominio NTPasa-helicasa, pero no participa en la replicación del ARN. Se ha demostrado que tiene actividad supresora de silenciamiento de ARN que es necesaria para el movimiento del virus. Las proteínas de 12 y 8 kDa contienen grandes bloques de aminoácidos no cargados y están asociadas con vesículas de membrana derivadas del retículo endoplásmico. La tercera proteína TGB del virus del mosaico de Alternanthera (AltMV) (pero no la de PVX) se dirige al cloroplasto y es necesaria para el movimiento de la epidermis a la capa del mesófilo. La CP también participa en el movimiento de célula a célula. Los ORF 2 a 5 se expresan mediante la producción (y posterior traducción) de RNA subgenómicos (ARNsg). Pueden aislarse dos o tres ARNsg 3 ‘-co-terminales de plantas infectadas con potexvirus (aproximadamente 2.1, 1.2 y 1.0 kb); también se han detectado las contrapartes bicatenarias de estos sgRNA. El sgRNA de tamaño mediano (1.2 kb) es probablemente funcionalmente bicistrónico, y su traducción produce las proteínas de 12 y 8 kDa.
Los viriones de PVX contienen solo ARN genómico, pero algunos otros potexvirus también encapsidan el ARNsg con la CP. El ARN genómico se traduce como mensajero funcionalmente monocistrónico; sólo el gen Rep 5 ‘proximal es traducido directamente por los ribosomas, produciendo la proteína Rep (150-181 kDa). La secuencia líder 5’-UTR de PVX RNA consta de 83 nt (excluyendo la estructura de la tapa) y mejora la traducción.
.
- Organización y expresión del genoma del virus X de la papa. Mtr = metiltransferasa; Hel = helicasa; RdRP = ARN polimerasa dirigida por ARN; TGB = bloqueo de triple gen; CP = proteína de la cápside. Fuente: ICTV
.
.
.
Sintomatología
Esta virosis puede pasar inadvertida, ya que a veces se produce sólo una leve alteración del color del follaje. De allí su denominación de mosaico latente. Las infecciones primarias no producen síntomas. Las provenientes de papa semilla infectada los presentan más claramente como mosaicos limitados por las nervaduras.
.
- Fuente: Copyright owner’s name / www.discoverlife.org
.
.
Efectos citopáticos
El citoplasma de las células infectadas contiene agregados fibrosos, en bandas o irregulares de partículas víricas y, a menudo, acumulación en la membrana. No existe una citopatología específica para los potexvirus, aunque algunos virus inducen estructuras únicas, como las láminas con cuentas que se encuentran en las células infectadas por PVX.
.
Condiciones predisponentes
El ambiente influye en la manifestación de los síntomas. Las temperaturas elevadas los enmascaran, pero se agudizan con temperaturas frescas (14-20 ºC).
.
Transmisión
El PVX, como todos los potexvirus, se transmiten en la naturaleza por contacto mecánico.
.
Ciclo de la enfermedad
El virus se perpetúa en tubérculos: NO SE TRANSMITE POR INSECTOS (no tiene insecto vector conocido). La transmisión en el campo se realiza con facilidad por contacto entre plantas (entre tallos, hojas, raíces) y aún por la acción del hombre, animales o maquinarias que circulan por el cultivo (cuchillos de cortadores, masticaduras de insectos).
.
Manejo Integrado
Como para todas las virosis, el manejo debe ser preventivo. El método más efectivo para controlar el PVX es mediante la incorporación de genes de resistencia en las variedades de papa y mediante programas de fiscalización de semilla libre de virus (Fuller et al., 2020). Se han utilizado esquejes de tallos y tecnologías de micropropagación para desarrollar plantas libres de virus que luego se utilizan para producir papa semilla limpias. Varias generaciones de plantas se cultivan en los campos para producir semillas libre de virus para las ventas comerciales (Hutton et al., 2015). La mayoría de los países tienen un programa nacional de certificación de papa que realiza pruebas de enfermedades para verificar que estas semillas estén libre de enfermedades para su distribución (Loebenstein et al., 2001). En Argentina el organismo responsable del programa es el INASE:
Norma de Semilla Fiscalizada de Papa. INSTITUTO NACIONAL DE SEMILLAS.
.
Las innovaciones tecnológicas de diagnóstico más recientes se centran en métodos para detectar múltiples virus de un cultivo específico. Los investigadores se centraron en microarrays basados en oligonucleótidos y métodos de PCR multiplex para detectar virus en la papa (Boonham et al., 2003; Bystricka et al., 2005). Este y otros enfoques de hibridación que utilizan sondas sintéticas son más baratos y menos laboriosos, al tiempo que proporcionan un mayor espectro de datos de diagnóstico.
.
.
.
Bibliografía
Angell SM, Davies C, Baulcombe DC (1996) Cell-to-cell movement of Potato virus X is associated with a change in the size-exclusion limit of plasmodesmata in tricomere cells of Nicotiana clevelandii. Virology 216: 197–201. doi: 10.1006/viro.1996.0046
Atabekov JG, Rodionova NP, Karpova OV, et al. (2001) Translational activation of encapsidated potato virus X RNA by coat protein phosphorylation. Virology 286: 466–474. doi: 10.1006/viro.2001.1013
Baratova LA, Grebenshchikov NI, Dobrov EN, et al. (1992) The organization of potato virus X coat proteins in virus particles studied by tritium planigraphy and model building. Virology 188: 175–180. doi: 10.1016/0042-6822(92)90747-D
Boonham N, Walsh K, Smith P, et al. (2003) Detection of potato viruses using microarray technology: towards a generic method for plant viral disease diagnosis. Journal of Virological Methods 108: 181–187. doi: 10.1016/S0166-0934(02)00284-7
Bystricka D, Lenz O, Mraz I, et al. (2005) Oligonucleotide-based microarray: a new improvement in microarray detection of plant viruses. Journal of Virological Methods 128: 176–182. doi: 10.1016/j.jviromet.2005.04.009
Fuller KB, McIntosh C, Zidack N (2020) Valuing Disease Prevention in a Vegetatively Propagated Annual Crop: Benefits From the Montana Seed Potato Certification Program. Plant Disease 104(8): 2060-2067. doi: 10.1094/PDIS-03-19-0443-SR
Grinzato A, Kandiah E, Lico C, et al. (2020)Atomic structure of potato virus X, the prototype of the Alphaflexiviridae family. Nat Chem Biol 16: 564–569. doi: 10.1038/s41589-020-0502-4
Hutton F, Spink JH, Griffin D, et al. (2015) Distribution and incidence of viruses in Irish seed potato crops. Irish Journal of Agricultural and Food Research 54: 98–106. doi: 10.1515/ijafr-2015-0011
Lico C, Benvenuto E and Baschieri S (2015) The Two-Faced Potato Virus X: From Plant Pathogen to Smart Nanoparticle. Front. Plant Sci. 6: 1009. doi: 10.3389/fpls.2015.01009
Loebenstein G, Berger PH, Brunt AA, Lawson RH (2001) Virus and virus-like diseases of potatoes and production of seed-potatoes. Dordrecht, Netherlands: Springer.
Sun H, Jiao WB, Krause K, et al. (2022) Chromosome-scale and haplotype-resolved genome assembly of a tetraploid potato cultivar. Nat Genet. doi: 10.1038/s41588-022-01015-0
(2021) Potato virus X: A global potato-infecting virus and type member of the Potexvirus genus. Molecular Plant Pathology 00, 1– 6. doi: 10.1111/mpp.13163
Wagemans J, Holtappels D, Vainio E, et al. (2022) Going Viral: Virus-Based Biological Control Agents for Plant Protection. Annu Rev Phytopathol. 60: 21-42. doi: 10.1146/annurev-phyto-021621-114208