.
Condición fitosanitaria: Plaga Cuarentenaria Ausente
Grupo de cultivos: Hortícolas
Especie hospedante: papa, sesamo, zanahoria, etc
Rango de hospedantes: relativamente estrecho
Etiología: Bacteria sin pared celular (Clase Mollicutes). Limitada al floema. Considerada Biotrófica. Bacteria fastidiosa (no cultivable).
Agente causal: Candidatus phytoplasma asteris Lee et al. 2004, candidatus name (nombre provisional para organismos bien caracterizados pero aún sin cultivar in vitro)
Taxonomía: Bacteria > Terrabacteriagroup > Tenericutes > Mollicutes > Acholeplasmatales > Acholeplasmataceae > Candidatus Phytoplasma (grupo 16Sr I-B)
.
Los Candidatus Phytoplasma son procariontes sin pared celular pertenecientes a la clase Mollicutes (mycoplasmas), que invaden el floema y se transmiten por chicharritas vectoras. Los fitoplasmas no pueden ser cultivados in vitro, y se caracterizan por poseer un genoma pequeño (0.53 – 1.35 Mb), con bajo %GC (21-28%) (Kube et al. 2008; Marcone et al. 1999). Causan amarillamientos, achaparramientos, escobas de bruja y otras alteraciones del crecimiento.
.
En Argentina se encontró el Argentinian catharanthus little leaf phytoplasma (ACLL) infectando naturalmente a Daucus carota L. (zanahoria), Catharanthus roseus (LG Don) (vinca de Madagascar) y Matricaria chamomilla L. (manzanilla silvestre ). Este patógeno fue clasificado en el grupo 16SrI («Ca. Phytoplasma asteris»), nuevo subgrupo 16SrI-S (rr-rp) tuf-H (Torres et al., 2011).
.
.
Antecedentes e importancia económica
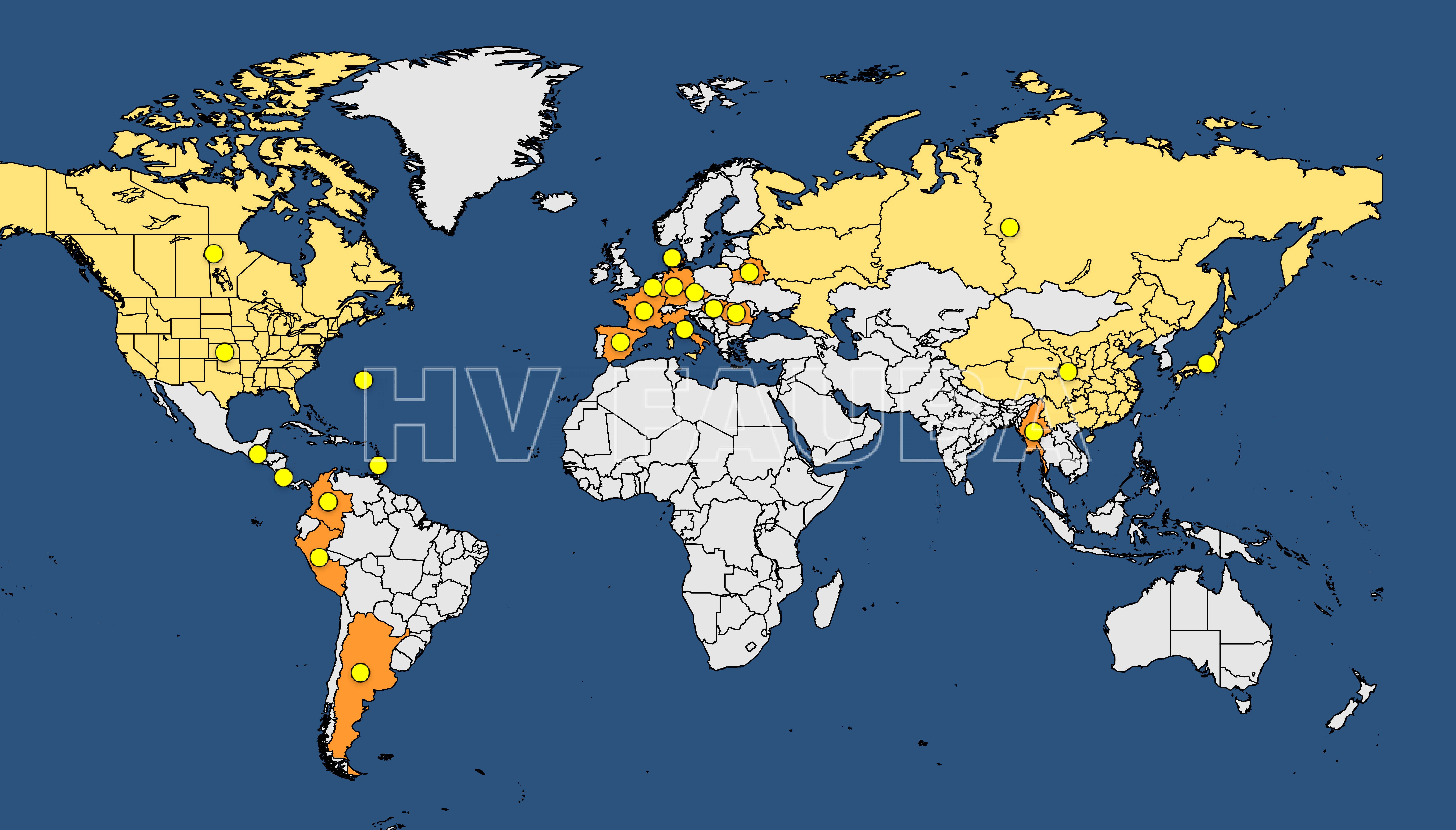
La enfermedad se encontraba presente en Argentina hasta 1976 (ver mapa). Actualmente no se encuentra presente.
- Mapa obsoleto, donde se muestra la situación hasta 1976. De acuerdo con el SENASA/SINAVIMO, actualmente esta enfermedad no se encuentra presente en Argentina. Fuente: www.gd.eppo.int/taxon/PHYPAS/distribution
.
.
Sintomas
- Descoloramiento en cultivo de papa. Autor: Maria A. Kuznetsova, All-Russian Research Institute of Phytopathology, publicado en EPPO
- Filodia en sésamo. Autor: Parthasarathy Seethapathy
.
.
.
Bibliografía
Chen J, Pu X, Deng X, Liu S, Li H, Civerolo E (2009) A phytoplasma related to ‘Candidatus phytoplasma asteris’ detected in citrus showing Huanglongbing (yellow shoot disease) symptoms in Guangdong, P. R. China. Phytopathology 99(3): 236-42. doi: 10.1094/PHYTO-99-3-0236
EPPO (1976) Current pest situation evaluated by EPPO on the basis of information dated 1976: Present, no details From CABI Disease map 056 (1976): Present, no details
Fernández F, et al. (2020) Enfermedades causadas por Fitoplasmas. Situación en Argentina. Boletín de la Asociación Argentina de Fitopatologos ISSN: 2618-1932. Diciembre 2020. N°7. Link
Huang W, MacLean AM, Sugio A, et al. (2021) Parasitic modulation of host development by ubiquitin-independent protein degradation. Cell 184: 1–14. doi: 10.1016/j.cell.2021.08.029
Kitazawa Y, Iwabuchi N, Maejima K, et al. (2022) A phytoplasma effector acts as a ubiquitin-like mediator between floral MADS-box proteins and proteasome shuttle proteins, The Plant Cell koac062. doi: 10.1093/plcell/koac062
Meneguzzi N, Torres L, Galdeano E, Guzmán F, Nome S, Conci L (2008) Molecular characterization of a phytoplasma of the ash yellows group (16Sr VII-B) occurring in Artemisia annua and Conyza bonariensis weeds. AgriScientia 25(1): 7–15. doi: 10.31047/1668.298x.v25.n1.2736
Sun H, Jiao WB, Krause K, et al. (2022) Chromosome-scale and haplotype-resolved genome assembly of a tetraploid potato cultivar. Nat Genet. doi: 10.1038/s41588-022-01015-0
, , , et al. (2023) Target degradation specificity of phytoplasma effector phyllogen is regulated by the recruitment of host proteasome shuttle protein. Molecular Plant Pathology 00: 1–12. doi: 10.1111/mpp.13410
Torres L, Galdeano E, Fernández F, Meneguzzi N, Conci L (2011) Establishment of the new subgroup 16SrI-S (rrrp) tuf-H belonging to ‘Ca. phytoplasma asteris’ in wild and cultivated plants in Argentina. J Plant Pathol;93: 311–320. doi: 10.4454/jpp.v93i2.1185
, , , et al. (2024) Phytoplasma: A plant pathogen that cannot be ignored in agricultural production—Research progress and outlook. Molecular Plant Pathology 25: e13437. doi: 10.1111/mpp.13437