.
Condición fitosanitaria: Presente
Grupo de cultivos: Cereales
Rango de hospedantes: centeno y raigrás (hospedantes de importancia económica principales), cebada, avena, triticale, trigo y otras especies de gramíneas cultivadas y silvestres de la subfamilia Pooideae, que incluyen bentgrass, bluegrass y festuca. Los miembros del género Claviceps parasitan más de 600 plantas monocotiledóneas (Bové, 1970).
Especie hospedante: Centeno (Secale cereale)
Epidemiología: oligocíclica, subaguda.
Etiología: Hongo. Biotrófico. El hongo se comporta como un verdadero biótrofo en planta, aunque se puede cultivar fácilmente en cultivo axénico.
Agente causal: Claviceps purpurea (Fr.) Tul. 1883
Taxonomía: Fungi > Dikarya > Ascomycota > Pezizomycotina > Sordariomycetes > Hypocreales > Clavicipitaceae > Claviceps
.
.
Antecedentes
La palabra ergot deriva de la palabra latina articulum (articulación o unión) a través del antiguo argot francés (cockspur, que sugiere la forma del esclerocio del hongo, ya que la gente en Francia notó cierta semejanza entre los esclerocios y las espuelas de las patas de gallo). El cornezuelo del centeno es una enfermedad fúngica causada por hongos del género Claviceps. Las especies de este género son únicas porque solo infectan los ovarios de las plantas hospedantes; ninguna otra parte de la planta es infectada por el patógeno. Hay aproximadamente 40 especies de Claviceps, siendo C. purpurea (Fries ex Fries) Tulasne la especie de mayor importancia. Aunque C. purpurea tiene un rango de hospedantes muy amplio, que incluye aproximadamente 400 especies de gramíneas, la más importante desde el punto de vista económico es el centeno.
Aunque el cornezuelo del centeno causa reducciones en el rendimiento, la importancia de la enfermedad está relacionada principalmente con los alcaloides tóxicos presentes en los cornezuelos (esclerocios). Los alcaloides pueden causar graves problemas de salud tanto en humanos como en animales. Los brotes de intoxicación grave como resultado de los hongos del cornezuelo del centeno se denominan ergotismo. La infección por cornezuelo del centeno causa una reducción en el rendimiento y la calidad del grano y el heno producidos, y si el ganado se alimenta con grano o heno infectado, puede causar ergotismo. Los alcaloides sintetizados por el hongo patógeno son sustancias psicoactivas, es decir, tiene efectos alucinógenos. El ergotismo produce convulsiones, transtornos mentales graves, precipita los ataques epilépiticos, ocasiona una infección gangrenosa, los miembros ennegrecen y se hinchan. La pérdida de miembros era frecuente en la Edad Media. También tiene capacidad de producir abortos La actividad farmacológica de los alcaloides del cornezuelo de centeno se debe a la analogía estructural que presentan con aminas biogénicas: noradrenalina, dopamina, serotonina. Lo que explica la afinidad de los alcaloides y sus derivados por los correspondientes receptores y su capacidad para ejercer efectos agonistas o antagonistas (Smakosz et al., 2021; Uhlig et al., 2021).
Las primeras descripciones precisas del ergot datan hacia el año 1000. En la Edad Media europea, las enfermedades causadas por el cornezuelo del centeno se denominaban fuego de San Antonio o fuego sagrado. Existen datos de ocurrencia de epidemias de ergotismo hacia el 857, y se dice que en el 944 murieron en Aquitania 40.000 personas. Éstas eran epidemias de ergotismo que, durante varios siglos, asolaron la Europa occidental. Incluso se piensa que pudo tener una influencia directa sobre la fertilidad de la población. En los brotes importantes, se reportó que las tasas de mortalidad estaban entre el 10 y el 20%. Antes de que se entendiera esta enfermedad, los cornezuelos se trituraban junto con los granos de centeno y se ingirieron cuando se usaba la harina para hornear. Su historia no está clara porque los diagnósticos eran primitivos y los síntomas podían atribuirse a varias enfermedades. Los síntomas también variaron dependiendo de qué toxinas (o alcaloides) estaban presentes en los cornezuelos ingeridos y en qué concentración. Hay dos formas principales de toxicidad clínica del ergotismo: gangrenoso y convulsivo. Los síntomas comunes incluyen extrañas aberraciones mentales, alucinaciones, sensación de quemazón en la piel o insectos que se arrastran debajo de la piel. Algunas víctimas desarrollaron gangrena debido a la constricción de los vasos sanguíneos en las extremidades; muchas víctimas perdieron manos y pies. Los pacientes con ergotismo fueron atendidos en hospitales dedicados a San Antonio hasta que cesó su doloroso y prolongado sufrimiento. La forma gangrenosa comenzaba por una inflamación dolorosa de las extremidades, seguida de un entumecimiento, ennegrecimiento y desecación de los tejidos, y que podía ocasionar la pérdida espontánea de los miembros a nivel de la articulación; y la forma convulsiva o «mal de los ardientes» con síntomas de agitación mental, delirio y perturbaciones sensoriales. El ergotismo disminuyó con el progreso de la agricultura y la diversificación de la alimentación, pero han existido epidemias de ergotismo hasta el siglo XIX en el norte y este de Europa y en la exURRS en 1926, y en Etiopía en 1977-78 también aparecieron casos. Hasta el siglo XVII no se asoció con la contaminación de granos de centeno. La primera descripción inequívoca del hongo y su acción fue la de Adam Lonitzer en su Kräuterbuch de 1582 donde, en un apéndice sobre centeno, escribió: “hay clavijas largas, negras, duras y estrechas en las orejas, internamente blancas, a menudo que sobresalen como uñas largas de entre los granos de la oreja». La naturaleza fúngica del cornezuelo fue reconocida en 1711 y hasta 1853 no se conoció el ciclo completo del hongo. En 1918 se aislaron los alcaloides responsables de la enfermedad. Las propiedades oxitócicas del cornezuelo se conocen desde antaño, y a partir del siglo XIX su uso se reservaba al control de hemorragias post partum.
.
Sintomatología
El primer signo obvio de infección por cornezuelo de centeno es la aparición de «melaza», una solución azucarada de color amarillo pegajoso que consta de savia del hospedante y conidios entre las glumas afectadas del centeno. Este es secretado por el ovario de la planta infectada, que eventualmente es reemplazado por un esclerocio de color negro violáceo, comúnmente conocido como cornezuelo de centeno. El tamaño del esclerocio depende de la planta hospedante; generalmente es de 1 a 5 veces más grande que la semilla de la planta hospedante. Por lo tanto, los cornezuelos más grandes (1 a 5 cm) se encuentran en plantas de semillas grandes como el centeno. El esclerocio consiste en un tejido micelial blanquecino que contiene células de almacenamiento y una corteza externa pigmentada oscura que protege el micelio fúngico de la desecación, la luz ultravioleta y otras condiciones ambientales adversas.
.
.
- Esclerocios de Claviceps purpurea sobre espiga de centeno (Secale cereale). Fuente: www.plantasyhongos.es
.
.
- Ergot en trigo. Autor: Stefan Engelhardt
.
Toxicología
Ocasionalmente, los animales liberados en los campos para el pastoreo son envenenados por el cornezuelo del centeno en los pastos silvestres, particularmente después de un clima frío y húmedo prolongado en la primavera. El cornezuelo de centeno también puede ser un problema cuando los productores ganaderos dependen del heno de pasto para alimentarse durante el invierno. Cuando se administra al ganado, niveles de cornezuelo de centeno superiores al 0,3%, en peso, pueden provocar la pérdida de las puntas de las orejas y otras extremidades durante el clima muy frío. El cornezuelo de centeno sigue siendo un problema importante en la producción de semillas de gramíneas al reducir los rendimientos, crear problemas de cosecha debido a los residuos de melaza y causar restricciones en el envío de semillas contaminadas a otros países. Los métodos de limpieza modernos eliminan los cornezuelos del grano antes de molerlos o utilizarlos para la alimentación animal, pero el proceso es costoso y puede dejar residuos tóxicos. En EE. UU. el límite legal de cornezuelo de centeno (por peso) es de 0,3% para el centeno, 0,05% para el trigo y 0,1% para la cebada, la avena o el triticale. Si se excede el límite, el grano se clasifica como «infectado con cornezuelo» y se reduce su valor. Las toxinas del cornezuelo del centeno no se destruyen al hornear.
El cornezuelo del centeno tiene una composición compleja: además de glúcidos y numerosos aminoácidos, contiene gran cantidad de lípidos (20-40%) constituidos fundamentalmente por un aceite que se enrancia rápidamente. Aparecen también esteroles (ergosterol y compuestos relacionados), aminas procedentes de la descarboxilación de aminoácidos y de pigmentos, de naturaleza antraquinónica (clavorrubina, endocrocina) o xantonas dimerizadas (ergocromas). El contenido de alcaloides ergolínicos es de aproximadamente 1%, además de trazas de clavinas. En cualquier preparación de cornezuelo de centeno existen hasta 12 alcaloides diferentes (mayores y menores) basados en la estructura fundamental del ácido lisérgico y sus amidas, incluidas la ergotamina, la ergometrina y la ergocriptina. Se identificaron otros alcaloides «falsos», incluyendo ergotoxina, ergotinina y ergostereno. El químico farmacéutico francés Charles Tanret pasó 20 años de su vida aislando alcaloides del cornezuelo de centeno, que al final resultaron no ser compuestos «puros». Se distinguen dos grupos principales:
* amidas simples del ácido lisérgico, representan el 20% del total alcaloídico, el alcaloide mayoritario es la ergometrina (=ergobasina, =ergonovina), además ergina =lisergamida).
* esgopeptinas, ampliamente mayoritarias (80%), su hidrólisis libera ácido lisérgico, prolina, amoniaco, aminoácidos y un alfa-cetoácido. El elemento estructural base se denomina ergopeptina: ergotamina, ergotoxina.
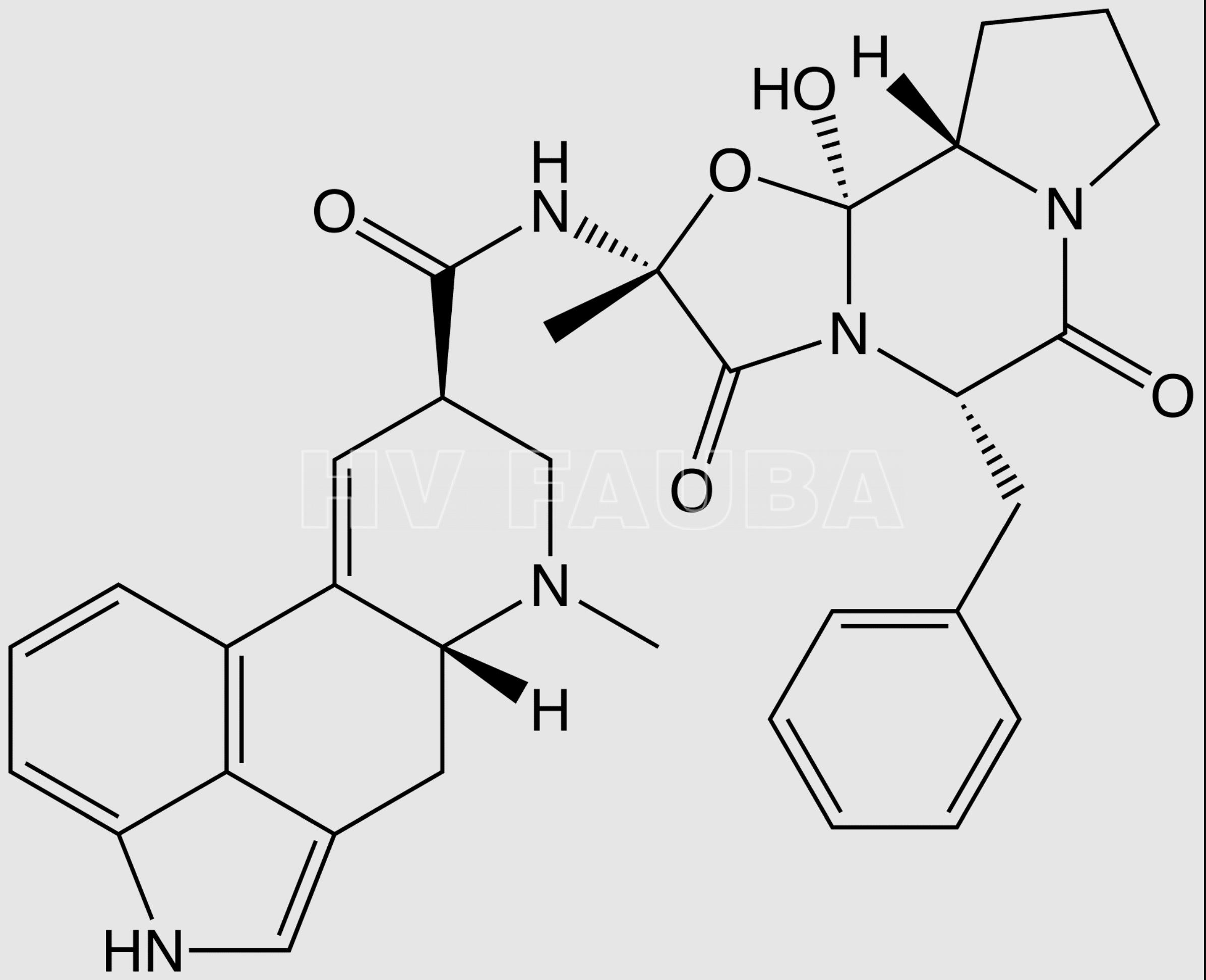
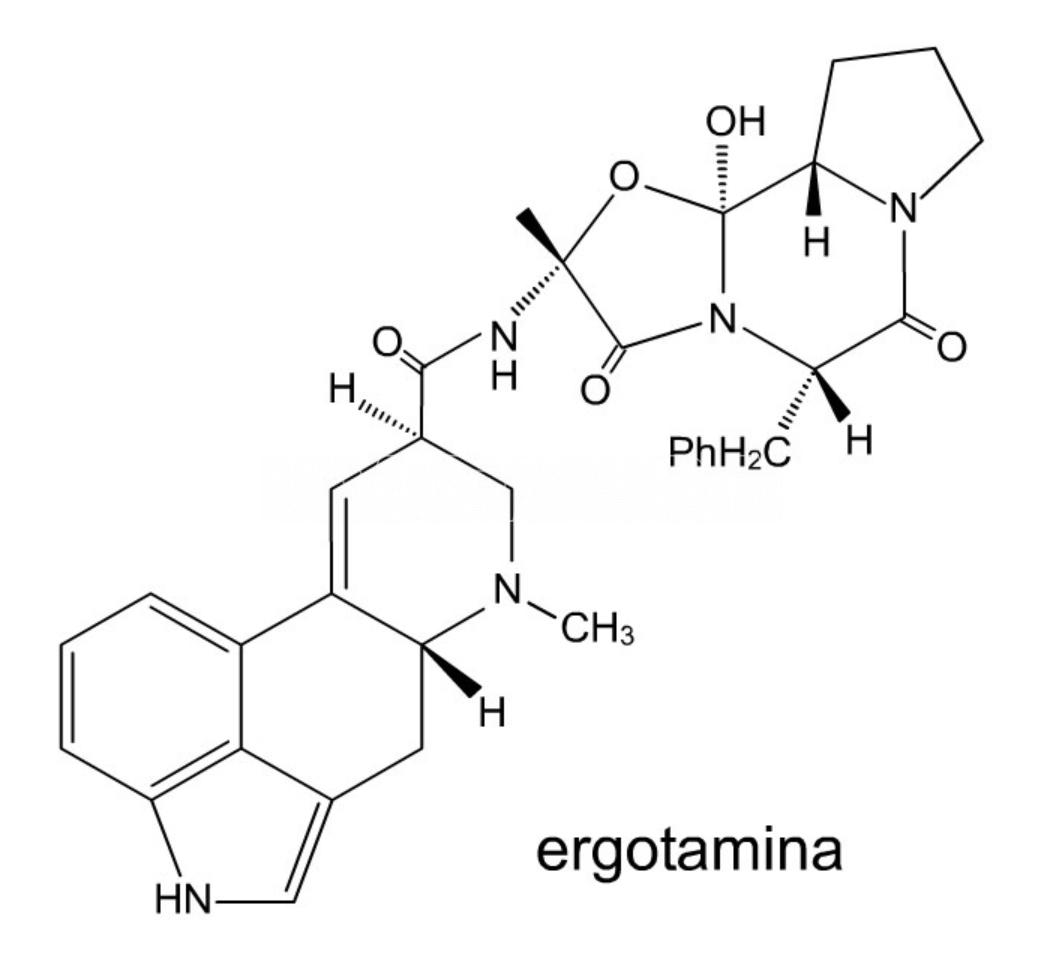
El aislamiento de ergotamina por Arthur Stoll en Suiza marca el inicio de la investigación moderna sobre alcaloides del cornezuelo del centeno. La ergotamina es un compuesto heterocíclico que forma parte de la familia de los alcaloides. Su estructura molecular, estructural y bioquímicamente muy afín a la de la ergolina, es similar a la de algunos neurotransmisores cerebrales por lo que tiene efectos a nivel del sistema nervioso central del ser humano; su actividad biológica principal es como vasoconstrictor, aunque a dosis suficientemente altas presenta actividad alucinógena y a mayor dosis resulta letal. La ergolina es un compuesto químico heterocíclico cuyo esqueleto estructural forma parte de un rango diverso de alcaloides. Desde entonces, los químicos han estudiado intensamente más de 40 alcaloides producidos por el hongo, incluido el infame alucinógeno, dietilamida del ácido lisérgico (LSD). El LSD fue sintetizado por primera vez por el químico suizo Albert Hofmann en 1938, mientras buscaba estimulantes respiratorios y circulatorios. Los principios activos de la ergotina son básicamente derivados del ácido lisérgico, el LSD es un derivado sintétidco de la ergotina creado en laboratorio por Albert Hofmann. Los derivados lisérgicos son inestables.
El cornezuelo de centeno se cultiva ahora deliberadamente en el campo y en el laboratorio con fines medicinales. Se han aislado y modificado varios compuestos del cornezuelo de centeno para usos medicinales, como el tratamiento de migrañas, hemorragias posparto, trastornos neurológicos y cardiovasculares y en obstetricia moderna. El alcaloide ergotamina se utiliza con fines medicinales en conjunto con la cafeína para prevenir que los vasos sanguíneos se expandan provocando las cefaleas.
.
- Ergotamina
.
.
Ciclo de la enfermedad y epidemiología
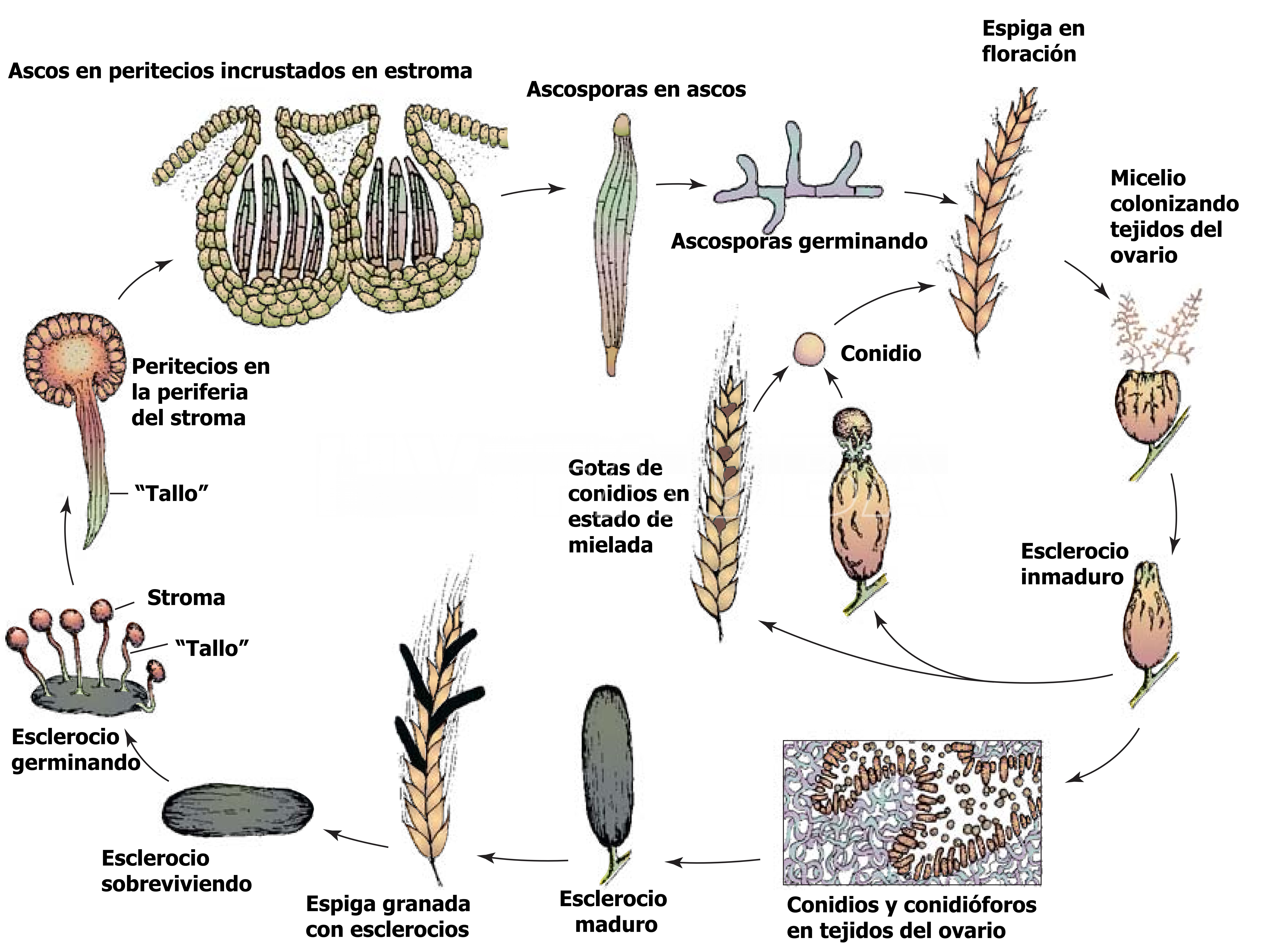
El hongo sobrevive como esclerocios sobre o en el suelo o mezclado con la semilla del hospedante. Cuando un esclerocio maduro cae al suelo, el hongo permanece inactivo hasta que las condiciones adecuadas desencadenan su fase de fructificación (inicio de la primavera, período de lluvia, necesidad de temperaturas frescas durante el invierno, etc.). De acuerdo con las investigaciones de Uppala et al. (2016), el frío fue esencial para la germinación de esclerocios cuando la temperatura de incubación fue alta (al menos superior a 20°C). A temperaturas de incubación más bajas (10 a 20°C), el preacondicionamiento con frío también jugó un papel en la mejora de la germinación de los esclerocios. Las condiciones óptimas de germinación de esclerocios fueron: 4°C (en la oscuridad) durante 4 a 8 semanas seguido de incubación a 10 y 20 °C (ciclo de 12 h de oscuridad y 12 h de luz), o 15°C constante (ciclo de 12 h de oscuridad y 12 h de luz ). Cuando los esclerocios se acondicionaron previamente durante 4 semanas o más, el número de días de incubación necesarios para el inicio de la germinación no se vio afectado por la temperatura en el rango de 10 a 25 °C (ciclo de 12/12 de luz/oscuridad), aunque la duración de la germinación (o la velocidad de progreso de la germinación) todavía se veía afectada por la temperatura. El esclerocio germina, formando uno o varios cuerpos fructíferos con cabeza y estípite, de varios colores. En la cabeza, se forman peritecios y en su interno esporas sexuales filiformes (ascosporas), que se expulsan simultáneamente cuando florecen las gramíneas hospedantes.
.
Reproducción sexual
La reproducción sexual implica la fusión de ascogonios femeninos y anteridios masculinos, cariogamia para formar núcleos diploides, que es seguida por meiosis para volver al estado haploide. Esto da como resultado la producción de cuerpos fructíferos sexuales llamados peritecios que contienen múltiples ascos, cada uno de los cuales contiene ocho ascosporas filiformes, que tienen hasta 2 µm de diámetro y 60-70 µm de largo. Las ascosporas son expulsadas de los ascos y peritecios al aire de manera explosiva (a una altura de 7-15 cm) y son diseminadas por corrientes de aire o por insectos. Cada peritecio produce hasta un millón de ascosporas. Solo aquellas ascosporas que aterrizan en un estigma u ovario del hospedante pueden causar infección. El estigma de una flor de pasto es grande y similar a una pluma para atrapar el polen transportado por el viento. Esta misma característica atrapa las ascosporas en el aire. Las ascosporas, que son el inóculo primario (inicial), germinan e infectan el ovario en 24 h.
.
Reproducción asexual
Una ascospora germinada produce una hifa filamentosa larga que coloniza el ovario de la flor de la planta hospedante. A medida que las hifas se hacen más largas y numerosas, se les llama micelio. El micelio fúngico produce numerosos conidios asexuales (inóculo secundario) a partir de conidióforos en empalizada dentro de una sustancia mucilaginosa dulce, amarillenta, llamada melaza. Esta etapa también se llama etapa de sphacelia o melaza. La melaza atrae insectos a las flores polinizadas por el viento. Los insectos contaminados con conidios pueden visitar flores sanas donde se inician nuevas infecciones. Las gotas de lluvia también ayudan en la dispersión de los conidios. Los conidios de gramíneas silvestres infectadas con cornezuelo de centeno, particularmente en las hileras de cercas, pueden ser el inóculo principal en los campos de producción de semillas de cereales y gramíneas. Con el tiempo, las hifas consumen todo el ovario y los hilos de las hifas se vuelven más gruesos y entrelazados. Mientras tanto, cesa la producción de conidios y melaza. La presión mutua de las hifas en constante crecimiento provoca la producción de una masa densa de tejido compacto llamado pseudoparenquima, que eventualmente se convierte en un esclerocio duro de color oscuro o cornezuelo de centeno.
.
Las esporas adheridas a los pelos estigmáticos forman un pequeño tubo germinativo que penetra directamente en la débil cutícula vegetal de la pared epidérmica externa sin que se formen estructuras de infección específicas como el apresorio. Después de la penetración, las hifas normalmente crecen en haces (sin ramificación intensa) hacia la raquilla en el tejido transmisor a lo largo del trayecto del tubo polínico fuera del óvulo; sólo en la región micropilar el hongo abandona este camino, girando en la dirección de la raquilla y golpeando el tejido vascular (Luttrell, 1980; Shaw y Mantle, 1980; Tudzynski et al., 1995). Las señales que guían este crecimiento dirigido aún se desconocen. Posteriormente, el hongo coloniza completamente la pared del ovario y, con cierta demora, invade el óvulo (Campbell, 1958; Kirchhoff, 1929; Willingale y Mantle, 1987). Sin embargo, no crecen hifas más allá de la punta de la raquilla. Por tanto, se forma una interfaz clara y persistente entre el estroma fúngico y el tejido del hospedante no infectado (Luttrell, 1980; Shaw y Mantle, 1980; Tudzynski et al., 1995). La detención del crecimiento de hongos en esta área podría deberse a los compuestos fenólicos del hospedante que se acumulan durante la infección (Hambrock, 1996; Mower y Hancock, 1975; Shaw y Mantle, 1980). Un posible efecto podría ser la inhibición de la actividad de la pectinasa de hongos, que se ha demostrado que es crucial para el crecimiento de hongos en la planta.
.
.
- Ciclo del ergot del centeno, causado por Claviceps purpurea. Autor: Agrios, 2005.
.
.
Manejo integrado
No se conocen genes de resistencia y no se pueden detectar reacciones de resistencia eficaces en las primeras etapas de la infección. En esta fase temprana de la colonización del tejido del hospedante, el hongo muestra un crecimiento dirigido, casi sin ramificaciones, hacia la base del ovario (Tudzynski y Scheffer, 2004).
.
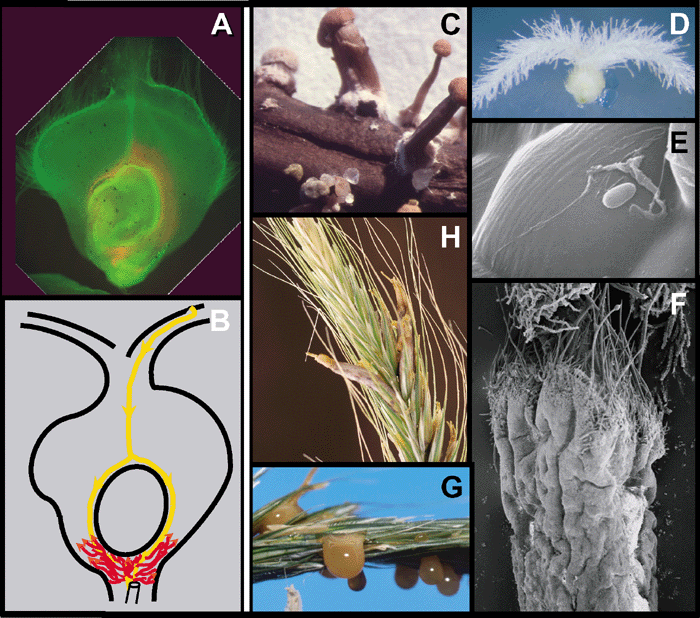
- Estilo de vida patógeno de C. purpurea. (A, B) Colonización del ovario de centeno. (A) Corte transversal, 4 dpi, teñido con azul anilina; (B) vista esquemática, las flechas amarillas y rojas indican la ruta de infección por el hongo. (C – H) Ciclo de etapas seleccionadas de la vida. (C) Esclerocio en germinación con estromas que contienen ascos; (D) ovario de centeno; (E) germinación de conidiosporas con crecimiento hifal subcuticular hacia la unión celular; (F) esfacelio; (G) espiga de centeno con melaza; (H) espiga de centeno madura con esclerocios. Autor: Tudzynski y Scheffer, 2004.
.
.
.
Fotos
.
.
Bibliografía
Agrios GN (2005) Plant Pathology. 5th ed. Elsevier–Academic Press, Boston.
Bové FJ (1970) The Story of Ergot. S. Karger, New York.
Caporael LR (1976) Ergotism: The Satan loosed in Salem? Science 192: 21-26.
Colotelo N, Cook W (1977) Perithecia and spore liberation of Claviceps purpurea: scanning electron microscopy. Canadian Journal of Botany 55(9): 1257-1259. doi: 10.1139/b77-146
Esser K, Düvell A (1984) Biotechnological exploitation of the ergot fungus (Claviceps purpurea). Process Biochem. 19: 142-149.
Guerre P (2015) Ergot alkaloids produced by endophytic fungi of the genus Epichloe. Toxins 7: 773-790.
Kind S, Schurack S, Hinsch J, Tudzynski P (2018) Brachypodium distachyon as alternative model host system for the ergot fungus Claviceps purpurea. Molecular Plant Pathology 19: 1005-1011. doi: 10.1111/mpp.12563
Kodisch A, Schmiedchen B, Eifler J, et al. (2022) Maternal differences for the reaction to ergot in unfertilized hybrid rye (Secale cereale). Eur J Plant Pathol. doi: 10.1007/s10658-022-02467-0
Králová M, Frébortová J, Pěnčík A, Frébort I (2021) Overexpression of Trp-related genes in Claviceps purpurea leading to increased ergot alkaloid production. New Biotechnology 61: 69-79. doi: 10.1016/j.nbt.2020.11.003
Kren V, Cvak L, eds. (1999) Ergot: The Genus Claviceps. Harwood Academic, Amsterdam, The Netherlands.
Lee MR (2009) The history of ergot of rye (Claviceps purpurea) I: from antiquity to 1900. J R Coll Physicians Edinb. 39(2): 179-84. Link
Lorenz K (1979) Ergot on cereal grains. CRC Crit. Rev. Food Sci. Nutr. 11: 311-354.
Madia M, Schrauf G (1999) Prospección de enfermedades de Pasto Miel (Paspalum dilatatum Poir) detectadas en la Región Pampeana de la República Argentina. Bol. San. Veg. Plagas 25: 435-443.
DM (2017) Evaluation of Claviceps purpurea isolates on wheat reveals complex virulence and host susceptibility relationships. Canadian Journal of Plant Pathology 39: 307-317. doi: 10.1080/07060661.2017.1355334
Miedaner T, Geiger HH (2015) Biology, genetics, and management of ergot (Claviceps spp.) in rye, sorghum, and pearl millet. Toxins 7: 659-678. doi: 10.3390/toxins7030659
Oeser B, Kind S, Schurack S, Schmutzer T, Tudzynski P, Hinsch J (2017) Cross-talk of the biotrophic pathogen Claviceps purpurea and its host Secale cereale. BMC Genomics 18: 273. doi: 10.1186/s12864-017-3619-4
Puranik SB, Mathre DE (1971) Biology and control of ergot on male sterile wheat and barley. Phytopathology 61: 1075-1080.
Quesada Díaz A, Ortega Díaz A (2011) El cornezuelo del centeno a lo largo de la Historia. Mitos y realidades. Pasaj. Cienc. 14: 16-25. Link
Rehacek Z, Sajdl P (1993)Ergot Alkaloids: Chemistry, Biological Effects, Biotechnology. Elsevier, New York.
Rozman D, Pertot E, Komel R, et al. (1989) Production of lysergic acid derivatives with immobilized Claviceps paspali mycelium. Applied Microbiology and Biotechnology 1989(32): 5–10. doi: 10.1007/BF00164814
Schultz TR, Johnston WJ, Golob CT, Maguire JD (1993) Control of ergot in Kentucky bluegrass seed production using fungicides. Plant Dis. 77: 685-687.
Schumann GL, Uppala S (2000) Ergot of rye. The Plant Health Instructor. Updated 2017. doi: 10.1094/PHI-I-2000-1016-01
Schwake-Anduschus C, Lorenz N, Lahrssen-Wiederholt M, et al. (2020) German monitoring 2012–2014: ergot of Claviceps purpurea and ergot alkaloids (EA) in feedingstuffs and their toxicological relevance for animal feeding. J Consum Prot Food Saf 15: 321–329. doi: 10.1007/s00003-020-01298-7
Smakosz A, Kurzyna W, Rudko M, Dąsal M (2021) The Usage of Ergot (Claviceps purpurea (fr.) Tul.) in Obstetrics and Gynecology: A Historical Perspective. Toxins 13(7): 492. doi: 10.3390/toxins13070492
Spanos N, Gottlieb J (1976) Ergotism and the Salem Village Witch Trials. Science. 194: 1390-1394.
Stange P, Seidl S, Karl T, et al. (2023) Evaluation of Trichoderma isolates as biocontrol measure against Claviceps purpurea. Eur J Plant Pathol. 167: 651–675 doi: 10.1007/s10658-023-02716-w
Tente E, Ereful N, Rodriguez AC, et al. (2021) Reprogramming of the wheat transcriptome in response to infection with Claviceps purpurea, the causal agent of ergot. BMC Plant Biol 21: 316. doi: 10.1186/s12870-021-03086-3
Tudzynski P, Scheffer J (2004) Claviceps purpurea: molecular aspects of a unique pathogenic lifestyle. Molecular Plant Pathology 5: 377–388. doi: 10.1111/j.1364-3703.2004.00237.x
Uhlig S, Rangel-Huerta OD, Divon HH, et al. (2021) Unraveling the Ergot Alkaloid and Indole Diterpenoid Metabolome in the Claviceps purpurea Species Complex Using LC–HRMS/MS Diagnostic Fragmentation Filtering. Journal of Agricultural and Food Chemistry 69, 25, 7137–7148. doi: 10.1021/acs.jafc.1c01973
Uppala S, Wu BM, Alderman SC (2016) Effects of temperature and duration of preconditioning cold treatment on sclerotial germination of Claviceps purpurea. Plant Disease 100: 2080-2086. doi: 10.1094/PDIS-02-16-0215-RE
Wegulo SN, Carlson MP (2011)Ergot of small grain cereals and grasses and its health effects on humans and livestock. University of Nebraska-Lincoln Extension. EC 1880. http://extensionpubs.unl.edu/publication/9000016368209/ergot-of-small-grain-cereals-and-grasses-and-its-health-effects-on-humans-and-livestock/
Wood G, Coley-Smith JR (1982) Epidemiology of ergot disease (Claviceps purpurea) in open-flowering male sterile cereals. Ann. Appl. Biol. 100: 73-82.
K (2022) Brome grasses represent the primary source of Claviceps purpurea inoculum associated with barley fields in the San Luis Valley of Colorado. Canadian Journal of Plant Pathology. doi: 10.1080/07060661.2022.2091041