.
Condición fitosanitaria: Ausente
Grupo de cultivos: Cereales
Especie hospedante: Maíz (Zea mays)
Rango de hospedantes: El rango de hospedante de P. maydis parece estar restringido a Zea mays (Cline, 2019), aunque otras especies de Phyllachora causan manchas de alquitrán en una amplia variedad de especies de gramíneas y otros hospedantes (Parbery, 1967, 1971).
Etiología: Hongo. Biotrófico
Agente causal: Phyllachora maydis Maubl., 1904 (*)
Taxonomía: Fungi > Dikarya > Ascomycota > > Pezizomycotina > Sordariomycetes > Phyllachorales > Phyllachoraceae > Phyllachora
.
(*) En América Latina, P. maydis está supuestamente asociado con otros dos hongos (Hock et al. 1995): Monographella maydis Müller & Samuels, un necrófito, y Coniothyrium phyllachorae Maubl., un hiperparásito fúngico (Hock et al. 1995). Sin embargo, en los EE. UU., Solo P. maydis se ha documentado en asociación con la mancha de alquitrán del maíz (McCoy et al., 2019).
.
Recientemente se publicó un borrador de la secuencia del genoma de P. maydis (Telenko et al. 2020). Un estudio de Hernández-Restrepo et al. (2016) utilizaron las regiones de ADNr ITS, TEF1, RPB2 y nrSSU para construir un árbol filogenético de Phyllachorales, validando el uso de estas regiones y generando secuencias que podrían adaptarse para futuros trabajos con P. maydis. Hasta la fecha, hay tres árboles filogenéticos publicados con loci similares, pero para la porción de Phyllachora solo se usó el gen ITS, y las distinciones de especies dentro del género aún deben resolverse.
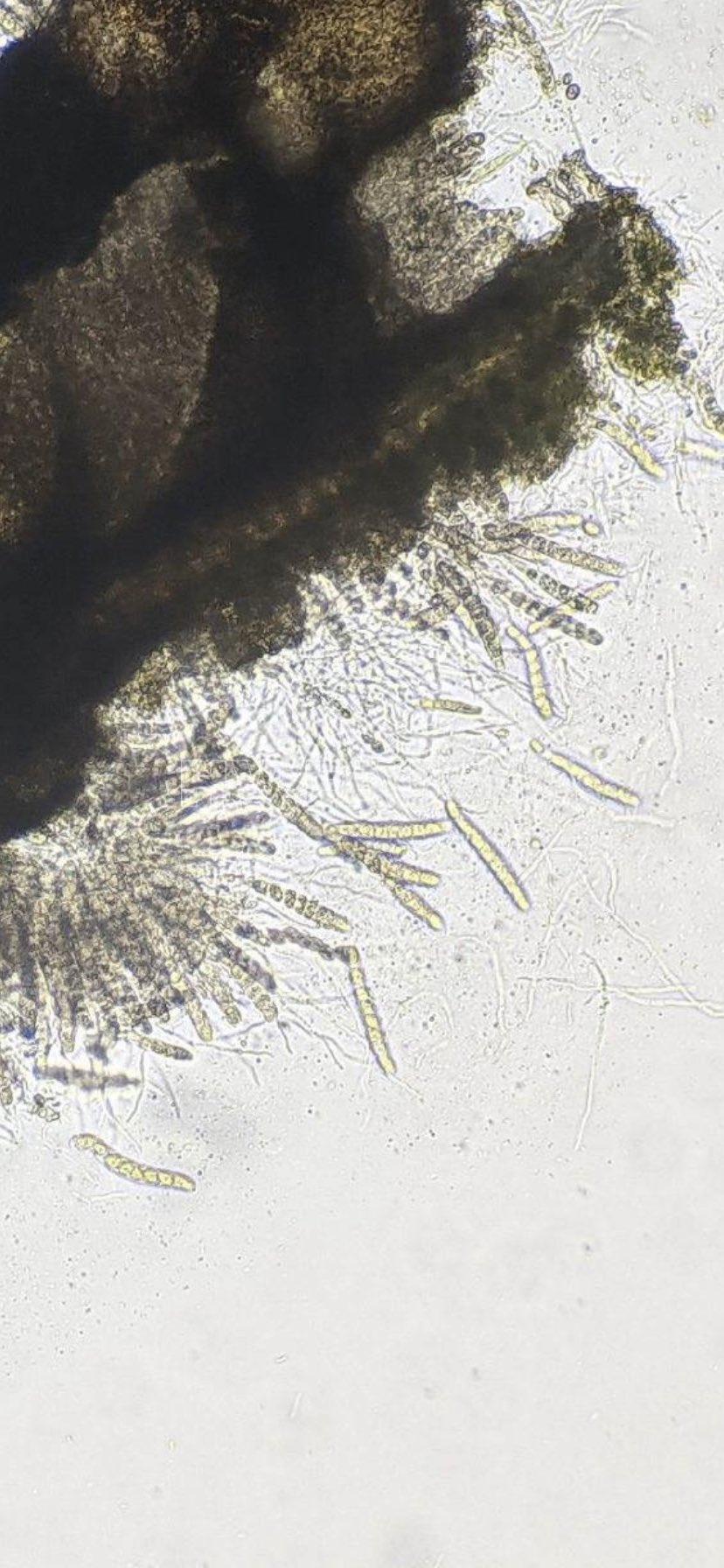
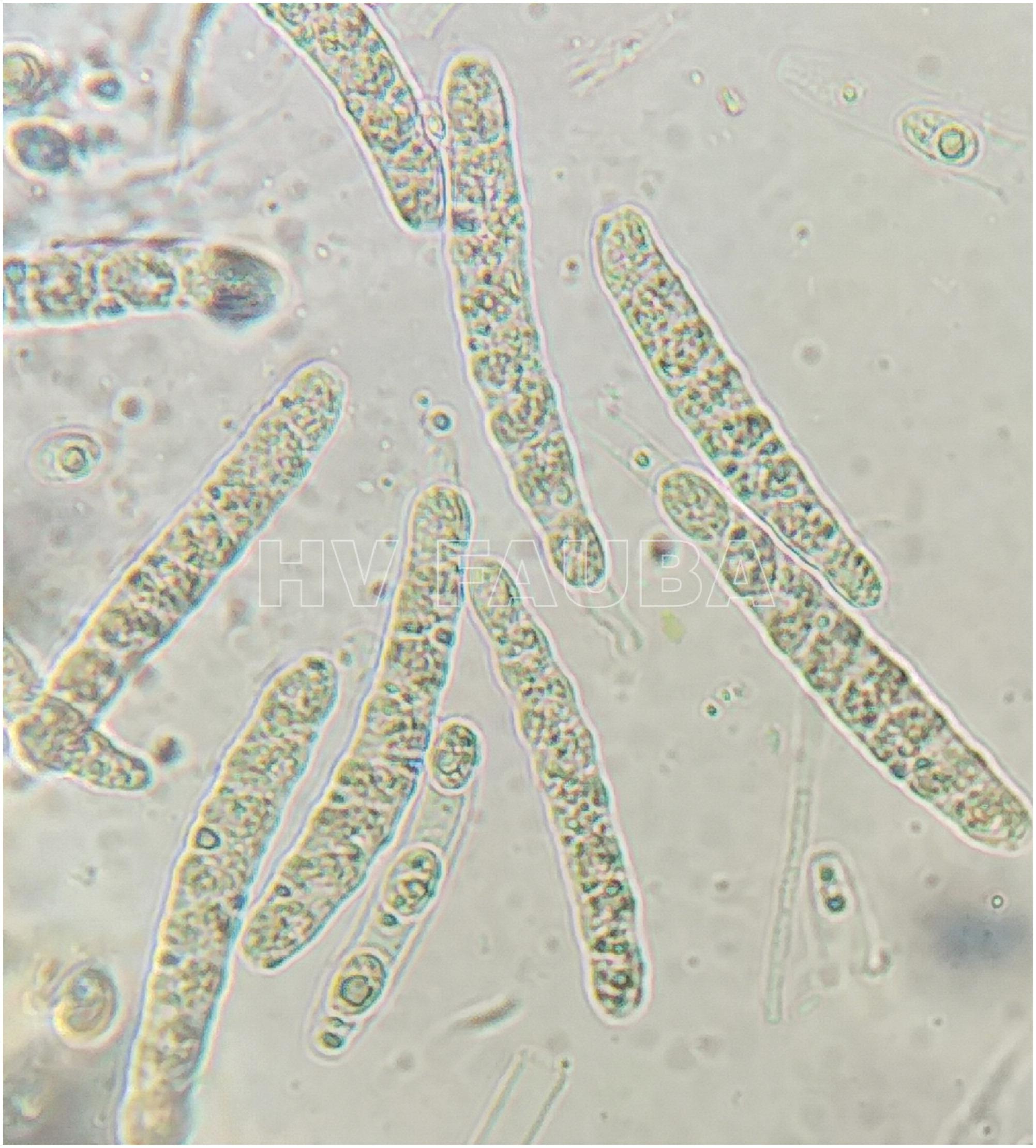
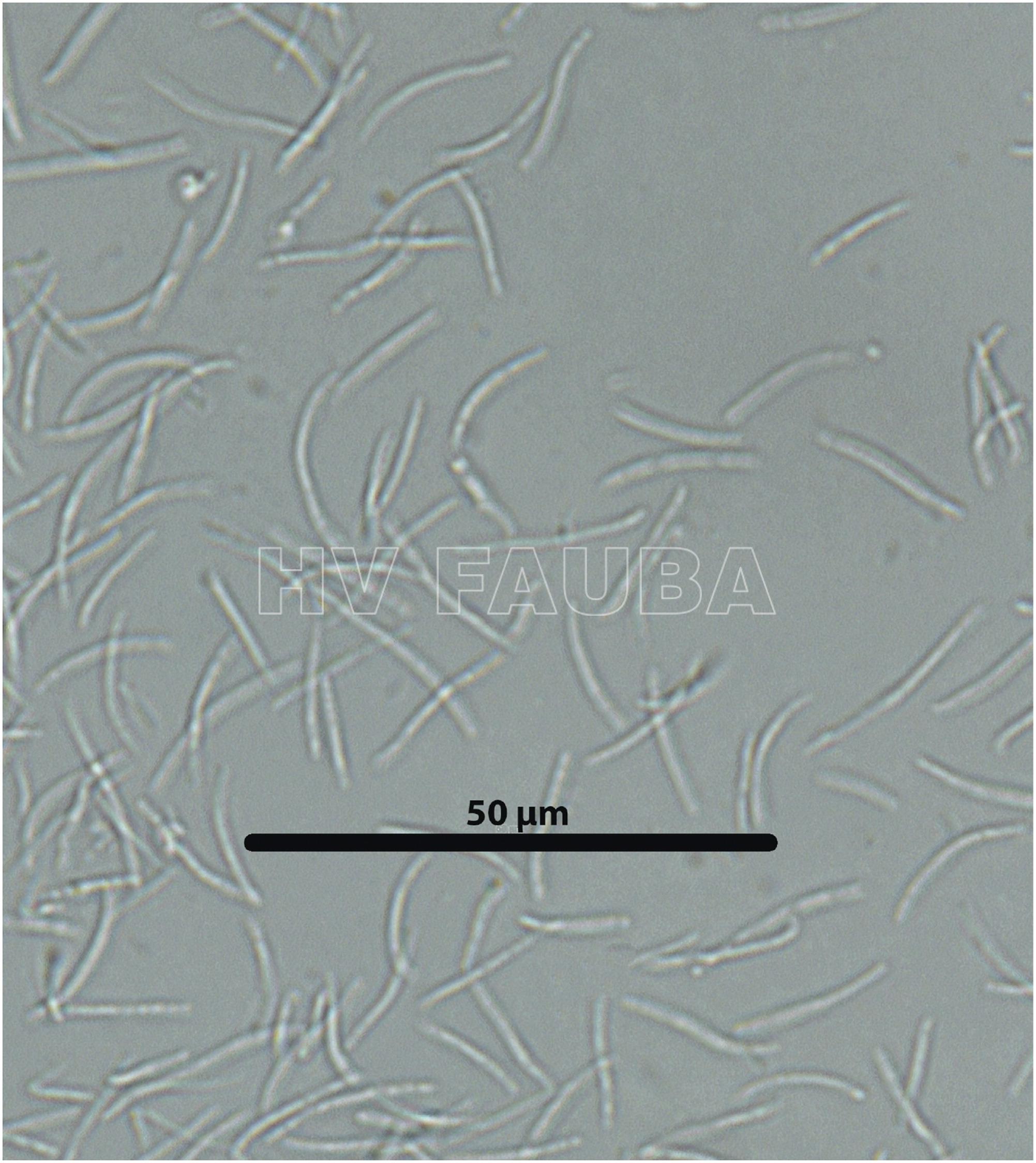
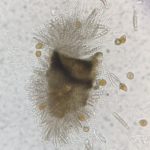
P. maydis es un ascomicete, que produce esporas sexuales (ascosporas) y esporas asexuales (conidios). Las ascosporas se forman en ascos de pared simple dentro de un solo peritecio cubierto por estromas. Se producen ocho ascosporas ovales a ovoides, de 10 a 14 µm x 5,5 a 8 µm, por asco (Hock et al., 1992; Liu, 1973; Maublanc, 1904). Las ascosporas se descargan a través del ostiolo peritecial en una masa mucilaginosa. Un solo peritecio descarga esporas repetidamente en el transcurso de varios días, produciendo ocasionalmente cirros pálidos (Parbery, 1963). Las ascosporas requieren un rango de temperatura de 20 a 25 °C para una germinación óptima con una humedad relativa> 75% y períodos prolongados de humedad de las hojas (mojado foliar) (Bajet et al., 1994; Groves et al., 2020; Hock et al., 1989; Maublanc, 1904; Pereyda- Hernández et al., 2009). Dittrich et al. (1991) encontraron que en estudios de laboratorio, la germinación de ascosporas puede ocurrir en tan solo 2 h en agua destilada a 24 °C. Estos investigadores también indicaron que la germinación de ascosporas y la formación de apresorios por P. maydis ocurrieron entre 10 y 20 °C, formándose apresorios dentro de las 12 a 24 h, lo cual es consistente con otros miembros del género (Parbery, 1963).
.
- Autor: Quin Godwin
- Esporas sexuales de Phyllachora maydis (ascosporas). Autor: Valle-Torres et al., 2020.
- Esporas asexuales de Phyllachora maydis (conidios). Autor: Valle-Torres et al., 2020.
.
.
.
Antecedentes
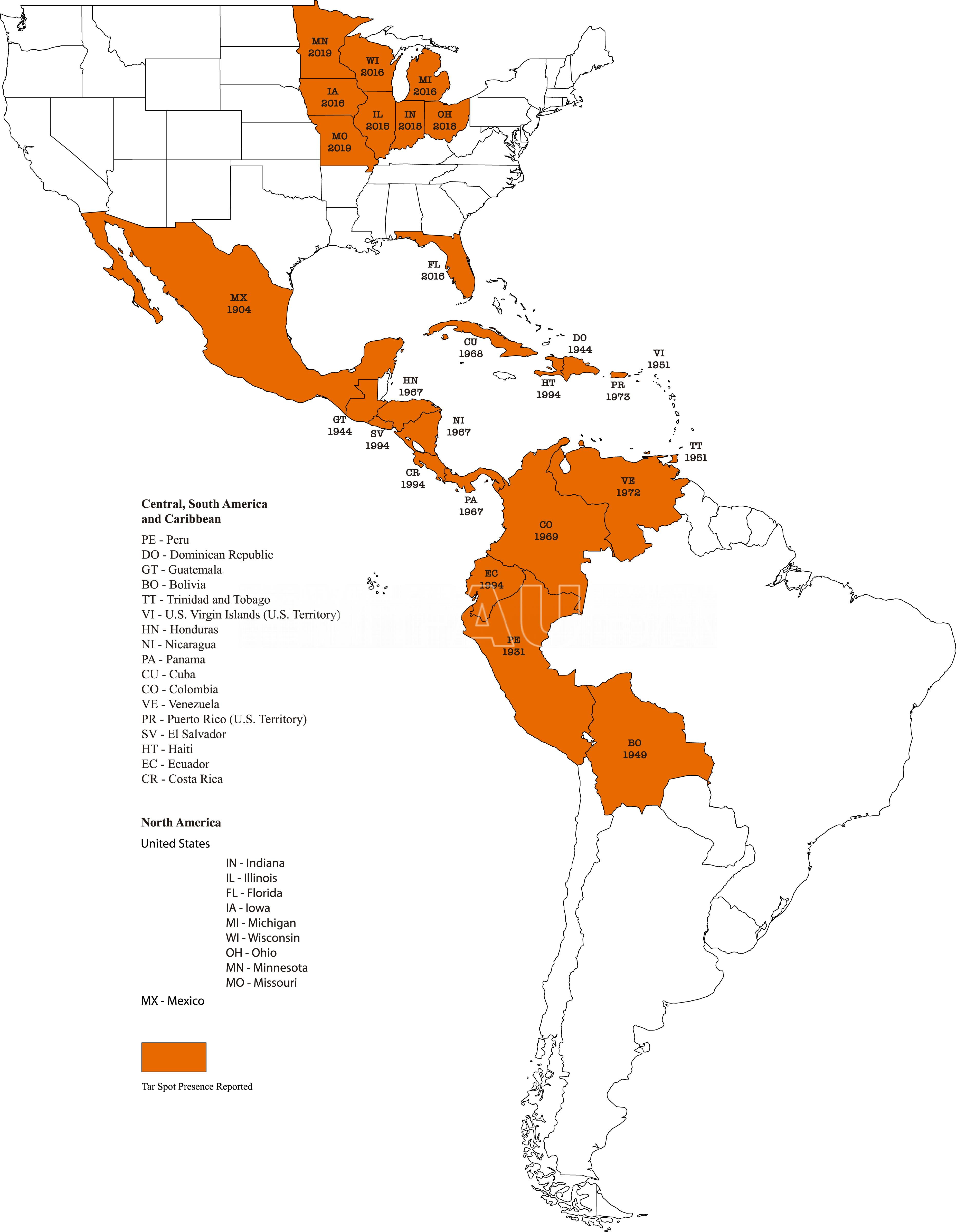
La mancha de alquitrán es una enfermedad fúngica del maíz que principalmente infecta y daña las hojas. Produce pequeñas manchas negras en hojas y chalas. La enfermedad puede disminuir el rendimiento de grano y la calidad del ensilado, rastrojo y chala del maíz (Bajet et al. 1994; Hock et al. 1989; Maublanc 1904). En América Latina, se ha documentado pérdidas económicas de hasta el 50% cuando las epidemias son graves en las primeras etapas de la reproducción de las plantas de maíz. P. maydis es endémica de América Latina (México y varios países de Centro y Sudamérica), y se identificó por primera vez en México en 1904 (Maublanc, 1904; Abbott, 1931; Bajet et al., 1994; Liu, 1973; Malaguti y Subero, 1972). A partir de 2015, P. maydis apareció y se ha extendido en el medio oeste de los Estados Unidos (EE. UU.) (Bissonnette, 2015; Dalla Lana et al., 2019; Malvick et al., 2020; McCoy et al., 2018; Ruhl et al., 2016). La mancha de alquitrán se ha convertido en una enfermedad emergente de alto perfil en los EE. UU., debido a su reciente identificación y propagación, el impacto documentado en el rendimiento del maíz y la amenaza que representa para la producción de maíz. Actualmente se desconocen los eventos que subyacen a la aparición de P. maydis en los EE. UU.
.
- Distribución mundail de Tar spot o mancha alquitran del maíz. Phyllachora maydis se reportó por primera vez en México en 1904 y actualmente está presente en 16 países más. En los EE. UU., se reportó por primera vez en 2015 y ahora está establecido en nueve estados. Autor: Valle-Torres et al., 2020
.
.
Síntomas
Los síntomas se manifiestan principalmente en las hojas, donde se producen pequeñas manchas negras. La mancha de alquitrán se caracteriza por la formación de estromas negros, los cuerpos fructíferos de P. maydis, en el follaje. Los estromas se asemejan a manchas de «alquitrán » (del Inglés, Tar spot). En campos con residuos de maíz infestados, los síntomas y signos iniciales de la mancha de alquitrán pueden aparecer en el dosel inferior de la planta de maíz (Bajet et al., 1994). En los Estados Unidos, los patrones de enfermedad «de arriba hacia abajo» ocurren con frecuencia en nuevos lugares, lo que sugiere una transmisión del inóculo a larga distancia. Sin embargo, en plantas de cualquier edad, hojas, vainas foliares y chalas son susceptibles a la infección (Bajet et al. 1994; Hock et al. 1995).
La infección por P. maydis da como resultado el desarrollo de estructuras brillantes (masa de tejidos fúngicos negros) conocidas como estromas (Carson, 1999; CIMMYT, 2003; Hock et al., 1995). Los estromas se incrustan en el tejido del hospedante y se dispersan o se agrupan en ambas superficies de las hojas, y ocasionalmente se fusionan en franjas (Liu, 1973). Los estromas a veces están rodeados por halos necróticos, elípticos y marrones denominados “lesiones de ojo de pez”. En casos severos, los halos necróticos se fusionan, causando una necrosis extensa y tizón foliar que conduce a la senescencia prematura y la muerte de las plantas (Carson, 1999; Ceballos y Deutsch, 1992; Hock et al., 1995).
.
- Autor: Edward-Beasley
- Primeros síntomas de Tar Spot. Autor: Alison Robertson
- Autor: Morgan Romoser
- Cuerpos de fructificación de Phyllachora maydis en el follaje, que se asemejan a «manchas de alquitrán». Autor: Valle-Torres et al., 2020.
- Estructuras ligeramente elevadas, semicirculares, de color marrón oscuro a negro brillante conocidas como estromas, las que se encuentran protegidas por clípeos. Autor: Valle-Torres et al., 2020.
- Los estromas pueden estar encerrados por halos marrones, elípticos y necróticos conocidos como «lesiones de ojo de pez» (indicadas por flechas). Autor: Valle-Torres et al., 2020.
- Peritecio con esporas sexuales (ascosporas) de Phyllachora maydis, las que se descargan a través de un ostiolo peritecial en una masa mucilaginosa. Autor: Valle-Torres et al., 2020.
- Autor: University-Of-Nebraska-Lincoln
- Autor: University-Of-Nebraska-Lincoln
- Autor: University-Of-Nebraska-Lincoln
- Mancha alguitran (Tar spot) y roya del sur (Puccinia polysora). Autor: Robert C Kemerait Jr
- Mancha alguitran (Tar spot) y roya del sur (Puccinia polysora). Autor: Robert C Kemerait Jr
- Asco con ascosporas de Phyllachora maydis (Tar spot) y algunas pocas uredinosporas de roya del sur (Puccinia polysora). Autor: Robert C Kemerait Jr
- Autor: Brent-Schwenneker
- Autor: Edward-Beasley
- Autor: Edward-Beasley
- Autor: Edward-Beasley
- Autor: Edward Beasley
- Autor: Bob Kemerait
- Autor: Daniel Bjorklund
- Autor: Darcy Telenko
.
.
Ciclo de la enfermedad
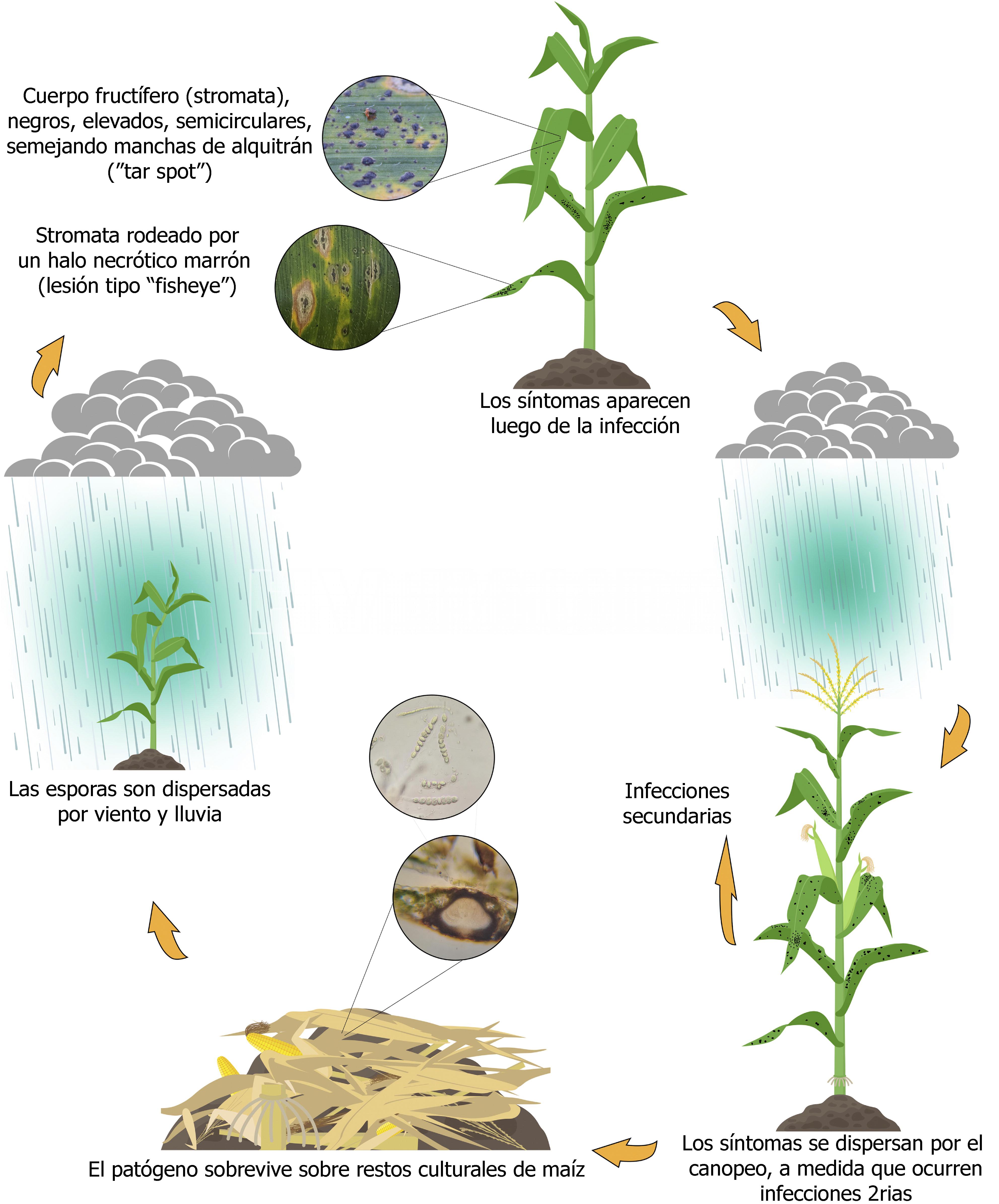
El ciclo de la enfermedad de la mancha de alquitrán no se comprende completamente. Como otras especies del género Phyllachora, P. maydis es un biótrofo obligado, que requiere un hospedante vivo para crecer y reproducirse (Cannon, 1991). Sin embargo, en campos con residuos de maíz infestados, los síntomas y signos iniciales de la mancha de alquitrán pueden aparecer en el dosel inferior de la planta de maíz (Bajet et al., 1994). Las ascosporas y conidios de P. maydis pueden sobrevivir en estromas en hojas de maíz en descomposición o residuos de cosecha en los campos (Groves et al., 2020; Kleczewski et al. 2019). Por tanto, los residuos infestados con propágulos son probablemente la fuente del inóculo primario. Según Hock et al. (1992), las ascosporas se liberan de los estromas y se dispersan por el viento o la lluvia al follaje durante períodos de temperatura moderada (16 a 23 °C), duración de la humedad de las hojas superior a 7 h por noche y humedad relativa superior al 75%. (Hock et al., 1995). La dispersión de esporas a larga distancia es otra posible fuente de inóculo primario. Sin embargo, la dispersión de ascosporas se ha documentado solo hasta 31 m de la fuente del inóculo (Liu, 1973). Las ascosporas infectan las plantas de maíz cercanas y este ciclo se repetirá varias veces por temporada de crecimiento en condiciones propicias (Bajet et al. 1994; Hock et al., 1989). En los EE. UU., en campos sin antecedentes de manchas de alquitrán se han documentado síntomas de manchas primero en el dosel superior del cultivo y no en el dosel inferior. Esto plantea interrogantes sobre la posibilidad de una dispersión a larga distancia. Ni el período de incubación (tiempo desde la inoculación hasta el desarrollo de los síntomas) ni el período de latencia (tiempo desde la inoculación hasta el inicio de las estructuras reproductivas) se han establecido claramente para P. maydis. Datos preliminares indicarían que el período de latencia puede ser variable, pero el rango suele ser de 14 a 20 días a una temperatura de 16 a 23 °C (Cruz y Kleczewski, inédito). Los períodos de latencia pueden verse significativamente influenciados por los grados día de crecimiento (GDD) y otros factores, incluido el nivel de resistencia del hospedante, por lo que es probable que la variabilidad en la latencia de P. maydis esté relacionada con estos factores. Los síntomas de la mancha de alquitrán se observan 14 días después de la infección y poco después se producen nuevas ascosporas en los estromas (Hock et al., 1995).
.
- Representación esquemática del presunto ciclo de la enfermedad de la mancha de alquitrán (tar spot) en los Estados Unidos. Phyllachora maydis es capaz de sobrevivir en residuos de maíz y generar infecciones secundarias. Los síntomas de la mancha de alquitrán se pueden observar 14 días después de la infección y poco después se producen nuevas ascosporas en los estromas. La dispersión de ascosporas se ha documentado hasta tan solo 31 m de la fuente. Sin embargo, la evidencia sugiere que también puede ocurrir una dispersión a larga distancia. Autor: Valle-Torres et al., 2020
.
.
Manejo Integrado
* Rotación de cultivos
* Evitar híbridos susceptibles
* Aplicación de fungicidas (existen pocos datos sobre el momento de aplicación y la respuesta económica)
* Manejo del riego
.
La arquitectura genética de la resistencia a la mancha de alquitrán es compleja, pero se ha detectado sistemáticamente un único locus que provee niveles elevados de resistencia (Cao et al., 2017; Ceballos y Deutsch, 1992; Mahuku et al., 2016). Recientemente, un locus de rasgos cuantitativos (QTL) de gran efecto ubicado en el cromosoma bin 8.03, denominado qRtsc8-1, se detectó consistentemente en múltiples poblaciones tropicales / subtropicales de maíz examinadas en varios lugares de América Central y del Sur (Cao et al., 2017; Mahuku et al., 2016). La la asociación más significativa identificada por Mahuku et al. (2016) en un estudio de mapeo de asociación de todo el genoma fue con un gen codificador de un receptor de repetición rico en leucina, que sería consistente con un gen de resistencia importante.
.
.
- Autor: K_Wise, Publicado en: Copyright © 2021 · All Rights Reserved · Crop Protection Network
- Autor: K_Wise, Publicado en: Copyright © 2021 · All Rights Reserved · Crop Protection Network
- Autor: Ed Zaworski, Publicado en: Copyright © 2021 · All Rights Reserved · Crop Protection Network
- Autor: Camila Nicolli
.
.
.
Bibliografía
Abbott E (1931) Further notes on plant diseases in Peru. Phytopathology 21: 1061-1071.
Baireddy S, Lee SY, Gongora-Canul C, et al. (2022) Leaf Tar Spot Detection Using RGB Images. arXiv:2205.00952. doi: 10.48550/arXiv.2205.00952
Bajet NB, Renfro BL, Carrasco JMV (1994) Control of tar spot of maize and its effect on yield. Int. J. Pest Manage. 40: 121-125.
Bissonnette S (2015) Corn disease alert: new fungal leaf disease “tar spot” Phyllachora maydis identified in 3 northern Illinois counties. The Bulletin: Pest Management and Crop Development Information for Illinois.
Broders K, Iriarte G, Bergstrom G, et al. (2024) Tar spot of maize in the Americas is caused by a complex of closely related Phyllachora species which vary in their host and geographic range. Authorea. doi: 10.22541/au.170669802.27673013/v1
Cannon PF (1991) A revision of Phyllachora and some similar genera on the host family Leguminosae. Mycol. Pap. 163: 302.
(2017) Genome-wide analysis of tar spot complex resistance in maize using genotype-by-sequencing SNPs and whole genome prediction. Plant Genome 10(2): 1-14. doi: 10.3835/plantgenome2016.10.0099
Cao S, Song J, Yuan Y, et al. (2021) Genomic Prediction of Resistance to Tar Spot Complex of Maize in Multiple Populations Using Genotyping-by-Sequencing SNPs. Front. Plant Sci. 12: 672525. doi: 10.3389/fpls.2021.672525
(1999) Diseases of minor importance or limited occurrence. Pages 23-25 in: Compendium of Corn Diseases. D. G. White, ed. American Phytopathological Society, St Paul, MN.
Ceballos H, Deutsch JA (1992) Inheritance of resistance to tar spot complex in maize. Phytopathology 82: 505-512. doi: 10.1094/Phyto-82-505
Check JC, Byrne AM, Singh MP, et al. (2023) Effects of Nitrogen Application Rate and Plant Density on Severity of Tar Spot of Corn. Plant Health Progress. doi: 10.1094/PHP-12-22-0125-RS
CIMMYT (2003) Maize Diseases: A guide for field identification. 4th Edition. International Maize and Wheat Improvement Center, Mexico, D.F., Mexico.
Cline E (2019) Phyllachora maydis. U.S. National Fungus Collections, ARS, USDA. Retrieved November 1. Link
Dalla Lana F, Plewa DE, Phillippi ES, et al. (2019) First report of tar spot of Maize (Zea mays), caused by Phyllachora maydis, in Ohio. Plant Disease 103: 1780.
Dittrich U, Hock J, Kranz J, Renfro BL (1991) Germination of Phyllachora maydis ascospores and conidia of Monographella maydis. Cryptogam. Bot. 2: 214-218.
Groves CL, Kleczewski NM, Telenko DEP, et al. (2020) Phyllachora maydis ascospore release and germination from overwintered corn residue. Plant Health Prog. 21: 26-30. doi: 10.1094/PHP-10-19-0077-RS
Helm M, Singh R, Hiles R, et al. (2022) Candidate Effector Proteins from the Maize Tar Spot Pathogen Phyllachora maydis Localize to Diverse Plant Cell Compartments. Phytopathology 112(12): 2538-2548. doi: 10.1094/PHYTO-05-22-0181-R
Hernández-Restrepo M, Groenewald JZ, Crous PW (2016) Taxonomic and phylogenetic re-evaluation of Microdochium, Monographella and Idriella. Persoonia 36: 57-82. doi: 10.3767/003158516X688676
Hock J, Kranz J, Renfro B (1989) El complejo “mancha de asfalto” de maíz: Su distribucción geográfica, requisitos ambientales e importancia económica en México. Rev. Mex. Fitopatol. 7: 129-135.
Hock J, Dittrich U, RenfroBL, Kranz J (1992) Sequential development of pathogens in the maize tarspot disease complex. Mycopathologia 117: 157-161. doi: 10.1007/BF00442777
Hock J, Kranz J, Renfo BL (1995) Studies on the epidemiology of the tar spot disease complex of maize in Mexico. Plant Pathol. 44: 490-502.
Kleczewski NM, Chilvers M, Mueller DS, et al. (2019) Corn disease management: Tar spot. CPN 2012-W. Crop Protection Network. doi: 10.31274/cpn-20190620-008
Lee D-Y, Na D-Y, Góngora-Canul C, et al. (2021) Contour-Based Detection and Quantification of Tar Spot Stromata Using Red-Green-Blue (RGB) Imagery. Front. Plant Sci. 12: 675975. doi: 10.3389/fpls.2021.675975
Liu L-J (1973) Incidence of tar spot disease of corn in Puerto Rico. J. Agric. Univ. P. R. 42: 211-216.
Loladze A, Rodrigues FA Jr, Toledo F, et al. (2019) Application of Remote Sensing for Phenotyping Tar Spot Complex Resistance in Maize. Front. Plant Sci. 10: 552. doi: 10.3389/fpls.2019.00552
Mahuku G, Chen J, Shrestha R, et al. (2016) Combined linkage and association mapping identifies a major QTL (qRtsc8-1), conferring tar spot complex resistance in maize. Theor Appl Genet. 129(6): 1217-29. doi: 10.1007/s00122-016-2698-y
Malaguti G, Subero LJ (1972) Mancha de asfalto del maiz. Agron. Trop. 22: 443-445.
Malvick DK, Plewa DE, Lara D, et al. (2020) First report of tar spot of corn caused by Phyllachora maydis in Minnesota. Plant Disease 104: 1865. doi: 10.1094/PDIS-10-19-2167-PDN
Helm M (2022) Tar Spot of Maize: Current knowledge of genetic interactions and future research prospects to improve disease resistance. Authorea. Link
Maublanc A (1904) Espéces nouvelles de champignons inferieurs. Bull. Soc. Mycol. Fr. 20: 72-74.
MacCready JS, Roggenkamp EM, Gdanetz K, Chilvers MI (2023) Elucidating the Obligate Nature and Biological Capacity of an Invasive Fungal Corn Pathogen. Mol Plant Microbe Interact. 36(7): 411-424. doi: 10.1094/MPMI-10-22-0213-R
MacCready JS, Roggenkamp EM, Gdanetz K, Chilvers MI (2023) Elucidating the Obligate Nature and Biological Capacity of an Invasive Fungal Corn Pathogen. Mol Plant Microbe Interact. 36(7): 411-424. doi: 10.1094/MPMI-10-22-0213-R
McCoy AG, Romberg MK, Zaworski ER, et al. (2018) First report of tar spot on corn (Zea mays) caused by Phyllachora maydis in Florida, Iowa, Michigan, and Wisconsin. Plant Disease 102: 1851. doi: 10.1094/PDIS-02-18-0271-PDN
Mottaleb KA, Loladze A, Sonder K, et al. (2019) Threats of Tar Spot Complex disease of maize in the United States of America and its global consequences. Mitig Adapt Strateg Glob Change 24: 281–300. doi: 10.1007/s11027-018-9812-1
Pandey L, Burks C, Gómez Londoño L, et al. (2022) First Report of Tar Spot on Corn caused by Phyllachora maydis in Georgia, USA. Plant Dis. doi: 10.1094/PDIS-11-21-2456-PDN
Parbery DG (1967) Studies on graminicolous species of Phyllachora Nke. in Fckl. V. A taxonomic monograph. Aust. J. Bot. 15: 271-375. doi: 10.1071/BT9670271
Parbery DG (1971) Studies on graminicolous species of Phyllachora Nke. in Fckl. VI. Additions and corrections to part V. Aust. J. Bot. 19: 207-235. doi: 10.1071/BT9710207
Pereyda-Hernández J, Hernández-Morales J, Sandoval-Islas JS (2009) Etiología y manejo de la mancha de asfalto (Phyllachora maydis Maubl.) del maíz en Guerrero, México. Agrociencia 43: 511-519.
Quiroga-Madrigal RR, Garrido-Ramírez ER, Rosales Esquinca MA, Salazar-Pinacho WM (2017) Manual técnico: Manejo integrado del complejo mancha de asfalto del maíz en México. Universidad Autónoma de Chiapas. Tuxtla Gutiérrez, Chiapas, México. 39 p.
Ríos-Herrera E, Partida-Martínez L, Ochoa-Fuentes Y, et al. (2016) First Report on the Presence of Phyllachora sp. in Corn Crops at Toluca, Estado de Mexico. American Journal of Plant Sciences, 7, 733-739. doi: 10.4236/ajps.2016.75067
Rocco da Silva C, Check J, MacCready JS, et al. (2021) Recovery Plan for Tar Spot of Corn, Caused by Phyllachora maydis. Plant Health Progress 22: 596-616. doi: 10.1094/PHP-04-21-0074-RP
Rogers A, Jaiswal N, Roggenkamp E, et al. (2024) Genome-informed trophic classification and functional characterization of virulence proteins from the maize tar spot pathogen Phyllachora maydis. bioRxiv 2024.01.22.576543; doi: 10.1101/2024.01.22.576543
Ross TJ, Allen T, Sujoung S, et al. (2023) Investigations into economic returns resulting from foliar fungicides and application timing on management of tar spot in Indiana hybrid corn. Plant Disease. doi: 10.1094/PDIS-05-23-0932-RE
Ross TJ, Jumbam B, Bonkowski J, et al. (2023) Small but significant genetic differentiation among populations of Phyllachora maydis in the midwestern United States revealed by microsatellite (SSR) markers. bioRxiv 2023.10.31.563566; doi: 10.1101/2023.10.31.563566
Solórzano JE, Cruz CD, Arenz BE, et al. (2023) Tar Spot of Corn: A Diagnostic and Methods Guide. Plant Health Progress. doi: 10.1094/PHP-04-22-0033-DG
Telenko DEP, Chilvers MI, Kleczewski N, et al. (2019) How tar spot of corn impacted hybrid yields during the 2018 Midwest epidemic. Crop Protection Network. doi: 10.31274/cpn-20190729-002
Telenko DEP, Ross TJ, Shim S, et al. (2020) Draft Genome Sequence Resource for Phyllachora maydis-An Obligate Pathogen That Causes Tar Spot of Corn with Recent Economic Impacts in the United States. Mol Plant Microbe Interact. 33(7): 884-887. doi: 10.1094/MPMI-03-20-0075-A
Telenko DEP, Chilvers MI, Byrne A, et al. (2022) Fungicide efficacy on tar spot and yield of corn in the Midwestern United States. Plant Health Progress 23: 342-344. doi: 10.1094/PHP-10-21-0125-RS
Valle-Torres J, Ross TJ, Plewa D, et al. (2020) Tar Spot: An Understudied Disease Threatening Corn Production in the Americas. Plant Disease 104(10): 2541-2550. doi: 10.1094/PDIS-02-20-0449-FE
, , , et al. (2023) Uncovering the Environmental Conditions Required for Phyllachora maydis Infection and Tar Spot Development on Corn in the United States for Use as Predictive Models for Future Epidemics. bioRxiv 2023.03.18.533264; doi: 10.1101/2023.03.18.533264
Wise KA, Telenko DEP, Shim S, et al. (2023) First report of tar spot on corn caused by Phyllachora maydis in Kentucky. Plant Disease. doi: 10.1094/PDIS-01-23-0172-PDN