.
.
Condición fitosanitaria (por patógeno):
Presentes: Phaeomoniella chlamydospora, Botryosphaeria dothidea, Lasiodiplodia theobromae, Eutypa leptoplaca, Eutypella microtheca
Presente solo en algunas áreas del país: Diplodia seriata, Diatrypella favacea
Ausentes: Phaeoacremonium tuscanicum, Fomitiporia mediterranea, Neofusicoccum parvum
Grupo de cultivos: Frutales
Especie hospedante: Vid (Vitis vinifera L.)
Rango de hospedantes: amplio. Muchas especies de Phaeoacremonium tienen una amplia gama de hospedantes. Se necesitan estudios más intensivos sobre la flora nativa y los viñedos.
Epidemiología: es considerada una enfermedad poliética
Etiología: complejo de patógenos
Agentes causales: uno o varios hongos que habitan en el xilema. Las tres enfermedades principales causantes de GTD son:
.
* ESCA = complejo de enfermedad que comprende varios síndromes.
Phaeomoniella chlamydospora (W. Gams, Crous, M.J. Wingfield and L. Mugnai) P.W. Crous and W. Gams
Phaeoacremonium spp.
Fomitiporia mediterranea M. Fisch., 2002
.
* Muerte regresiva (dieback) por Botryosphaeria: es una enfermedad de distribución mundial asociada a Botryosphaeria dothidea (Moug. ex Fr.) Ces. & De Not., 1863, Diplodia seriata De Notaris, 1845 , Neofusicoccum parvum (Pennycook & Samuels) Crous, Slippers & A.J.L. Phillips 2006, y Lasiodiplodia theobromae (Pat.) Griffon & Maubl., 1909 entre otras varias especies de Botryosphaeriaceae.
.
* Muerte regresiva (dieback) por Eutypa: es causada principalmente por la especie Eutypa lata (Pers.) Tul. & C. Tul. 1863, que infecta las heridas de la poda de la vid, aunque otros microorganismos como Eutypa leptoplaca, Cryptovalsa ampelina, Diatrypella sp. o Eutypella spp. también fueron observados en plantas afectadas por la muerte regresiva de Eutypa (Gubler et al., 2005)
.
.
Taxonomía:
Fungi > Dikarya > Ascomycota > Pezizomycotina > Eurotiomycetes > Phaeomoniellales > Phaeomoniellaceae > Phaeomoniella
.
Fungi > Dikarya > Ascomycota > Pezizomycotina > Sordariomycetes > Sordariomycetidae > Togniniales > Togniniaceae > Phaeoacremonium
.
Fungi > Dikarya > Basidiomycota > Agaricomycotina > Agaricomycetes > Agaricomycetes incertae sedis > Hymenochaetales > Hymenochaetaceae > Fomitiporia
.
Fungi > Dikarya > Ascomycota > Pezizomycotina > Dothideomycetes > Dothideomycetes incertae sedis > Botryosphaeriales > Botryosphaeriaceae > Botryosphaeria
.
Fungi > Dikarya > Ascomycota > Pezizomycotina > Dothideomycetes > Dothideomycetes incertae sedis > Botryosphaeriales > Botryosphaeriaceae > Diplodia
.
Fungi > Dikarya > Ascomycota > Pezizomycotina > Dothideomycetes > Dothideomycetes incertae sedis > Botryosphaeriales > Botryosphaeriaceae > Neofusicoccum
.
Fungi > Dikarya > Ascomycota > Pezizomycotina > Dothideomycetes > Dothideomycetes incertae sedis > Botryosphaeriales > Botryosphaeriaceae > Lasiodiplodia
.
Fungi > Dikarya > Ascomycota > Pezizomycotina > Sordariomycetes > Xylariomycetidae > Xylariales > Diatrypaceae > Eutypa
.
Fungi > Dikarya > Ascomycota > Pezizomycotina > Sordariomycetes > Xylariomycetidae > Xylariales > Diatrypaceae > Cryptovalsa
.
Fungi > Dikarya > Ascomycota > Pezizomycotina > Sordariomycetes > Xylariomycetidae > Xylariales > Diatrypaceae > Diatrypella
.
Fungi > Dikarya > Ascomycota > Pezizomycotina > Sordariomycetes > Xylariomycetidae > Xylariales > Diatrypaceae > Eutypella
.
Fungi > Dikarya > Ascomycota > Pezizomycotina > Sordariomycetes > Hypocreomycetidae > Hypocreales > Nectriaceae > Cylindrocarpon
.
Fungi > Dikarya > Ascomycota > Pezizomycotina > Sordariomycetes > Sordariomycetidae > Diaporthales > Diaporthaceae > Diaporthe (Phomopsis)
.
.
.
.
.
Antecedentes
Las enfermedades del tronco de la vid (GTD, del Inglés Grapevine trunk diseases) son las enfermedades más destructivas de los viñedos en todo el mundo (Ouadi et al., 2019). Durante las últimas dos décadas, las GTD se han convertido en un problema importante para la industria del vino. Considerando una reposición del 1% de las plantas por año, se estima que la reposición de las plantas muertas por las GTDs es superior a los 1.500 millones de dólares (Hofstetter et al., 2012). El impacto de las GTD es proporcional a la edad del viñedo y los síntomas más graves aparecen en los viñedos más viejos (Gubler et al., 2005). La severidad y el impacto de las GTD difieren entre los cultivares, aunque no hay cultivares resistentes a estas enfermedades (Gubler et al., 2005; Surico et al., 2006).
Actualmente, las GTD se distribuyen ampliamente en todo el mundo. Durante las últimas décadas, la frecuencia de los síntomas de estas enfermedades ha aumentado considerablemente en todo el mundo. Antes del 2001, cuando se permitió la aplicación de arsenito de sodio, la incidencia de GTD, a saber, enfermedad de ESCA en Portugal, Hungría, Francia y Alemania era del 20, 11, 15 y 19%, respectivamente (Mugnai et al., 1999). Actualmente, se estima que el 13% de los viñedos son improductivos en Francia (Bruez et al., 2014). En España, el 7% de las plantas infectadas con GTD en la región de Castilla y León se informa en 2006 (Martin y Cobos, 2007). En Portugal, las GTD se notificaron a principios de la década de 1990 y la incidencia de las GTD es más importante en las denominaciones Vinho Verde, Dão y Alentejo. En Italia, la enfermedad de ESCA afecta a diferentes regiones vitivinícolas como Toscana, Sicilia y La Puglia. En general, se estima que el promedio de aumento anual de la incidencia de GTD en Italia es del 4 al 5% (Mugnai et al., 1999). En California, EE. UU., se estima que el 64 y el 55% de Sauvignon Blanc y Chardonnay están infectados con muerte regresiva por Botryosphaeria, respectivamente (Gubler et al., 2005). En Columbia Británica, Canadá, se observó una baja incidencia de ESCA (0,2%) y disminución de vid jóvenes (8%) (Úrbez-Torres et al., 2014). En Chile, se observó que entre 694 muestras de madera con síntomas de GTD, recolectadas en 67 regiones de viñedos, las especies de P. chlamydospora (85%) y Botryosphaeriaceae (56%), a saber, D. seriata, fueron los microorganismos más frecuentemente aislados (Díaz et al., 2013). Asimismo, las especies de uva de mesa Botryosphaeriaceae fueron las más observadas y la incidencia de la enfermedad varió entre 22 y 69% según la edad de la vid (11 a 20 años, respectivamente) (Morales et al., 2012). En Nueva Zelanda, se estimó que en 43 viñedos distribuidos en seis regiones vinícolas, el 88% estaban infectadas con las especies de Botryosphaeriaceae N. luteum y N. parvum fueron los microorganismos más prevalentes (Baskarathevan et al., 2012). Finalmente, en China, un país emergente de producción de vino, los viñedos se ven muy afectados especialmente por la muerte regresiva de Botryosphaeria (Yan et al., 2013).
Se ha sugerido que la diseminación reciente y sustancial de las GTD alrededor de los viñedos se debe a cambios en las prácticas culturales, como la reducción del cuidado sanitario del material de propagación de la vid y la mala protección de las heridas de poda (Graniti et al., 2000; Almeida, 2007). Se sabe que otros factores como el clima, la temperatura y los períodos de lluvia (humedad) y la edad de la vid aumentan la susceptibilidad de la vid a la infección por GTD. Además, los suelos fértiles, la fertilización intensa, el portainjerto vigoroso, el cultivar de vid y las condiciones de fisiología de la planta influyen en la diseminación de las GTD (Graniti et al., 2000; Surico et al., 2004; Surico et al., 2006). Además, el único tratamiento disponible para controlar las GTD anteriormente se basaba en la aplicación de arsenito de sodio. Pero debido a su considerable toxicidad y también porque se considera carcinógeno, este compuesto fue prohibido en 2001 (Almeida, 2007; Larignon et al., 2009). Se observó un aumento de los síntomas foliares en plantas tratadas con bioactivadores o bioestimulantes, y probablemente se debió a un aumento en el proceso fisiológico de la planta, como resultado de lo cual las toxinas fúngicas podrían trasladarse más fácilmente a la hoja (Calzarano et al., 2007; Di Marco y Osti, 2009). Se ha identificado una variedad de metabolitos biosintetizados por estos hongos patógenos en la muerte regresiva de eutypa (Renaud et al., 1989; Tey-Rulh et al., 1991; Andolfi et al., 2011), esca (Evidente et al., 2000; Tabacchi et al., 2000; Abou-Mansour et al., 2004; Bruno et al., 2007) y la muerte regresiva por botryosphaeria (Martos et al., 2008; Djoukeng et al., 2009; Evidente et al., 2010).
A la inversa, los tratamientos con fosetil Al provocaron una disminución de la expresión de los síntomas foliares correlacionados con una disminución de la fotosíntesis y la transpiración foliar (Di Marco et al., 2011). Sin embargo, actualmente no existen tratamientos disponibles para el control de las GTD.
.
Síntomas
Las GTD se caracterizan por la presencia de diferentes especies de un patógeno principal o un complejo de patógenos causales que crecen dentro de la madera, causando decoloración y descomposición de la madera (Bertsch et al., 2013; Bruez et al., 2014; Luque et al. 2014). Las tres principales GTD son la enfermedad de ESCA, la muerte regresiva por Botryosphaeria y la muerte regresiva por Eutypa, que normalmente atacan los órganos perennes, en todas las etapas del crecimiento de la vid. La infección puede ocurrir en el material de propagación o a través de heridas de poda, causar síntomas en tejidos leñosos, en hojas y bayas; en varios casos conduciendo a la muerte de la vid (Larignon et al., 2009; Bruez et al., 2014). Estas tres enfermedades, descritas ya a finales del siglo XIX, atacan principalmente a los órganos perennes de la vid (Vitis vinifera), provocando síntomas de hojas y bayas y la muerte. Por lo general, los síntomas aparecen normalmente en vides de al menos 7 años, aunque también son posibles los síntomas en vides más jóvenes, como ocurre en la ESCA joven (enfermedad de Petri) o en el declive de la vid joven (Bruez et al., 2014).
.
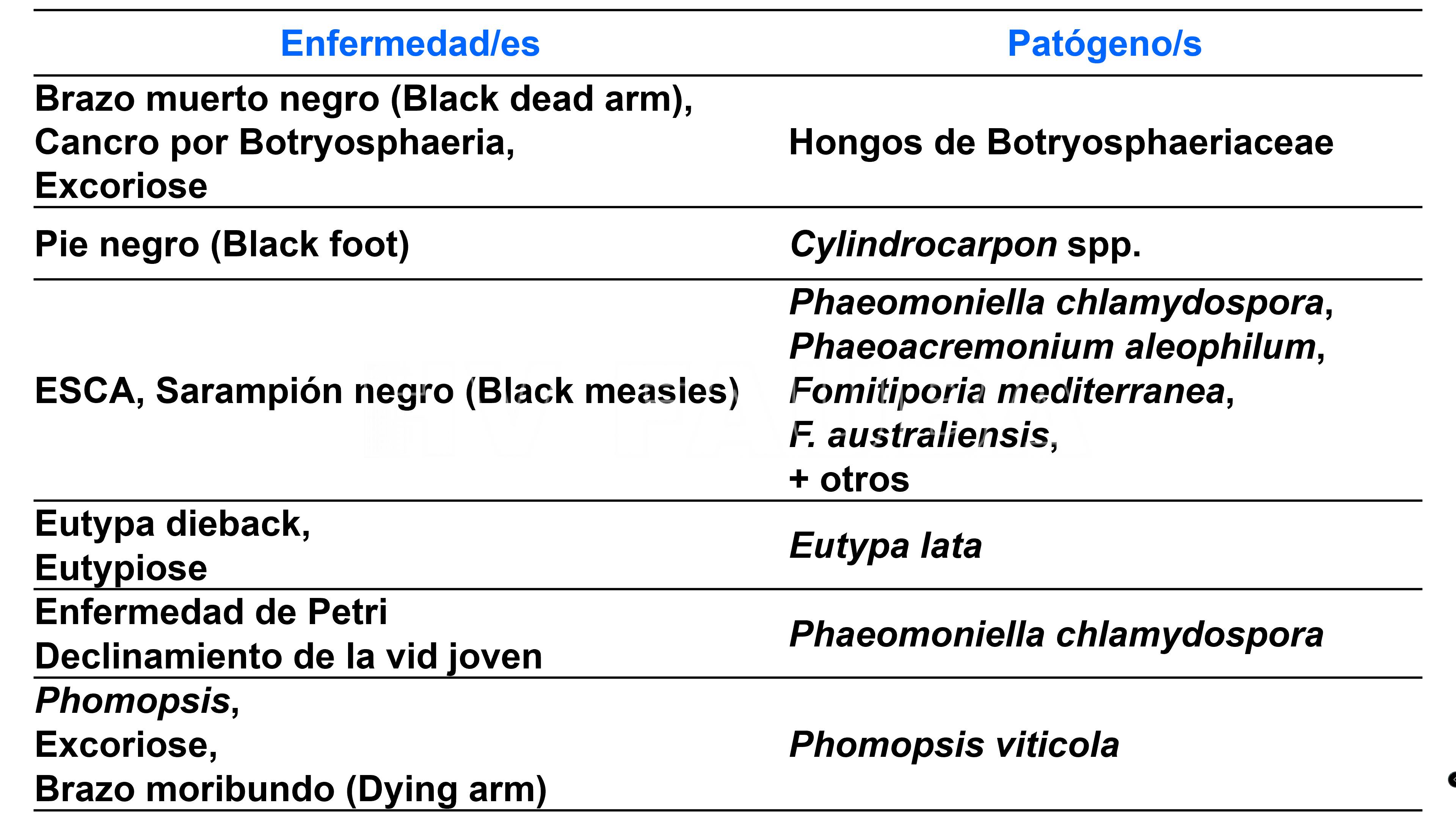
Resumen de las enfermedades y síntomas del Decaimiento de la Vid
.
- Resumen actualizado de las enfermedades del complejo GTD y sus agentes causales. Fuente: International Council on Grapevine Trunk Diseases
.
.
.
Sintomatología de las principales enfermedades del tronco de la vid (GTD) que ocurren en viñedos adultos. Las diferentes enfermedades incluidas en el complejo ESCA tienen diferentes síntomas pero algunos síntomas de la madera en común. En el viñedo, la enfermedad de la raya de la hoja de la vid (GLSD) o los síntomas propios de ESCA son visibles en verano y toda la vid puede mostrar: (A) síntomas de la raya de la hoja; (A’) marchitamiento repentino de toda la planta o parte de la planta, es decir, síntomas de apoplejía, un síntoma inespecífico pero frecuente en viñedos más viejos. (B) Un detalle del patrón típico de rayas de tigre de hojas sintomáticas. Los síntomas externos de GLSD también pueden incluir puntos negros diminutos llamados «sarampión negro» en las bayas (C). La madera de las vides afectadas por GLSD muestra manchas negras, vetas vasculares, decoloración, necrosis y, especialmente en las vides de más de 8 años, también puede mostrar pudrición blanca (dando el síndrome completo de ESCA apropiado que incluye todos los síntomas de la madera y el follaje asociados con el complejo ESCA) (D). Los primeros síntomas de muerte regresiva por <i>Botryosphaeria</i> (a menudo confundidos con los de “brazo muerto negro” [BDA] por <i>Diplodia mutila</i>, y sinónimo de cancro <i>Botryosphaeria</i>) son visibles desde el brote en primavera y consisten en espuelas / brotes muertos y en un crecimiento retardado o atrofiado (E). También puede aparecer en una forma severa similar a la apoplejía de ESCA. Los síntomas foliares, cuando están presentes, pueden ser similares a la clorosis o al ESCA (F). Los hongos Botryosphaeriaceous podrían determinar también la pudrición del racimo en las uvas (G). La madera de las plantas infectadas con <i>Botryosphaeria</i> muestra la presencia de sectores necróticos marrones, típicamente en forma de arco y necrosis sectorial, en forma de cuña (H). Los síntomas externos de la muerte regresiva por <i>Eutypa</i> (antes Eutypiose) aparecen temprano en la temporada vegetativa, con brotes atrofiados con entrenudos acortados (formando síntomas de escoba de bruja) (I). Las hojas son pequeñas, cloróticas, ahuecadas y deformadas (J); las uvas de las cañas afectadas no se forman en absoluto o son pequeñas, poco desarrolladas y desordenadas (K). La madera interna de las vides infectadas con Eutypa muestra sectores necróticos grisáceos en forma de cuña, indistinguibles de los cancros de muerte regresiva de Botryosphaeria (L). La presencia simultánea de patógenos de diferentes GTD en la misma vid puede resultar en síntomas superpuestos. Autor: Mondello et al., 2018.
.
.
* ESCA
La ESCA es una enfermedad compleja, que involucra varios factores bióticos (hongos patógenos) y factores abióticos posiblemente asociados con prácticas culturales (Lecomte et al., 2012; Travadon et al., 2016; Lecomte et al., 2018). Se trata de una enfermedad que causa marchitez vascular cuando los órganos perennes de la vid son atacados, produciendo una extensa necrosis de la madera en el tronco y cordón a través del desarrollo lento y sistémico de hongos patógenos. La enfermedad causa varios síndromes, entre los que la «ESCA» y la «enfermedad de la raya de la hoja de la vid» (GLSD, del Inglés grapevine leaf stripe disease) son los más extendidos en los viñedos.
El nombre de la enfermedad «ESCA» deriva del latín «tinder» (= yesca). A principios de 1900, los viticultores del sur de Italia usaban el término ‘ESCA’ para referirse a la apoplejía (Surico, 2009), probablemente debido a la presencia de madera del tronco podrida que se observa principalmente en plantas apopléjicas, que de hecho se usaba como yesca. La asociación de apoplejía y/o tronco podrido con determinadas decoloraciones foliares llevó, con el tiempo, al uso de ‘ESCA’ para este último, incluso en ausencia de apoplejía y/o tronco podrido. Aunque los resultados de muchos estudios de investigación han llevado a que ESCA se defina como un complejo de enfermedades (complejo de enfermedad de ESCA), el término «ESCA» todavía se utiliza comúnmente para referirse a la mayoría de las enfermedades que forman el complejo. La caracterización de las enfermedades del tronco de la vid (GTD) es fundamental, no solo para estudiar sus propiedades fitotóxicas, sino también porque su detección en la vid representa una herramienta útil para el diagnóstico precoz de las enfermedades del tronco (Fleurat-Lessard et al., 2010).
La ESCA es causada por Phaeomoniella chlamydospora, Phaeoacremonium minimal, Fomitiporia mediterranea y especies de Botryosphaeriaceae (Crous et al., 1996; Larignon y Dubos, 1997; Fischer, 2006; Mostert et al., 2006; Pouzoulet et al., 2013).
GLSD es un síndrome traqueomicótico causado principalmente por Phaeomoniella chlamydospora y varias especies de Phaeoacremonium. Los síntomas de GLSD ocurren tanto en los tejidos leñosos del tronco y las ramas, como en las hojas y las bayas. Los síntomas de la madera más comunes (observables en cepas madre, esquejes enraizados o en el tronco y las ramas de las enredaderas en pie) comprenden varias formas de decoloración, entre las que se encuentran rayas negras de la madera que involucran uno o varios vasos del xilema y áreas con necrosis oscura o marrón que circunscriben la médula, que son los observados con mayor frecuencia; o rayas marrones longitudinales del xilema debajo de la corteza (Larignon y Dubos, 2001; Lecomte et al., 2012). Los síntomas externos de GLSD se caracterizan por manchas que aparecen entre las nervaduras a lo largo de los bordes de las hojas, y estas se expanden y confluyen para finalmente dar como resultado franjas anaranjadas cloróticas o rojas y necróticas, con solo una franja verde angosta a lo largo de la nervadura central.
El término «ESCA» se refiere comúnmente a la pudrición blanca que se produce en el tronco y las ramas de las enredaderas maduras en pie y que es causada por Fomitiporia mediterranea y/u otros basidiomicetes. ‘ESCA propiamente dicha’, que se encuentra generalmente en viñedos maduros, indica la coexistencia de GLSD y ESCA en la misma vid (Surico, 2009; Bertsch et al., 2013). La «apoplejía», que consiste en el marchitamiento repentino parcial o completo de la copa, ocurre principalmente en plantas afectadas por GLSD y/o ESCA propiamente dicha (Surico et al., 2008; Letousey et al., 2010). La propagación de la enfermedad se produce por la dispersión de esporas por el viento y la lluvia. Las variedades varían en susceptibilidad: Tempranillo, también conocido como Tinta Roriz o Aragonez, es muy susceptible a ambos tipos de enfermedad de ESCA (Almeida, 2007). Otros cultivares de uva como Cabernet Sauvignon, Thompson Seedless, Sauvignon blanc, Mourvèdre, Ugni blanc, Cinsault o Trousseau son más susceptibles a la ESCA propiamente dicha en comparación con Merlot, Pinot Noir, Carignan o Roussane (Marchi et al., 2001; Feliciano et al., 2004; Larignon et al., 2009; Lorrain et al., 2012).
En los viveros de vid, estos hongos pueden ser patógenos eficientes que tienen la capacidad de sobrevivir en el suelo (Pouzoulet et al., 2013).
.
.
- Síntomas de la enfermedad de ESCA en vid. (A, B) necrosis y clorosis “tipo tigre” en las hojas. (C) apoplejía, caracterizada por la muerte regresiva de uno o más brotes. (D) manchado en bayas de uva. (E, F) sección transversal del tronco que muestra podredumbre blanca (E) y vetas negras de la madera (F). Autores de las imágenes (A) Fontaine Florence y el resto Philippe Larignon, IFV. Publicado en Fontaine et al., 2016.
- Síntomas de ESCA observados en un viñedo de 14 años de Vitis vinifera cv. Italia en el sur de Italia: patrón de ‘rayas de tigre’ (A), sustancia viscosa negra (B), podredumbre blanca con vetas de madera marrón adyacentes (C), sarampión negro (D), agrietamiento del tronco en conexión con un sector de madera en descomposición (E) y núcleos de madera tomados con un taladro Pressler del tronco a 30 y 110 cm sobre el suelo (F – H): vides sanas (F), vides enfermas con vetas de madera marrón (G), enredaderas enfermas con vetas de madera marrón y podredumbre blanca (H). Autor: Bruno et al., 2007.
.
.
* Muerte regresiva (dieback) por Botryosphaeria
La muerte regresiva de Botryosphaeria es causada por varias especies de Botryosphaeriaceae, siendo las más comúnmente aisladas Botryosphaeria dothidea, Diplodia seriata, Diplodia mutila, Neofusicoccum parvum o Lasiodiplodia theobromae (Úrbez-Torres, 2011). La muerte regresiva por Botryosphaeria se distribuye ampliamente y se describió en Australia, Brasil, Chile, Egipto, Francia, India, Italia, Líbano, México, Portugal, Sudáfrica, España y Estados Unidos de América (Gubler et al.2005; Úrbez-Torres 2011). Los agentes de muerte regresiva de Botryosphaeria se consideran agentes causales de los cancros del tronco y el declinamiento de la vid. Los síntomas de la enfermedad en la madera consisten en vetas marrones de la madera, lesiones necróticas internas de la madera, decoloración de la madera (“franja marrón”) en el xilema externo y cancros perennes. Los síntomas externos consisten en necrosis de las yemas o su mortalidad, manchas foliares, brazos muertos, muerte regresiva de los brotes y pudrición del racimo (Dubos et al., 2001; Niekerk et al., 2004; Úrbez-Torres, 2011; Spagnolo et al., 2014). La propagación de la enfermedad se produce con la liberación de esporas en la temporada de crecimiento, que se propagan por la lluvia y el viento. Se describe que las variedades de uva como Cabernet Sauvignon, Cabernet Franc o Sauvignon Blanc son susceptibles a la muerte regresiva por Botryosphaeria, mientras que Merlot es menos susceptible (Larignon et al., 2009).
.
.
- Síntomas de la enfermedad de la muerte regresiva por Botryosphaeria en la vid. (A, B) manchas anaranjadas típicas en los márgenes de la hoja. (C) sección transversal del tronco que muestra un cancro gris en forma de cuña. (D) franja marrón debajo de la corteza, que también se puede observar en la enfermedad de ESCA. (E) sección transversal del tronco con rayas marrones. El autor de las imágenes es Philippe Larignon, IFV. Publicado en Fontaine et al., 2016.
.
.
* Muerte regresiva (dieback) por Eutypa
La muerte regresiva o eutipiosis es causada principalmente por la especie Eutypa lata que infecta las heridas de la poda de la vid, aunque otros microorganismos como Eutypa leptoplaca, Cryptovalsa ampelina, Diatrypella sp. o Eutypella spp. también se observaron en plantas afectadas por la muerte regresiva de Eutypa (Gubler et al. 2005). La propagación de la infección ocurre con la liberación de ascosporas por episodios de lluvia y viento, en primavera (Leavitt, 1991). Los síntomas de la muerte regresiva de Eutypa en las heridas incluyen un cancro necrótico en la madera que comienza en la herida y se mueve a través de la rama (Gubler et al. 2005; Almeida, 2007). También se observa un crecimiento atrofiado y débil de los brotes y las hojas son pequeñas, cloróticas y con necrosis marginal (Leavitt 1991). La evolución de la enfermedad puede llevar a la muerte de la planta en 3 a 5 años después de la visualización de los primeros síntomas (Almeida, 2007). Existen diferencias en la susceptibilidad varietal, las variedades como Cabernet Sauvignon, Chasselas, Chenin, Cinsaur, Mauzac, Muscadelle, Négrette, Sauvignon o Ugni blanc son muy sensibles y Alicante Bouschet, Chardonnay, Gewürztraminer y Jurançon son susceptibles. Otras como Cabernet franc, Carignane, Colombard, Duras, Gamay, Malbec, Mourvèdre, Pinot Meunier y Portugais bleu son moderadamente susceptibles y Aligoté, Merlot, Sémillon, Sylvaner, Grolleau o Petit Verdot son tolerantes a las enfermedades (Bertsch et al., 2013).
.
.
- Síntomas de la enfermedad de la muerte regresiva de Eutypa en la vid. (A, B) brotes y hojas atrofiados característicos de los síntomas foliares de muerte regresiva de Eutypa. (C) sección transversal de madera que muestra una cuña de tejido descolorido. El autor de las imágenes es Philippe Larignon, IFV. Publicado en Fontaine et al., 2016.
.
Los principales efectos fisiológicos reportados se refieren al metabolismo de los carbohidratos y las respuestas de defensa en los diferentes órganos de la vid. En el tronco, el agotamiento de las reservas de almidón en los tejidos leñosos se asocia con la colonización por hongos; en las hojas, donde los patógenos no están presentes, el metabolismo de los carbohidratos también se ve afectado, como lo revela una disminución de la tasa fotosintética. Una consecuencia de estas alteraciones es una menor reserva de carbono que podría contribuir a una disminución del desarrollo y el vigor de la planta durante el año siguiente. Otras actividades metabólicas, como el metabolismo de lípidos y aminoácidos, están reguladas negativamente. La perturbación de estos metabolismos primarios se asocia a menudo con la inducción de respuestas de defensa. El desarrollo de barreras bioquímicas resultantes de la acumulación tanto de tilosis como de gomosis se observa durante la infección de la madera provocando el bloqueo de los vasos del xilema y limitando así la invasión fúngica. Su progresión en la madera también se ve inhibida por la formación de zonas de reacción ricas en polifenoles y por la acumulación de proteínas relacionadas con la patogénesis, y el estallido oxidativo y la producción de especies reactivas de oxígeno. Además, intervienen procesos de desintoxicación de la vid; esta reacción podría estar relacionada con la producción de compuestos extracelulares por agentes GTD, algunos de los cuales son fitotóxicos (Abou-Mansour et al., 2015). Como consecuencia, la calidad sensorial de las bayas y probablemente el vino elaborado a partir de estas bayas disminuye (Fontaine et al., 2016).
.
.
Diagnóstico de la enfermedad
El diagnóstico temprano de las GTD es bastante difícil debido a la falta de síntomas externos de la planta, como en hojas o bayas, o de otra manera debido a la complejidad de los síntomas. En algunos casos es posible observar síntomas de más de una de las GTD en la misma planta o confundir síntomas con diferentes GTD. Además, los síntomas y la virulencia de algunas enfermedades, como la muerte regresiva por Botryosphaeria, podrían diferir entre países o incluso en diferentes regiones del mismo país (Niekerk et al., 2004; Úrbez-Torres, 2011). El diagnóstico de la enfermedad también es difícil debido a un período de latencia antes de la aparición de los síntomas después de la infección de los patógenos (Larignon et al., 2009). Bruez et al. (2014) al analizar la comunidad microbiana presente en tejidos de madera de Cabernet Sauvignon con cepas de 10 años, no encontraron diferencias significativas entre los síntomas de la enfermedad ESCA foliar de plantas asintomáticas y sintomáticas.
.
.
Manejo Integrado
Actualmente no existen tratamientos disponibles para el control de las GTD y la prevención actual se basa en la aplicación de medidas profilácticas que incluyen la renovación del tronco y la cirugía rejuvenecedora. Se requiere urgentemente el desarrollo de nuevas estrategias sostenibles para la gestión de viñedos.
* La severidad y el impacto de las GTD difieren entre los cultivares, aunque no hay cultivares resistentes a estas enfermedades (Gubler et al., 2005; Surico et al., 2006). No se conocen taxa de vid, ya sean cultivados o silvestres, que sean resistentes a las GTD (Surico et al., 2006; Wagschal et al., 2008; Larignon et al., 2009).
* Los fungicidas (como el arsenito de sodio o la 8-hidroxiquinolina, utilizados para combatir la ESCA) con potencial para controlar la GTD han sido prohibidos en Europa y no existen tratamientos altamente efectivos disponibles.
* Tratamiento de agua caliente del material de propagación vegetativo
* Control biológico: en viveros, la incidencia de P. chlamydospora y Phaeacremonium spp. en esquejes de portainjertos se redujo al remojar el material de plantación en formulaciones de Trichoderma spp. (Di Marco et al., 2004; Fourie y Halleen, 2004, 2006; Mounier et al., 2014; Halleen y Fourie, 2016; Pertot et al., 2016).
* Camas de propagación de vivero: Rotación de cultivos en viveros.
* Aplicación de diferentes productos, como por ej. cobre y protectores (Reis et al., 2021), fungicidas y controladores biológicos (ej. Trichoderma) (Martinez-Diz et al., 2021) (Carro-Huerga et al., 2021), sobre las heridas de poda
.
.
.
.
International Council on Grapevine Trunk Diseases (ICGTD)
International Workshops on GTD (1999-2019) – Abstracts
.
Video
Enfermedades del tronco de la vid
.
.
Bibliografía
Abou-Mansour E, Couché E, Tabacchi R (2004) Do fungal naphthalenones have a role in the development of esca symptoms? Phytopathologia Mediterranea 43: 75–82. doi: 10.14601/Phytopathol_Mediterr-1728
Abou-Mansour E, Débieux J-L, Ramírez-Suero M, et al. (2015) Phytotoxic metabolites from Neofusicoccum parvum, a pathogen of Botryosphaeria dieback of grapevine. Phytochemistry. doi: 10.1016/j.phytochem.2015.01.012
Abreo E, Martinez S, Bettucci L, Lupo S (2011) Phaeomoniella chlamydospora and Phaeoacremonium spp. in grapevines from Uruguay. Phytopathologia Mediterranea 50(4): 77-85. doi: 10.14601/Phytopathol_Mediterr-8682
Albetis J, Jacquin A, Goulard M, et al. (2019) On the Potentiality of UAV Multispectral Imagery to Detect Flavescence dorée and Grapevine Trunk Diseases. Remote Sensing. 11(1): 23. doi: 10.3390/rs11010023
Almeida F (2007) Technical note 2 – “grapevine wood diseases—eutypa dieback and esca”. ADVID Technical Notes, 1–14.
Andolfi L, Mugnai L, Luque J, et al. (2011) Phytotoxins produced by fungi associated with grapevine trunk diseases. Toxins: 1569–1605. doi: 10.3390/toxins3121569
Baskarathevan J, Jaspers MV, Jones EE, Ridgway HJ (2012) Incidence and distribution of botryosphaeriaceous species in New Zealand vineyards. European Journal of Plant Pathology, 132(4): 549–560. doi: 10.1007/s10658-011-9900-5
Baumgartner K, Hillis V, Lubell M, et al. (2019) Restricted accessManaging Grapevine Trunk Diseases in California’s Southern San Joaquin Valley. Am J Enol Vitic. 70: 267-276. doi: 10.5344/ajev.2019.18075
Bertsch C, Ramirez-Suero M, Magnin-Robert M, et al. (2013) Grapevine trunk diseases: complex and still poorly understood. Plant Pathology 62(2): 243–265. doi: 10.1111/j.1365-3059.2012.02674.x
Brown AA, Travadon R, Lawrence DP, et al. (2021) Pruning-wound protectants for trunk-disease management in California table grapes. Crop Protection 141: 105490. doi: 10.1016/j.cropro.2020.105490
Bruez E, Vallance J, Gerbore J, et al. (2014) Analyses of the temporal dynamics of fungal communities colonizing the healthy wood tissues of esca leaf-symptomatic and asymptomatic vines. Plos One 9(5). doi: 10.1371/journal.pone.0095928
Bruno G, Sparapano L, Graniti A (2007) Effects of three esca-associated fungi on Vitis vinifera L.: IV. Diffusion through the xylem of metabolites produced by two tracheiphilous fungi in the woody tissue of grapevine leads to esca-like symptoms on leaves and berries. Physiological Molecular and Plant Pathology 71: 106–24. doi: 10.1016/j.pmpp.2007.12.004
Calzarano F, Amalfitano C, Seghetti L, D’Agostino V (2007) Foliar treatment of esca-proper affected vines with nutrients and bioactivators. Phytopathologia Mediterranea 44: 207–217. doi: 10.14601/Phytopathol_Mediterr-2152
Carro-Huerga G, Mayo-Prieto S, Rodríguez-González Á, et al. (2021) The Influence of Temperature on the Growth, Sporulation, Colonization, and Survival of Trichoderma spp. in Grapevine Pruning Wounds. Agronomy 11(9): 1771. doi: 10.3390/agronomy11091771
Cimmino A, Bahmani Z, Masi M, et al. (2021) Phytotoxins produced by Didymella glomerata and Truncatella angustata, associated with grapevine trunk diseases (GTDs) in Iran. Nat Prod Res. 20: 1-8. doi: 10.1080/14786419.2021.1979544
Cimmino A, Bahmani Z, Castaldi S, et al. (2021) Phenazine-1-Carboxylic Acid (PCA), Produced for the First Time as an Antifungal Metabolite by Truncatella angustata, a Causal Agent of Grapevine Trunk Diseases (GTDs) in Iran. J Agric Food Chem. 69(41): 12143-12147. doi: 10.1021/acs.jafc.1c03877
Crous PW, Gams W, Wingfield MJ, van Wyk PS. Phaeoacremonium gen. nov. associated with wilt and decline diseases of woody hosts and human infections. Mycologia. 1996; 88(5): 786–796. doi: 10.2307/3760973
Del Frari G, Gobbi A, Aggerbeck MR, et al. (2019) Characterization of the Wood Mycobiome of Vitis vinifera in a Vineyard Affected by Esca. Spatial Distribution of Fungal Communities and Their Putative Relation With Leaf Symptoms. Front. Plant Sci. 10: 910. doi: 10.3389/fpls.2019.00910
Del Frari G, Oliveira H, Boavida Ferreira R (2021) White Rot Fungi (Hymenochaetales) and Esca of Grapevine: Insights from Recent Microbiome Studies. Journal of Fungi 7(9): 770. doi: 10.3390/jof7090770
Dewasme C, Mary S, Darrieutort G, et al. (2022) Long-Term Esca Monitoring Reveals Disease Impacts on Fruit Yield and Wine Quality. Plant Dis. 106(12): 3076-3082. doi: 10.1094/PDIS-11-21-2454-RE
Di Marco S, Osti F, Cesari A (2004) Experiments on the control of Esca by Trichoderma. Phytopathol. Mediterr. 43: 108-115. Link
Di Marco S, Osti F (2009) Effect of biostimulant sprays on Phaeomoniella chlamysdospora and esca proper infected vines under greenhouse and field conditions. Phytopathologia Mediterranea, 48, 1150–1157. doi: 10.14601/Phytopathol_Mediterr-2874
Di Marco S, Osti F, Calzarano F, et al. (2011) Effects of grapevine applications of fosetyl-aluminium formulations for downy mildew control on “esca” and associated fungi. Phytopathologia Mediterranea 50S: S285–S299. doi: 10.14601/Phytopathol_Mediterr-9802
Diaz GA, Auger J, Besoain X, et al. (2013) Prevalence and pathogenicity of fungi associated with grapevine trunk diseases in Chilean vineyards. Ciencia e Investigacion Agraria 40(2): 327–339. Link
Djoukeng JD, Polli S, Larignon P, Abou-Mansour E (2009) Identification of phytotoxins from Botryosphaeria obtusa, a pathogen of black dead arm disease of grapevine. European Journal of Plant Pathology 124: 303–308. doi: 10.1007/s10658-008-9419-6
Dubos B, Cere L, Larignon P, Fulchic R (2001) Observation on black dead arm in French vineyards. Phytopathologia Mediterranea 40S(3): 336–342. doi: 10.14601/Phytopathol_Mediterr-1629
Edwards J, Pascoe IG (2004) Occurrence of Phaeomoniella chlamydospora and Phaeoacremonium aleophilum associated with Petri disease and esca in Australian grapevines. Australasian Plant Pathology 33: 273–279. doi: 10.1071/AP04016
Eskalen A, Feliciano AJ, Gubler WD (2007) Susceptibility of Grapevine Pruning Wounds and Symptom Development in Response to Infection by Phaeoacremonium aleophilum and Phaeomoniella chlamydospora. Plant Disease 91(9): 1100-1104. doi: 10.1094/PDIS-91-9-1100
Evidente A, Sparapano L, Andolfi A, Bruno G (2000) Two naphthalenone pentaketides from liquid cultures of Phaeoacremonium aleophilum, a fungus associated with esca of grapevine. Phytopathologia Mediterranea 39: 162–168. doi: 10.14601/Phytopathol_Mediterr-1559
Evidente A, Punzo B, Andolfi A, et al. (2010) Lipophilic phytotoxins produced by Neofusicoccum parvum, a grapevine canker agent. Phytopathologia Mediterranea 49: 74–9. doi: 10.14601/Phytopathol_Mediterr-5433
Feliciano A, Eskalen A, Gubler W (2004) Differential susceptibility of three grapevine cultivars to Phaeoacremonium aleophilum and Phaeomoniella chlamydospora in California. Phytopathologia Mediterranea 43: 66–69. doi: 10.14601/Phytopathol_Mediterr-1727
Fischer M (2006) Biodiversity and geographic distribution of basidiomycetes causing esca-associated white rot in grapevine: a worldwide perspective. Phytopathologia Mediterranea. 45(4): 30–42. doi: 10.14601/Phytopathol_Mediterr-1846
Fleurat-Lessard P, Luini E, Berjeaud JM, Roblin G (2010) Diagnosis of grapevine esca disease by immunological detection of Phaeomoniella chlamydospora. Australian Journal of Grape and Wine Research 16: 455–463. doi: 10.1111/j.1755-0238.2010.00106.x
Fontaine F, Pinto C, Vallet J, et al. (2016) The effects of grapevine trunk diseases (GTDs) on vine physiology. Eur J Plant Pathol 144: 707–721. doi: 10.1007/s10658-015-0770-0
Fourie PH, Halleen F (2004) Proactive control of Petri disease of grapevine through treatment of propagation material. Plant Disease 88: 1241-1245. doi: 10.1094/PDIS.2004.88.11.1241
Fourie PH, Halleen F (2006) Chemical and biological protection of grapevine propagation material from trunk disease pathogens. Eur. J. Plant Pathol. 116: 255-265. doi: 10.1007/s10658-006-9057-9
Graham AB, Johnston PR, Weir BS (2009) Three new Phaeoacremonium species on grapevines in New Zealand. Australasian Plant Pathology 38: 505–513. doi: 10.1071/AP09035
Gramaje D, Úrbez-Torres JR, Sosnowski MR (2018) Managing Grapevine Trunk Diseases With Respect to Etiology and Epidemiology: Current Strategies and Future Prospects. Plant Disease 102(1): 12-39. doi: 10.1094/PDIS-04-17-0512-FE
Graniti A, Surico G, Mugnai L (2000) Esca of grapevine: a disease complex or a complex diseases? Phytopathologia Mediterranea 39, 16–20. doi: 10.14601/Phytopathol_Mediterr-1539
Gubler WD, Baumgartner K, Browne GT, et al. (2004) Root diseases of grapevines in California and their control. Australasian Plant Pathology 33: 157–165. doi: 10.1071/AP04019
Gubler W, Rolshausen P, Trouillas F, et al. (2005) Grapevine trunk diseases in California. Pratical Winery and Vineyard Magazine, 6–25. Link
Halleen F, Fourie PH (2016) An integrated strategy for the proactive management of grapevine trunk disease pathogen infections in grapevine nurseries. S. Afr. J. Enol. Vitic. 37: 104-114. doi: 10.21548/37-2-825
Halleen F, Baloyi Ma, Bester Mc, Mostert L (2020) Aerial inoculum patterns of Petri disease pathogens in South African vineyards and rootstock mother blocks. Phtytopathologia Mediterranea 59: 515-536. doi: 10.14601/Phyto-11370
Hofstetter V, Buyck B, Croll D, et al. (2012) What if esca disease of grapevine were not a fungal disease? Fungal Diversity 54(1): 51–67. doi: 10.1007/s13225-012-0171-z
Ji T, Altieri V, Salotti I, et al. (2023) Role of rain in the spore dispersal of fungal pathogens associated with grapevine trunk diseases. Plant Dis. doi: 10.1094/PDIS-03-23-0403-RE
Larignon P, Dubos B (1997) Fungi associated with esca disease in grapevine. European Journal of Plant Pathology. 103(2): 147–157. doi: 10.1023/A:1008638409410
Larignon P, Fontaine F, Farine S, et al. (2009) Esca et Black Dead Arm: deux acteurs majeurs des maladies du bois chez la Vigne. Comptes Rendus Biologies 332: 765-783. doi: 10.1016/j.crvi.2009.05.005
Leavitt G (1991) Diseases. In: Grape pest management, 2nd Ed., Univ. of California IPM Manual. Flaherty, D., et al. (eds), Chapter 22, 162–172.
Lecomte P, Darrieutort G, Liminana J-M, et al. (2012) New insights into Esca of grapevine: the development of foliar symptoms and their association with xylem discoloration. Plant Disease 96(7): 924–934. doi: 10.1094/PDIS-09-11-0776-RE
Lecomte P, Diarra B, Carbonneau A, et al. (2018) Esca of grapevine and training practices in France: results of a 10-year survey. Phtytopathologia Mediterranea 57(3): 472–487. doi: 10.14601/Phytopathol_Mediterr-22025
Letousey P, Baillieul F, Perrot G, et al. (2010) Early events prior to visual symptoms in the apoplectic form of grapevine esca disease. Phytopathology 100(5): 424–431. doi: 10.1094/PHYTO-100-5-0424
Lorrain B, Ky I, Pasquier G, et al. (2012) Effect of Esca disease on the phenolic and sensory attributes of Cabernet Sauvignon grapes, musts and wines. Australian Journal of Grape and Wine Research 18(1): 64–72. doi: 10.1111/j.1755-0238.2011.00172.x
Luque J, Elena G, Garcia-Figueres F, et al. (2014) Natural infections of pruning wounds by fungal trunk pathogens in mature grapevines in Catalonia (Northeast Spain). Australian Journal of Grape and Wine Research 20(1): 134–143. doi:10.1111/ajgw.12046
Marais A, Faure C, Comont G, et al. (2021) Characterization of the Mycovirome of the Phytopathogenic Fungus, Neofusicoccum parvum. Viruses 13(3): 375. doi: 10.3390/v13030375
Marchi G, Pascoe IG, Edwards J (2001) Young esca in Australia. Phytopathologia Mediterranea 40: S303–S310. doi: 10.14601/Phytopathol_Mediterr-1646
Martin M, Cobos R (2007) Identification of fungi associated with grapevine decline in Castilla y Léon (Spain). Phytopathologia Mediterranea 46: 18–25. doi: 10.14601/Phytopathol_Mediterr-1854
Martínez-Diz MP, Díaz-Losada E, Díaz-Fernández A, et al. (2021) Protection of grapevine pruning wounds against Phaeomoniella chlamydospora and Diplodia seriata by commercial biological and chemical methods. Crop Protection 143: 105465. doi: 10.1016/j.cropro.2020.105465
Martos S, Andolfi A, Luque J, et al. (2008) Production of phytotoxic metabolites by five species of Botryosphaeriaceae causing decline on grapevines, with special interest in the species Neofusicoccum luteum and N. parvum . Eur J Plant Pathol 121: 451–461. doi: 10.1007/s10658-007-9263-0
Morales A, Latorre BA, Piontelli E, Besoain X (2012) Botryosphaeriaceae species affecting table grape vineyards in Chile and cultivar susceptibility. Ciencia e Investigacion Agraria 39(3): 445–458. doi: 10.4067/S0718-16202012000300005
Mostert L, Halleen F, Fourie P, Crous PW (2006) A review of Phaeoacremonium species involved in Petri disease and asca of grapevines. Phytopathologia Mediterranea 45(1): 1000–1018. doi: 10.14601/Phytopathol_Mediterr-1844
Molyneux RJ, Mahoney N, Bayman P, et al. (2002) Eutypa Dieback in Grapevines: Differential Production of Acetylenic Phenol Metabolites by Strains of Eutypa lata. J. Agric. Food Chem. 50: 1393–1399. doi: 10.1021/jf011215a
Mondello V, Songy A, Battiston E, et al. (2018) Grapevine Trunk Diseases: A Review of Fifteen Years of Trials for Their Control with Chemicals and Biocontrol Agents. Plant Disease 102(7): 1189-1217. doi: 10.1094/PDIS-08-17-1181-FE
Mounier E, Cortes F, Cadious M, Pajot E (2014) The benefits of Trichoderma atroviride I-1237 for the protection of grapevines against trunk diseases: from the nursery to the vineyard. Phytopathol. Mediterr. 53: 591-592.
Mugnai L, Graniti A, Surico G (1999) Esca (Black measles) and brown wood-streaking: two old and elusive diseases of grapevines. Plant Disease 83(5): 404–418. doi: 10.1094/PDIS.1999.83.5.404
Ouadi L, Bruez E, Bastien S, et al. (2019) Ecophysiological impacts of Esca, a devastating grapevine trunk disease, on Vitis vinifera L. PLoS ONE 14(9): e0222586. doi: 10.1371/journal.pone.0222586
Pacetti A, Moretti S, Pinto C, et al. (2021) Trunk Surgery as a Tool to Reduce Foliar Symptoms in Diseases of the Esca Complex and Its Influence on Vine Wood Microbiota. Journal of Fungi. 7(7): 521. doi: 10.3390/jof7070521
Perez-Gonzalez G, Sebestyen D, Petit E, et al. (2022) Oxygen Radical-Generating Metabolites Secreted by Eutypa and Esca Fungal Consortia: Understanding the Mechanisms Behind Grapevine Wood Deterioration and Pathogenesis. Front. Plant Sci. 13: 921961. doi: 10.3389/fpls.2022.921961
Pertot I, Prodorutti D, Colombini A, Pasini L (2016) Trichoderma atroviride SC1 prevents Phaeomoniella chlamydospora and Phaeoacremonium aleophilum infection of grapevine plants during the grafting process in nurseries. BioControl 61: 257-267. doi: 10.1007/s10526-016-9723-6
Pouzoulet J, Mailhac N, Couderc C, et al. (2013) A method to detect and quantify Phaeomoniella chlamydospora and Phaeoacremonium aleophilum DNA in grapevine-wood samples. Applied Microbiology Biotechnology 97(23): 10163–10175. doi: 10.1007/s00253-013-5299-6
Reis P, Magnin-Robert M, Nascimento T, et al. (2016) Reproducing Botryosphaeria Dieback Foliar Symptoms in a Simple Model System. Plant Disease 100(6): 1071-1079. doi: 10.1094/PDIS-10-15-1194-RE
Reis P, Gaspar A, Alves A, et al. (2021) Combining an HA + Cu (II) Site-Targeted Copper-Based Product with a Pruning Wound Protection Program to Prevent Infection with Lasiodiplodia spp. in Grapevine. Plants 10(11): 2376. doi: 10.3390/plants10112376
Renaud JM, Tsoupras G, Tabacchi R (1989) Biologically active natural acetylenic compounds from Eutypa lata. Helvetica Chimica Acta 72: 929–32.
Rosa M, Molina l, Pappano D, et al. (2017) Identification of the mycobiota associated with the decline of vines in Imperial Seed and Cardinal varieties in San Juan Province. XXXVI Jornadas Argentinas de Botánica. Link
Rudelle JA, Octave SA, Kaid-Harche MB, et al. (2005) Structural modifications induced by Eutypa lata in the xylem of trunk and canes of Vitis vinifera. Functional Plant Biology 32(6): 537-547. doi: 10.1071/FP05012
Spagnolo A, Larignon P, Magnin-Robert M, et al. (2014) Flowering as the Most Highly Sensitive Period of Grapevine (Vitis vinifera L. cv Mourvèdre) to the Botryosphaeria Dieback Agents Neofusicoccum parvum and Diplodia seriata Infection. International Journal of Molecular Sciences. 15(6): 9644-9669. doi: 10.3390/ijms15069644
Surico G, Bandinelli R, Braccinni P, et al. (2004) On the factors that may have influenced the esca epidemic in Tuscany in the eighties. Phytopathologia Mediterranea 43: 136–143. doi: 10.14601/Phytopathol_Mediterr-1734
Surico GML, Marchi G, Marchi G (2006) Older and more recent observations on esca: a critical review. Phytopathologia Mediterranea 45: S68–S86. doi: 10.14601/Phytopathol_Mediterr-1847
Surico G, Mugnai L, Marchi G (2008) The esca disease complex. In A. Ciancio & K. Mukerji (Eds.), Integrated management of diseases caused by fungi, phytoplama and bacteria (pp. 119–136). Dordrecht: Springer.
Surico G (2009) Towards a redefinition of the disease within the esca complex of grapevine. Phytopathologia Mediterranea 48: 5–10. doi: 10.14601/Phytopathol_Mediterr-2870
Tabacchi R, Fkeyrat A, Poliart C, Dubin GM (2000) Phytotoxins from fungi of esca of grapevine. Phytopathologia Mediterranea 39: 156–61. doi: 10.14601/Phytopathol_Mediterr-1552
Tey-Rulh P, Phillippe I, Renaud JM, et al. (1991) Eutypine, a phytotoxin produced by Eutypa lata, the causal agent of dying-arm disease of grapevine. Phytochemistry 30: 471–473. doi: 10.1016/0031-9422(91)83707-R
Travadon R, Lecomte P, Diarra B, et al. (2016) Grapevine pruning systems and cultivars influence the diversity of wood-colonizing fungi. Fungal Ecology 24(Part A): 82–93. doi: 10.1016/j.funeco.2016.09.003
Úrbez-Torres JR (2011) The status of Botryosphaeriaceae species infecting grapevines. Phytopathologia Mediterranea 50: S5–S45. doi: 10.14601/Phytopathol_Mediterr-9316
Úrbez-Torres JR, Haag P, Bowen P, O’Gorman DT (2014) Grapevine trunk diseases in British Columbia: incidence and characterization of the fungal pathogens associated with esca and petri diseases of grapevine. Plant Disease 98(4): 469–482. doi: 10.1094/PDIS-05-13-0523-RE
van Niekerk JM, Crous PW, Groenewald JZ, Fourie PH, Halleen F (2004) DNA phylogeny, morphology and pathogenicity of Botryosphaeria species on grapevines. Mycologia 96(4): 781–798. doi: 10.1080/15572536.2005.11832926
Wagschal I, Abou-Mansour E, Petit AN, et al. (2008) Wood diseases of grapevine: a review on eutypa dieback and esca. In: Ait Barka E, Clément C, eds. Plant–Microbe Interactions. Kerala, India: Research Signpost, 367–91.
Yan JY, Xie Y, Zhang W, et al. (2013) Species of Botryosphaeriaceae involved in grapevine dieback in China. Fungal Diversity 61(1): 221–236. doi: 10.1007/s13225-013-0251-8
Zhang Y, Zhou Y, Sun W, et al. (2021) Toward a Natural Classification of Botryosphaeriaceae: A Study of the Type Specimens of Botryosphaeria sensu lato. Front. Microbiol. 12: 737541. doi: 10.3389/fmicb.2021.737541