..
Condición fitosanitaria: Presente ampliamente distribuida
Grupo de cultivos: Cereales
Especie hospedante: Trigo (Triticum aestivum L., 1753, nom. cons.) in [Linnaeus C (1753c)])
Rango de hospedantes: El trigo es el hospedante preferido del ácaro del trigo y un excelente hospedante del WSMV. Tanto los ácaros como el WSMV se encuentran en otros cultivos como el maíz (Zea mays L.), la cebada (Hordeum vulgare L.), el centeno (Secale cereale L.), la avena (Avena sativa L.), el mijo (Pennisetum glaucum L.) y sorgo (Sorghum bicolor). El virus también infecta pastos silvestres como cola de zorro (Setaria P. Beauv. Spp.), pasto aguja (Stipa L. spp.), pasto de cabra (Aegilops L. spp.), crabgrass (Digitaria Haller. Spp.), raigrás (Lolium L. spp.), cebadilla (Bromus Scop. Spp.), cupgrass (Eriochloa Kunth spp.) y otras gramíneas (Sill y Connin 1953, Sill y Agusiobo 1955, Brakke 1971, Christian y Willis 1993). No se han encontrado dicotiledóneas hospedantes del WSMV. Los ácaros del trigo también utilizan varios pastos silvestres como hospedantes (Hadi et al., 2011).
Etiología: Virus (parásito obligado)
Agente causal: Wheat Streak Mosaic Virus (WSMV)
Taxonomía: Viruses > Riboviria > Orthornavirae > Pisuviricota > Stelpaviricetes > Patatavirales > Potyviridae > Tritimovirus
Baltimore classification: Group IV: ssRNA(+) Baltimore, 1971
.
El WSMV es un virus de ARN monopartito, de sentido positivo, monocatenario y el miembro tipo del género Tritimovirus en la familia Potyviridae.
.
ICTV:
Potyviridae es la familia más grande de virus vegetales de ARN, cuyos miembros tienen genomas de ARN monocatenario de sentido positivo y partículas filamentosas flexibles de 680 a 900 nm de largo y 11 a 20 nm de ancho. Ésta familia posee doce géneros y más de 200 especies, todas de virus vegetales. Algunos miembros tienen un rango de hospedantes estrecho, mientras que la mayoría de los miembros de ésta familia, infectan un número intermedio de especies vegetales. Sólo algunos virus infectan especies de plantas de hasta 30 familias distintas. La transmisión a la mayoría de los hospedantes, se logra fácilmente mediante inoculación mecánica, aunque también, la mayoría de ellos, son transmitidos por artrópodos. Sólo los virus del género Bymovirus son transmitidos por plasmodiofóridos. También en algunos casos, ocurre la transmisión por semilla.
.
Se reconocen tres tipos de WSMV: A (México), B (Europa, Rusia, Asia) y D (EE. UU., Argentina, Brasil, Australia, Turquía, Canadá) (Singh et al., 2018).
.
.
.
Antecedentes
El Wheat Streak Mosaic Virus (WSMV) causa el mosaico del rayado del trigo, una enfermedad de los cereales y las gramíneas que causa daños en los cultivos de trigo en todo el mundo. El WSMV fue observado por primera vez en 1922 por Peltier en Nebraska en las Grandes Llanuras Centrales (Central Great Plains) de los EE. UU., y descrito como «mosaico amarillo» (McKinney, 1937; Staples y Allington, 1956). Actualmente, el virus se encuentra ampliamente distribuido en la mayoría de las regiones productoras de trigo del mundo, incluyendo EE. UU., Canadá, México, Brasil, Argentina, Europa, Turquía, Irán, Australia y Nueva Zelanda (Hadi et al., 2011; Navia et al., 2013).
.
Sintomatología
Las plantas infectadas están atrofiadas y presentan un mosaico amarillo de rayas discontinuas paralelas en las hojas. En las hojas individuales, los síntomas comienzan como pequeñas líneas cloróticas. A medida que avanza el desarrollo de los síntomas, las líneas cloróticas se alargan para formar rayas discontinuas de color amarillo a verde pálido, formando un patrón de mosaico en las hojas. En casos severos, las rayas pueden fusionarse, formando grandes áreas cloróticas, y comúnmente resultan en que los síntomas progresen hacia la necrosis del tejido foliar y la muerte de la planta. El retraso del crecimiento es otro síntoma destacado de las plantas infectadas. Las plantas infectadas suelen atrofiarse y producen menos semillas, que a menudo están muy arrugadas. Cuanto antes se produzca la infección, mayor será el efecto sobre la planta.
.
.
- Wheat Streak Mosaic Virus (confirmado por análisis serológico en IPAVE) en Klein Tauro. Autores: Silvana Di Nubila, Marcelo Carmona
- Wheat Streak Mosaic Virus (confirmado por análisis serológico en IPAVE) en Klein Tauro. Autores: Silvana Di Nubila, Marcelo Carmona
- Wheat Streak Mosaic Virus (confirmado por análisis serológico en IPAVE) en Klein Tauro. Autores: Silvana Di Nubila, Marcelo Carmona
- Autor: M. Burrows
- Autor: M. Burrows
- Síntomas de WSMV en el campo. (A) Los síntomas virales típicos de WSMV son rayas amarillas en forma de mosaico en las hojas. (B) Los síntomas graves de infecciones mixtas de WSMV + TriMV ( Triticum mosaic virus) incluyen retraso en el crecimiento, que conduce al subdesarrollo y la pérdida total de los cultivos. (C) Una imagen de primer plano del trigo atrofiado infectado con WSMV, que es solo el doble del tamaño de la mazorca de maíz seca utilizada para la comparación. La altura esperada del trigo en esta etapa de maduración es tres veces mayor. Autor: Redila et al., 2021.
- Síntomas del ácaro del trigo (Aceria tosichella) y el WSMV. (A) especímenes del ácaro en una hoja de trigo; (B) síntomas (rizos de las hojas) causados por el ácaro; y (C) síntomas de WSMV en hoja de trigo. Autor: Skoracka et al., 2018
.
.
Transmisión
Se ha demostrado que el ácaro del trigo (Aceria tosichella) es el único transmisor de cuatro virus distintos para el trigo y muchos otros hospedantes de gramíneas (Stenger et al., 2016). Aceria tosichella se ha identificado recientemente como un complejo de especies de biotipos que difieren en la transmisión del virus.
Se han reportado tasas bajas de transmisión por semillas.
.
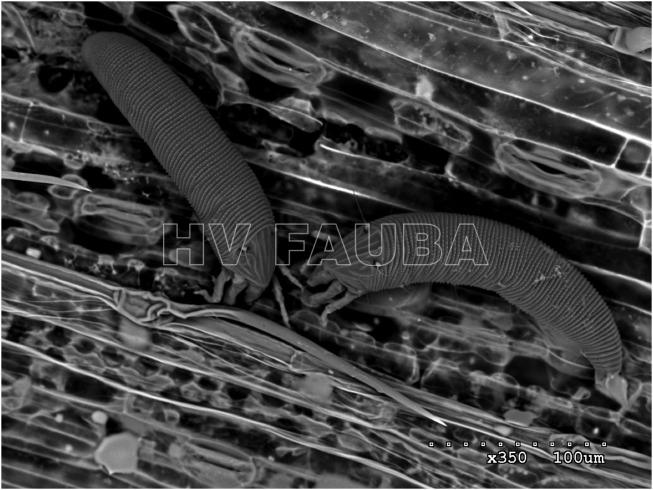
- Imagen de microscopía electrónica de barrido (SEM) de muestras de ácaro del trigo (Aceria tosichella) en una hoja de trigo. Autor: Skoracka et al., 2018
.
.
Diagnóstico y detección
La detección de WSMV se realiza mediante ensayo inmunoabsorbente ligado a enzimas (ELISA), reacción en cadena de la polimerasa con transcripción inversa (RT-PCR) o RT-PCR cuantitativa (RT-qPCR).
.
.
Ciclo de la enfermedad y epidemiología
El virus ingresa a las hojas y se propaga a todas las partes de la planta. El virus es transmitido por el ácaro del trigo y puede penetrar también por microheridas producidas por el frotamiento de las hojas. El viento puede dispersar el ácaro de un campo a otro.
Los ácaros sobreviven como huevos, larvas, ninfas o adultos en la corona y las vainas de las hojas de trigo voluntarias. En el otoño, los ácaros se mueven del trigo voluntario infectado por el WSMV y otras gramíneas hospedantes al trigo recién emergido y transmiten el virus que sobrevive al invierno dentro de las plantas voluntarias. En la primavera / verano, los ácaros se mueven de la cosecha de trigo en maduración al trigo voluntario y otras gramíneas hospedantes y transmiten el WSMV, y al trigo recién emergido en el otoño al que transmiten el virus, etc, completando el ciclo de la enfermedad. En la primavera, los ácaros se multiplican rápidamente y se diseminan hasta nuevos lotes de trigos. Estos hospedantes albergan el ácaro y el virus durante el verano, completando el ciclo de la enfermedad.
El desarrollo de esta enfermedad depende de la población de ácaros, la presencia de plantas de trigo guachas infectadas con virus y la humedad suficiente para un buen crecimiento de las plantas y una rápida reproducción de los ácaros. Las epidemias severas ocurren cuando hay una acumulación de ácaros y virus en el trigo voluntario de primavera en campos cercanos al trigo sembrado en forma temprana.
Los síntomas de la enfermedad se vuelven más pronunciados cuando las temperaturas superan los 10 °C en la primavera.
Por lo tanto, el WSMV puede causar la pérdida completa de una cosecha cuando se produce una infección generalizada en las plántulas de trigo, cuando un puente verde (plantas guachas de trigo y malezas hospedantes secundarios) muy infectado no se controla antes de una siembra temprana, y las temperaturas cálidas favorecen el incremento de la población de ácaros.
.
.
- Autor: KSU Wheat Pathology
.
.
Manejo Integrado
La manera de evitar daños significativos es combinar la mayor cantidad posible de las siguientes herramientas de manejo ( 2016):
* Resistencia genética cuando estuvieran disponibles variedades de trigo resistentes. Se han identificado los genes de resistencia Wsm1, Wsm2 y Wsm3. El más eficaz, Wsm2, se ha introducido en varios cultivares de trigo (Whelan y Hart, 1988; Chen et al., 1998; Harvey et al., 2003; Malik et al., 2003; Hakizimana et al., 2004; Carrera et al., 2012; Carver et al., 2016).
* Control de plantas de trigo voluntarias.
* Evitar siembras tempranas.
* Evitar siembras en lotes vecinos con maíz, mijo, sorgo o cultivos de cobertura de grano pequeño.
.
.
.
Bibliografía
Alemandri MV, Bainotti CT, Rodriguez MS, et al. (2015) Evaluacion del comportamiento de cultivares de trigo argentinos y brasileros frente a Wheat streak mosaic virus (WSMV) y Wheat mosaic virus (WMoV) en infecciones artificiales. XV Jornada Fitosanitarias Argentinas. Ciudad de Santa Fe. Santa Fe. 07-09 de octubre. Libro de resumenes: 24.
Alemandri MV, Dumon AD, Rodriguez MS, et al. (2014) Monitoreo e incidencia de virus transmitidos por Aceria tosichella Keifer. Jornadas de Cierre del Proyecto Cooperacion Internacional INTA-EMBRAPA. Ciudad de Cordoba. Cordoba. 06-08 de octubre. Libro de Resumenes: 46-47.
Alemandri MV, Mattio MF, Dumon AD, et al. (2014) Situacion actual del complejo de virus transmitidos por Aceria tosichrlla Keifer a diez alos de su deteccion en Argentina. Jornadas de Cierre del Proyecto Cooperacion Internacional INTA-EMBRAPA. Ciudad de Cordoba. Cordoba. 06-08 de octubre. Libro de Resumenes: 27-28.
Alemandri MV, Mattio MF, Dumon AD, et al. (2013) Transmision del complejo viral WSMV – WMoV – TriMV y caracteristicas biologicas de poblaciones de Aceria tosichella Keifer originarias de Argentina. XXII Congreso Peruano y XVII Congreso Latinoamericano de Fitopatologia. Lambayeque. Peru. 1-5 de Octubre. Libro de Resumenes: 121.
Bainotti C, Sagadin M, Rodriguez S, Truol G (2009) Incidencia del Wheat streak mosaic virus (WSMV) y High plains virus (HPV) según fechas de siembra y cultivares afectados. XIII Jornadas Fitosanitarias Argentinas. Resúmenes
Carrera SG, Davis H, Aguirre-Rojas L, et al. (2012) Multiple categories of resistance to wheat curl mite (Acari: Eriophyidae) expressed in accessions of Aegilops tauschii. J. Econ. Entomol. 105: 2180–2186. doi: 10.1603/EC12252
Carver BF, Smith CM, Chang W, et al. (2016) Registration of OK 05312, a high-yielding hard winter wheat donor of Cmc4 for wheat curl mite resistance. J. Plant Regist. 10: 75–79. doi: 10.3198/jpr2015.04.0026crg
Chen Q, Conner R, Ahmad F, et al. (1998) Molecular characterization of the genome composition of partial amphiploids derived from Triticum aestivum×Thinopyrum ponticum and T. aestivum×Th. intermedium as sources of resistance to wheat streak mosaic virus and its vector, Aceria tosichella. Theor Appl Genet 97: 1–8. doi: 10.1007/s001220050860
Choi IR, French R, Hein GL, Stenger DC (1999) Fully biologically active in vitro transcripts of the eriophyid mite-transmitted wheat streak mosaic tritimovirus. Phytopathology 89: 1182-1185. doi: 10.1094/PHYTO.1999.89.12.1182
Couretot L, Lanzillota JJ, Alemandri V (2021) Detección del virus mosaico estriado del trigo en el Norte de la Pcia. de Bs As. Link
Cruz L, Shoup Rupp JL, Trick HN, Fellers JP (2014) Stable resistance to Wheat streak mosaic virus in wheat mediated by RNAi. In Vitro Cell. Dev. Biol. Plant 50: 665-672. doi: 10.1007/s11627-014-9634-0
Detección del virus mosaico estriado del trigo en el Norte de la Pcia. de Bs As.
Fahim M, Ayala-Navarrete L, Millar AA, Larkin PJ (2010) Hairpin RNA derived from viral NIa gene confers immunity to wheat streak mosaic virus infection in transgenic wheat plants. Plant Biotechnol. J. 8: 821-834. doi: 10.1111/j.1467-7652.2010.00513.x
Fellers JP, Seifers D, Ryba-White M, Martin TJ (2009) The complete genome sequence of Triticum mosaic virus, a new wheat-infecting virus of the High Plains. Arch. Virol. 154: 1511-1515. doi: 10.1007/s00705-009-0462-1
French R, Stenger DC (2003) Evolution of Wheat streak mosaic virus: Dynamics of population growth within plants may explain limited variation. Annu. Rev. Phytopathol. 41: 199-214. doi: 10.1146/annurev.phyto.41.052002.095559
, , (2011) Wheat streak mosaic virus on wheat: biology and management. J. Integr. Pest Manag. 2: 1–5. doi: 10.1603/IPM10017
Hakizimana F, Ibrahim AMH, Langham MAC, et al. (2004) Diallel analysis of Wheat streak mosaic virus resistance in winter wheat. Crop Sci. 44: 89–92. doi: 10.2135/cropsci2004.8900
Haley SD, Martin TJ, Quick JS, et al. (2002) Registration of CO960293-wheat germplasm resistant to Wheat streak mosaic virus and Russian wheat aphid. Crop Sci. 42: 1381-1382. doi: 10.2135/cropsci2002.1381
Harvey TL, Martin TJ, Seifers DL (2003) Resistance to the wheat curl mite (Acari: Eriophyidae) prevents loss in wheat yield. J. Agric. Urban Entomol. 20: 7–10. Link
Jones RAC, Vazquez-Iglesias I, Hajizadeh M, et al. (2022) Phylogenetics and evolution of wheat streak mosaic virus: Its global origin and the source of the Australian epidemic. Plant Pathology, 71, 1660– 1673. doi: 10.1111/ppa.13609
Lebas BSM, Ochoa-Corona FM, Alexander BJR, et al. (2009) First report of Wheat streak mosaic virus on wheat in New Zealand. Plant Disease 93: 430. doi: 10.1094/PDIS-93-4-0430B
Lu H, Price J, Devkota R, et al. (2011) A dominant gene for resistance to Wheat streak mosaic virus in winter wheat line CO960293-2. Crop Sci. 51: 5-12. doi: 10.2135/cropsci2010.01.0038
Malik R, Brown-Guedira GL, Smith CM, et al. (2003) Genetic mapping of wheat curl mite resistance genes Cmc3 and Cmc4 in common wheat. Crop Sci. 43: 644–650. doi: 10.2135/cropsci2003.6440
(1937) Mosaic Diseases of Wheat and Related Cereals. US Department of Agriculture Circular No. 442, 1–23. Link
McMechan AJ, Tatineni S, French R, Hein GL (2014) Differential transmission of Triticum mosaic virus by wheat curl mite populations collected in the Great Plains. Plant Dis. 98: 806-810. doi: 10.1094/PDIS-06-13-0582-RE
(2016) Planting date and variety selection for management of viruses transmitted by the wheat curl mite (Acari: Eriophyidae). J. Econ. Entomol. 109: 70–77. doi: 10.1093/jee/tov311
, , , (2013) Phylogenetic analyses reveal extensive cryptic speciation and host specialization in an economically important mite taxon. Mol. Phylogenet. Evol. 66: 928–940. doi: 10.1016/j.ympev.2012.11.021
Miller ZJ, Lehnhoff EA, Menalled FD, Burrows M (2015) Effects of soil nitrogen and atmospheric carbon dioxide on Wheat streak mosaic virus and its vector (Aceria tosichella Kiefer). Plant Disease 99: 1803–1807. doi: 10.1094/PDIS-01-15-0033-RE
, , , (2013) Wheat curl mite, Aceria tosichella, and transmitted viruses: an expanding pest complex affecting cereal crops. Exp. Appl. Acarol. 59, 95–143. doi: 10.1007/s10493-012-9633-y
Qu F (2010) Antiviral role of plant-encoded RNA-dependent RNA polymerases revisited with deep sequencing of small interfering RNAs of virus origin. Mol. Plant-Microbe Interact. 23: 1248-1252. doi: 10.1094/MPMI-06-10-0124
Ranabhat NB, Bruce MA, Fellers JP, et al. (2022) A reproducible methodology for absolute viral quantification and viability determination in mechanical inoculations of wheat streak mosaic virus. Trop. plant pathol. 47: 553–561. doi: 10.1007/s40858-022-00507-y
Redila CD, Phipps S and Nouri S (2021) Full Genome Evolutionary Studies of Wheat Streak Mosaic-Associated Viruses Using High-Throughput Sequencing. Front. Microbiol. 12: 699078. doi: 10.3389/fmicb.2021.699078
Sagadin M, Truol GA (2008) Transmisión por semilla de Wheat streak mosaic virus (WSMV) en infecciones naturales y experimentales. Libro de Resúmenes. Workshop en virosis de cereales transmitidas por el ácaro Aceria tosichella – Wheat Streak Mosaic Virus y High Plains Virus – en los países del Cono Sur: situación, detección y manejo.
Sagadín M, Rodriguez S, Truol G (2008) Transmisión por semilla de Wheat streak mosaic virus (WSMV) en infecciones naturales y experimentales. VII Congreso Nacional de Trigo.
Sagadín M, Bainotti C, Gomez D, et al. (2008) Incidencia de Wheat streak mosaic virus (WSMV) según fechas de siembra. VII Congreso Nacional de Trigo.
Seifers DL, Martin TJ, Harvey TL, et al. (2006) Temperature sensitivity and efficacy of Wheat streak mosaic virus resistance derived from C0960293 wheat. Plant Dis. 90: 623-628. doi: 10.1094/PD-90-0623
Seifers DL, Martin TJ, Harvey TL, Haber S (2007) Temperature-sensitive Wheat streak mosaic virus resistance identified in KS03HW12 wheat. Plant Dis. 91: 1029-1033. doi: 10.1094/PDIS-91-8-1029
Seifers DL, Martin TJ, Fellers JP (2011) Occurrence and yield effects of wheat infected with Triticum mosaic virus in Kansas. Plant Dis. 95: 183-188. doi: 10.1094/PDIS-03-10-0222
Seifers DL, Martin TJ, Harvey TL, et al. (2009) Identification of the wheat curl mite as the vector of Triticum mosaic virus. Plant Dis. 93: 25-29. doi: 10.1094/PDIS-93-1-0025
Singh K, Wegulo SN, Skoracka A, Kundu JK (2018) Wheat streak mosaic virus: a century old virus with rising importance worldwide. Mol Plant Pathol. 19(9): 2193-2206. doi: 10.1111/mpp.12683
Sivamani E, Brey CW, Dyer WE, et al. (2000) Resistance to wheat streak mosaic virus in transgenic wheat expressing the viral replicase (NIb) gene. Mol. Breed. 6: 469-477. doi: 10.1023/A:1026576124482
Sivamani E, Brey CW, Talbert LE, et al. (2002) Resistance to wheat streak mosaic virus in transgenic wheat engineered with the viral coat protein gene. Transgenic Res. 11: 31-41. doi: 10.1023/A:1013944011049
Skoracka A, Rector BG and Hein GL (2018) The Interface Between Wheat and the Wheat Curl Mite, Aceria tosichella, the Primary Vector of Globally Important Viral Diseases. Front. Plant Sci. 9: 1098. doi: 10.3389/fpls.2018.01098
(1956) Streak Mosaic of Wheat in Nebraska and its Control, Research Bulletin No. 178. Lincoln, NE: University of Nebraska-Lincoln College of Agriculture, Agricultural Experiment Station.
Stenger DC, Hall JS, Choi IR, French R (1998) Phylogenetic relationships within the family potyviridae: Wheat streak mosaic virus and brome streak mosaic virus are not members of the genus rymovirus. Phytopathology 88: 782-787. doi: 10.1094/PHYTO.1998.88.8.782
Stenger DC, Young BA, Qu F, et al. (2007) Wheat streak mosaic virus lacking helper component-proteinase is competent to produce disease synergism in double infections with Maize chlorotic mottle virus. Phytopathology 97: 1213-1221. doi: 10.1094/PHYTO-97-10-1213
Stephan D, Moeller I, Skoracka A, et al. (2008) Eriophyid mite transmission and host range of a Brome streak mosaic virus isolate derived from a full-length cDNA clone. Arch Virol 153: 181–185. doi: 10.1007/s00705-007-1065-3
Tatineni S, Graybosch RA, Hein GL, et al. (2010) Wheat cultivar-specific disease synergism and alteration of virus accumulation during co-infection with Wheat streak mosaic virus and Triticum mosaic virus. Phytopathology 100: 230-238. doi: 10.1094/PHYTO-100-3-0230
Tatineni S, Kovacs F, French R (2014) Wheat streak mosaic virus infects systemically despite extensive coat protein deletions: Identification of virion assembly and cell-to-cell movement determinants. J. Virol. 88: 1366-1380. doi: 10.1128/JVI.02737-13
Tatineni S, Wosula EN, Bartels M, et al. (2016) Temperature-dependent Wsm1 and Wsm2 gene-specific blockage of viral long-distance transport provides resistance to Wheat streak mosaic virus and Triticum mosaic virus. Mol. Plant-Microbe Interact. 29: 724-738. doi: 10.1094/MPMI-06-16-0110-R
Tatineni S, Sato S, Nersesian N, et al. (2020) Transgenic Wheat Harboring an RNAi Element Confers Dual Resistance Against Synergistically Interacting Wheat Streak Mosaic Virus and Triticum Mosaic Virus. Mol Plant Microbe Interact. 33(1): 108-122. doi: 10.1094/MPMI-10-19-0275-R
Truol G (2005) Presencia de Aceria tosichella (Keifer) vector del Wheat streak mosaic virus (WSMV) en Argentina.
Wagemans J, Holtappels D, Vainio E, et al. (2022) Going Viral: Virus-Based Biological Control Agents for Plant Protection. Annu Rev Phytopathol. 60: 21-42. doi: 10.1146/annurev-phyto-021621-114208
Whitfield AE, Falk BW, Rotenberg D (2015) Insect vector-mediated transmission of plant viruses. Virology 479-480: 278-289. doi: 10.1016/j.virol.2015.03.026
Wong CH, Alexander J, Tatineni S (2024) Plant Viral Synergism: Co-Expression of P1 and NIa-Pro Cistrons of Wheat Streak Mosaic Virus and Triticum Mosaic Virus Is Required for Synergistic Interactions in Wheat. Mol Plant Microbe Interact. doi: 10.1094/MPMI-10-24-0126-FI