.
Condición fitosanitaria: Presente
Grupo de cultivos: Frutales
Rango de hospedantes: frutales de carozo. Infecta a la mayoría de las especies de Prunus, incluyendo duraznero, melocotón, nectarina, ciruela y almendro, y ocasionalmente cereza.
Especie hospedante: Prunus spp.
Etiología: Bacteria. Gram negativa. Considerada hemibiotrófica
Agente causal: Xanthomonas arboricola pv. pruni (Xap)
La especie Xanthomonas arboricola comprende hasta nueve patovares. Entre los principales patógenos, el patovar pruni es el más monomórfico y está muy adaptado a Prunus spp. con una patogenicidad destacada y una baja variación genética entre cepas (Fischer-Le Saux et al., 2015).
El genoma consta de un solo cromosoma de alrededor de 5.000.000 pb con un contenido de GC del 65% en moles y un elemento plásmido extracromosómico de alrededor de 41.000 pb con un contenido de GC del 62% en moles. Los estudios genómicos comparativos en X. arboricola han permitido la identificación de componentes de virulencia putativos asociados con el proceso de infección de la mancha bacteriana de los frutales de carozo.
Taxonomía: Bacteria > Proteobacteria > Gammaproteobacteria > Xanthomonadales > Xanthomonadaceae > Xanthomonas
.
- Imágenes de X. arboricola CITA 44 (arriba) y X. arboricola pv. pruni IVIA 2626.1 (abajo) usando microscopía de fase de contraste (izquierda) y la apariencia de la morfología de la colonia después de 48 h de crecimiento en medio de agar YPGA a 27 °C (derecha). Los flagelos se tiñeron (izquierda). Autor: Garita-Cambronero et al., 2016.
.
.
.
Antecedentes
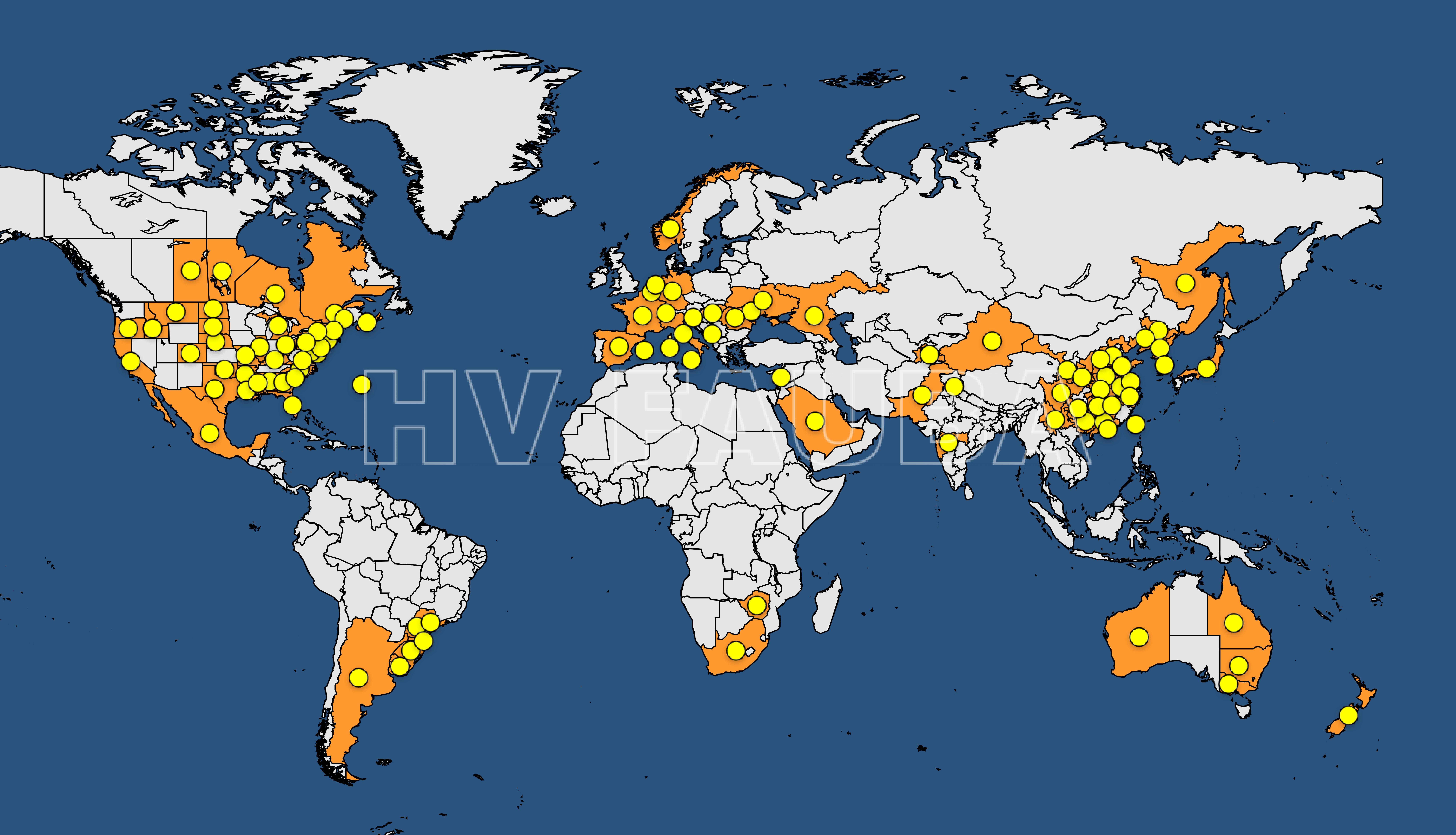
Es una enfermedad importante que puede reducir el rendimiento y el vigor de los árboles, así como la calidad comercial de los frutos afectados. Se distribuye en todo el mundo. El agente causal, Xap, fue aislado en África, América del Norte y del Sur, Asia, Europa y Oceanía. Es una enfermedad común en áreas geográficas en las que se cultivan frutales de carozo. Este patógeno, Xap, está catalogado como organismo de cuarentena en varias áreas del mundo.
.
- Distribución mundial de la mancha bacteriana de Peunua por Xanthomonas arboricola pv. pruni. Fuente: https://gd.eppo.int/taxon/XANTPR/distribution
.
.
Sintomatología
Los síntomas se encuentran en hojas, frutos, ramitas y ramas o troncos, pero no se presentan síntomas en las flores. Aunque se pueden observar algunas diferencias, los síntomas tienen características comunes en todas las especies de Prunus (Roselló et al., 2012). En infecciones graves, puede ocurrir defoliación y caída de frutas.
En las primeras etapas, la infección en las hojas se revela por la aparición de pequeñas manchas translúcidas o de color verde pálido, que evolucionan hacia una necrosis oscura o negra y se agrandan con el tiempo. Estas lesiones son poligonales, delimitadas por las nervaduras laterales, visibles a ambos lados de las hojas y muchas veces se agrupan en áreas de acumulación de agua, como la nervadura central y el borde apical de la hoja. En duraznero y nectarina (P. persica y P. persica var. nucipersica, respectivamente), se puede observar un gradiente de color característico (marrón a amarillo a verde) en la parte apical de algunas hojas y, cuando se ven gravemente afectadas, se se vuelven amarillos y caen. En el almendro (P. amygdalus, syn. P. dulcis), rara vez se observan amarillamiento de las hojas y defoliación (Palacio-Bielsa et al., 2010; Roselló et al., 2012). En ciruelo europeo y japones (P. domestica y P. salicina, respectivamente), cerezo agridulce (P. avium y P. cerasus, respectivamente) y laurel cerezo (P. lauroceraus), las hojas permanecen en el árbol y adquieren un aspecto de «agujereado por tiro» (del Inglés: «shot-hole») por el desprendimiento de tejidos secos.
.
- Los síntomas de Xanthomonas arboricola pv. pruni sobre Prunus spp. (A) Manchas foliares agrupadas en hojas de almendro. (B) Manchas en las hojas de duraznero, seguidas de coloración amarillenta y parda. (C) Aspecto perforado en hoja de ciruela. Lesiones características en frutos de duraznero, (D) damasco (E) y ciruela (F). (G) Lesiones iniciales de nuez de almendra hundidas y corchosas (derecha), y últimas lesiones elevadas en el mesocarpio deshidratado (izquierda). (H) Cancro de rama característico en ciruela. Fotografías de M. A. Cambra. Autor: Garita-Cambronero et al., 2018.
- Síntomas típicos de Xanthomonas arboricola en almendro. (A) Manchas necróticas rodeadas de halos cloróticos en las hojas, (B) lesiones hundidas y corchosas con supuración de goma fruto, (C) lesiones en una nuez con mesocarpio deshidratado y (D) manchas de color marrón oscuro en el endocarpio de la nuez. Fotos de M. Cambra. Publicado en Lamichhane (2014).
.
.
Diagnóstico e identificación
En base a las diferencias genómicas observadas entre las cepas virulentas y no virulentas aisladas de Prunus, Palacio-Bielsa et al. (2011), Palacio-Bielsa et al. (2015) y Garita-Cambronero et al. (2017) diseñaron un protocolo de PCR en tiempo real (qPCR) sensible y específico para detectar e identificar las cepas Xap. Este método evita errores de identificación debidos a cepas atípicas de X. arboricola que pueden cohabitar con Prunus..
.
Manejo Integrado
El manejo de la mancha bacteriana de los frutales de carozo se basa en un enfoque integrado que comprende medidas esenciales para evitar la introducción de Xap en una zona de producción, así como el uso de material vegetal tolerante o resistente (cuando estuviera disponible) y tratamientos químicos, principalmente a base de compuestos de cobre. Los programas de manejo también incluyen el uso de prácticas de cultivo apropiadas cuando la enfermedad ya está establecida. Finalmente, para el control efectivo de la enfermedad, se necesitan métodos de detección y caracterización apropiados para su uso en muestras sintomáticas o asintomáticas como un primer enfoque para la exclusión de patógenos.
.
.
- Síntomas de mancha bacteriana y cancro causados por patovares de Xanthomonas arboricola en frutales de carozo. (A) Manchas foliares seguidas de amarilleo y pardeamiento (B) y lesiones características en frutos de durazno (C, D y E). Lesiones necróticas en hojas (F) y frutos (G) de damasco y un cancro característico de las ramitas (H). Fotos de M. Cambra, y Jay Ram Lamichhane (2014).
.
.
.
.
Bibliografía
Aarrouf J, Garcin A, Lizzi Y, Maâtaoui ME (2008) Immunolocalization and Histocytopathological Effects of Xanthomonas arboricola pv. pruni on Naturally Infected Leaf and Fruit Tissues of Peach (Prunus persica L. Batsch). Journal of Phytopathology 156: 338-345. doi: 10.1111/j.1439-0434.2007.01364.x
Cesbron S, Briand M, Essakhi S, et al. (2015) Comparative Genomics of Pathogenic and Nonpathogenic Strains of Xanthomonas arboricola Unveil Molecular and Evolutionary Events Linked to Pathoadaptation. Front. Plant Sci. 6: 1126. doi: 10.3389/fpls.2015.01126
Costa J, Pothier JF, Boch J, et al. (2021) Integrating science on Xanthomonadaceae for sustainable plant disease management in Europe. Mol Plant Pathol. 22(12): 1461-1463. doi: 10.1111/mpp.13150
Domingo-Calap ML, Bernabéu-Gimeno M, Aure MC, et al. (2022) Comparative Analysis of Novel Lytic Phages for Biological Control of Phytopathogenic Xanthomonas spp. Microbiol Spectr. e0296022. doi: 10.1128/spectrum.02960-22
Garita-Cambronero J, Palacio-Bielsa A, López MM, et al. (2016) Draft genome sequence for virulent and avirulent strains of Xanthomonas arboricola isolated from Prunus spp. in Spain. Stand in Genomic Sci 11, 12. doi: 10.1186/s40793-016-0132-3
Garita-Cambronero J, Palacio-Bielsa A, López MM, Cubero J (2017) Pan-Genomic Analysis Permits Differentiation of Virulent and Non-virulent Strains of Xanthomonas arboricola That Cohabit Prunus spp. and Elucidate Bacterial Virulence Factors. Front. Microbiol. 8: 573. doi: 10.3389/fmicb.2017.00573
Garita-Cambronero J, Palacio-Bielsa A, Cubero J (2018) Xanthomonas arboricola pv. pruni, causal agent of bacterial spot of stone fruits and almond: its genomic and phenotypic characteristics in the X. arboricola species context. Molecular Plant Pathology 19: 2053-2065. doi: 10.1111/mpp.12679
Giovanardi D, Dallai D, Stefani E (2017) Population features of Xanthomonas arboricola pv. pruni from Prunus spp. orchards in northern Italy. Eur J Plant Pathol 147: 761–771. doi: 10.1007/s10658-016-1040-5
Iličić R, Popović T (2020) Occurrence of Xanthomonas arboricola pv. pruni causing bacterial leaf spot and shot-hole on peach in Montenegro. Plant Disease 104: 1250-1250. doi: 10.1094/PDIS-06-19-1309-PDN
Lamichhane JR (2014) Xanthomonas arboricola diseases of stone fruit, almond, and walnut trees: progress toward understanding and management. Plant Disease 98(12): 1600-1610. doi: 10.1094/PDIS-08-14-0831-FE
Linardelli CE, Soto A, Puglia MC, et al. (2002) Presencia de Xanthomonas campestris pv. pruni (Smith) Dye, en plantaciones de ciruelo de la provincia de Mendoza. XI Jornadas Fitosanitarias Argentinas.
Monterroso L, Nuñez MM, Venero A (1996) Incidencia y severidad de la bacteriosis (Xanthomonas campestris pv. pruni) en ciruelos y duraznos en Azul, provincia de Buenos Aires. Fitopatología 31(3): 196-200.
Morales G, Llorente I, Montesinos E, Moragrega C (2017) A model for predicting Xanthomonas arboricola pv. pruni growth as a function of temperature. PLoS ONE 12(5): e0177583. doi: 10.1371/journal.pone.0177583
Morales G, Moragrega C, Montesinos E, Llorente I (2018) Effects of leaf wetness duration and temperature on infection of Prunus by Xanthomonas arboricola pv. pruni. PLoS ONE 13(3): e0193813. doi: 10.1371/journal.pone.0193813
Palacio-Bielsa A, Roselló M, Cambra MA, López MM (2010) First report on almond in Europe of bacterial spot disease of stone fruits caused by Xanthomonas arboricola pv. pruni. Plant Disease 94: 786. doi: 10.1094/PDIS-94-6-0786B
Palacio-Bielsa A, Cubero J, Cambra MA, et al. (2011) Development of an efficient real-time quantitative PCR protocol for detection of Xanthomonas arboricola pv. pruni in Prunus species. Appl Environ Microbiol. 77(1): 89-97. doi: 10.1128/AEM.01593-10
Palacio-Bielsa A, López-Soriano P, Bühlmann A, et al. (2015). Evaluation of a real-time PCR and a loop-mediated isothermal amplification for detection of Xanthomonas arboricola pv. pruni in plant tissue samples. J. Microbiol. Methods 112: 36–39. doi: 10.1016/j.mimet.2015.03.005
Palacio-Bielsa A, Berruete I, López M, et al. (2015) La mancha bacteriana de los frutales de hueso y del almendro (Xanthomonas arboricola pv. pruni) en España y Sudamérica. Phytoma España 271 : 21-28. Link
Popović T, Menković J, Prokić A, Obradoviċ A (2021) First report of Xanthomonas arboricola pv. pruni causing leaf and fruit spot on apricot (Prunus armeniaca L.) in Montenegro. Plant Disease. doi: 10.1094/PDIS-01-21-0161-PDN
Roselló M, Santiago R, Palacio-Bielsa A, et al. (2012) Current status of bacterial spot of stone fruits and almond caused by Xanthomonas arboricola pv. pruni in Spain. J. Plant Pathol. 94: 15–21. doi: 10.4454/jpp.v94i1sup.004
Sherif S, Paliyath G, Jayasankar S (2012) Molecular characterization of peach PR genes and their induction kinetics in response to bacterial infection and signaling molecules. Plant Cell Rep. 31(4): 697-711. doi: 10.1007/s00299-011-1188-6
Teper D, White FF, Wang N (2023) The Dynamic Transcription Activator-Like Effector Family of Xanthomonas. Phytopathology 113(4): 651-666. doi: 10.1094/PHYTO-10-22-0365-KD
Zaccardelli M, Malaguti S, Bazzi C (1998) Biological and epidemiological aspects of Xanthomonas arboricola pv. pruni on peach in Italy. Journal of Plant Pathology 80. doi: 10.4454/jpp.v80i2.810
Zarei S, Taghavi SM, Rahimi T, et al. (2022) Taxonomic Refinement of Xanthomonas arboricola. Phytopathology. doi: 10.1094/PHYTO-12-21-0519-R
Zarei S, Taghavi SM, Osdaghi E (2022) Reassessment of the occurrence and distribution of Xanthomonas arboricola on fruit trees in Iran. Plant Pathol. doi: 10.1111/ppa.13632