.
Grupo de cultivos: Cereales
Especie hospedante: Maíz (Zea mays)
Rango de hospedantes: no específico / amplio
Epidemiología: monocíclica, subaguda.
Etiología: Complejo fúngico (Hongos Necrotróficos)
Agente causal: La etiología de la enfermedad responde a un complejo de hongos fitopatógenos. Entre los principales se encuentran:
* Fusarium graminearum Schwabe (anamorfo) / Gibberella zeae (Schwein.) Petch (teleomorfo)
* Fusarium verticillioides (Sacc.) Nirenberg. (Nirenberg and O’Donnell 1998) (syn. F. moniliforme J. Sheldon; teleomorfo G. moniliformis Wineland)
* Stenocarpella spp (syn. Diplodia spp)
* Colletotrichum graminicola (Ces.) G.W. Wilson
* Macrophomina phaseolina (Tassi) Goid
.
.
.
Antecedentes e importancia
La pudrición de la raíz y del tallo es una de las principales enfermedades del maíz en la Argentina. Durante los últimas campañas agrícolas las pudriciones de tallo y raíces (PTR) han aparecido con mayor frecuencia e intensidad en todas las zonas productoras, especialmente en la zona núcleo. Este complejo de patógenos causa la muerte prematura de las plantas e incrementan la probabilidad del vuelco. Los más importantes afectan al cultivo hacia el final del ciclo. La pudrición es causada por varios hongos, los que atacan los tejidos del tallo y raíz, cuando estos comienzan a senescer. Las mayores pérdidas de cosecha causadas por estos patógenos se deben a la rotura del tallo y el acamado de las plantas.
.
Síntomas
La sintomatología general que acompaña esta enfermedad es la pudrición de raíz y/o tallo, acompañadas por marchitamiento de las hojas y debilitamiento general de la planta. Las plantas marchitas permanecen erectas cuando se secan y al partir verticalmente los entrenudos inferiores se observa que el floema de los tallos infectados es color café oscuro. En las etapas finales de la infección, la medula es destruida y los tejidos adyacentes pierden su color. La pudrición del tallo hace referencia también a la muerte prematura, rotura o quiebre del mismo y al vuelco. La podredumbre de raíces se inicia en etapas vegetativas, pero los síntomas típicos de la enfermedad se observan desde formación de la espiga a cosecha, ya que en etapas anteriores pasan desapercibidos por la formación de raíces nuevas y la escasa demanda de fotosintatos hacia de la parte aérea. Lo primero que puede observarse es la pérdida de vigor y debilitamiento de las plantas y la presencia de plantas aisladas que comienzan a madurar anticipadamente. A medida que avanza la estación de cultivo los síntomas se generalizan y se observa la pérdida de turgencia de la base del tallo (cede a la presión de los dedos), la decoloración del mismo y el enriado de la médula, es decir la podredumbre del tejido parenquimático y la separación de los haces vasculares. Este último síntoma se observa al hacer un corte longitudinal del tallo, lo cual permite además observar los signos característicos de los agentes causales. Es común observar espigas más pequeñas y mirando prematuramente hacia abajo, lo cual indica la presencia de plantas enfermas. En muchos casos, las plantas con la base podrida vuelcan y se dificulta la recolección. Además los mismos patógenos atacan las espigas ocasionando la podredumbre de los granos.
.
- Autor: Emmanuel Byamukama
- Autor: Emmanuel Byamukama
- Autor: Alison Robertson. Fuente: www.cropprotectionnetwork.org
.
Pudrición por Giberella – Fusarium graminearum
Es uno de los agentes causantes de pudrición de tallo más perjudiciales. Acompañando la sintomatología general descripta inicialmente, la base del tallo de la planta enferma altera su color, tornándose pardo o de color pajizo, en contraste con el amarilleado, verdoso o morado de las plantas sanas, lo que depende de la presencia y de la concentración de pigmentos en el híbrido. Los tejidos internos de la médula se desintegran, dejando solamente los haces vasculares intactos, pero sueltos. En estas plantas solamente con fricción del dedo pulgar y del dedo índice se puede quebrar los tallos. Un síntoma diagnóstico que permite diferenciar a giberela de otras pudriciones es la coloración rosa-rojiza que ocurre dentro del tallo (medula), conferida por la colonización del hongo en plantas con tallos aún verdes y en plantas maduras próximas a cosecha. La presencia de costras de peritecios, en la superficie de los tejidos infectados, también puede ayudar en el diagnóstico directo. Los peritecios son pequeños, visibles al ojo desnudo, esféricos, de color negro, dispuestos en grupos en los tejidos senescidos, ásperos, pudiendo ser removidos por raspado.
.
- Pudrición de espiga de maíz por Fusarium. Signo: micelio. Autor: Gary-Munkvold. Fuente: www.cropprotectionnetwork.org
.
Pudrición por fusarium – Fusarium verticillioides (Sin.= Fusarium moniliforme)
Los síntomas de la pudrición de Fusarium inician con la alteración de la coloración externa de la base del tallo, siendo que las plantas infectadas presentan la médula de color blanco-rosada a rosa-salmón. Cuando la infección es severa puede ocurrir la esporulación del patógeno, en la parte externa del tejido afectado, en la forma de una masa de esporas de color rosa-salmón. La pudrición afecta las raíces, base de la planta y los entrenudos inferiores, pudiendo llevar al quebrado del tallo y a madurez prematura. La pudrición por Fusarium puede ser diagnosticada por la ausencia de peritecios sobre la superficie del tejido afectado, lo que no ocurre con la pudrición de Gibberella. La enfermedad inicia comúnmente luego de la polinización y se torna más severa a medida que la planta se acerca a la maduración.
Fusarium verticillioides es un patógeno frecuente en semillas de maíz. Este patógeno puede causar la pudrición de las semillas, de las espigas y de la base del tallo y raíces, provocando el vuelco. Fusarium verticillioides es un patógeno importante y amenazante en la agricultura, particularmente en la producción de maíz. Este hongo toxicogénico posee la capacidad de sobrevivir en condiciones extremas, como altas temperaturas, y produce esporas anemófilas, lo que explica su amplia presencia en el medio ambiente. Es un patógeno con capacidad de supervivencia en el suelo, que puede infectar la semilla y las raíces en crecimiento de la planta de maíz, después de lo cual coloniza (asciende) por la planta misma (Czembor et al., 2015; Omotayo y Babalola, 2023).
.
- Autor: Alison Robertson. Fuente: www.cropprotectionnetwork.org
.
Pudrición por Diplodia – Stenocarpella macrospora y S. maydis
La especie S. maydis causa pudrición del tallo en zonas frías y húmedas, y S. macrospora, en zonas cálidas y húmedas. El cuadro sintomatológico incluye alteración del color externo del tallo, parte interna de los nudos y desintegración de la médula, dejando apenas los haces vasculares intactos. Se observa una coloración café en la medula de los entrenudos inferiores. Normalmente en el primer y segundo entrenudo las plantas infectadas presentan lesiones externas en el tallo, de forma localizada, de color oscuro, iniciando preferencialmente en el nudo. Esta enfermedad puede ser identificada por el desarrollo de numerosos picnidios negros, sub-epidérmicos, pequeños, en los internudos inferiores de los tallos, principalmente cuando el tejido se encuentra senescido (próximo a cosecha o luego de cosecha). Las plantas atacadas pueden ser prematuramente muertas. Los tallos se debilitan y se quiebran fácilmente cuando hay vientos o lluvias fuertes.
.
- Síntomas de pudrición de la mazorca por Diplodia y características morfológicas de S. maydis. (A) espiga infectada con síntomas de momificación causada por S. maydis en un campo de maíz; (B) picnidios de S. maydis en una espiga infectada; (C) Cirros (cirrhi) conidiales de S. maydis; (D) picnidios de S. maydis producidos en mnedio de cultivo; y (E) masas de conidios de picnidios triturados de S. maydis. Autor: Zaccaron et al., 2017.
.
Antracnosis – Colletotrichum graminicola
La pudrición del tallo se ha reportado principalmente en zonas cálidas y húmedas de todo el mundo (CIMMYT, 2004). Los síntomas de la antracnosis son visibles en las plantas normalmente a partir de la maduración fisiológica, cuando éstas inician el proceso de senescencia natural. Los síntomas en la base externa de los tallos se manifiestan como áreas o placas (lesiones) oscuras, negras, de aspecto brillante, inicialmente desarrollados en los nudos y progresando hacia entrenudos, en la forma de manchas angostas y alargadas. Estas manchas pueden coalescer para formar largos “bloques o rayas” negras. Esta decoloración típica puede aparecer sea en los internudos inferiores o en todo el tallo. Las plantas infectadas normalmente presentan síntoma de marchites de las hojas (causado por la destrucción total del tejido de la medula), las que pueden secarse. Se produce el desgarramiento de los haces vasculares, que adquieren una coloración café oscura. En algunas situaciones hay quiebre de tallo, seguido de vuelco, y hasta muerte prematura de la planta.
.
Pudrición gris o carbonosa por Macrophomina – Macrophomina phaseolina
Es más común en climas cálidos y secos. La incidencia aumenta rápidamente cuando predominan condiciones de sequía y temperaturas altas antes de la floración. Los síntomas de la infección de Macrophomina son detectados en las plantas de maíz próximas a cosecha, principalmente cuando esas sufren estrés hídrico. Uno de los primeros síntomas es el secado anormal del tejido de las hojas superiores. Las plantas infectadas no presentan en el tallo síntomas externos, localizados, de decoloración o pudrición. Los tallos se tornan pardos y quebradizos cuando son presionados con los dedos, debido a los tejidos internos de la médula que se presentan desintegrados, con los haces vasculares sueltos. El diagnóstico diferencial de otras pudriciones del tallo es la coloración ceniza dentro del tallo y la presencia de pequeños puntos negros, constituidos por los micro-esclerocios del hongo, en el área afectada que predominantemente ocurre próximo a los nudos del tallo.
.
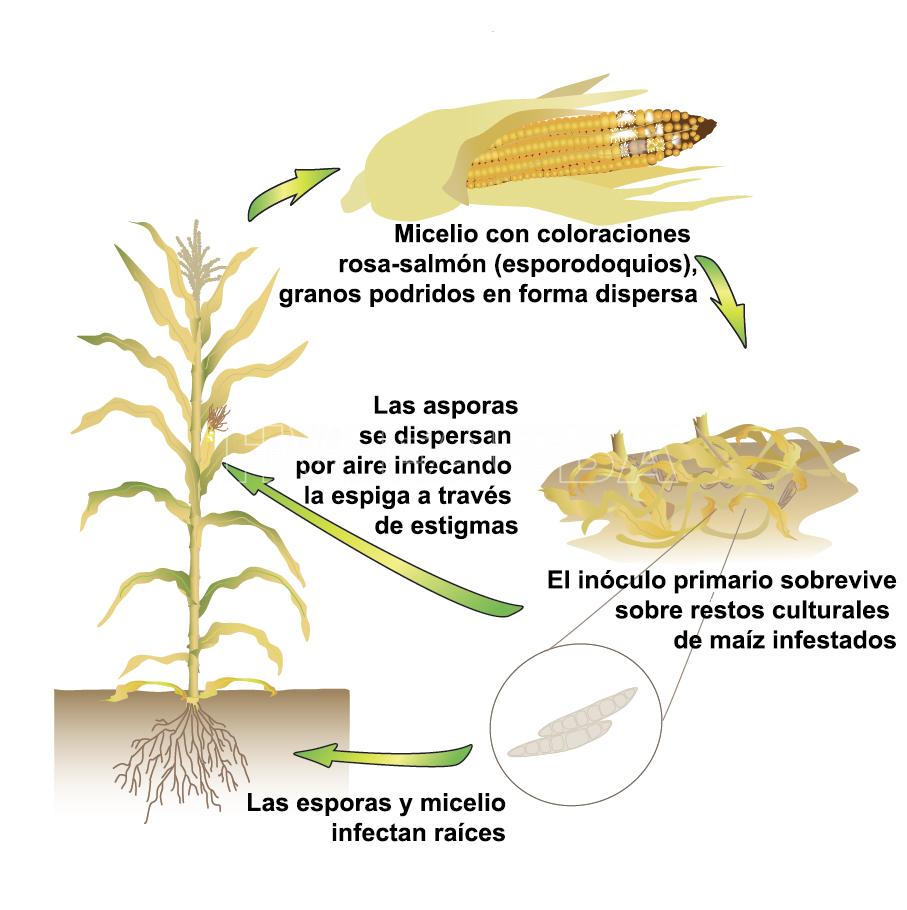
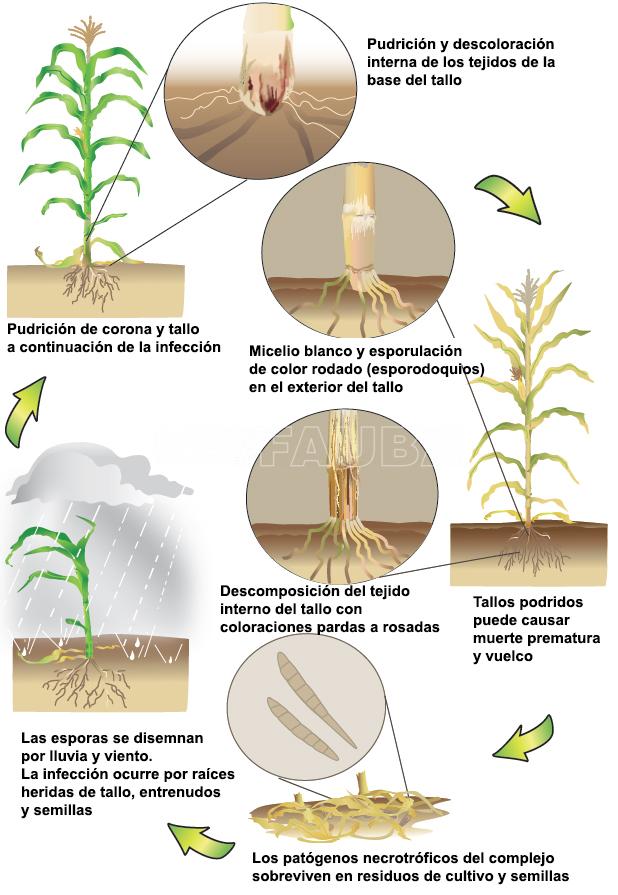
Ciclo de la enfermedad
El inóculo primario está presente en los rastrojos y en el suelo, iniciándose la infección en etapas tempranas del cultivo. La podredumbre de las raíces comienza en etapas vegetativas pero pasa desapercibida hasta que comienza la migración de fotosintatos de la base de los tallos a las espigas, con su consecuente debilitamiento. Como la mayoría de los agentes causales son habitantes de suelo, la enfermedad se considera monocíclica, ya que, aunque puede haber infecciones secundarias, las pérdidas dependen del inóculo presente en los lotes al momento de la siembra.
.
- Ciclo de la pudrición de la espiga por Fusarium. Autor: www.cropprotectionnetwork.org
.
- Ciclo de la pudrición del tallo por Fusarium. Autor: www.cropprotectionnetwork.org
.
Condiciones predisponentes
Todos los factores que causen stress en las plantas, que determinen tallos más delgados, sistema radicular pobre, migración temprana de fotosintatos desde la base del tallo, o heridas en los mismos, incrementan la susceptibilidad de las plantas a la podredumbre y el vuelco.
La enfermedad es más severa cuando existe un desbalance de nitrógeno en relación con el potasio, sobre todo una disminución de la provisión de nitrógeno en etapas avanzadas del ciclo, y un exceso de nitrógeno en relación al potasio en las primeras etapas.
Las enfermedades foliares como roya y tizón común, pueden predisponer a una mayor intensidad de las podredumbres de raíz y tallo, debido a que disminuye la eficiencia fotosintética y la provisión de hidratos acentuando el desequilibrio energético
El ataque de insectos que causan perforaciones en los tallos y raíces facilita la entrada de los patógenos.
Macrophomina phaseolina prevalece por sobre los otros agentes causales en años secos y calurosos.
.
Manejo de la enfermedad
* Híbridos tolerantes.
* Rotación de cultivos.
* Evitar alta densidad de siembra ya que en esas condiciones los tallos son más delgados y más predispuestos al vuelco.
*Controlar las enfermedades foliares
* Cosecha anticipada
* Siembra perpendicular a los vientos predominantes para facilitar la recolección de plantas volcadas.
* Mantener un balance nutricional entre N/K
* Mantener buen drenaje/manejo del riego
.
.
RESUMEN
.
Síntomas
* quebrado de tallo y vuelco de la planta
* decoloración externa e interna de los tallos
* haces vasculares desintegrados
* muerte precoz de plantas
* síntomas secundarios: plantas enfermas marchitas, las hojas alteran su color de verde brillante a verde opaco
.
Daños
* quebrado de tallo y vuelco de la planta
* contacto de espigas con el suelo en plantas volcadas
* muerte precoz de plantas
* reducción de la productividad de granos
* espigas con granos sueltos, leves o chuzos
.
Predisposición
* susceptibilidad del híbrido
* semilla infectada
* monocultura
* alta población de plantas
* presencia de plantas voluntarias
* presencia de hospedantes intermediarios
* desequilíbrio nutricional
* alta severidad de enfermedades foliares
.
Medidas de manejo integrado
* rotación de cultivos
* tratamiento de semillas con fungicida
* específico para hongos de semilla
* evitar sucesión con gramíneas
* manter equilíbrio nutricional (N y K)
* evitar estres hídrico
* evitar poblaciones de plantas por encima de lo indicado para cada híbrido
* híbridos tolerantes
.
.
.
- Pudrición de tallo de maíz por Fusarium. Autor: Ing. Agr. Guillermo Alonso
- Síntomas de Fusarium graminearum en tallo de maíz. Autor: Dirceu Gassen
- Autor: Alison Robertson.
- Autor: Gary-Munkvold
- Autor: Gary-Munkvold
- Autor: Gary-Munkvold
- Pudrición de espiga de maíz por Fusarium. Signo: micelio. Autor: Gary-Munkvold. Fuente: www.cropprotectionnetwork.org
- Autor: Alison Robertson.
- Autor: Alison Robertson.
- Autor: Alison Robertson. Fuente: www.cropprotectionnetwork.org
- Autor: Alison Robertson.
- Autor: Alison Robertson. Fuente: www.cropprotectionnetwork.org
- Pudrición de espiga por Diplodia. Autor: Tom Allen
- Pudrición de espiga por Diplodia. Autor: Tom Allen
- Pudrición de espiga por Diplodia. Autor: Tom Allen
.
.
.
.
Bibliografía
Andriolli, C.F., Casa, R.T., Kuhnem, P.R. et al. (2016) Timing of fungicide application for the control of Gibberella ear rot of maize. Tropical Plant Pathology 41(4): 264–269. doi: 10.1007/s40858-016-0095-3
, , , et al. (2024) Comparison of four inoculation methods and three Fusarium species for phenotyping stalk rot resistance among 22 maize hybrids (Zea mays). Plant Pathology 00: 1–12. doi: 10.1111/ppa.13874
Bakker MG, Brown DW, Kelly AC, Kim HS, Kurtzman CP, Mccormick SP (2018) Fusarium mycotoxins: a trans-disciplinary overview. Canadian Journal of Plant Pathology 40(2): 161-171. doi: 10.1080/07060661.2018.1433720
Bandara YMAY, Weerasooriya DK, Liu S, Little CR (2018) The Necrotrophic Fungus Macrophomina phaseolina Promotes Charcoal Rot Susceptibility in Grain Sorghum Through Induced Host Cell-Wall-Degrading Enzymes. Phytopathology 108(8): 948-956. doi: 10.1094/PHYTO-12-17-0404-R
Bhattacharya D, Dhar TK, Siddiqui KAI, Ali E (1994) Inhibition of seed germination by Macrophomina phaseolina is related to phaseolinone production. Journal of Applied Bacteriology 77: 129–133. doi: 10.1111/j.1365-2672.1994.tb03055.x
Bhattacharya D, Dhar TK, Ali E (1992) An enzyme immunoassay of phaseolinone and its application in estimation of the amount of toxin in Macrophomina phaseolina-infected seeds. Appl. Environ. Microbiol. 58: 1970-1974. doi: 10.1128/aem.58.6.1970-1974.1992
Battilani P, Lanubile A, Scala V, et al. (2018) Oxylipins from both pathogen and host antagonize jasmonic acid‐mediated defence via the 9‐lipoxygenase pathway in Fusarium verticillioides infection of maize. Molecular Plant Pathology 19: 2162-2176. doi: 10.1111/mpp.12690
Belisário R, Robertson AE, Vaillancourt LJ (2022) Maize Anthracnose Stalk Rot in the Genomic Era. Plant Disease 106(9): 2281-2298. doi: 10.1094/PDIS-10-21-2147-FE
Campos LJM, de Almeida REM, da Silva DD, et al. (2021) Physiological and biophysical alterations in maize plants caused by Colletotrichum graminicola infection verified by OJIP study. Trop. plant pathol. 46: 674–683. doi: 10.1007/s40858-021-00465-x
Cao Y, Wang Y, Gui C, et al. (2023) Beneficial Rhizobacterium Triggers Induced Systemic Resistance of Maize to Gibberella Stalk Rot via Calcium Signaling. Mol Plant Microbe Interact. 36(8): 516-528. doi: 10.1094/MPMI-08-22-0173-R
Capo L, Zappino A, Reyneri A, Blandino M (2020) Role of the Fungicide Seed Dressing in Controlling Seed-Borne Fusarium spp. Infection and in Enhancing the Early Development and Grain Yield of Maize. Agronomy 10, 784. doi: 10.3390/agronomy10060784
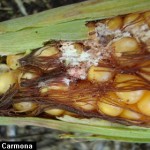
Carmona M, Reis E, Gally M (2006) Pudriciones del tallo y raíces del cultivo de maíz. Maíz en SD, AAPRESID: 86-89.
Carmona M, Scandiani M (2010) Las pudriciones de tallo y raíces del maíz Pudriciones por Fusarium. Plagas y Enfermedades AAPRESID: 131-138.
Carmona M, Scandiani M (2011) Importancia y control de Fusarium verticillioides en semillas de maíz. Propuesta para su manejo. Enfermedades Maiz, AAPRESID: 73-76.
Cavinder B, Sikhakolli U, Fellows KM, Trail F (2012) Sexual development and ascospore discharge in Fusarium graminearum. J Vis Exp. (61): 3895. doi: 10.3791/3895
Czembor E, Stępień Ł, Waśkiewicz A (2015) Effect of Environmental Factors on Fusarium Species and Associated Mycotoxins in Maize Grain Grown in Poland. PLoS ONE 10(7): e0133644. doi: 10.1371/journal.pone.0133644
da Costa RV, de Almeida REM, Cota LV, et al. (2023) Corn stunt disease complex increases charcoal rot (Macrophomina phaseolina) under field conditions. Trop. plant pathol. 48: 283–292. doi: 10.1007/s40858-023-00570-z
da Silva MP, Tylka GL, Munkvold GP (2016) Seed Treatment Effects on Maize Seedlings Coinfected with Fusarium spp. and Pratylenchus penetrans. Plant Disease 100(2): 431-437. doi: 10.1094/PDIS-03-15-0364-RE
Dhar TK, Siddiqui KAI, Ali E (1982) Structure of phaseolinone, a novel phytotoxin from Macrophomina phaseolina. Tetrahedron Letters 23: 5459-5462. doi: 10.1016/0040-4039(82)80157-3
de la Torre-Hernández ME, Sánchez-Rangel D, Galeana-Sánchez E, Plasencia-de la Parra J (2014) Fumonisinas –Síntesis y función en la interacción Fusarium verticillioides-maíz. TIP 17(1): 77-91. doi: 10.1016/S1405-888X(14)70321-3
Del Ponte EM, Moreira GM, Ward TJ, et al. (2022) Fusarium graminearum Species Complex: A Bibliographic Analysis and Web-Accessible Database for Global Mapping of Species and Trichothecene Toxin Chemotypes. Phytopathology 112(4): 741-751. doi: 10.1094/PHYTO-06-21-0277-RVW
Dinango VN, Dhouib H, Wakam LN, et al. (2024) Bacterial endophytes inhabiting desert plants provide protection against seed rot caused by Fusarium verticillioides and promote growth in maize. Pest Manag Sci, 80: 1206-1218. doi: 10.1002/ps.7850
, , , et al. (2022) Genetic variability and pathogenicity of Fusarium verticillioides isolates from the summer-sown maize regions in China. Plant Pathology: 1– 11. doi: https://doi.org/10.1111/ppa.13673
El-Ganainy SM, Mosa MA, Ismail AM, Khalil AE (2023) Lignin-Loaded Carbon Nanoparticles as a Promising Control Agent against Fusarium verticillioides in Maize: Physiological and Biochemical Analyses. Polymers 15(5): 1193. doi: 10.3390/polym15051193
Eranthodi A, González-Peña Fundora D, Montenegro Alonso AP, et al. (2022) Cerato-platanin protein 1 is not critical for Fusarium graminearum growth and aggressiveness, but its overexpression provides an edge to Fusarium head blight in wheat. Canadian Journal of Plant Pathology. doi: 10.1080/07060661.2022.2044910
Gai X, Dong H, Wang S, Liu B, Zhang Z, Li X, et al. (2018) Infection cycle of maize stalk rot and ear rot caused by Fusarium verticillioides. PLoS ONE 13(7): e0201588. doi: 10.1371/journal.pone.0201588
Gao X, Wu M, Xu R, et al. (2014) Root Interactions in a Maize/Soybean Intercropping System Control Soybean Soil-Borne Disease, Red Crown Rot. PLoS ONE 9(5): e95031. doi: 10.1371/journal.pone.0095031
Giomi GM, Sampietro DA, Velazco JG, et al. (2021) Map overlapping of QTL for resistance to Fusarium ear rot and associated traits in maize. Euphytica 217: 81. doi: 10.1007/s10681-021-02814-y
Görtz A, Oerke EC, Steiner U, et al. (2008) Biodiversity of Fusarium species causing ear rot of maize in Germany. 3rd In. FHB Symposium, Szeged, Hungary, 2008. pp. 617-622. doi: 10.1556/CRC.36.2008.Suppl.B.51
Goswami RS, Kistler HC (2004) Heading for disaster: Fusarium graminearum on cereal crops. Mol Plant Pathol. 5(6): 515-525. doi: 10.1111/j.1364-3703.2004.00252.x
Hao JJ, Xie SN, Sun J, et al. (2017) Analysis of Fusarium graminearum Species Complex from Wheat–Maize Rotation Regions in Henan (China). Plant Disease 101(5): 720-725. doi: 10.1094/PDIS-06-16-0912-RE
Hofgaard IS, Seehusen T, Aamot HU, et al. (2016) Inoculum Potential of Fusarium spp. Relates to Tillage and Straw Management in Norwegian Fields of Spring Oats. Frontiers in Microbiology 7: 556. doi: 10.3389/fmicb.2016.00556
Hou M, Cao Y, Zhang X, et al. (2023 )Genome-wide association study of maize resistance to Pythium aristosporum stalk rot. Front Plant Sci. 14: 1239635. doi: 10.3389/fpls.2023.1239635
Kebede AZ, Woldemariam T, Reid LM, et al. (2016) Quantitative trait loci mapping for Gibberella ear rot resistance and associated agronomic traits using genotyping-by-sequencing in maize. Theoretical and Applied Genetics 129(1): 17-29. doi: 10.1007/s00122-015-2600-3
Khambhati VH, Abbas HK, Sulyok M, et al. (2020) First Report of the Production of Mycotoxins and Other Secondary Metabolites by Macrophomina phaseolina (Tassi) Goid. Isolates from Soybeans (Glycine max L.) Symptomatic with Charcoal Rot Disease. Journal of Fungi 6(4): 332. doi: 10.3390/jof6040332
Kistner MB, Romero AM, Iglesias J (2022) Unravelling the complexity of maize resistance to bacterial and fungal diseases: an integrative perspective. Trop. plant pathol. doi: 10.1007/s40858-021-00486-6
Kouadri MEA, Zaim S, Bekkar AA (2021) First report of Macrophomina pseudophaseolina infecting Lens culinaris. Australasian Plant Dis. Notes 16: 26. doi: 10.1007/s13314-021-00440-0
Krishnan SV, Anaswara PA, Nampoothiri KM, et al. (2025) Biocontrol Activity of New Lactic Acid Bacteria Isolates Against Fusaria and Fusarium Mycotoxins. Toxins 17(2): 68. doi: 10.3390/toxins17020068
Lagogianni CS and Tsitsigiannis DI (2019) Effective Biopesticides and Biostimulants to Reduce Aflatoxins in Maize Fields. Frontiers in Microbiology 10: 2645. doi: 10.3389/fmicb.2019.02645
Lanubile A, Maschietto V, Borrelli VM, et al. (2017) Molecular Basis of Resistance to Fusarium Ear Rot in Maize. Front. Plant Sci. 8: 1774. doi: 10.3389/fpls.2017.01774
Lanza FE, Zambolim L, Costa RV, et al. (2017) Symptomatological aspects associated with fungal incidence and fumonisin levels in corn kernels. Tropical Plant Pathology 42(4): 304–308. doi: 10.1007/s40858-017-0148-2
Leyva-Madrigal KY, Sandoval-Castro E, CalderónVázquez CL, et al. (2017) Pathogenic and genetic variability of Fusarium verticillioides from maize in northern Mexico, Canadian Journal of Plant Pathology 39(4): 486-496. doi: 10.1080/07060661.2017.1378726
Lima WN, de Sousa Santos Alves CP, Negreiros AMP, et al. (2024) Macrophomina pseudophaseolina isolated from weeds is pathogenic against cowpea, mung bean, corn, and sorghum. Eur J Plant Pathol 168: 225–230. doi: 10.1007/s10658-023-02748-2
Mahato SB, Siddiqui KAI, Bhattacharya G, et al. (1987) Structure and stereochemistry of phaseolinic acid: A new acid from Macrophomina phaseolina. J. Nat. Prod. 50: 245–247. doi: 10.1021/np50050a024
Maschietto V, Colombi C, Pirona R, et al. (2017) QTL mapping and candidate genes for resistance to Fusarium ear rot and fumonisin contamination in maize. BMC Plant Biol 17: 20. doi: 10.1186/s12870-017-0970-1
Moschini R, Borsarelli M, Martinez M, et al. (2020) Analysis of preharvest meteorological conditions in relation to concentration of fumonisins in kernels of two genetically different maize hybrids. Australasian Plant Pathology 49: 665–677. doi: 10.1007/s13313-020-00742-4
MunkvoldGary P, WhiteDonald G (2015) Compendium of Corn Diseases, Fourth Edition. Diseases and Pests Compendium Series. American Phytopathological Society Press, St. Paul, MN. doi: 10.1094/9780890544945
O’Donnell K, Whitaker BK, Laraba I, et al. (2022) DNA Sequence-Based Identification of Fusarium: A Work in Progress. Plant Disease 106(6): 1597-1609. doi: 10.1094/PDIS-09-21-2035-SR
Omotayo OP, Babalola OO (2023) Fusarium verticillioides of maize plant: Potentials of propitious phytomicrobiome as biocontrol agents. Front. Fungal Biol. 4: 1095765. doi: 10.3389/ffunb.2023.1095765
Otaiza-González SN, Mary VS, Arias SL et al. (2022) Cell death induced by fumonisin B1 in two maize hybrids: correlation with oxidative status biomarkers and salicylic and jasmonic acids imbalances. Eur J Plant Pathol. doi: 10.1007/s10658-022-02469-y
Pfordt A, Ramos Romero L, Schiwek S, et al. (2020) Impact of Environmental Conditions and Agronomic Practices on the Prevalence of Fusarium Species Associated with Ear- and Stalk Rot in Maize. Pathogens 9(3): 236. doi: 10.3390/pathogens9030236
Quarantin A, Glasenapp A, Schäfer W, et al. (2016) Involvement of the Fusarium graminearum cerato-platanin proteins in fungal growth and plant infection. Plant Physiol Biochem. 109: 220-229. doi: 10.1016/j.plaphy.2016.10.001
Ramezani M, Shier WT, Abbas HK, et al. (2007) Soybean Charcoal Rot Disease Fungus Macrophomina phaseolina in Mississippi Produces the Phytotoxin (−)-Botryodiplodin but No Detectable Phaseolinone. Journal of Natural Products 70(1): 128-129. doi: 10.1021/np060480t
Reis EM, Baruffi D, Remor L, Zanatta M (2011) Decomposition of corn and soybean residues under field conditions and their role as inoculum source. Summa Phytopathologica 37(1): 65-67. doi: 10.1590/S0100-54052011000100011
Ridenour JB, Bluhm BH (2017) The novel fungal-specific gene FUG1 has a role in pathogenicity and fumonisin biosynthesis in Fusarium verticillioides. Molecular Plant Pathology 18: 513–528. doi: 10.1111/mpp.12414
Rogério F, Taati A, García-Rodríguez P, et al. (2023) First Report of Colletotrichum graminicola Causing Maize Anthracnose in Galicia, Northwestern Spain. Plant Disease. doi: 10.1094/PDIS-04-23-0729-PDN
Rose LJ, Mouton M, Beukes I, et al. (2016) Multi-environment Evaluation of Maize Inbred Lines for Resistance to Fusarium Ear Rot and Fumonisins. Plant Disease 100(10): 2134-2144. doi: 10.1094/PDIS-11-15-1360-RE
Sampietro DA, Belizana MM, Baptista ZP, et al. (2014) Essential oils from Schinus species of northwest Argentina: Composition and antifungal activity. Nat Prod Commun. 9(7): 1019-22. doi: 10.1177/1934578X1400900734
Shier TW, Nelson J, Abbas HK, Baird RE (2012) Root Toxicity of the Mycotoxin Botryodiplodin in Soybean Seedlings. Toxicon 60(2): 163. doi: 10.1016/j.toxicon.2012.04.134
Singh R, Goodwin SB (2022) Exploring the Corn Microbiome: A Detailed Review on Current Knowledge, Techniques, and Future Directions. PhytoFrontiers™ 2: 158-175. doi: 10.1094/PHYTOFR-04-21-0026-RVW
, , , (2021) A natural two-nucleotide deletion affirms role for NADPH oxidase in pathogenicity and perithecium formation in Fusarium graminearum species complex. Plant Pathology 00: 1– 9. doi: 10.1111/ppa.13499
van Rensburga BJ, Mc Laren NW, Schoeman A, Flett BC (2016) The effects of cultivar and prophylactic fungicide spray for leaf diseases on colonisation of maize ears by fumonisin producing Fusarium spp. and fumonisin synthesis in South Africa. Crop Protection 79: 56-63. doi: 10.1016/j.cropro.2015.10.009
Venturini G, Toffolatti SL, Assante G, et al. (2015) The influence of flavonoids in maize pericarp on fusarium ear rot symptoms and fumonisin accumulation under field conditions. Plant Pathology 64: 671–679. doi: 10.1111/ppa.12304
Vicente I, Quaratiello G, Baroncelli R, et al. (2022) Insights on KP4 Killer Toxin-like Proteins of Fusarium Species in Interspecific Interactions. Journal of Fungi 8(9): 968. doi: 10.3390/jof8090968
Wang Y, Zhou Z, Gao J, et al. (2016) The Mechanisms of Maize Resistance to Fusarium verticillioides by Comprehensive Analysis of RNA-seq Data. Frontiers in Plant Science 7: 1654. doi: 10.3389/fpls.2016.01654
Wang D, Zhang Y, Zhou S, et al. (2023) Gcc1 homologs regulate growth, oxidative stress, conidiation and appressorium formation in Colletotrichum siamense and Colletotrichum graminicola. Microb Pathog. 182: 106249. doi: 10.1016/j.micpath.2023.106249
Zaccaron AZ, Woloshuk CP, Bluhm BH (2017) Comparative genomics of maize ear rot pathogens reveals expansion of carbohydrate-active enzymes and secondary metabolism backbone genes in Stenocarpella maydis. Fungal Biology 121: 966-983. doi: 10.1016/j.funbio.2017.08.006
Zhang H, Mukherjee M, Kim J-E, et al. (2017) Fsr1, a striatin homologue, forms an endomembrane-associated complex that regulates virulence in the maize pathogen Fusarium verticillioides. Molecular Plant Pathology (in press). doi: 10.1111/mpp.12562
, , , et al. (2023) Integrative transcriptome and proteome analysis reveals maize responses to Fusarium verticillioides infection inside the stalks. Molecular Plant Pathology 00: 1– 18. doi: 10.1111/mpp.13317