.
Condición fitosanitaria: Presente
Grupo de cultivos: Hortícolas
Especie hospedante: Brassicaceae (crucíferas), como la colza canola (Brassica napus), rábano (Raphanus sativus), coliflor (Brassica oleracea var. botrytis), brócol (Brassica oleracea var. italica), nabo (Brassica rapa rapa) y repollo (Brassica oleracea), (en orden decreciente de susceptibilidad).
Etiología: Protozoa
Agente causal: Plasmodiophora brassicae Woronin 1877
Taxonomía: Eukaryota > Sar > Rhizaria > Endomyxa > Phytomyxea > Plasmodiophorida > Plasmodiophoridae > Plasmodiophora
.
La enfermedad Clubroot, causada por Plasmodiophora brassicae Wor., se considera una de las enfermedades más destructivas de la producción de col. P. brassicae es un patógeno con capacidad de supervivencia en el suelo durante mucho tiempo en ausencia de hospedante, como esporas en reposo. P. brassicae alguna vez fue referido como moho limoso (Myxomycetes), pero luego fue transferido a los plasmodiofóridos, un grupo de protistas patógenos de plantas. Tienen en común con los hongos una pared celular quitinosa de las esporas en reposo, pero las características distintivas que incluyen división nuclear cruciforme, zoosporas secundarias biflageladas, plasmodios multinucleados, esporas en reposo uninucleadas y falta de crecimiento filamentoso hacen que los plasmodiofóridos sean claramente divergentes de los hongos y oomicetos (Javed et al., 2023).
Con el avance de la secuenciación del ADN, se demostró que los plasmodiofóridos pertenecen a Phytomyxea (Endomyxa) en el grupo eucariota Rhizaria. Phytomyxea consta de parásitos biotróficos obligados de algas pardas, oomicetos (Phagomyxids) y una amplia gama de plantas hospedantes (Plasmodiophorids) y el recientemente descrito Marinomyxa. Junto con el patógeno causante del Clubroot, el agente causal de la sarna en polvo de la papa, Spongospora subterranea, es otro miembro patógeno vegetal bien conocido de Phytomyxea.
.
.
Antecedentes
La Hernia de las Cruciferas es una enfermedad cosmopolita y es una de las enfermedades más importantes de las crucíferas en todo el mundo (Dixon, 2009).
.
Sintomatología
* La Hernia de las Cruciferas o Clubroot es una enfermedad que afecta a las plantas de la familia Brassicaceae.
* Las plantas infectadas se atrofian, se marchitan fácilmente y pueden tener hojas amarillentas.
* Las raíces de las plantas infectadas se hinchan en formas gruesas e irregulares.
El síntoma característico es una consecuencia de la hiperplasia y la hipertrofia de los tejidos infectados.
Los síntomas más comunes incluyen: sobrecrecimiento, agallas y malformación del sistema radical, lo cual disminuye el vigor de la planta, genera marchitez y clorosis foliar y, en casos más severos, la muerte de la planta. Ocasionalmente, se pueden observar brotes secundarios provenientes de la raíz.
.
- Autor: University of Minnesota
- Raíces hinchadas y distorsionadas causadas por la hernia de las coles. Autor: University of Minnesota
.
.
Ciclo de la enfermedad
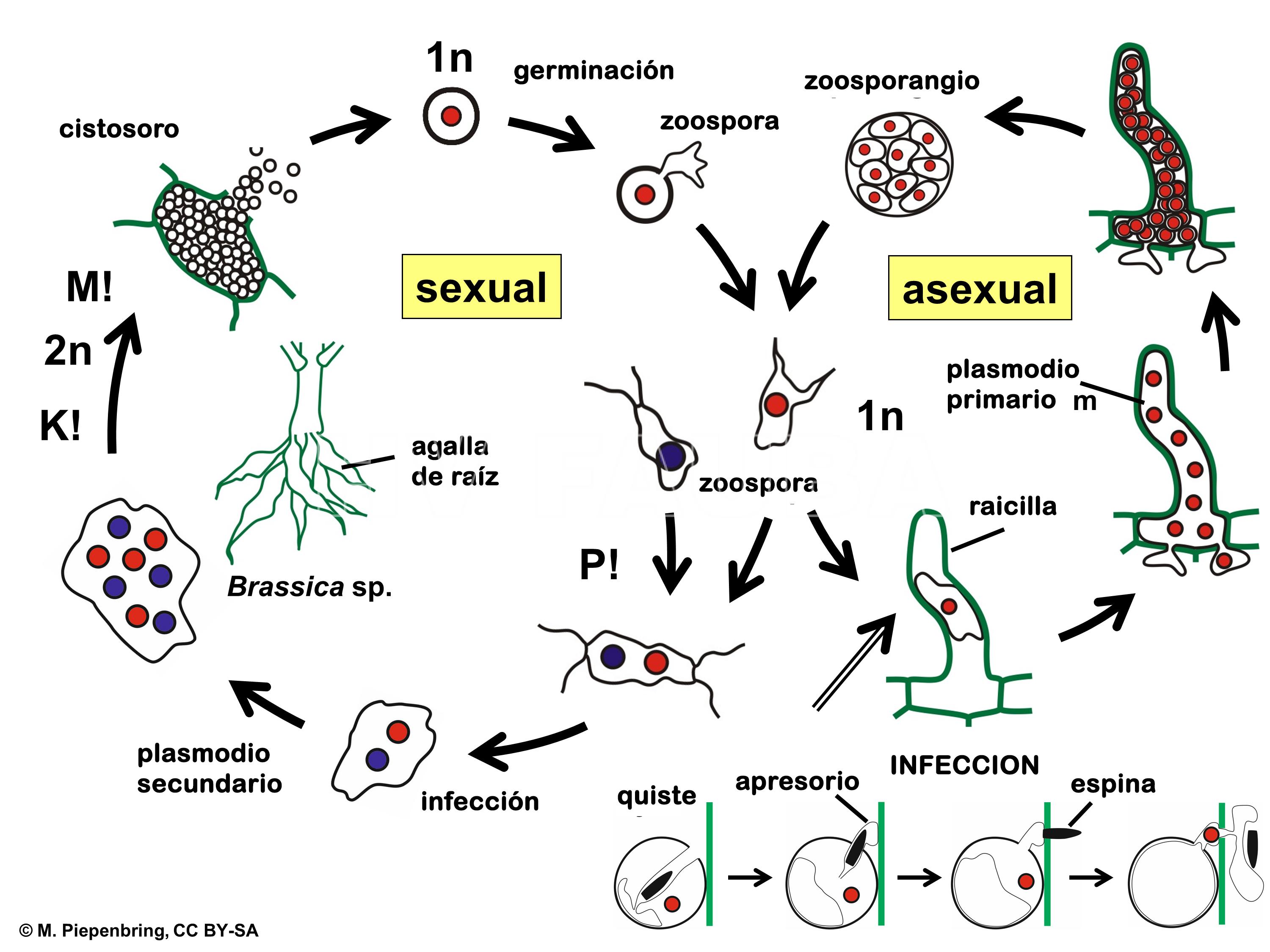
Plasmodiophora brassicae sobrevive como esporas que permanecen latentes en el suelo, sin necesidad de un hospedante. Sin embargo, requiere de la presencia de plantas crucíferas para germinar e iniciar su ciclo. El ciclo de la enfermedad se puede dividir en dos:
Infección primaria: durante el trasplante, pelos radicales y raicillas de plantines son infectados por esporas móviles (zoosporas), germinadas desde esporas latentes en el suelo y estimuladas por la presencia de raíces de crucíferas.
Infección secundaria: las zoosporas liberadas de los pelos radicales re-infectan y colonizan las células de la raíz hospedante, formando el cuerpo del patógeno (plasmodio). A medida que los plasmodios crecen, las células cercanas son estimuladas para crecer y dividirse de forma anormal, lo cual explica la malformación radical. Los plasmodios crean zoosporas o esporas de reposo que se liberan al suelo a medida que la raíz infectada se pudre, volviendo a empezar el ciclo de infección.
El patógeno se disemina a largas distancias principalmente por movimientos de suelo, maquinaria agrícola, presencia de restos de raíces y plantines infectados. Además, debido a la presencia de esporas móviles, puede transportarse por agua a cortas distancias. No se transmite por semillas; sin embargo, la semilla puede venir externamente contaminada con este patógeno (semilla infestada).
.
.
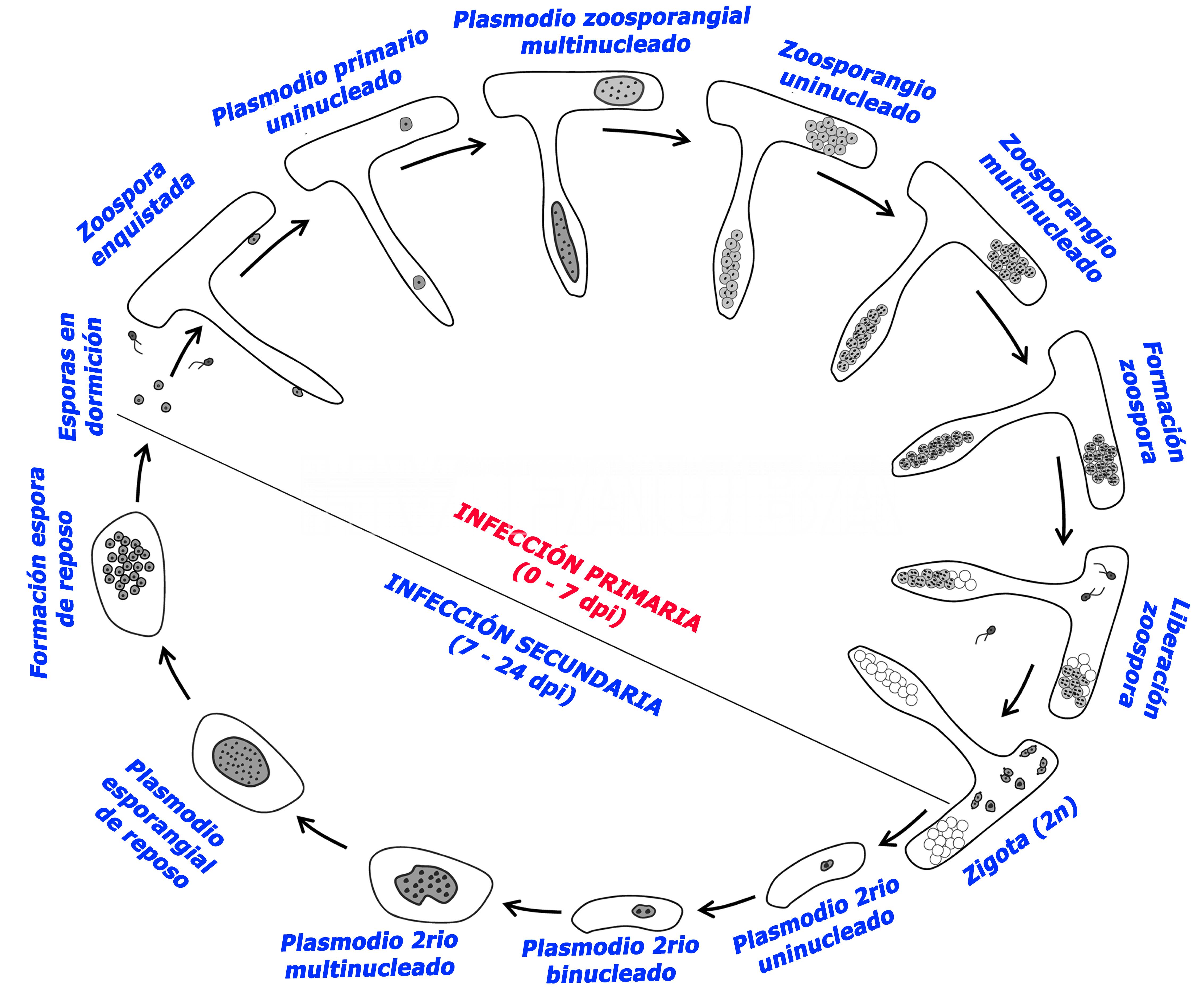
- Diagrama del ciclo de vida refinado de Plasmodiophora brassicae. Autor: Liu et al., 2020.
.
- El ciclo de vida de Plasmodiophora brassicae consta de dos fases principales. La fase uno es una etapa esporangial que dará lugar a una zoospora de vida corta. La segunda etapa conduce a una fase esporógena que crea esporas persistentes en reposo. Dentro de las dos fases, P. brassicae tiene tres etapas distintas dentro de su ciclo de vida. Comenzando por sobrevivir dentro del suelo, desde allí encontrará un hospedante e infectará los pelos radiculares de la planta, y finalmente iniciará la infección cortical.
.
En la figura se muestra el diagrama del ciclo de vida refinado de Plasmodiophora brassicae (Liu et al., 2020). El ciclo de vida de P. brassicae implica una infección primaria en los pelos radiculares del hospedante y las células epidérmicas, y una infección secundaria en los tejidos corticales. Fase de infección primaria: la infección primaria comienza con esporas en reposo en el suelo que germinan para producir zoosporas primarias. Luego, una zoospora primaria enquistada perfora la pared de la célula hospedante; se produce un plasmodio primario uninucleado en los pelos radiculares o en las células epidérmicas (1 día después de la inoculación [dpi]); luego un plasmodio zoosporangial multinucleado resulta de divisiones mitóticas del plasmodio primario uninucleado (1 a 3 dpi); después se produce un grupo zoosporangial uninucleado por escisión del citoplasma del plasmodio zoosporangial multinucleado (3 a 4 dpi); luego se forma un zoosporangio multinucleado por divisiones mitóticas del zoosporangio uninucleado; las zoosporas secundarias uninucleadas se producen dentro de cada zoosporangio multinucleado después de las escisiones del citoplasma; las zoosporas secundarias se liberan de cada zoosporangio en la luz de los pelos radiculares o células epidérmicas (a partir de 4 dpi); y un cigoto uninucleado diploide (2n) resulta de la conjugación de dos zoosporas secundarias uninucleadas haploides (n) en la célula epidérmica de la raíz. Fase de infección secundaria: se forma un plasmodio secundario uninucleado después del inicio de la infección secundaria en la célula cortical (8 dpi); luego un plasmodio secundario binucleado formado por una división mitótica del plasmodio secundario uninucleado (10 dpi); después un plasmodio secundario multinucleado producido por divisiones mitóticas continuas del plasmodio secundario binucleado (aproximadamente 15 dpi); a continuación un plasmodio esporangial en reposo multinucleado haploide resultante de una división meiótica del plasmodio secundario multinucleado; y finalmente esporas uninucleadas haploides (n) en reposo, que se producen después de escisiones citoplasmáticas del plasmodio esporangial en reposo (24 dpi).
.
.
Condiciones favorables para el desarrollo de la enfermedad
* Monocultivo de crucíferas, plantas voluntarias y malezas hospedantes.
* Suelos arcillosos, mal drenados y/o compactados.
* Suelos ácidos (pH < 6.5).
* Acidificación del suelo por fertilización
.
Manejo Integrado
El manejo debe ser esencialmente preventivo, ya que no existe un control químico efectivo para esta enfermedad.:
* Tanto en plantineras como en el campo se debe utilizar un sustrato o suelo libre de este patógeno. Para ello, es recomendable disminuir la densidad de inóculo presente en el suelo, incorporando la solarización o aplicación de fumigantes al proceso productivo.
* Evitar los movimientos de suelo y desinfectar los equipos de trabajo y laboreo agrícola.
* Reducir el escurrimiento superficial para reducir el movimiento de esporas.
* Eliminar malezas hospederas durante períodos de descanso y de cultivos sin crucíferas.
* Rotaciones largas (al menos 2 años) con avena, leguminosas y otras especies no hospederas.
* En suelos ácidos (pH<6,5), encalar con cal viva. Al fertilizar con nitrógeno, preferir nitrato de calcio y nitrato de boro.
* En el caso de presentar un foco de hernia, eliminar las plantas infectadas y sembrar cereales en el área afectada. Las plantas infectadas deben compostarse o enterrarse en el lugar.
.
.
.
Bibliografía
Buczacki ST (1983) Plasmodiophora. An inter-relationship between biological and practical problems. Pages 161-191 in: Zoosporic Plant Pathogens. S. T. Buczacki, ed. Academic Press, London.
Channon AG, Maude RB (1971) Vegetable diseases. Pages 323-363 in: Diseases of Crop Plants. J. H. Western, ed. Macmillan and Co., New York.
Dixon GR (2009) The Occurrence and Economic Impact of Plasmodiophora brassicae and Clubroot Disease. J Plant Growth Regul 28: 194–202. doi: 10.1007/s00344-009-9090-y
, , (2022) Grasses and field crops reduce the concentration of resting spores of Plasmodiophora brassicae in soil under controlled conditions. Plant Pathology 00: 1– 8. doi: 10.1111/ppa.13601
, , , et al. (2023) The clubroot pathogen Plasmodiophora brassicae: A profile update. Molecular Plant Pathology 24: 89– 106. doi: 10.1111/mpp.13283
(2011) Mechanisms of the biofungicide Serenade (Bacillus subtilis QST713) in suppressing clubroot. Biocontrol Science and Technology 21: 1351-1362. doi: 10.1080/09583157.2011.618263
Lahlali R, Peng G, Gossen BD, et al. (2013) Evidence that the biofungicide Serenade (Bacillus subtilis) suppresses clubroot on canola via antibiosis and induced host resistance. Phytopathology 103(3): 245-54. doi: 10.1094/PHYTO-06-12-0123-R
Liu L, Qin L, Zhou Z, et al. (2020) Refining the Life Cycle of Plasmodiophora brassicae. Phytopathology 110(10): 1704-1712. doi: 10.1094/PHYTO-02-20-0029-R
Padrón-Rodríguez L, Cerdán Cabrera CR, Sánchez Coello NG, et al. (2022) Plasmodiophora brassicae in Mexico: From Anecdote to Fact. Plant Dis. 106(7): 1832-1836. doi: 10.1094/PDIS-11-21-2607-RE
Struck C, Rüsch S, Strehlow B (2022) Control Strategies of Clubroot Disease Caused by Plasmodiophora brassicae. Microorganisms 10(3): 620. doi: 10.3390/microorganisms10030620