.
Condición fitosanitaria: Presente
Grupo de cultivos: Cereales
Especie hospedante: Arroz (Oryza sativa)
Rango de hospedantes: amplio, no específico
Epidemiología: monocíclica, subaguda.
Etiología: Hongo. Necrotrófico
Agente causal:
Nakataea oryzae (Cattaneo) J. Luo & N. Zhang, 2013; syn Sclerotium oryzae Catt., 1877 (sinamorfo) (*)
Magnaporthe salvinii (Catt.) Krause and Webster. (teleomorfo)
.
Taxonomía: Eukaryota > Fungi > Dikarya > Ascomycota > Pezizomycotina > Sordariomycetes > Magnaporthales > Magnaporthaceae > Nakataea
.
(*) Anamorfo: estadio reproductivo asexual (morfo). Cuando un hongo solo produce múltiples anamorfos morfológicamente distintivos, se denominan sinanamorfos
.
- Conidios de Nakataea oryzae formados en el interior del tallo de Oryza sativa. Autor: Dra. María Águeda Cúndom
- Esclerocios de Nakataea oryzae formados en el interior del tallo de Oryza sativa. Autor: Dra. María Águeda Cúndom
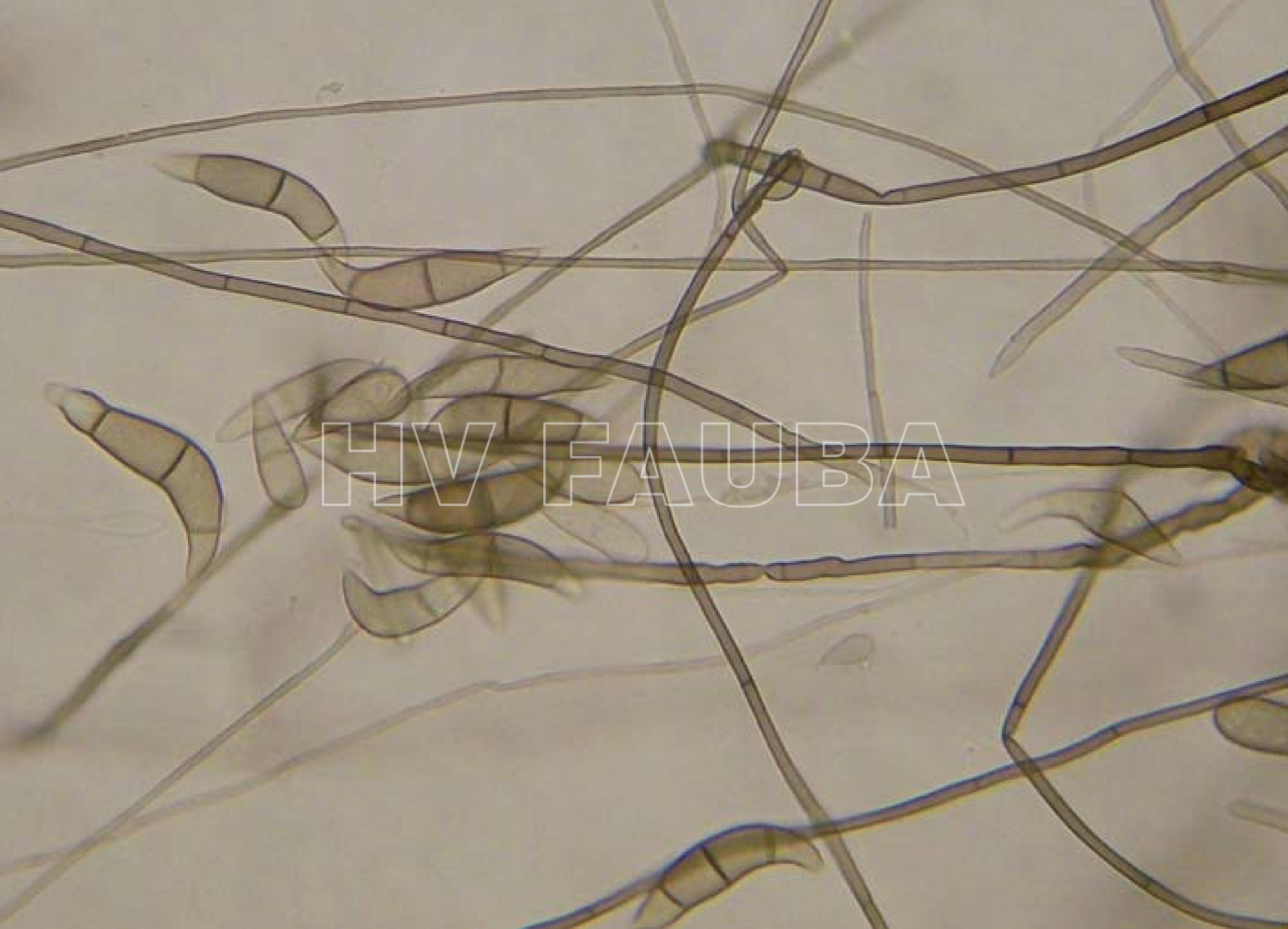
- A. Ascoma. B-C. Ascos. D-E. Ascosporas. F – G. Conidióforos. H – J. Conidios. D. Asco y ascosporas. K – L. Esclerocios. M. Hyphopodium. Barras de escala: A = 400 µm; B – E = 20 µm; F – J, M = 10 µm; K – L = 200 µm. Autor: Luo y Zhang, 2013, 2021
.
.
.
Sintomatología
- Autor: Dra. María Águeda Cúndom
- Autor: Dra. María Águeda Cúndom
- Autor: Pramesh et al., 2017
.
Ciclo de la enfermedad
El patógeno sobrevive como esclerocios, los que se producen abundantemente en tallos y vainas de las plantas de arroz infectadas, a medida que progresa la enfermedad y el desarrollo fisiológico del cultivo (Webster, 1992). Estos esclerocios son incorporados al suelo (durante la cosecha y al realizarse diferentes prácticas de manejo durante la siguiente siembra) o permanecen sobre su superficie. Asimismo, en los restos culturales (rastrojo) que permanecen sobre el suelo continúan formándose nuevos esclerocios si las condiciones de temperatura y humedad son favorables. Por lo tanto, los esclerocios constituyen en la principal fuente de inóculo primario de la enfermedad (Ou, 1985; Cintas y Webster, 2001). Estos pueden permanecer viables en el suelo durante muchos años.
Cuando el arrozal es inundado en la siguiente estación del cultivo, los esclerocios que se encuentran en el suelo y en el rastrojo, al ser hidrófobos, flotan en la superficie del agua y al entrar en contacto con las vainas foliares de las plantas nuevas de arroz, germinan e infectan los tejidos a la altura de la línea de agua para luego penetrar en el tallo. A medida que la enfermedad progresa, los tejidos van muriendo y nuevos esclerocios se forman abundantemente, pudiendo ser diseminados por el agua de irrigación de un campo a otro.
.
.
.
Bibliografía
Asselborn M, Pedraza MV (2021) Nakatea oryzae –Sclerotium sclerotium oryzae en raquis de panoja arroz en Entre Ríos, Argentina. 5° Congreso Argentino de Fitopatología. 59° Reunión de la División Caribe de la APS / Asociación Argentina de Fitopatólogos; American Phytopathological Society – Caribbean Division, 22 y 23 de septiembre de 2021, modalidad virtual.
, , , et al. (2023) Two nucleotide sugar transporters are important for cell wall integrity and full virulence of Magnaporthe oryzae. Molecular Plant Pathology 24: 374– 390. doi: 10.1111/mpp.13304
Cintas NA, Webster RK (2001) Effects of rice management on Sclerotium oryzae inoculum, stem rot severity, and yield of rice in California. Plant Dis. 85: 1140-1144. doi: 10.1094/PDIS.2001.85.11.1140
Cúndom MA (2010) Evaluación del potencial de inóculo de Sclerotium oryzae en relación con la incidencia de la podredumbre del tallo en arrozales de la provincia de Corrientes. Tesis de Maestría en Protección Vegetal, Facultad de Ciencias Agrarias, UNNE, Páginas: 54. Link
Cúndom MA, Popoff OF, López SE (2011) Umbral de inóculo para la pudrición del tallo del arroz en Corrientes, Argentina. 2º Cogreso Fitopatológico Argentino. Libro de Resúmenes: 192 (Ep-HyS). Mar del Plata, Buenos Aires. 1-3 de junio. Pág. 414. ISBN/ISSN: 978-987-544-389-1
Lee GH, Min CW, Jang JW, et al. (2023) Analysis of post-translational modification dynamics unveiled novel insights into Rice responses to MSP1. J Proteomics. 287: 104970. doi: 10.1016/j.jprot.2023.104970
Luo J, Zhang N (2013) Magnaporthiopsis, a new genus in Magnaporthaceae (Ascomycota). Mycologia 105(4): 1019–1029. doi: 10.3852/12-359
Luo J, Zhang N (2021) The Rice Blast Fungus and Allied Species: A Monograph of the Fungal Order Magnaporthales. Link
Maidment HR, Shimizu M, Vera S, et al. (2022) Effector target-guided engineering of an integrated domain expands the disease resistance profile of a rice NLR immune receptor. bioRxiv 2022.06.14.496076; doi: 10.1101/2022.06.14.496076
Mazzanti de Castañón MA, Gutiérrez SA (2001) Enfermedades del cultivo del arroz en Argentina. Resumen. Fitopatol. Bras. 26 (Supl.): 471-472. Sao Pedro. Brasil.
Ou SH (1985) Rice Diseases. 2nd ed. Kew, Surrey, England, Commonwealth Mycological Institute. 380 p.
Pramesh D, Saddamhusen Alase M, Kirana K, Muniraju KM (2017) Incidence of Stem Rot Disease in North-Eastern Region of Karnataka, India. Int.J.Curr.Microbiol.App.Sci. 6(10): 3007-3013. doi: 10.20546/ijcmas.2017.610.354
Ryder LS, Lopez SG, Michels L, et al. (2023) A molecular mechanosensor for real-time visualization of appressorium membrane tension in Magnaporthe oryzae. Nat Microbiol. 8(8): 1508-1519. doi: 10.1038/s41564-023-01430-x