.
Condición fitosanitaria: Presente
Grupo de cultivos: Hortícolas
Especie hospedante: Zanahoria (Daucus carota)
Rango de hospedantes: no específico / amplio. El patógeno puede infectar un amplio rango de plantas leñosas y herbáceas, atacando a más de 200 especies de plantas de cultivos en más de 137 géneros de plantas en muchas familias, pero principalmente se ven afectados los miembros de las familias Fabaceae, Solanaceae y Cucurbitaceae, incluyendo cultivos como tomate, poroto, maní, batata, soja, algodón, tabaco, achicoria, yuca amarilla (Manihot esculenta), entre otros (Otani, 1962; Geldenhuis et al., 2006; Coumans et al., 2011; Prinsloo et al., 1991; Tabachnik et al., 1979; Gayed, 1972; Koike y Henderson, 1998; Mondal et al., 2004; Nehl et al., 2004; Cedeño et al., 2016; Martino et al., 2021). Además, es un patógeno importante de poscosecha en las zanahorias de mercado fresco (Punja et al., 1992).
Epidemiología: monocíclica, subaguda.
Etiología: Hongo. Necrotrófico
Agente causal: Berkeleyomyces basicola (Nel et al., 2018)
syn Thielaviopsis (T.) basicola (Berk. & Broome) Ferraris (= Chalara elegans Nag Raj & W.B. Kendr.)
syn Chalaropsis thielavioides
syn Torula basicola Berk. & Broome, 1850
syn Thielavia basicola (Berk. & Broome) Zopf, 1876
.
Taxonomía: Eukaryota > Fungi > Dikarya > Ascomycota > Pezizomycotina > Sordariomycetes > Hypocreomycetidae > Microascales > Ceratocystidaceae > Berkeleyomyces
.
Berkeleyomyces basicola y B. rouxiae, son dos especies hermanas previamente denominadas colectivamente como Thielaviopsis basicola, que pertenecen a la familia Ceratocystidaceae (Microascales, Ascomycota). B. basicola es un hongo de suelo con distribución mundial (Nag Raj y Kendrick, 1975). Tiene un amplio rango de hospedantes y se ha encontrado en más de 137 géneros de plantas (Yarwood, 1981).
No se ha observado ningún estado sexual para T. basicola, aunque estudios filogenéticos basados en ADN indican que reside con Ceratocystis en las Microascales (Paulin-Mahady et al., 2002). El patógeno es haploide y se reproduce a través de endoconidios y clamidosporas de paredes gruesas, lo que le permite sobrevivir en el suelo durante largos períodos de tiempo (Nag Raj y Kendrick, 1975).
.
.
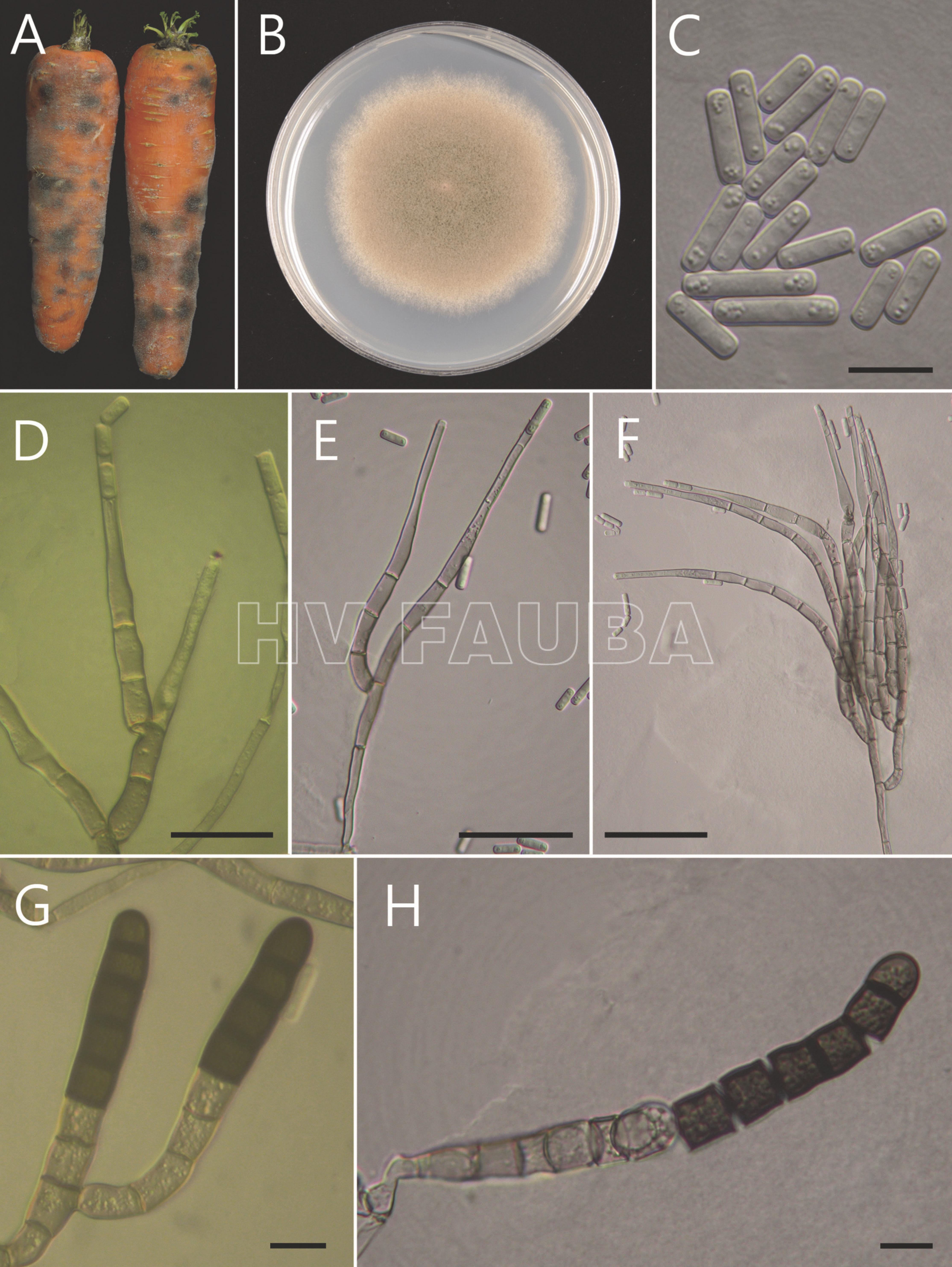
- Berkeleyomyces basicola. (A) Síntoma en zanahorias. (B) Colonia en PDA. (C) Conidios. (D-F) Conidióforos, células conidiógenas fialídicas y conidios. (G) Clamidosporas. (H) Fragmentación de clamidosporas. Barras: C, G y H = 10 μm. D-F = 30 µm. Autor: Huang y Chen, 2010.
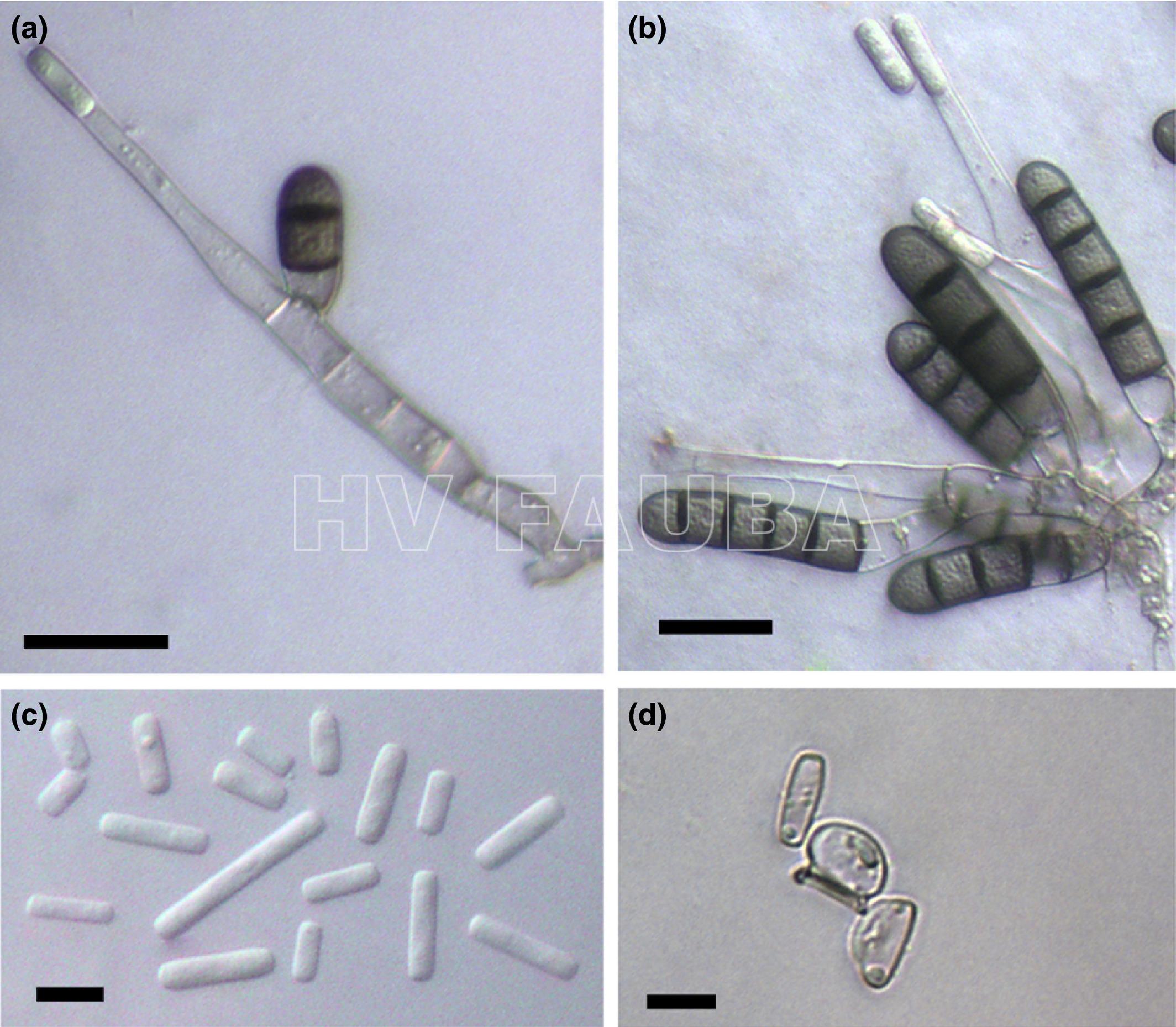
- Estructuras de Berkeleyomyces basicola. (a) Fialuro terminal que da lugar a un endoconidio y una clamidospora de transmisión lateral que contiene dos tabiques; (b) Grupo de clamidosporas y fialidas; (c) Endoconidios; (d) Dos conidios secundarios con un endoconidio. Escala: (a, b) 20 μm; (c, d) 10 micras. Autor: Nel et al., 2018.
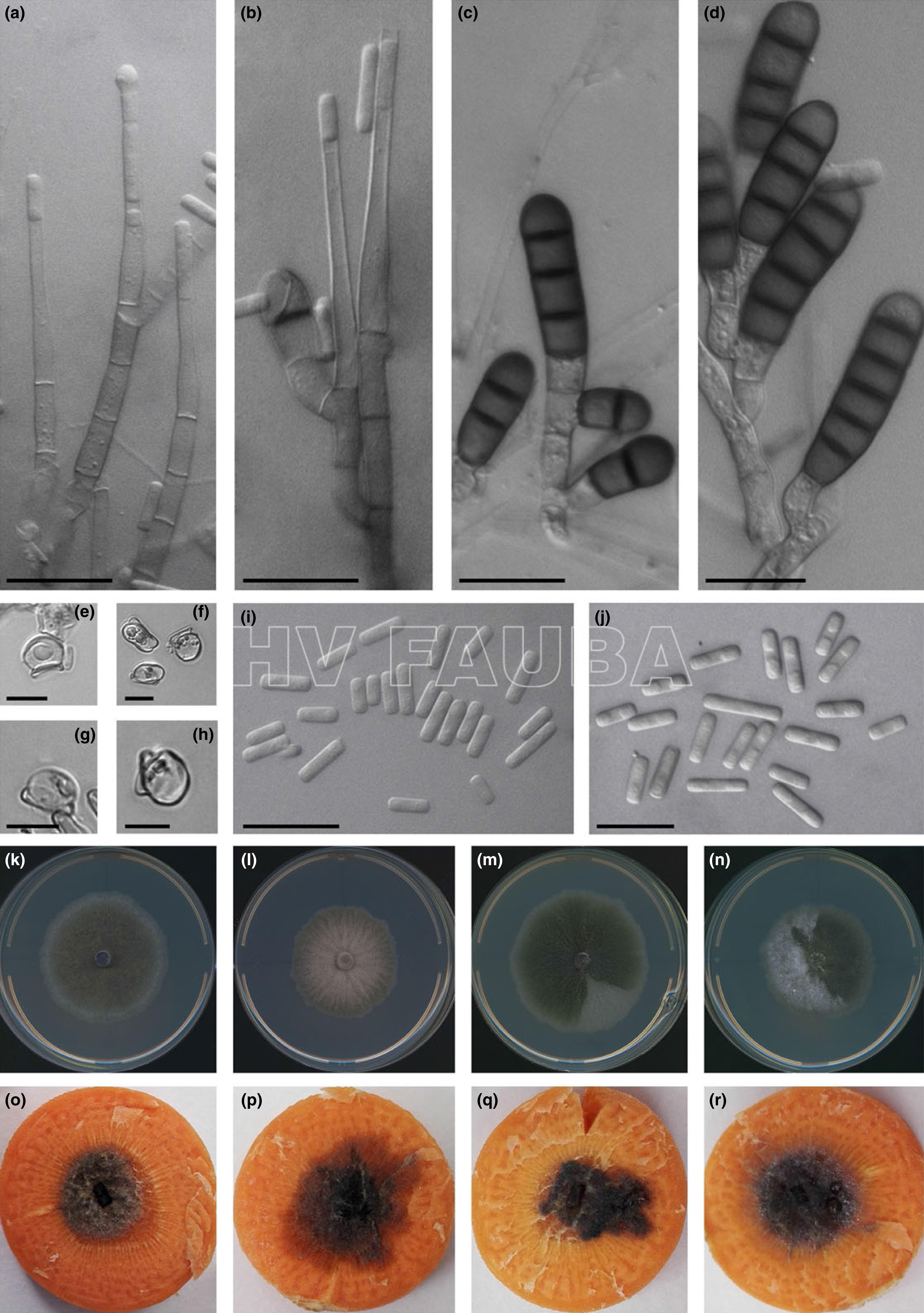
- Características morfológicas de Berkeleyomyces basicola y B. rouxiae. (a, b) Fialides; (c, d) clamidosporas; (e – h) clamidosporas secundarias; (i, j) endoconidios; (k – n) cuatro variantes culturales diferentes de B. basicola; (o – r) síntomas de pudrición de raíz negra inducidos en discos de zanahoria utilizando diferentes aislamientos de B. basicola y B. rouxiae. Barras de escala = 25 um. Autor: Nel et al., 2019
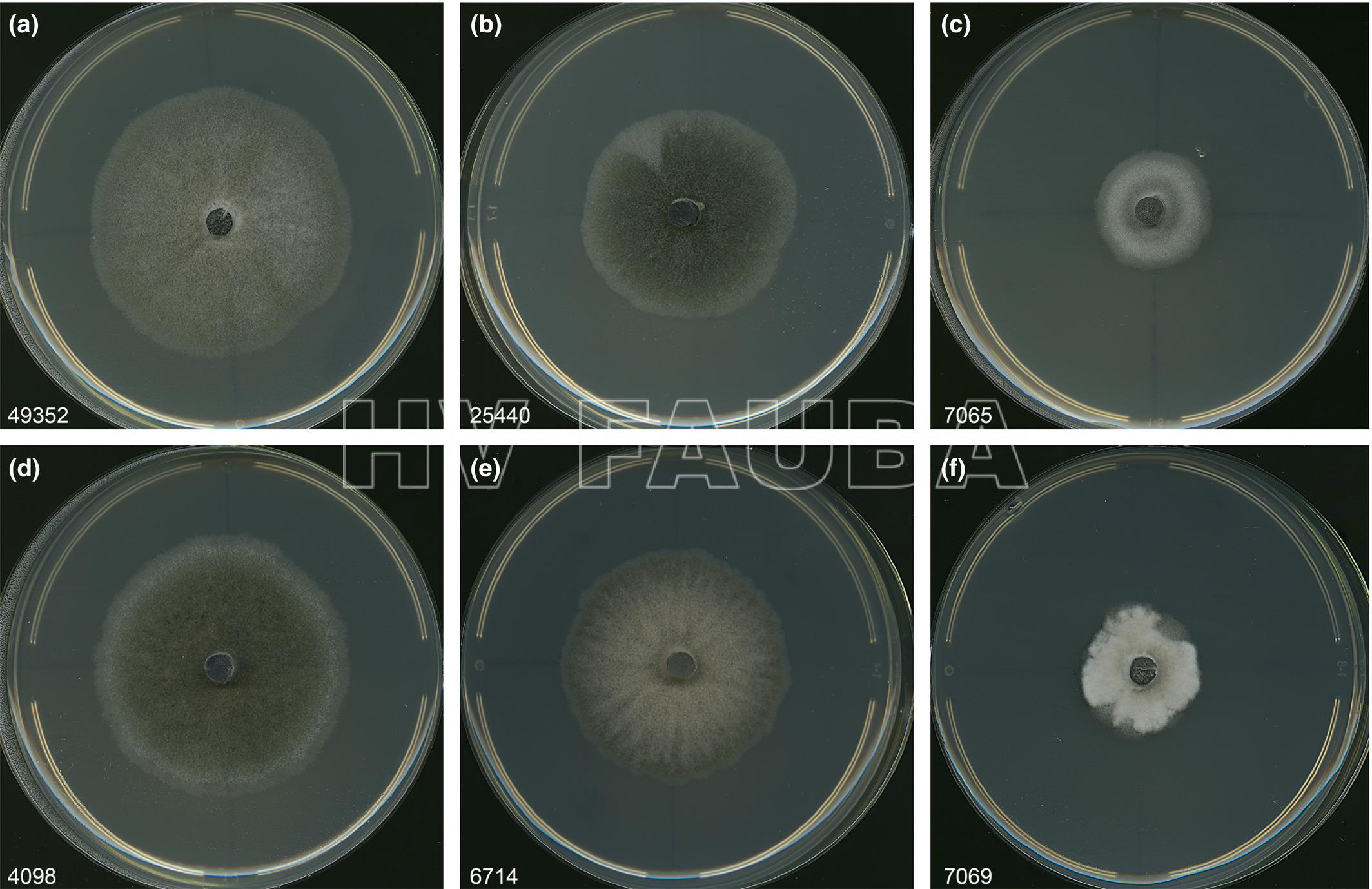
- Variaciones morfológicas dentro de la especie Berkeleyomyces basicola. Los aislamientos se cultivaron durante 10 días a 25 °C. Autor: Nel et al., 2018.
- Clamidosporas de Berkeleyomyces basicola. Autor: Björn Sothmann
.
.
.
Sintomatología
En muchos hospedantes, el hongo invade la corteza de la raíz, causando la pudrición negra de la raíz.
.
- Síntomas de pudrición negra poscosecha de zanahoria y ensayo de patogenicidad. (a) zanahorias naturalmente infectadas con lesiones negras circulares con micelio blanco a negro, tomadas del mercado. (b) zanahorias infectadas naturalmente con lesiones expansivas cubiertas de micelio blanco a negro después de 12 días a temperatura ambiente. Izquierda, Thielaviopsis thielavioides (Berkeleyomyces basicola); derecha, Ceratocystis fimbriata, con peritecios negros (zoom). (c) zanahorias 2 semanas después de la inoculación con aislamientos de T. thielavioides (izquierda, las 2 primeras zanahorias), y con aislamientos de C. fimbriata (las dos del medio); control de zanahoria tratada con agua (derecha, ultima zanahoria). Autor: Xu et al., 2020
- Fuente: diArk.com
.
- Pudrición negra de la raíz de plántulas voluntarias de soja en Australia, causada por Berkeleyomyces basicola. Autor: Mondal et al., 2004
.
.
Ciclo de la enfermedad
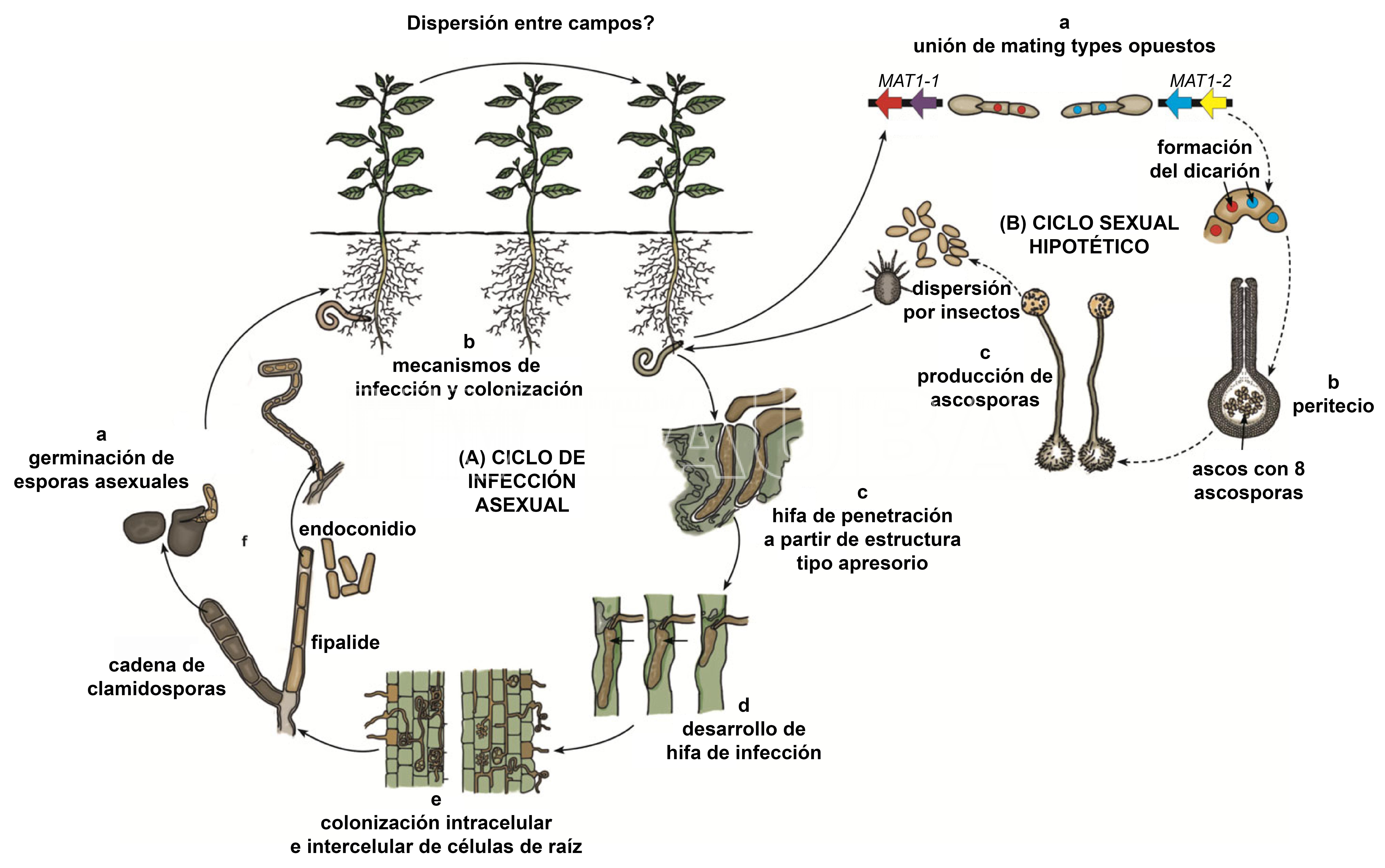
Las clamidosporas (a) de paredes gruesas en el suelo germinan en presencia de exudados de las raíces del hospedante. Los tubos germinativos crecen para entrar en contacto con el hospedante donde penetran en el tejido vivo (b) a través de las células epidérmicas de los pelos de las raíces, ocasionalmente a través de estomas, o a través de heridas causadas por nematodos y alimentación de artrópodos o daño mecánico (Wick y Moore, 1983; Mims et al., 2000; Linderman y Tousson, 1968; Hood y Shew, 1997; Pierre y Wilkinson, 1970; Wheeler et al., 2000; Baard y Laubscher, 1985). La penetración del tejido se produce a través de clavijas de penetración simples (Nan et al., 1992; Hood y Shew, 1997) o (c) hifas de penetración que surgen de estructuras similares a apresorios (Baard y Laubscher, 1985; Mauk y Hine, 1988). Dentro del tejido del hospedante, las hifas de penetración colonizan las células de la raíz, ya sea directamente por las características hifas de infección (d) (Baard y Laubscher, 1985) o por el desarrollo de vesículas de infección terminal en forma de ‘punta de lanza’ que luego dan lugar a la hifas de infección (Mims et al., 2000). La colonización del tejido de la raíz continúa a través del contacto de célula a célula mediante una combinación de (e) crecimiento intra e intercelular (Punja et al., 1992). A medida que se desarrollan lesiones en la superficie del tejido, (f) se producen endoconidios dentro de las células de la raíz que conducen a una infección secundaria continua (Mosma y Struck, 2013). A medida que estos tejidos comienzan a morir y los patógenos entran en la fase necrotrófica de sus ciclos de vida, las clamidosporas se producen abundantemente en los tejidos muertos, lo que aumenta la carga de inóculo en el suelo (Linderman y Tousson, 1968; Pierre y Wilkinson, 1970; Mosma y Struck, 2013). Luego, se produce una mayor propagación a través de tejido vegetal infectado, suelo contaminado o posiblemente actividad de ácaros o artrópodos.
El ciclo sexual es hipotético, ya que no se ha observado reproducción sexual para ninguna de las dos especies de Berkeleyomyces, pero sus loci de tipo de apareamiento sugieren un ciclo sexual heterotálico (Nel et al., 2018). Por lo tanto, si la reproducción sexual tuviera lugar en estas especies, entrarían en contacto dos aislamientos del tipo de apareamiento opuesto (a). Una vez que ocurre el intercambio genético entre los aislamientos del tipo de apareamiento opuesto (b) los hongos producirían estructuras sexuales que para las Ceratocystidaceae serían ascomas, probablemente con ascos delicuescentes y esporas sexuales (ascosporas) envainadas (c).
.
- Ciclos de vida putativos de Berkeleyomyces basicola y B. rouxiae. (A) Infección putativa y ciclo reproductivo asexual: B. basicola y B. rouxiae son patógenos vegetales hemibiotróficos. Autor: Nel et al., 2019
.
.
.
Bibliografía
Baard SW, Laubscher C (1985) Histopathology of blackhull incited by Thielaviopsis basicola in groundnuts. Phytophylactica 17: 85–88.
Cedeño L, Fermin G, Ruiz-Arellano R, et al. (2016) Podredumbre negra en yuca amarilla (Manihot esculenta Crantz) causada por Thielaviopsis basicola. Agronomía & Ambiente 36: 96-108. Link
Gayed SK (1972) Host range and persistence of Thielaviopsis basicola in tobacco soil. Canadian Journal of Plant Science 52: 869-873. doi: 10.4141/cjps72-150
Geldenhuis MM, Roux J, Cilliers AJ, et al. (2006) Clonality in South African isolates and evidence for a European origin of the root pathogen Thielaviopsis basicola. Mycological Research 110, 306–11. doi: 10.1016/j.mycres.2005.11.009
Hewajulige IGN, Wijesundera RLC (2014) Thielaviopsis paradoxa, Thielaviopsis basicola (Black Rot, Black Root Rot). Postharvest Decay
Control Strategies. pp. 287-308. doi: 10.1016/B978-0-12-411552-1.00009-0
Hood ME, Shew HD (1997) Initial cellular interactions between Thielaviopsis basicola and tobacco root hairs. Phytopathology 87: 228–235. doi: 10.1094/PHYTO.1997.87.3.228
Huang Y, Xie X, Shi Y, et al. (2021) First Report of Berkeleyomyces basicola Causing Black Root Rot on Lisianthus (Eustoma grandiflorum) in China. Plant Dis. doi: 10.1094/PDIS-08-21-1724-PDN
Koike ST, Henderson DM (1998) Black root rot, caused by Thielaviopsis basicola, on tomato transplants in California. Plant Disease 82: 447 (Abstr.)
Linderman RG, Tousson TA (1968) Pathogenesis of Thielaviopsis basicola in nonsterile soil. Phytopathology 58: 1578–83.
Martino JA, Di Feo L del V, Paccioretti M, et al. (2021) First report of Berkeleyomyces basicola (synonymous: Thielaviopsis basicola) on roots of sweet potato (Ipomoea batatas (L.) Lam) in Argentina. Revista De La Facultad De Ciencias Agrarias UNCuyo 53(1): 283–287. doi: 10.48162/rev.39.027
Mathre DE, Ravenscroft AV, Garber RH (1966) The role of Thielaviopsis basicola as a primary cause of yield reduction in cotton in California. Phytopathology 56: 1213-1216.
Mauk PA, Hine RB (1988) Infection, colonization of Gossypium hirsutum and G. barbadense, and development of black root rot caused by Thielaviopsis basicola. Phytopathology 78: 1662–1667. doi: 10.1094/Phyto-78-1662
Mims CW, Copes WE, Richardson EA (2000) Ultrastructure of the penetration and infection of pansy roots by Thielaviopsis basicola. Phytopathology 90: 843–50. doi:
Mondal AH, Nekl DB, Allen SJ (2004) First report of Thielaviopsis basicola on soybean in Australia. Australasian Plant Pathology 33: 451–452. doi: 10.1071/AP04044
Mosma S, Struck C (2013) Studies on penetration, infection and colonization of lupin roots infected by Thielaviopsis basicola. Science Research Reporter 3: 97–101. Link
Nag Raj TR, Kendrick B (1975) A Monograph of Chalara and Allied Genera Wilfrid Laurier University Press, Waterloo.
Nel WJ, Duong TA, Wingfield MJ, et al. (2018) Heterothallism revealed in the root rot fungi Berkeleyomyces basicola and B. rouxiae. Fungal Biology 122: 1031-1040. doi: 10.1016/j.funbio.2018.08.006
Nel WJ, Duong TA, Wingfield BD, et al. (2018) A new genus and species for the globally important, multihost root pathogen Thielaviopsis basicola. Plant Pathol, 67: 871-882. doi: 10.1111/ppa.12803
Nel WJ, Duong TA, de Beer ZW, Wingfield MJ (2019) Black root rot: a long known but little understood disease. Plant Pathol, 68: 834-842. doi: 10.1111/ppa.13011
Nehl DB, Allen SJ, Mondal AH, et al. (2004) Black root rot: a pandemic in Australian cotton. Australasian Plant Pathology 33: 87–95. doi: 10.1071/AP03085
Otani Y (1962) Studies on the black root rot disease caused by Thielaviopsis basicola (Berk. & Br.) Ferris. Bulletin Okayama Tobacco Experiment Station 23: 1–118.
Paulin-Mahady AE, Harrington TC, McNew D (2002) Phylogenetic and taxonomic evaluation of Chalara, Chalaropsis, and Thielaviopsis anamorphs associated with Ceratocystis. Mycologia 94: 62-72. doi: 10.1080/15572536.2003.11833249
Pierre RE, Wilkinson RE (1970) Histopathological relationship of Fusarium and Thielaviopsis with beans. Phytopathology 60: 821–824. Link
Prinsloo GC, Baard SW, Ferreira JF (1991) Organisms associated with black root rot of chicory in South Africa. Phytophylactica 23: 59-67.
Punja ZK, Chittaranjan S, Gaye M (1992) Development of black root rot caused by Chalara elegans of fresh market carrots. Canadian Journal of Plant Pathology 14: 299-309. doi: 10.1080/07060669209500868
Shukla PK, Fatima T, Kumari N (2020) First report of Berkeleyomyces basicola causing mango root rot and decline in India. Plant Dis. doi: 10.1094/PDIS-10-20-2133-PDN
Tabachnik M, Devay JE, Garber RH, Wakeman RJ (1979) Influence of soil inoculum concentrations on host range and disease reactions caused by isolates of Thielaviopsis basicola and comparison of soil assay methods. Phytopathology 69: 974-977. doi: 10.1094/Phyto-69-974
Wheeler TA, Hake KD, Dever JK (2000) Survey of Meloidogyne incognita and Thielaviopsis basicola: their impact on cotton fruiting and producers’ management choices in infested fields. Journal of Nematology 32: 576–583. Link
Wick RL, Moore LD (1983) Histopathology of root disease incited by Thielaviopsis basicola in Ilex crenata. Phytopathology 73: 561–564. diu: 10.1094/Phyto-73-561
Wilson IW, Moncuquet P, Ellis M, et al. (2021) Characterization and Genetic Mapping of Black Root Rot Resistance in Gossypium arboreum L. International Journal of Molecular Sciences 22(5): 2642. doi: 10.3390/ijms22052642
Xu K, Li J, Yang X, et al. (2020) Postharvest rot on carrot caused by Ceratocystis fimbriata and Chalaropsis thielavioides (≡ Thielaviopsis thielavioides) in China. J Gen Plant Pathol 86: 322–325. doi:
Yarwood CE (1981) The occurrence of Chalara elegans Mycologia, 73, pp. 524-530