.
Condición fitosanitaria: Presente solo en algunas áreas del país
Etiología (agente causal): Citrus leprosis virus, complejo viral (*)
Taxonomía: Viruses > Riboviria > Orthornavirae > Negarnaviricota > Haploviricotina > Monjiviricetes > Mononegavirales > Rhabdoviridae > unclassified Rhabdoviridae
Baltimore classification:
Hospedantes: la naranja dulce (C. × sinensis), el pomelo (C. × paradisi) y la mandarina (C. reticulata) son susceptibles a la infección por CiLV-C, pero los limones (C. × limon) son inmunes (Bastianel et al., 2010). Se encontró que Swinglea glutinosa, una planta ornamental perenne nativa de Filipinas, y Commelina benghalensis, una maleza, estaban naturalmente infectadas con CiLV-C en Meta, Colombia (Leon et al., 2008) y São Paulo, Brasil (Nunes et al., 2012), respectivamente. Experimentalmente, Chenopodium quinoa, C. amaranticolor, Gomphrena globosa, H. rosa-sinensis, Malvaviscus arboreus, Grevillea robusta, Phaseolus vulgaris y Solanum violaefolium han sido reportados como hospedantes de CiLV-C por diferentes autores (Colariccio et al., 1995; Garita et al., 2013; Groot et al., 2006; Nunes et al., 2012; Rodrigues et al., 2005).
En un estudio experimental ampliado del rango de hospedantes de CiLV-C, se evaluaron 140 especies de plantas de 43 familias; donde 40 especies pertenecientes a 18 familias produjeron lesiones cloróticas y/o necróticas localizadas en hojas identificadas como positivas para CiLV-C (Garita et al., 2014). Se ha identificó la presencia de CiLV-C2 en cuatro cultivares de naranja dulce (‘Valencia’, ‘Delta Valencia’, ‘Rhode Red Valencia’ y ‘Cara Cara Navel’) (Roy et al., 2013). Se ha reportado que C. volkameriana y H. arnottianus son hospedantes de HGSV-2 (Melzer et al., 2012). También se han reportado infecciones de campo de siete especies de cítricos: pomelo, limón, lima (C. × aurantifolia), mandarina, naranjo agrio (C. aurantium), lima dulce (C. limetta) y naranjo dulce por CiLV-N, y cuatro especies de cítricos: pomelo, naranjo agrio, naranjo dulce y mandarina por CiNSV han sido reportadas en los estados de Querétaro y Jalisco, México, respectivamente (Cruz-Jaramillo et al., 2014; Roy et al., 2015)
Actualmente no se conocen hospedantes vegetales sistémicos para estos virus.
Epidemiología: es considerada una enfermedad poliética
.
Los rabdovirus (Rhabdoviridae) son virus de ARN de sentido negativo, unidos a membrana, que infectan hospedantes muy divergentes. Se han descrito más de 160 especies de rabdovirus, muchas de las cuales son una amenaza para la salud humana, animal o vegetal (Fu, 2005; Jackson et al., 2005). La familia Rhabdoviridae incluye seis géneros (Fu, 2005), con miembros de cada género que infectan uno o dos grupos de organismos. El análisis filogenético de rabdovirus basado en el gen de la polimerasa más conservado indica que los géneros que infectan plantas, Nucleorhabdovirus y Cytorhabdovirus, se agrupan e infectan plantas e insectos vectores, mientras que los géneros Lyssavirus, Ephemerovirus y Vesiculovirus se agrupan e infectan principalmente a los animales vertebrados.
Los rabdovirus se replican e invaden sistémicamente a sus hospedantes vegetales y animales. Tienen viriones baciliformes o en forma de bala con una envoltura derivada del hospedante (Jackson et al., 2005). Los dos géneros de rabdovirus vegetales, Cytorhabdovirus y Nucleorhabdovirus, se han clasificado según su morfogénesis en las células hospedadoras. En las células de plantas e insectos, los citobdovirus, como el Lettuce necrotic yellows virus (LNYV), parecen madurar de manera similar a los rabdovirus que infectan a los vertebrados, ya que brotan a través de las membranas citoplasmáticas, es decir, el retículo endoplásmico y las cisternas citoplasmáticas asociadas donde se acumulan las partículas maduras (Dietzgen, 1995; Jackson et al., 2005; Sylvester y Richardson, 1992). Por el contrario, los nucleorhabdovirus, como el Maize mosaic virus (MMV) y el Sonchus yellow net virus (SYNV), se multiplican en los núcleos de las células vegetales; sus viriones maduran brotando a través de la membrana nuclear interna y se acumulan en el espacio perinuclear entre la envoltura nuclear interna y externa. En el insecto hospedante, sin embargo, los nucleorhabdovirus brotan tanto en las membranas nucleares como en las citoplasmáticas (Ammar, 1985).
(*)
La etiología de la leprosis de los cítricos fue inicialmente cuestionada. Debido a la asociación de los ácaros Brevipalpus spp. con la leprosis de cítricos, los síntomas se atribuyeron inicialmente a las toxinas de la saliva del ácaro (Vergani, 1945) o a un patógeno, probablemente un virus, transmitido por el ácaro (Frezzi, 1940). En Florida, Knorr (1968) demostró que la leprosis podía transmitirse a través de la inserción de brotes sintomáticos mediante injerto de puntas en plantas sanas. La transmisión de leprosis por injerto fue confirmada en Brasil por Chagas y Rossetti (1984). Kitajima et al. (1972) observaron la presencia de partículas baciliformes asociadas a lesiones de leprosis por microscopía electrónica de transmisión (TEM), reforzando la hipótesis de que un virus era el agente causal. Finalmente, Colariccio et al. (1995) obtuvieron síntomas típicos de leprosis por inoculación mecánica de savia en plantas del mismo género y otras herbáceas (Chenopodium amaranticolor Coste & Reyn., C. quinoa Willd., y Gomphrena globosa L.), demostrando la causa viral de la enfermedad.
Se han reportado dos tipos de viriones a partir de tejidos sintomáticos de la leprosis de los cítricos, uno en el citoplasma (virus de la leprosis de los cítricos tipo citoplasmático [CiLV-C]) y el otro en el núcleo (tipo nuclear [CiLV-N]) (Freitas-Astúa et al., 2005). En Brasil, el CiLV-N se encontró restringido a los estados de Sao Paulo, Rio Grande do Sul y Minas Gerais y en Boquete en Panamá, mientras que CiLV-C se ha estado dispersando rápidamente en América del Sur y Central.
El complejo de leprosis de los cítricos es una enfermedad asociada con dos taxones de virus no relacionados distribuidos en América del Sur, Central y del Norte. Los virus citoplasmáticos son Citrus leprosis virus C (CiLV-C), Citrus leprosis virus C2 (CiLV-C2) e Hibiscus green spot virus 2, y los virus nucleares son Citrus leprosis virus N (CiLV-N) y Citrus necrotic spot virus (Roy et al., 2015). En Argentina se ha reportado el CiLV-C.
El virus de la leprosis de los cítricos C (CiLV-C) pertenece al género Cilevirus, familia Kitaviridae, y es considerado el virus más devastador que infecta a los cítricos en Brasil, siendo el principal patógeno viral responsable de la leprosis de los cítricos (CL), una enfermedad grave que afecta a los montes de cítricos en Latinoamérica.
Él virión de CiLV es no envuelto, baciliforme, de alrededor de 150 nm de largo y 50 nm de ancho, parecido a los de los higrevirus.
El genoma de CiLV es segmentado, bipartito, lineal, ssRNA (+). Los dos segmentos tienen un tamaño de aproximadamente 8,7 y 5 kb. El ARN genómico está protegido y poliadenilado.
CiLV-C causa una infección no sistémica (Chabi-Jesus et al., 2021).
.
.
R.
Antecedentes y Distribución geográfica
La leprosis de los cítricos es una de las enfermedades virales económicamente más importantes de Citrus spp. en América del Sur y Central (Bastianel et al., 2010). Desde que los portugueses introdujeron las plantas de cítricos en las Américas alrededor de la década de 1520, el análisis filodinámico bayesiano realizado por Chabi-Jesus et al., (2021). sugirió que los ancestros de los principales linajes CiLV-C probablemente se originaron en contacto con la vegetación nativa de América del Sur.
Esta enfermedad fue descrita originalmente en el estado de Florida en los Estados Unidos hace más de cien años, y luego se encontró en Paraguay, Uruguay, Argentina y Brasil, donde es endémica.
En EE. UU. se reportó por primera vez en Florida durante la década de 1860 (Knorr, 1968) y resultó en graves impactos en la producción de cítricos. Después de 1926, la incidencia de leprosis en Florida comenzó a disminuir. La leprosis estaba presente solo en áreas aisladas en la costa este de Florida en la década de 1950 (Knorr, 1968), y los relevamientos realizados desde 1968 no han dado como resultado ningún hallazgo en Florida (Childers et al., 2003).
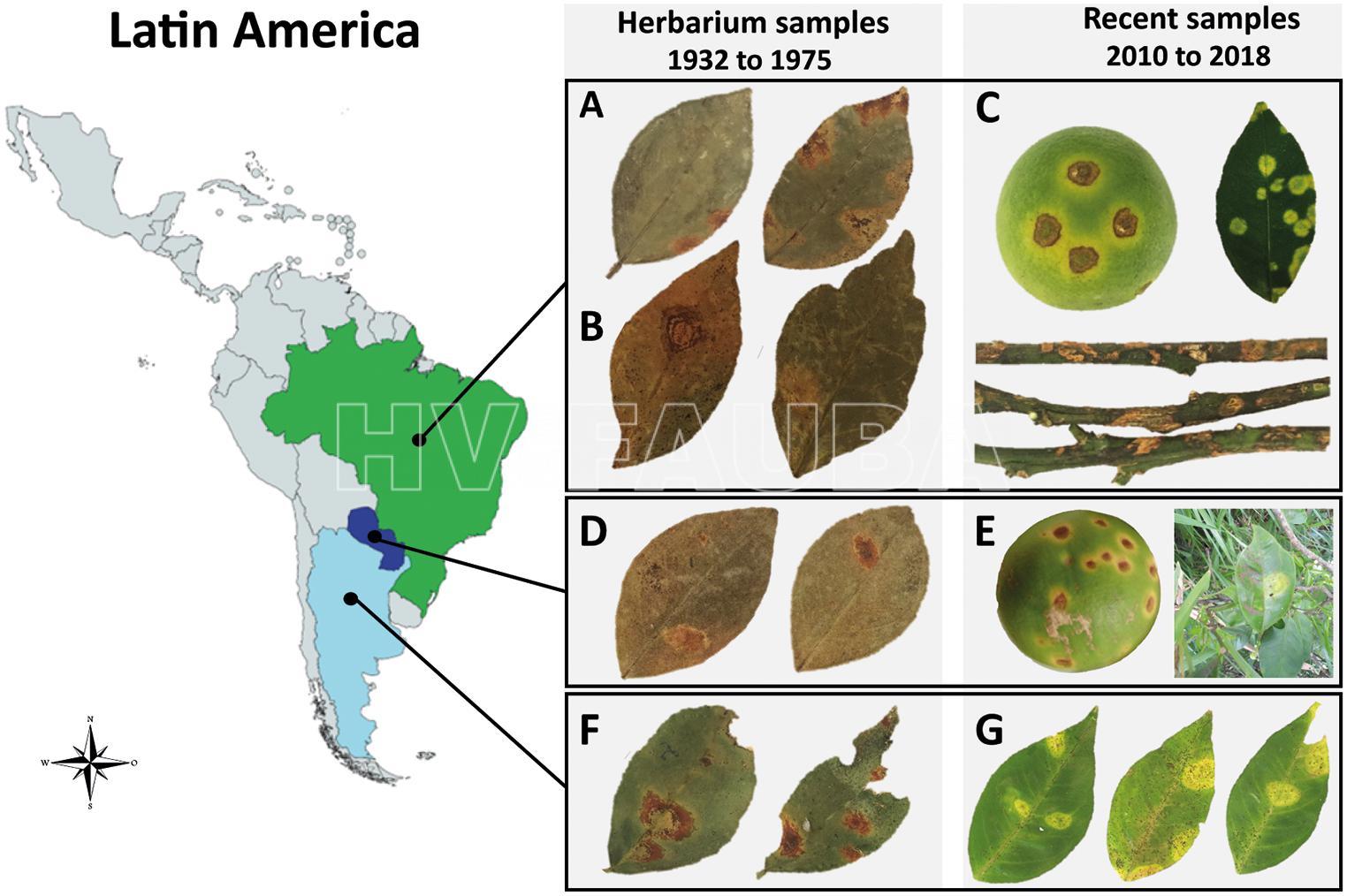
El primer reporte de leprosis de cítricos en Brasil fue en 1931, en naranjos dulces que crecían en Sorocaba, Sao Paulo (Bitancourt 1934), con hallazgos posteriores en Argentina (Bitancourt, 1940). Recientemente, se detectó CiLV-C en Bolivia, Venezuela y Colombia, y se está extendiendo hacia el norte a través de los países de Panamá, Costa Rica, Nicaragua, Guatemala, Honduras, El Salvador y México. Esta proximidad y el daño potencial que puede causar concierne a Estados Unidos, donde no se observa la enfermedad desde la década de 1960, y las islas del Caribe, que aún están libres de leprosis. Hasta hace poco, uno de los problemas del tratamiento de la leprosis de los cítricos era el diagnóstico, que se basaba principalmente en los síntomas. Esto puede ser engañoso, porque otras plagas y patógenos pueden causar lesiones similares a las asociadas con la leprosis. Por la misma razón, se deben revisar los informes de la enfermedad en países de Asia y África. Si no se confirma la presencia de CiLV-C en los continentes asiático y africano, la leprosis de los cítricos se ha limitado al continente americano. El uso de microscopía electrónica y, más recientemente, el desarrollo de herramientas moleculares aumentaron la precisión y confiabilidad de la detección de CiLV-C. Por lo tanto, se pudieron confirmar muchos de los informes antiguos de leprosis de cítricos en diferentes áreas de Brasil, ampliando el área conocida de ocurrencia. Hoy, la leprosis de los cítricos está confirmada en todo Brasil, lo que indica la necesidad de manejo en montes frutales comerciales. Cuando aún no se ha reportado de la enfermedad, es necesario evitar su introducción.
En la actualidad, la leprosis citoplasmática está presente en la mayor parte de Brasil, principalmente en los estados del sur y sureste, incluidas las regiones productoras de cítricos de São Paulo (Bastianel et al., 2010; Muller et al., 2005; Rodrigues et al., 2003; Salva y Massari, 1995). Además, la leprosis nuclear se informó por primera vez en Brasil (estados de Sao Paulo). La industria de los cítricos brasileña gasta más de 100 millones de dólares estadounidenses por año en acaricidas para controlar el vector Brevipalpus phoenicis (Rodrigues et al., 2003).
En Argentina se encuentra presente solo en algunas áreas del país, de acuerdo con el SINAVIMO.
.
- Síntomas de la leprosis de los cítricos. (F) CiLV-C aislado Ar06, Misiones, Argentina, 1937. (G) CiLV-C aislado AR04, Corrientes, Argentina, 2017. Autor: Chabi-Jesus et al., 2021
.
.
Sintomatología
Esta enfermedad reduce directamente la producción y la vida útil de la planta de cítricos. La leprosis involucra síntomas en hojas, tallos y frutos de cítricos, que pueden variar según la especie hospedante, el estado de desarrollo de la planta y los aislamientos del patógeno (Rossetti, 1995).
Los principales síntomas de la enfermedad incluyen lesiones en frutos, hojas y ramitas o ramas pequeñas, que provocan la caída prematura de la fruta, la defoliación y la muerte de las ramitas o ramas que provocan un grave deterioro de los árboles; eventualmente puede causar defoliación severa, ramas ceñidas, caída prematura de la fruta, muerte de las ramitas y reducción tanto en la calidad como en el rendimiento de la fruta, así como la muerte del árbol en un plazo de 3 a 5 años.
.
- Fuente: https://idtools.org
- Autor: University of Florida
- Infección natural mixta de Citrus leprosis virus C2 (CiLV-C2) y CiLV-N en: (A) Swinglea glutinosa y (B) Dieffenbachia sp. en Colombia y una sola infección de (C) lima persa (Citrus latifolia) e (D) Hibiscus rosa-sinensis por CiLV-N y CiLV-C2 observada en México y Colombia, respectivamente. Autor: Roy et al., 2015
.
.
Diagnóstico
RT-PCR
.
Transmisión
Es transmitido por ácaros del género Brevipalpus (Acari: Tenuipalpidae).
Tanto CiLV-C como CiLV-N son baciliformes y se transmiten por ácaros tenuipalpidos del género Brevipalpus. Pocos otros virus de plantas son transmitidos por ácaros, y la mayoría de ellos son de la familia de los eriófidos. Además, el virus no se propaga sistémicamente ni siquiera en su hospedante principal y solo provoca lesiones localizadas donde se acumulan las partículas.
En Argentina, Frezzi (1940) y Vergani (1945) demostraron que la leprosis de los cítricos era transmitida por el ácaro Tenuipalpus pseudocuneatus Blanch, posteriormente identificado como Brevipalpus obovatus Donnadieu. La asociación de la enfermedad con ácaros se confirmó en Estados Unidos y se identificó a B. californicus Banks como vector en Florida (Knorr, 1950, 1968) y en Guatemala (Palmieri et al., ). En Brasil, Musumecci y Rossetti (Mussumeci y Rossetti, 1963) informaron la presencia de B. phoenicis Geijskes en plantas con síntomas de leprosis.
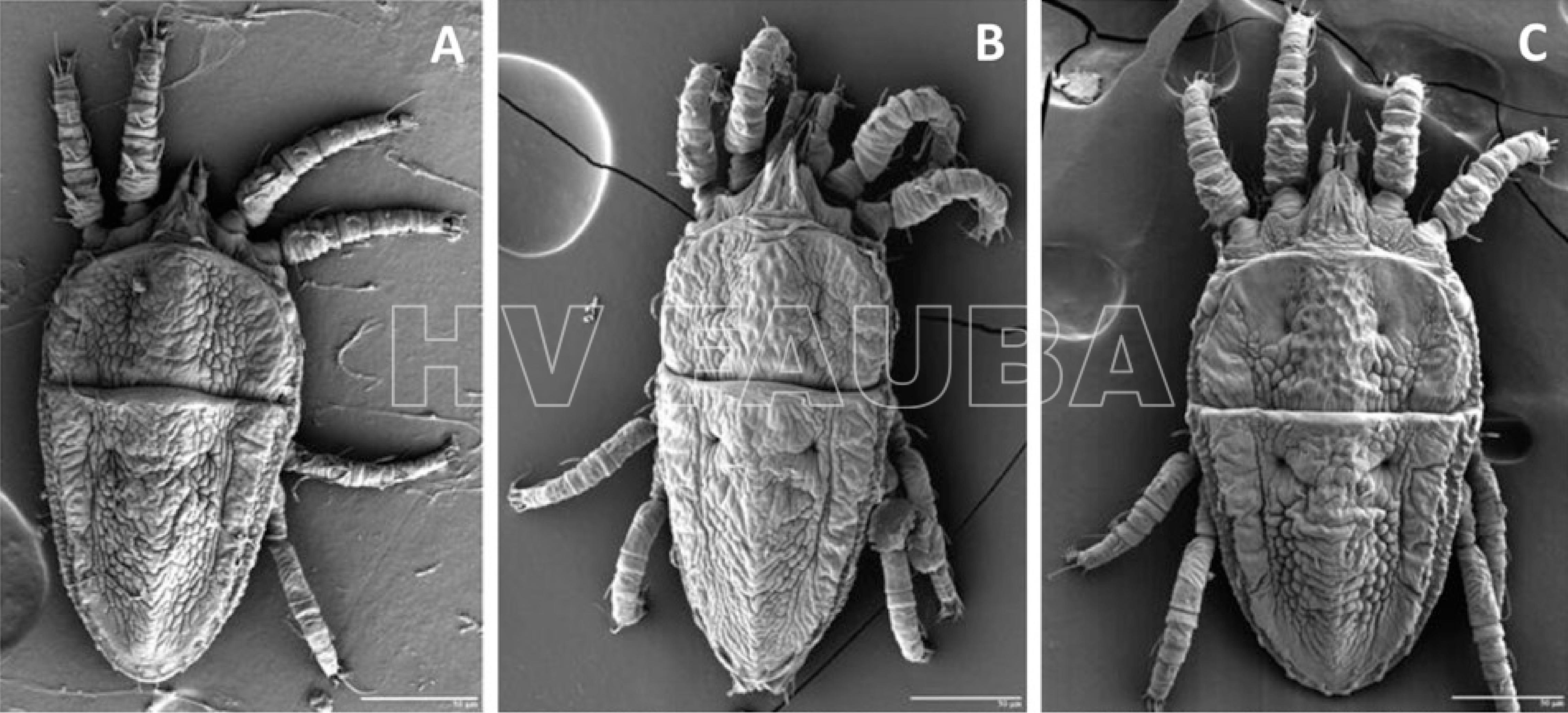
Históricamente se creía que todos los virus de la leprosis eran transmitidos por la especie de ácaro Brevipalpus phoenicis. Sin embargo, los ácaros recolectados de los cultivos de cítricos infectados con CiLV-C y CiLV-N en México se identificaron como B. yothersi y B. californicus sensu lato, respectivamente, y solo se detectó B. yothersi de las infecciones mixtas CiLV-C2 y CiLV-N en las regiones del Orinoco de Colombia.
El virus se ha transmitido mecánicamente con algunas dificultades, de naranja dulce a naranja dulce y algunos hospedantes herbáceos. Sin embargo, el mecanismo de transmisión y dispersión más importante es a través del ácaro vector.
.
- Identificación morfológica de especies de Brevipalpus asociadas con Citrus leprosis virus C (CiLV-C) y CiLV-N mediante microscopía electrónica de barrido a baja temperatura. Imágenes de (A) B. californicus sensu lato (s.l.), (B) B. yothersi, (C) B. phoenicis sensu estricto (s.s.). Autor: Roy et al., 2015
Epidemiología
Manejo integrado de la enfermedad
.
.
.
Bibliografía
Citrus Leprosis. University of Florida
Citrus Leprosis. www.idtools.org
Ammar E-D, Nault LR (1985) Assembly and accumulation sites of Maize mosaic virus in its planthopper vector. Intervirology 24: 33–41. doi: 10.1159/000149616
Ammar el-D, Tsai CW, Whitfield AE, et al. (2009) Cellular and molecular aspects of rhabdovirus interactions with insect and plant hosts. Annu Rev Entomol. 54: 447-468. doi: 10.1146/annurev.ento.54.110807.090454
Bastianel M, Novelli VM, Kitajima EW, et al. (2010) Citrus Leprosis: Centennial of an Unusual Mite-Virus Pathosystem. Plant Dis. 94(3): 284-292. doi: 10.1094/PDIS-94-3-0284
Bitancourt AA (1934) Relacao das doencas e fungos parasitas observados na seccao de fitopatologia durante os anos de 1931 e 1932. Arq. Inst. Biol. (Sao Paulo) 5: 185-196.
Bitancourt AA (1940) A leprose dos citrus. O Biol. 6: 39-45.
Cáceres S, Aguirre A (2009) Manejo de la Leprosis a través del control de los vectores e impacto económico en Argentina. Pág. 9.
Cáceres S, et al. (2013) Present status of citrus leprosis in Argentina and Paraguay. Tropical Plant Pathology 38: 282-294. doi: 10.1590/S1982-56762013005000015
Chabi-Jesus C, Ramos-González PL, Postclam-Barro M, et al. (2021) Molecular Epidemiology of Citrus Leprosis Virus C: A New Viral Lineage and Phylodynamic of the Main Viral Subpopulations in the Americas. Front. Microbiol. 12: 641252. doi: 10.3389/fmicb.2021.641252
Chagas CM, Rossetti VV (1984) Transmission of leprosis by grafting. Pages 215-217 in: Proc. 9th Conf. Int. Org. Citrus Virol. S. M. Garnsey, L. W. Timmer, and J. A. Dodds, eds. IOCV, Riverside, USA.
Chagas CM, Rossetti VV, Chiavegato LG (1984) Effectiveness of the different life cycle stages of Brevipalpus phoenicis Geijskes in leprosis transmission. Pages 211-214 in: Proc. 9th Conf. Int. Org. Citrus Virol. S. M. Garnsey, L. W. Timmer, and J. A. Dodds, eds. IOCV, Riverside, USA
Childers CC, Derrick KS (2003) Brevipalpus mites as vectors of unassigned rhabdoviruses in various crops. Exp. Appl. Acarol. 30:1-3.
Childers CC, Rodrigues JCV, Derrick KS, et al. (2003) Citrus leprosis and its status in Florida and Texas: Past and present. Exp. Appl. Acarol. 30: 181-202. doi: 10.1023/B:APPA.0000006548.01625.72
Childers CC, Rodrigues JCV, Kitajima EW, et al. (2001) A control strategy for breaking the virusvector cycle of Brevipalpus spp. and the Rhabdovirus disease, citrus leprosis. Manejo Integrado Plagas (Costa Rica) 60:76-79.
Colariccio A, Lovisolo O, Chagas CM, et al. (1995) Mechanical transmission and ultrastructural aspects of citrus leprosis virus. Fitopatol. Bras. 20: 208-213.
Cruz-Jaramillo JL, Ruiz-Medrano R, Rojas-Morales L, et al. (2014) Characterization of a proposed dichorhavirus associated with the citrus leprosis disease and analysis of the host response. Viruses 6: 2602-2622. doi: 10.3390/v6072602
Dietzgen RG (1995) Rhabdoviridae. In Pathogenesis and Host-Parasite Specificity in Plant Diseases: Histopathological, Biochemical, Genetic and Molecular Basis, ed. RP Singh, US Singh, K Kohmoto, 3: 177–97. Oxford: Pergamon.
Freitas-Astúa J, Kitajima EW, Locali EC, et al. (2005) Further evidence to support that Citrus leprosis virus-cytoplasmic and nuclear types are different viruses. En: Annual Meeting of the American Phytopathological Society – Proceedings Caribbean Division, pp.93-93.
Frezzi MJ (1940) La lepra explosiva del naranjo. Investigaciones realizadas por el laboratorio de patologáa de Bela Vista (Corrientes). Bol. Frutas y Hortalizas. Buenos Aires. Min. Agric. Nación. n. 5.
Fu ZF (2005) Genetic comparison of the rhabdoviruses from animals and plants. Curr. Top. Microbiol. Immunol. 292: 1–24. doi: 10.1007/3-540-27485-5_1
Garita LC, Tassi AD, Calegario RF, et al. (2013) Common Bean: Experimental Indicator Plant for Citrus leprosis virus C and Some Other Cytoplasmic-Type Brevipalpus-Transmitted Viruses. Plant Disease 97: 1346-1351. doi: 10.1094/PDIS-12-12-1143-RE
Garita LC, Tassi AD, Calegario RF, et al. (2014) Experimental host range of Citrus leprosis virus C (CiLV-C). Trop. Plant Pathol. 39: 43-55. doi: 10.1590/S1982-56762014005000004
Groot TVM, Freitas-Astua J, Kitajima EW (2006) Brevipalpus phoenicis transmits citrus leprosis virus, cytoplasmic type (CiLV-C) to common bean (Phaseolus vulgaris) under experimental conditions. Virus Rev. Res. 11: 67-68. doi:
Jackson AO, Dietzgen RG, Goodin MM, et al. (2005) Biology of plant rhabdoviruses. Annu. Rev. Phytopathol. 43: 623–60. doi: 10.1146/annurev.phyto.43.011205.141136
Kitajima EW, Calegario RF, Locali-Fabris EC, et al. (2008) In situ detection of CiLV-C in the mite vector Brevipalpus phoenicis, evidence for a circulative type of virus/vector relationship and a model for the virus circulation in the mite. Trop. Plant Pathol. 33: 289.
Kitajima EW, Chagas CM, Rodrigues JCV (2003) Brevipalpus transmitted plant virus and virus-like diseases: Cytopathology and some recent cases. Exp. Appl. Acarol. 30: 135-160.
Kitajima EW, Ferreira PTO, Freitas-Astúa J, Machado MA (2004) Ocorrência da leprose dos citros, tipo nuclear (CiLV-N) nos municípios paulistas de Monte Alegre do Sul e Amparo. Summa Phytopathol. 30:68.
Kitajima EW, Moraes GJ, Calegario RF, Salaroli RB (2006) Visualização dos vírus transmitidos por Brevipalpus (Acari: Tenuipalpidae) nos tecidos do ácaro vetor. Fitopatol. Bras. 31: 214-215.
Kitajima EW, Müller GW, Costa AS, Yuki W (1972) Short, rodlike particles associated with citrus leprosis. Virology 50: 254-258. doi: 10.1016/0042-6822(72)90366-2
Kitajima EW, Rosillo MA, Portillo MM, et al. (1974) Microscopia eletrônica de tecidos foliares de laranjeiras infectadas pela lepra explosiva da Argentina. Fitopatologia 9: 55-56.
Knorr LC (1950) Etiological association of a Brevipalpus mite with Florida scaly bark of citrus. Phytopathology 40:15.
Knorr LC (1968) Studies on the etiology of leprosis in citrus. Pages 332-340 in: J. F. L. Childs, ed. Proc. 4th Conf. Int. Org. Citrus Virol. IOCV, Gainesville, USA.
Leastro MO, Castro DYO, Freitas-Astúa J, et al. (2020) Citrus Leprosis Virus C Encodes Three Proteins With Gene Silencing Suppression Activity. Front. Microbiol. 11: 1231. doi: 10.3389/fmicb.2020.01231
Leon G, Kitajima EW, Freitas A, et al. (2006) Deteccion del virus de la leprosis de los cítricos tipo citoplasmatico en los Llanos Orientales de Colombia. Rev. Corpoica 7: 67-72.
Leon GA, Becerra CH, Freitas-Astua J, et al. (2008) Natural infection of Swinglea glutinosa by the Citrus leprosis virus, cytoplasmic type (CiLV-C) in Colombia. Plant Disease 92: 1364. doi: 10.1094/PDIS-92-9-1364C
Leon GA, Realpe CE, Garzon PA, et al. (2006) Occurrence of Citrus leprosis virus in Llanos Orientales, Colombia. Plant Disease 90: 682. doi: 10.1094/PD-90-0682C
Locali-Fabris EC, Freitas-Astúa J, Souza AA, et al. (2006) Complete nucleotide sequence, genomic organization and phylogenetic analysis of Citrus leprosis virus cytoplasmic type. J Gen Virol. 87(Pt 9): 2721-2729. doi:
Melzer MJ, Sether DM, Borth WB, Hu JS (2012) Characterization of a virus infecting Citrus volkameriana with citrus leprosis-like symptoms. Phytopathology 102: 122-127. doi: 10.1094/PHYTO-01-11-0013
Melzer MJ, Simbajon N, Carillo J, et al. (2013) A cilevirus infects ornamental hibiscus in Hawaii. Arch. Virol. 158: 2421-2424. doi: 10.1007/s00705-013-1745-0
Mussumeci MR, Rossetti VV (1963) Transmissão dos sintomas da leprose dos citros pelo ácaro Brevipalpus phoenicis. Ciência Cultura 15: 228.
Nunes MA, Bergamini MP, Coerini LF, et al. (2012) Citrus leprosis virus C naturally infecting Commelina benghalensis, a prevalent monocot weed of citrus orchards in Brazil. Plant Dis. 96: 770. doi: 10.1094/PDIS-11-11-0925-PDN
Nunes MA, Oliveira CAL, Oliveira ML, et al. (2012) Transmission of Citrus leprosis virus, cytoplasmic type, by Brevipalpus phoenicis (Geijskes) to alternate host plants found in citrus orchards. Plant Dis. 96: 968-972. doi: 10.1094/PDIS-06-11-0538
Palmieri M, Donis I, Salazar AL, et la. (2005) Leprosis in Guatemala. Page 510 in: Proc. 16th Conf. Int. Org. Citrus Virol. M. E. Hilf, N. Duran-Vila, and M. A. Rocha-Peña, eds. IOCV, Riverside, USA.
Roy A, Choudhary N, Guillermo LM, et al. (2013) A novel virus of the genus Cilevirus causing symptoms similar to citrus leprosis. Phytopathology 103(5): 488-500. doi: 10.1094/PHYTO-07-12-0177-R
Roy A, Stone A, Otero-Colina G, et al. (2013) Genome assembly of Citrus leprosis virus nuclear type reveals a close association with orchid fleck virus. Genome Announc. 1(4): e00519-13. doi: 10.1128/genomeA.00519-13
Roy A, Leon MG, Stone AL, et al. (2014) First report of Citrus leprosis virus nuclear type in sweet orange in Colombia. Plant Dis. 98: 1162. doi: 10.1094/PDIS-02-14-0117-PDN
Roy A, Stone AL, Shao J, et al. (2015) Identification and molecular characterization of nuclear Citrus leprosis virus, a member of the proposed Dichorhavirus genus infecting multiple Citrus species in Mexico. Phytopathology 105: 564-575. doi: 10.1094/PHYTO-09-14-0245-R
Rodrigues JCV, Nogueira NL, Freitas DS, Prates HS (1997) Virus-like particles associated with Brevipalpus phoenicis Geijskes (Acari: Tenuipalpidae), vector of citrus leprosis virus. Ann. Soc. Entomol. Brasil 26: 391-395. doi: 10.1590/S0301-80591997000200025
Rodrigues JC, Gall-Meagher M, Ochoa R, et al. (2004) Mitochondrial DNA and RAPD polymorphisms in the haploid mite Brevipalpus phoenicis (Acari: Tenuipalpidae). Exp. Appl. Acarol. 34: 275-290. doi: 10.1007/s10493-004-0571-1
Rodrigues J, Kitajima E, Childers C, et al. (2003) Citrus Leprosis Virus Vectored by Brevipalpus phoenicis (Acari: Tenuipalpidae) on Citrus in Brazil. Exp Appl Acarol 30: 161–179. doi: 10.1023/B:APPA.0000006547.76802.6e
Rodrigues JCV, Locali EC, Freitas-Astua J, Kitajima EW (2005) Transmissibility of citrus leprosis virus by Brevipalpus phoenicis in Solanum violaefolium. Plant Dis. 89: 911. doi: 10.1094/PD-89-0911B
Rodrigues JCV, Antony LMK, Salaroli RB, Kitajima EW (2008) Brevipalpus-associated viruses in the central Amazon Basin. Trop. Plant Pathol. 33: 12-19. doi: 10.1590/S1982-56762008000100003
Rodrigues JCV, Childers CC (2013) Brevipalpus mites (Acari: Tenuipalpidae): Vectors of invasive, non-systemic cytoplasmic and nuclear viruses in plants. Exp. Appl. Acarol. 59: 165-175. doi: 10.1007/s10493-012-9632-z
Rossetti V (1995) A leprose dos citros no Brasil. Pages 1-12 in: Leprose dos Citros. (C. A. L. Oliveira and L. C. Donadio, eds. FUNEP, Jaboticabal, Brazil.
Roy A, Hartung JS, Schneider WL, et al. (2015) Role Bending: Complex Relationships Between Viruses, Hosts, and Vectors Related to Citrus Leprosis, an Emerging Disease. Phytopathology 105(7): 1013-1025. doi: 10.1094/PHYTO-12-14-0375-FI
Sylvester ES, Richardson J (1992) Aphid-borne rhabdoviruses-relationship with their aphid vectors. In Advances Disease Vector Research, ed. KF Harris, 9: 313–41. New York: Springer-Verlag.
Tassi AD, Garita-Salazar LC, Amorim L, et al. (2017) Virus-vector relationship in the Citrus leprosis pathosystem. Exp Appl Acarol 71, 227–241. doi: 10.1007/s10493-017-0123-0
Trinh J, Li T, Franco JY, et al. (2022) Citrus relatives exhibit natural variation in perception and response magnitude to microbial features. bioRxiv 2022.07.15.500235; doi: 10.1101/2022.07.15.500235
Wagemans J, Holtappels D, Vainio E, et al. (2022) Going Viral: Virus-Based Biological Control Agents for Plant Protection. Annu Rev Phytopathol. 60: 21-42. doi: 10.1146/annurev-phyto-021621-114208
Vergani AR (1945) Transmisión y naturaleza de la “lepra explosiva” del naranjo. Ministerio de Agricultura de la Nación. Buenos Aires. Instituto Sanidad Vegetal. Ser. A.5. p.1-11