.
Condición fitosanitaria: Plaga Cuarentenaria Ausente
Grupo de cultivos: Hortícola
Especie hospedante: Papa (Solanum tuberosum)
Rango de hospedantes: el patógeno tiene un amplio rango de hospedantes, puede infectar más de 350 especies de plantas.
Vector: nemátodos (Trichodorus spp, Paratrichodorus spp)
Epidemiología: monocíclica, aguda.
Etiología: Virus. Biotrófico (como todos los virus)
Agente causal: Tobacco rattle virus (TRV), ICTV accepted
Taxonomía: Viruses > Riboviria > Orthornavirae > Kitrinoviricota > Alsuviricetes > Martellivirales > Virgaviridae > Tobravirus
.
.
.
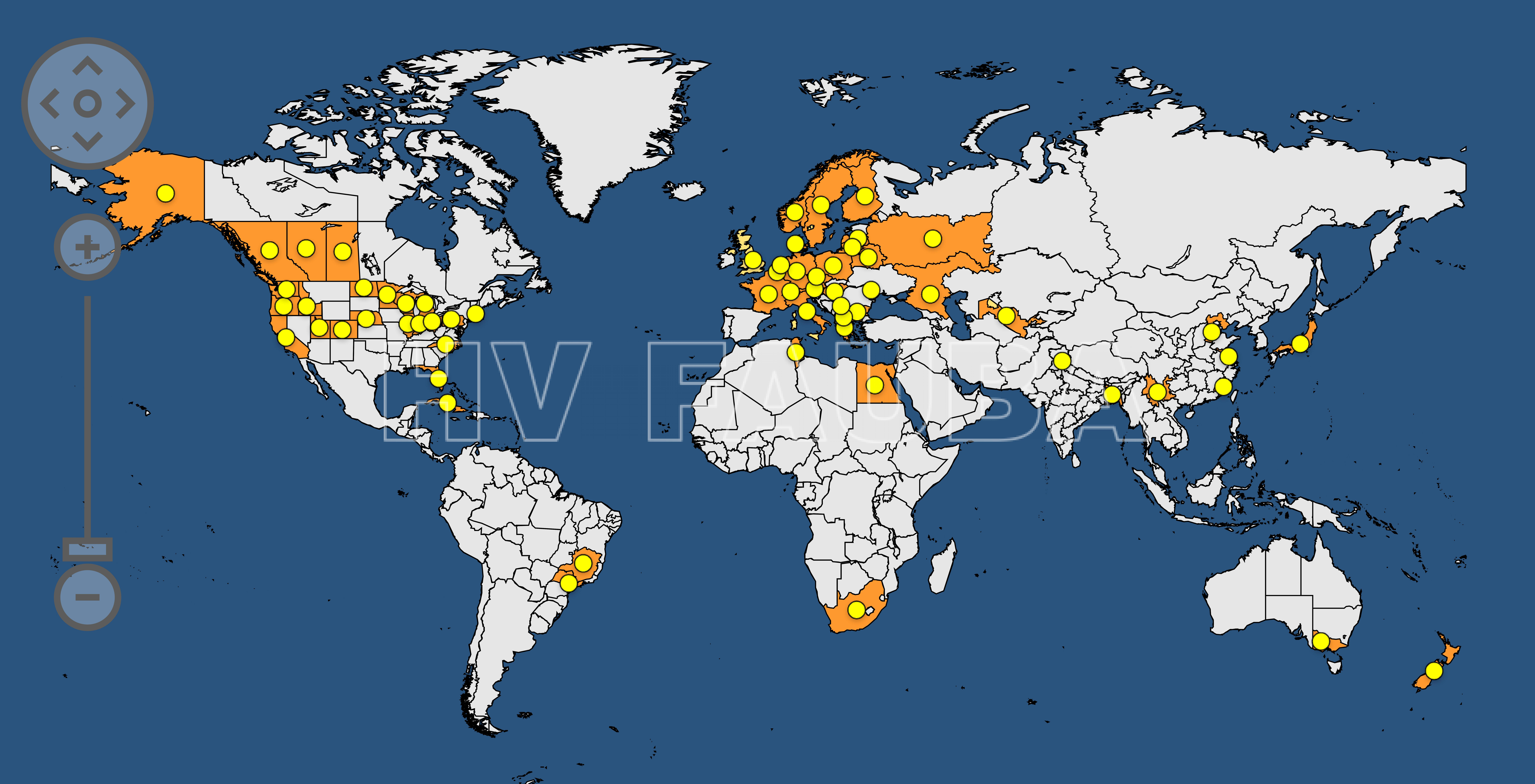
Distribución mundial
- Fuente: https://gd.eppo.int/taxon/TRV000/distribution
.
.
Sintomatología
Los síntomas de la infección por TRV incluyen manchas de anillos amarillos y patrones de líneas concéntricas. Los síntomas persisten, varían según la estación o desaparecen poco después de la infección, según la especie hospedante y la cepa del virus. El TRV tiene un rango de hospedantes de más de 350 especies de plantas y es transmitido por nematodos del género Trichodorus que habitan en el suelo, mecánicamente (en herramientas infectadas), injertos y semillas. No se transmite por contacto de planta a planta. Entre cultivos hospedantes importantes se encuentran: papa, espinaca, remolacha, poroto y la pimienta. Hospedantes ornamentales importantes incluyen: Narcissus, Gladiolus, Calendula, Tulipa, Petunia X hybrida y vinca.
Las pérdidas de rendimiento pueden llegar hasta el 50%.
Los nemátodos vectores, generalmente se encuentran a profundidades del suelo superiores a 30 cm.
- Autor: University of Florida
- Autor: University of Florida
.
.
.
Bibliografía
Tobacco rattle virus. EPPO Database
Alter H, Peer R, Dombrovsky A, et al. (2022) Tobacco Rattle Virus as a Tool for Rapid Reverse-Genetics Screens and Analysis of Gene Function in Cannabis sativa L. Plants 11(3): 327. doi: 10.3390/plants11030327
Deng XB, Kelloniemi J, Haikonen T, et al. (2013) Modification of tobacco rattle virus RNA1 to serve as a VIGS vector reveals that the 29K movement protein is an RNA silencing suppressor of the virus. Mol. Plant Microbe Interact. 26: 503–514. doi: 10.1094/MPMI-12-12-0280-R
Diezma-Navas L, Pérez-González A, Artaza H, et al. (2019), Crosstalk between epigenetic silencing and infection by tobacco rattle virus in Arabidopsis. Molecular Plant Pathology 20: 1439-1452. doi: 10.1111/mpp.12850
Dikova B (2006) Identification of Tobacco Rattle Virus (TRV) in Sugar Beet in Bulgaria. Biotechnology & Biotechnological Equipment 20: 49-59. doi: 10.1080/13102818.2006.10817380
Dong YY, Burch-Smith TM, Liu YL, et al. (2007) A ligation-independent cloning tobacco rattle virus vector for high-throughput virus-induced gene silencing identifies roles for NbMADS4-1 and -2 in floral development. Plant Physiol. 145: 1161–1170. doi: 10.1104/pp.107.107391
Ghazala W, Varrelmann M (2007) Tobacco rattle virus 29K movement protein is the elicitor of extreme and hypersensitive-like resistance in two cultivars of Solanum tuberosum. Mol Plant Microbe Interact. 20(11): 1396-405. doi: 10.1094/MPMI-20-11-1396
Liu E, Page JE (2008) Optimized cDNA libraries for virus-induced gene silencing (VIGS) using tobacco rattle virus. Plant Methods 4: 5. doi: 10.1186/1746-4811-4-5
Moyo L, Raikhy G, Hamid A, et al. (2022) Phylogenetics of tobacco rattle virus isolates from potato (Solanum tuberosum L.) in the USA: a multi-gene approach to evolutionary lineage. Virus Genes 58: 42–52. doi: 10.1007/s11262-021-01875-4
Ratcliff F, Martin-Hernandez AM, Baulcombe DC (2001) Technical Advance. Tobacco rattle virus as a vector for analysis of gene function by silencing. Plant J. 25(2): 237-45. doi: 10.1046/j.0960-7412.2000.00942.x
Senthil-Kumar M, Mysore KS (2014) Tobacco rattle virus based virus-induced gene silencing in Nicotiana benthamiana. Nat. Protoc. 9: 1549–1562. doi: 10.1038/nprot.2014.092
Shi G, Hao M, Tian B, et al. (2021) A Methodological Advance of Tobacco Rattle Virus-Induced Gene Silencing for Functional Genomics in Plants. Front. Plant Sci. 12: 671091. doi: 10.3389/fpls.2021.671091
Tian J, Pei HX, Zhang S, et al. (2014) TRV-GFP: a modified Tobacco rattle virus vector for efficient and visualizable analysis of gene function. J. Exp. Bot. 65: 311–322. doi: 10.1093/jxb/ert381
Wagemans J, Holtappels D, Vainio E, et al. (2022) Going Viral: Virus-Based Biological Control Agents for Plant Protection. Annu Rev Phytopathol. 60: 21-42. doi: 10.1146/annurev-phyto-021621-114208
Walkinshaw C, Larson R (1958) A Soil-borne Virus associated with the Corky Ringspot Disease of Potato. Nature 181: 1146. doi: 10.1038/1811146a0
Zeng H, Xie Y, Liu G, et al. (2019) Agrobacterium-Mediated Gene Transient Overexpression and Tobacco Rattle Virus (TRV)-Based Gene Silencing in Cassava. International Journal of Molecular Sciences 20(16): 3976. doi: 10.3390/ijms20163976
Zhang J, Yu D, Zhang Y, et al. (2017) Vacuum and Co-cultivation Agroinfiltration of (Germinated) Seeds Results in Tobacco Rattle Virus (TRV) Mediated Whole-Plant Virus-Induced Gene Silencing (VIGS) in Wheat and Maize. Front. Plant Sci. 8: 393. doi: 10.3389/fpls.2017.00393