.
Condición fitosanitaria: Presente
Grupo de cultivos: Oleaginosas
Rango de hospedantes: específico / estrecho
Hospedante (primario): Maní (Arachis hypogaea L.)
Hospedante intermediario: P. arachidis no posee ningún hospedante intermediario o alternativo ni en plantas leguminosas ni en no leguminosas (Subrahmanyam y McDonald, 1982). Esta singularidad de P. arachidis de otras especies típicas de Puccinia sp. impulsó un estudio de diversidad molecular entre 13 patógenos: Puccinia sp., Uromyces appendiculatus, Phakospora pachyrhizi, Hemilieia vastatrix y Rhizoctinia solani basado en el citocromo b y la variación de secuencias del espaciador transcrito interno (ITS) (Grasso et al., 2006). El resultado mostró que P. arachidis estaba estrechamente relacionado con U. appendiculatus (roya del poroto) pero más distante de otras Puccinia sp. Tal estudio necesita más verificación. Si el patógeno se vuelve realmente más cercano a Uromyces sp., entonces se deben considerar cambios en la nomenclatura taxonómica de la roya del maní.
Etiología: policíclica, subaguda
Etiología: Hongo. Basidiomycota. Biotrófico
Agente causal: Puccinia arachidis Speg., 1884 Speg.
Taxonomía: Eukaryota > Fungi > Dikarya > Basidiomycota > Pucciniomycotina > Pucciniomycetes > Pucciniales > Pucciniaceae > Puccinia
.
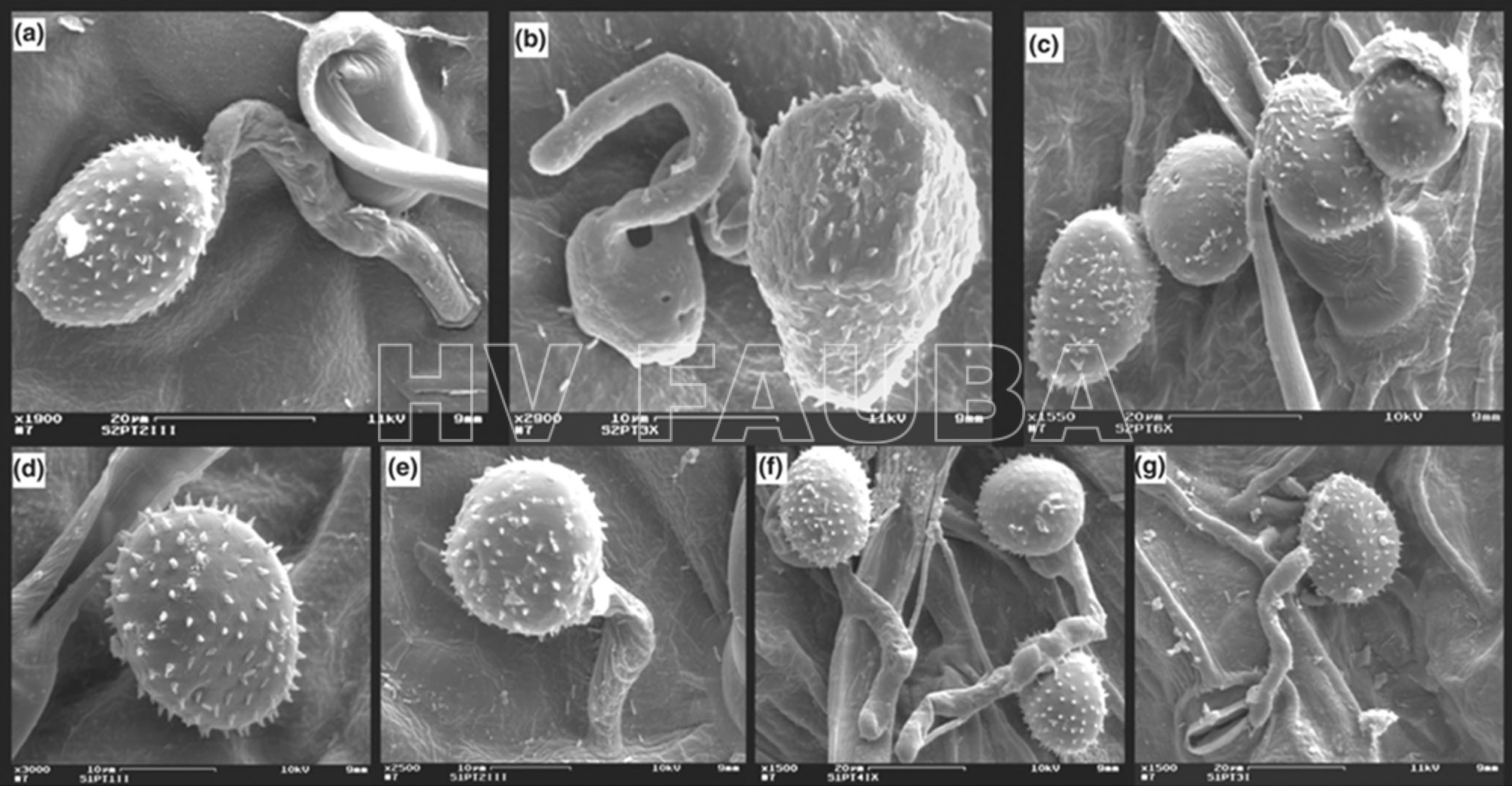
- Ultraestructura de interacción de Puccinia arachidis con hojas de Arachis stenosperma (resistente) y Arachis hypogaea L. (susceptible) durante la etapa inicial de infección. Uredosporas de la roya del maní en la superficie inferior de las hojas de Arachis stenosperma (a, b, c) resistente y Arachis hypogaea (d, e, f, g). Uredosporas en las hojas de A. hypogaea 3 hpi (d). Tubos germinativos cilíndricos y largos de uredosporas germinadas a 6 hpi (a, e) y apresorios a 12 hpi (b, f) en las hojas de ambos genotipos. Reducción de la proliferación del tubo germinativo en A. stenosperma a las 24 hpi en relación con A. hypogaea (c). Presencia de tubos germinativos en la apertura de los estomas en A. hypogaea 72 hpi (g). Autor: Mondal y Badigannavar 2015
.
.
Antecedentes
La roya del maní reduce el rendimiento y la calidad e indirectamente aumenta el costo de producción. Bajo condiciones epidémicas de la enfermedad, el patógeno puede causar hasta un 57% de daño económico al cultivo (Subrahmanyam y McDonald, 1987). El patógeno coevolucionó con el hospedante en América del Sur y se informó por primera vez en Surinam en 1827 (Leppik, 1971). Primero fue reconocido como Uredo arachidis por Nils Gustav Lagerheim y posteriormente como Uromyces arachidis por Paul Hennings en 1896. Más tarde, fue nombrado Bullaria arachidis en 1922 por Arthur y Mains. Finalmente, un espécimen fue recolectado por un botánico francés, Benedict Balansa de Caa-guaza, Paraguay, y fue identificado por Spegazzini como una nueva especie y rebautizado como P. arachidis (Hennen et al., 1976). P. arachidis se encuentra distribuida en todo el mundo dondequiera que se cultive maní (Bromfield, 1971). Sin embargo, la incidencia y severidad de la enfermedad varía entre localidades y años.
La roya del maní aparece en el campo en condiciones cálidas y húmedas y se propaga rápidamente por ciclos repetidos de infección de uredosporas. En ausencia de medidas de control químico, puede destruir completamente el cultivo.
.
Síntomas y signos
La aparición de los síntomas de la roya del maní comienza 8 a 10 días después de la infección con la aparición de manchas blanquecinas en la superficie abaxial. Un día después, aparecen motas amarillentas en la superficie superior de las hojas y comienzan a formarse pústulas de color rojo anaranjado/marrón (uredinios) en la superficie inferior de las hojas. Las pústulas/uredinios suelen ser circulares a elípticas, elevadas y varían de 0,3 a 2,0 mm de diámetro. Las pústulas se rompen después de aproximadamente 2 días de aparición para exponer uredosporas circulares u ovaladas que son de color naranja oscuro al principio pero se vuelven de color marrón canela con la madurez (Savary et al., 1989). Ocasionalmente se desarrollan pústulas en la superficie superior de la hoja, pero nunca son tan numerosas como en la parte inferior. También se desarrolla necrosis en el área que rodea las pústulas. Las áreas necróticas pueden coalescer y provocar la defoliación. Los síntomas pueden desarrollarse en pecíolos y tallos. La roya del maní comúnmente se desarrolla en un patrón radiante desde un solo punto dentro de un campo. Estas manchas pueden aumentar rápidamente de tamaño durante los períodos de clima húmedo y cálido.
.
- Autor: Bob Kemerait
- Autor: Mondal y Badigannavar, 2015
.
Ciclo de la enfermedad
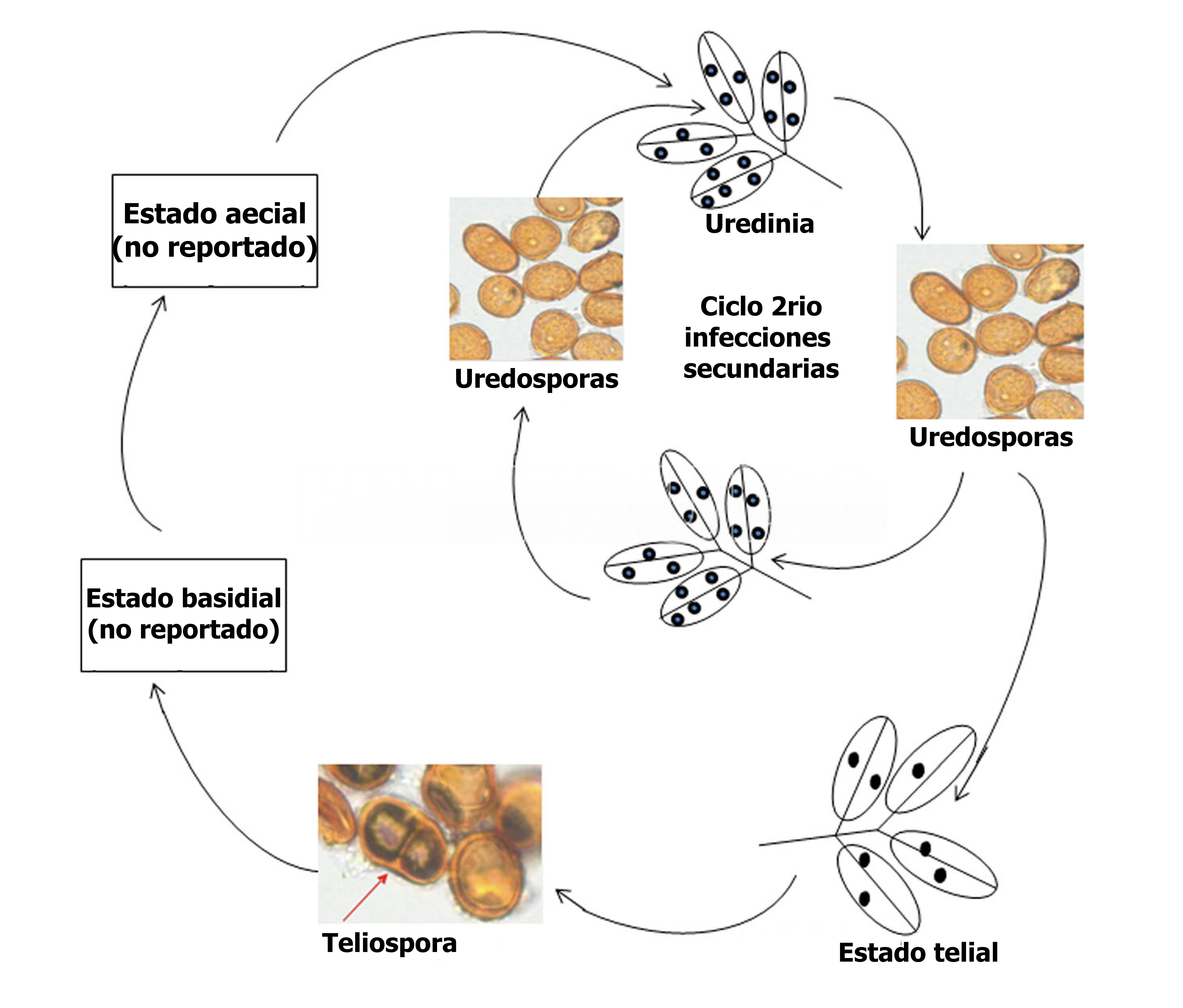
En maní, la etapa telial no es tan común y solo se reportó en América Central, Florida y Brasil en hojas de maní silvestre (Hennen et al., 1976). También se observó muy recientemente en un campo de maní cultivado en Gadag, Karnataka, India (Tashildar et al., 2012). Las telia son principalmente hipófilas, de 0,2 mm de diámetro, contienen numerosas teliosporas. Las teliosporas son oblongas, obovadas y de forma elipsoidal a ovalada, con un ápice redondo a agudo y engrosado, constreñido en el medio. Las teliosporas son de paredes lisas y de color amarillo claro, amarillo dorado o marrón castaño, predominantemente bicelulares. Aún no se conocen las basidiosporas de P. arachidis. Por lo tanto, la ocurrencia de cariogamia y meiosis sucesiva en basidio no se reporta hasta el momento en esta roya. La roya del maní existe principalmente en la naturaleza como forma uredial (etapa II). Los uredinios son hipófilos, subepidérmicos, de forma elipsoidal u oblonga, y adquieren un color marrón canela oscuro cuando maduran. Cada uredosoro contiene numerosas uredosporas pediculadas. El pedicelo de la uredospora es corto, frágil y hialino. El tamaño medio de las uredosporas es de 24,96 × 21,22 μm. La pared de la espora es de color marrón, de 1,22 μm de espesor y finamente echinulada con dos a cuatro poros germinales (Subrahmanyam et al., 1985; Ghewande, 2009). Dado que la roya del maní no tiene ningún hospedante alternativo, su etapa aecial es desconocida. En general, la roya del maní podría evolucionar claramente debido a ciertas mutaciones en su genoma. Debido a la ausencia de basidio (etapa sexual), no se reportan razas o variantes hasta el momento en esta roya. Pero, un estudio de Tashildar et al. (2012) ha detectado la variación del patrón isozímico de la peroxidasa y la polifenol oxidasa entre los diferentes aislamientos de P. arachidis, recolectados en diferentes partes de los estados de Karnataka, Tamilnadu y Maharastra en la India. Con base en la información anterior, a continuación se presenta un diagrama esquemático del ciclo de vida de la roya del maní (Mondal y Badigannavar, 2015). En el campo, las uredosporas infectan las hojas y forman uredosori, que después de la maduración revientan y liberan numerosas uredosporas. Estas uredosporas nacientes inician varias rondas de ciclos de infección en las hojas de maní en el campo. En condiciones de baja temperatura y estrés por nutrientes, las hifas dicarióticas de las uredosporas comúnmente forman telios. Estos telios contienen numerosas teliosporas. Hay muy pocos informes sobre la existencia de teliosporas de P. arachidis en la naturaleza (Hennen et al., 1976; Rodrigues et al., 2006; Tashildar et al., 2012). Por lo tanto, se necesitan más trabajos de investigación para confirmar la existencia y la función de la teliospora en la roya del maní. Generalmente, la presencia de esporas sexuales (basidiosporas) en el ciclo de vida del patógeno de la roya agregan más variaciones genéticas o heterogeneidad entre diferentes aislados. Sin embargo, un estudio reciente sobre genética de poblaciones de aislamientos de P. arachidis no detectó una alta variabilidad genética en base a la variación de secuencias del «citocromo b», «5.8S – ITS2 – 28S» y «factor de elongación de translongación 1α» (Power, 2014). La recombinación parasexual y somática podría dar la respuesta hacia la evolución de nuevas razas o patotipos como en Puccinia triticina y otras royas (Park y Wellings, 2012).
.
- Ciclo de vida esquemático de Puccinia arachidis en hojas de maní. Autor: Mondal y Badigannavar, 2015
.
Epidemiología
En la roya del maní, el único inóculo de importancia práctica lo constituyen las uredosporas. Estas se transportan por el aire, también pueden estar presentes en la superficie exterior de la vaina/semilla (Peregrene, 1971). No se transmite internamente por semillas (Subrahmanyam y McDonald, 1982). El desarrollo epidémico se ve favorecido por temperaturas cálidas continuas (>22°C) con clima húmedo o humedad elevada (>78%). Subrahmanyam y McDonald (1983) y Rao et al. (1997) informaron que la temperatura en el rango de 20 a 30°C favoreció el desarrollo de la roya en hojas desprendidas en condiciones de humedad saturada en cámara de crecimiento. La enfermedad progresó lentamente por debajo de los 10°C y por encima de los 35°C debido al incremento del período de incubación (Mallaiah y Rao, 1979; Rao et al., 1997; Zhou, 1987). Un estudio en Karnataka, India, confirmó que las uredosporas eran viables hasta 20 días en condiciones de campo (25-28°C) y se encontró que la temperatura óptima de 25°C era adecuada para la germinación máxima de las esporas. Además, las uredosporas en las plantas de maní voluntarias juegan un papel importante en la supervivencia y viabilidad del patógeno de una temporada a otra, lo que ayuda a perpetuar y trasladar la roya (Sunkad y Kulkarni, 2007). Además de la temperatura, la epidemiología de la roya también depende del genotipo del hospedante. Rao et al. (1997) informaron la posible interacción genotipo × ambiente para la epidemiología de la roya del maní al observar la frecuencia de infección diferencial en dos cultivares en condiciones de temperatura variable. Usando un simulador de lluvia y varios métodos de trampeo, se demostró que las lluvias ligeras favorecen la dispersión de esporas respecto de las lluvias intensas. El contenido de esporas de las lesiones en el dosel se redujo fuertemente por fuertes precipitaciones (Savary y Janeau, 1986). Aunque se observó prevalencia de esporas durante todo el año en el campo de maní, es menos frecuente en invierno. La captura de esporas en el dosel de la planta fue mayor durante la mañana que durante la noche (Bulbule y Mayee, 1997). Las temporadas de cultivo superpuestas proporcionan una acumulación continua de inóculo y la propagación aérea de uredosporas.
.
Manejo Integrado
* Siembra de variedades resistentes
* Aplicación de fungicidas
* Control de plantas voluntarias o guachas
S.
.
.
Bibliografía
Bromfield KR (1971) Peanut rust: a review of literature. J Am Peanut Res Educ Assoc 3: 111–112.
Bromfield KR, Bailey WK (1972) Inheritance of resistance to Puccinia arachidis in peanut. Phytopathology 62: 748.
Bulbule SV, Mayee CD (1997) Influence of weather parameters on the deposition pattern of urediniospores of groundnut rust. J Mycol Plant Pathol 27: 170–174.
Ghewande MP (2009) Rust of groundnut—an overview. In: Upadhyay RK, Mukherji KG, Chamola BP, Dubey OP (eds) Integrated pest and disease management. APH Publishing Corp., New Delhi, pp 326–334, 110012, India.
Grasso V, Sierotzki H, Garibaldi A, Gisi U (2006) Relatedness among agronomically important rusts based on mitochondrial cytochrome b gene and ribosomal ITS sequences. J Phytopathol 154: 110–118. doi: 10.1111/j.1439-0434.2006.01070.x
Hennen JF, Figucredo MB, Riberio IJA, Soave J (1976) The occurrence of teliospores of Puccinia arachidis (Uredinales) on Arachis hypogaea in Sao Paulo State, Brazil. Summa Phytopathol 2: 44–46.
Leppik EE (1971) Assumed gene centers of groundnuts and soybeans. Econ Bot 25: 188–194.
Lintz J, Dubrulle G, Cawston E, et al. (2022) A Short Review of Anti-Rust Fungi Peptides: Diversity and Bioassays. Front. Agron. 4: 966211. doi: 10.3389/fagro.2022.966211
Mallaiah KV, Rao AS (1979) Groundnut rust: factors influencing disease development, sporulation and germination of uredospores. Indian J Phytopathol 32: 382–388.
Mondal S, Badigannavar AM (2015) Peanut rust (Puccinia arachidis Speg.) disease: its background and recent accomplishments towards disease resistance breeding. Protoplasma 252: 1409–1420. doi: 10.1007/s00709-015-0783-8
Park RF, Wellings CR (2012) Somatic hybridization in the uredinales. Ann Rev Phytopathol 50: 219–239. doi: 10.1146/annurev-phyto-072910-095405
Peregrene WTJ (1971) Groundnut rust (Puccinia arachidis) in Brunei. PANS (Pest Artic News Summ) 19: 318–319.
Power IL (2014) Characterizing peanut rust resistance: determining its mechanisms, and the genetics of the peanut host and Puccinia arachidis. PhD thesis, University of Georgia, Athens, Georgia, USA. pp 125
Rao AS, McDonald D, Reddy KR (1997) Effect of temperature on rust and late leaf spot disease development in groundnut. J Oilseed Res 14: 249–255.
Rodrigues AAC, Silva GS, Moraes FHR, Silva CLP (2006) Arachis repens: Novo Hospedeiro de Puccinia arachidis. Fitopatol Bras 31(4): 410–411.
Savary S, Janeau JL (1986) Rain-induced dispersal in Puccinia arachidis, studied by means of a rainfall simulator. Neth J Plant Pathol 92: 163-174.
Savary S, Subba Rao PV, Zadoks JC (1989) A scale of reaction types of groundnut to Puccinia arachidis Speg. J Phytopathol 124: 259-266.
Subrahmanyam P, Vijaykumar CSK, Rao AS (1978) Transpiration in rust infected leaves of groundnut. Curr Sci 47: 302.
Subrahmanyam P, McDonald D (1982) Groundnut rust—its survival and carry over in India. Proc Indian Acad Sci 91: 93–100
Subrahmanyam P, McDonald D (1983) Rust disease of groundnut. Information Bulletin, No. 13, ICRISAT, India, pp 15
Subrahmanyam P, Hammons RO, Nigam SN, et al. (1983) International cooperative screening for resistance of peanut to rust and late leaf spot. Plant Dis 67: 1108–1111
Subrahmanyam P, Moss JP, Rao VR (1983) Resistance to peanut rust in wild Arachis species. Plant Dis 67: 209–212
Subrahmanyam P, Reddy LJ, Gibbons RW, McDonald D (1985) Peanut rust: a major threat to peanut production in the semiarid tropics. Plant Disease 69: 813–819. doi: 10.1094/PD-69-813
Subrahmanyam P, McDonald D (1987) Groundnut rust disease: epidemiology and control. In: Groundnut Rust Disease: Proc Discuss Group Meet. 24–28 September, 1984, ICRISAT, Patancheru, AP 502324, India. pp 27–39
Subrahmanyam P, McDonald D, Waliyar F, et al. (1995) Screening methods and sources of resistance to rust and late leaf spot of groundnut. In: Information bulletin, No 47, ICRI SAT, Patancheru, India
Subrahmanyam P (1997) Rust. In: Kokalis-Burelle N, Porter DM, Rodriguez-Kabana R, Smith DH, Subrahmanyam P (eds) Compendium of peanut disease. APS Press, St. Paul, pp 31–33
Sunkad G, Kulkarni S (2007) Studies on perpetuation and carryover of groundnut rust (Puccinia arachidis Speg.) in Northern Karnataka. Karnataka J Agric Sci 20: 297–300.
Tashildar CB, Avider SS, Chattannavar SN, et al. (2012) Morphological and isozyme variations in Puccinia arachidis Speg. causing rust of peanut.
Karnataka J Agric Sci 25(3): 340–345.
Zhou L (1987) The groundnut rust situation in the People’s Republic of China. In: Groundnut Rust Disease: Proc Discuss Group Meet. 24–28 September, 1984, ICRISAT, Patancheru, AP 502324, India. pp 103–106.