.
Condición fitosanitaria: Presente
Grupo de cultivos: Oleaginosas
Especie hospedante: Colza (Brassica napus)
Rango de hospedantes: Brassicas cultivadas como Brassica napus (colza, canola), B. rapa, B. juncea, B. oleracea, etc., junto con numerosas especies de crucíferas silvestres.
Etiología: Hongo. Hemibiotrófico
Agente causal:
Plenodomus lingam (Tode) Höhn., 1911; homotypic synonym (anamorph) Phoma lingam Tode ex Fr.)
Plenodomus biglobosus (Shoemaker & H. Brun) Gruyter, Aveskamp & Verkley, 2012 1); basionym:
Leptosphaeria biglobosa Shoemaker & H. Brun, 2001
.
Taxonomía: Fungi > Dikarya > Ascomycota > Pezizomycotina > Dothideomycetes > Pleosporomycetidae > Pleosporales > Pleosporineae > Leptosphaeriaceae > Leptosphaeria > Leptosphaeria maculans species complex
.
L. maculans es haploide y tiene un tamaño de genoma de aproximadamente 34 Mb (Howlett et al., 2001). Una especie estrechamente relacionada, Leptosphaeria biglobosa, también se asocia a menudo con la infección de la canola. Sin embargo, esta especie generalmente causa síntomas menos severos, está asociada con la infección del tallo superior y generalmente es superada por L. maculans cuando está presente (Fitt et al., 2006).
Las características de vida de L. maculans, incluido el gran tamaño de su población (debido a la colonización de restos de cultivos) y la capacidad de reproducirse tanto sexual como asexualmente, permiten que este patógeno evolucione y se adapte a los cambios rápidamente. A estas características biológicas se suma el genoma compartimentado de L. maculans, que da como resultado isocoros (grandes segmentos de ADN, ≫300 kb en promedio, que se caracterizan por una variación interna en GC muy por debajo de la variación total observada en el genoma de los mamíferos) ricos en GC y abundantes en genes en comparación con regiones ricas en AT y pobres en genes que están plagadas de elementos transponibles. Los genes de patogenicidad, conocidos como efectores o genes de avirulencia, se encuentran dentro de estas regiones ricas en AT que pueden sufrir una selección que da como resultado la virulencia. La especie menos competitiva, L. biglobosa, carece en gran medida de estas regiones ricas en AT (Grandaubert et al., 2014).
.
.
.
Antecedentes
El primer registro de una especie fúngica asociada a tallos secos de col lombarda (Brassica oleracea L. var. capitata f, rubra) fue el de Tode (1791). El cancro del tallo solo se convirtió en una preocupación económica importante con el éxito de la colza o canola (es decir, especies de Brassica de tipo primaveral de semillas oleaginosas con bajos niveles de glucosinolatos y ácido erúcico) como un cultivo de semillas oleaginosas importante en muchas partes del mundo, desde el mediados del siglo XX. Las epidemias fueron tan graves en las décadas de 1960 y 1970 que casi impidieron el desarrollo del cultivo en Australia (Roy y Reeves, 1975) o en los Estados Unidos (Hill, 1992). Actualmente, Leptosphaeria maculans es el patógeno más ubicuo de los cultivos de Brassica, y principalmente de las semillas oleaginosas de Brassica (colza, canola), que causa el devastador «cancro del tallo» o «pie negro». La enfermedad está clasificada entre las tres principales enfermedades de la canola en todas las regiones de cultivo del mundo, excepto China. Se han estimado pérdidas anuales promedio de 10 a 15%, y en epidemias extremas hasta 90% de pérdida de rendimiento. La enfermedad es ahora endémica en la mayoría de las regiones productoras de colza canola, y se observan graves epidemias de cancro del tallo siempre que las condiciones agroclimáticas cumplen los requisitos del patógeno y cuando el nivel de resistencia es insuficiente o inadecuado. Por ejemplo, en 1994, se observaron pérdidas de rendimiento medias del 40% en comparación con la producción nacional media en algunas regiones francesas (Ansan-Melayah et al., 1997).
.
Síntomas
Los síntomas primarios de la enfermedad son el colapso de color verde grisáceo del cotiledón o el tejido foliar, sin un margen visible, con puntuaciones negras (picnidios). Luego, el hongo desarrolla un crecimiento endófito asintomático durante algunos meses. Los síntomas secundarios, al final de la temporada de crecimiento, son necrosis seca de los tejidos de la corona con ennegrecimiento ocasional (cancro del tallo o pie negro) que provoca el acame de las plantas. Los pseudotecios se diferencian en los residuos sobrantes. El marchitamiento de las plántulas y la maduración prematura también se reportan bajo ciertas condiciones ambientales.
.
- Mancha foliar en colza (Brassica napus) causada por Leptosphaeria maculans, en Les Alluets-le-Roi, Francia. Se observan puntuaciones negras (picnidios) y conidios. Autor: Frédéric Suffert
.
Epidemiología
La germinación de esporas sexuales o asexuales del patógeno causa lesiones necróticas en las hojas antes de cambiar a una fase asintomática, creciendo por el pecíolo y hacia el tallo. A medida que las plantas maduran, el patógeno cambia a una fase necrotrófica y coloniza la corona del tallo, lo que restringe el flujo de nutrientes hacia arriba de la planta, provocando una pérdida de rendimiento y, en situaciones graves, provoca cancros en el tallo que matan a la planta (Hammond et al., 1985).
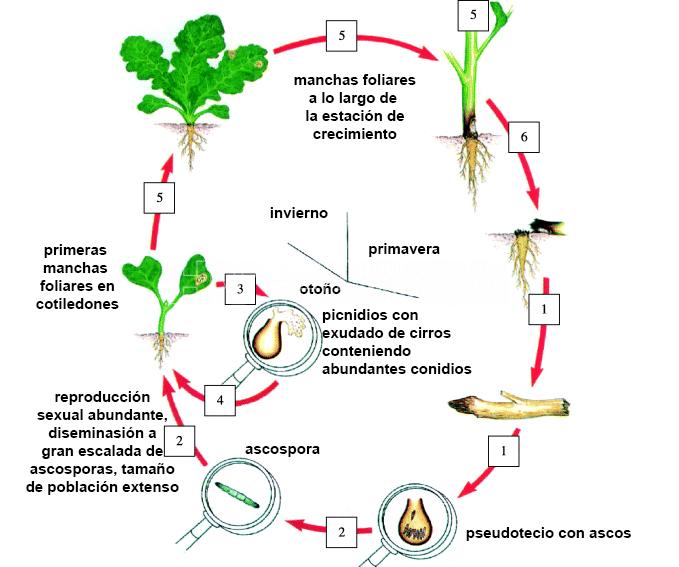
L. maculans es en primer lugar (i) «saprófito» en los residuos del tallo (restos culurales de su propio hospedante). Puede sobrevivir como saprobio durante muchos años en los rastrojos donde tiene lugar el apareamiento sexual, lo que da como resultado la producción de ascosporas, el inóculo principal. Estas esporas se producen en cantidades muy grandes y pueden ser dispersadas por el viento por kilómetros. Se depositan (inoculan) sobre los cotiledones o las hojas e infectan los cotiledones y/o las hojas al penetrar en los tejidos a través de estomas o heridas. El hongo (ii) es necrotrófico por un período de tiempo muy corto, causando manchas en las hojas donde tiene lugar la multiplicación asexual. Los conidios unicelulares se producen en el exudado y solo se dispersan a distancias cortas cuando salpica la lluvia. Se cree que los conidios tienen una importancia muy baja en el ciclo de vida del patógeno. La etapa de mancha foliar es seguida por (iii) una colonización sistémica endofítica prolongada de los tejidos de la hoja y el tallo, que puede durar hasta 9 meses en la colza canola de invierno, en Europa (West et al., 2001). Esta fase de la enfermedad es completamente asintomática, el hongo crece en los espacios intercelulares hacia la corona en la base del tallo y la raíz superior. Estos tejidos vegetales son un nicho ecológico específico donde numerosos individuos de L. maculans viven en reposo (Schmit et al., 2002; West et al., 2002). Al final de la temporada de crecimiento (iv) el hongo repentinamente se vuelve necrotrófico y destruye el tejido de la corona, causando el cancro de la corona responsable del vuelco de las plantas y pérdidas de rendimiento.
.
- Ciclo de vida/patogénico de Leptosphaeria maculans tal como ocurre en la colza de invierno en Europa. (1) etapa saprofita/supervivencia a largo plazo; (2) reproducción sexual/construcción de inóculo primario; (3) fase necrotrófica corta después del establecimiento de la infección primaria; (4) ciclo asexual/número creciente de sitios de entrada por planta; (5) estadio biotrófico prolongado/colonización asintomática desde los tejidos de la hoja hasta el tallo y el cuello; (6) cambio hacia necrotrofia/destrucción de la base del tallo. Autor: Rouxel y Balesdent, 2005.
.
Manejo Integrado
* Siembra de variedades genéticamente resistentes
.
.
.
Bibliografía
Ansan-Melayah D, Balesdent MH, Buée M, Rouxel T (1995) Genetic characterization of AvrLm1, the first avirulence gene of Leptosphaeria maculans. Phytopathology 85: 1525– 1529.
Ansan-Melayah D, Balesdent MH, Bertrandy J, et al. (1997) Phoma du colza. Des résistances spécifiques exploitables chez le colza. Phytoma, 490, 26– 29.
Ansan-Melayah D, Rouxel T, Bertrandy J, et al. (1997) Field efficiency of Brassica napus specific resistance correlates with Leptosphaeria maculans population structure. Eur. J. Plant Pathol. 103: 835– 841.
Ansan-Melayah D, Balesdent MH, Delourme R, et al. (1998) Genes for race-specific resistance against blackleg disease in Brassica napus L. Plant Breed. 117: 373– 378.
Bagi B, Palkovics L, Petróczy M (2023) Phylogenetic analysis of Plenodomus lingam and Plenodomus biglobosus isolates in Hungary. J Plant Dis Prot 130> 875–882. doi: 10.1007/s41348-023-00720-0
Balesdent MH, Gautier A, Plissonneau C, et al. (2022) Twenty Years of Leptosphaeria maculans Population Survey in France Suggests Pyramiding Rlm3 and Rlm7 in Rapeseed Is a Risky Resistance Management Strategy. Phytopathology: PHYTO04220108R. doi: 10.1094/PHYTO-04-22-0108-R
Borhan MH, Van de Wouw AP, Larkan NJ (2022) Molecular Interactions Between Leptosphaeria maculans and Brassica Species. Annu Rev Phytopathol. 60: 237-257. doi: 10.1146/annurev-phyto-021621-120602
Bouqellah NA, Elkady NA, Farag PF (2023) Secretome Analysis for a New Strain of the Blackleg Fungus Plenodomus lingam Reveals Candidate Proteins for Effectors and Virulence Factors. J Fungi (Basel). 9(7): 740. doi: 10.3390/jof9070740
Claassen BJ, Berry PA, Thomas WJ, et al. (2021) Black Leg and Chlorotic Leaf Spot Occurrence on Brassicaceae Crop and Weed Hosts. Plant Dis. 105(11): 3418-3425. doi: 10.1094/PDIS-03-21-0665-RE
de Gruyter J, Woudenberg JH, Aveskamp MM, et al. (2013) Redisposition of phoma-like anamorphs in Pleosporales. Stud Mycol. 75(1): 1-36. doi: 10.3114/sim0004
Fernando WGD, Zhang X, Amarasinghe CC (2016) Detection of Leptosphaeria maculans and Leptosphaeria biglobosa Causing Blackleg Disease in Canola from Canadian Canola Seed Lots and Dockage. Plants 5(1):12. doi: 10.3390/plants5010012
Fitt BDL, Huang YJ, van den Bosch F, West JS (2006) Coexistence of related pathogen species on arable crops in space and time. Annu. Rev. Phytopathol. 44: 163–168. doi: 10.1146/annurev.phyto.44.070505.143417
Frąc M, Kaczmarek J, Jędryczka M (2022) Metabolic Capacity Differentiates Plenodomus lingam from P. biglobosus Subclade ‘brassicae’, the Causal Agents of Phoma Leaf Spotting and Stem Canker of Oilseed Rape (Brassica napus) in Agricultural Ecosystems. Pathogens 11(1): 50. doi: 10.3390/pathogens11010050
Fu F, Zhang X, Liu F, et al. (2020) Identification of resistance loci in Chinese and Canadian canola/rapeseed varieties against Leptosphaeria maculans based on genome-wide association studies. BMC Genomics 21: 501. doi: 10.1186/s12864-020-06893-4
Grandaubert J, Lowe RG, Soyer JL, et al. (2014) Transposable element-assisted evolution and adaptation to host plant within the Leptosphaeria maculans–Leptosphaeria biglobosa species complex of fungal pathogens. BMC Genomics 15: 891. doi: 10.1186/1471-2164-15-891
Hammond KE, Lewis BG, Musa TM (1985) A systemic pathway in the infection of oilseed rape plants by Leptosphaeria maculans 34(4): 557–65.
(1992) Blackleg of crucifers. In Plant Diseases of International Importance, Vol. 2: Diseases of Vegetables and Oil Seed Crops ( H.S. Chaube, J. Kumar, A.N. Mukhopadhyay and U.S. Singh, eds). Englewood Cliffs: Prentice Hall, Inc., pp. 253– 271.
Howlett BJ, Idnurm A, Pedras MS (2001) Leptosphaeria maculans, the causal agent of blackleg disease of Brassicas. Fungal Genet Biol. 33(1): 1-14. doi: 10.1006/fgbi.2001.1274
Hwang S-F, Strelkov SE, Peng G, et al. (2016) Blackleg (Leptosphaeria maculans) Severity and Yield Loss in Canola in Alberta, Canada. Plants 5(3): 31. doi: 10.3390/plants5030031
Maryška L, Jindřichová B, Siegel J, et al. (2023) Impact of palladium nanoparticles on plant and its fungal pathogen. A case study: Brassica napus-Plenodomus lingam. AoB Plants. 15(2): plad004. doi: 10.1093/aobpla/plad004
Mitrousia GK, Huang YJ, Qi A, et al. (2018) Effectiveness of Rlm7 resistance against Leptosphaeria maculans (phoma stem canker) in UK winter oilseed rape cultivars. Plant Pathol. 67: 1339-1353. doi: 10.1111/ppa.12845
Robin AHK, Laila R, Abuyusuf M, et al. (2020) Leptosphaeria maculans Alters Glucosinolate Accumulation and Expression of Aliphatic and Indolic Glucosinolate Biosynthesis Genes in Blackleg Disease-Resistant and -Susceptible Cabbage Lines at the Seedling Stage. Front. Plant Sci. 11: 1134. doi: 10.3389/fpls.2020.01134
Rouxel T, Balesdent MH (2005) The stem canker (blackleg) fungus, Leptosphaeria maculans, enters the genomic era. Molecular Plant Pathology 6: 225-241. doi: 10.1111/j.1364-3703.2005.00282.x
(1975) Breeding better rape and linseed for Western Australia. J. Agric. Western Australia 16: 93– 97.
, , , (2002) La nécrose du collet du colza: analyse de la distribution du champignon dans la plante à l’aide d’outils moléculaires. OCL 2: 79– 85. Link
(1791) Fungi Mecklenburgenses Selecti. Fasciculus II, 51, plate XVI, Fig. 126.
, , (2001) Epidemiology and management of Leptosphaeria maculans (Phoma stem canker) on oilseed rape in Australia, Canada and Europe. Plant Pathol. 50: 10– 27.
West JS, Balesdent MH, Rouxel T, et al. (2002) Colonisation of winter oilseed rape tissues by A/Tox+ and B/Tox0 Leptosphaeria maculans (Phoma stem canker) in France and England. Plant Pathol. 51: 311– 321. doi: 10.1046/j.1365-3059.2002.00689.x
, , (2004) Comparing fungal diseases on oilseed rape in England, France and Poland. IOBC Bull. 27: 39– 43.