.
Condición fitosanitaria: Presente ampliamente distribuida
Grupo de cultivos: Cereales
Especie hospedante: Trigo (Triticum aestivum)
Rango de hospedantes: específico / estrecho
Etiología: Hongo. Biotrófico
Agente causal: Blumeria graminis f. sp. tritici [DC.] E.O. Speer Em. Marchal (synonym Erysiphe graminis DC)
Taxonomía: Eukaryota > Fungi > Dikarya > Ascomycota > Pezizomycotina > Leotiomycetes > Erysiphales > Erysiphaceae > Blumeria > Blumeria graminis
.
.
Síntomas y signos
El síntoma característico es la clorosis (amarillamiento) foliar. El patógeno es enteramente superficial y externo. Puede afectar todas las partes aéreas de las plantas, pero es más común sobre las vainas y los haces superiores de las hojas inferiores. Sobre la zona afectada se desarrolla el micelio o cuerpo del hongo de color blanquecino. Posteriormente intercalados en el micelio, se observan puntos oscuros que constituyen las fructificaciones sexuales del patógeno.
.
Ciclo de la enfermedad, Epidemiología
El desarrollo del oídio es óptimo a temperaturas entre 15‑22ºC y con humedad relativa entre 85 a 100 %. Por encima de los 25ºC el hongo frena su desarrollo, por eso es común observar esta enfermedad principalmente en macollaje. Para la germinación de las esporas no necesita agua libre. Al igual que en las royas las plantas guachas de cereales son las responsables de mantener el inóculo cuando no está el cultivo. A partir de estas plantas se liberan las esporas que serán depositadas en el nuevo cultivo de trigo y cebada. La diseminación por el viento es muy eficiente. El patrón de distribución en el lote es generalizada y uniforme.
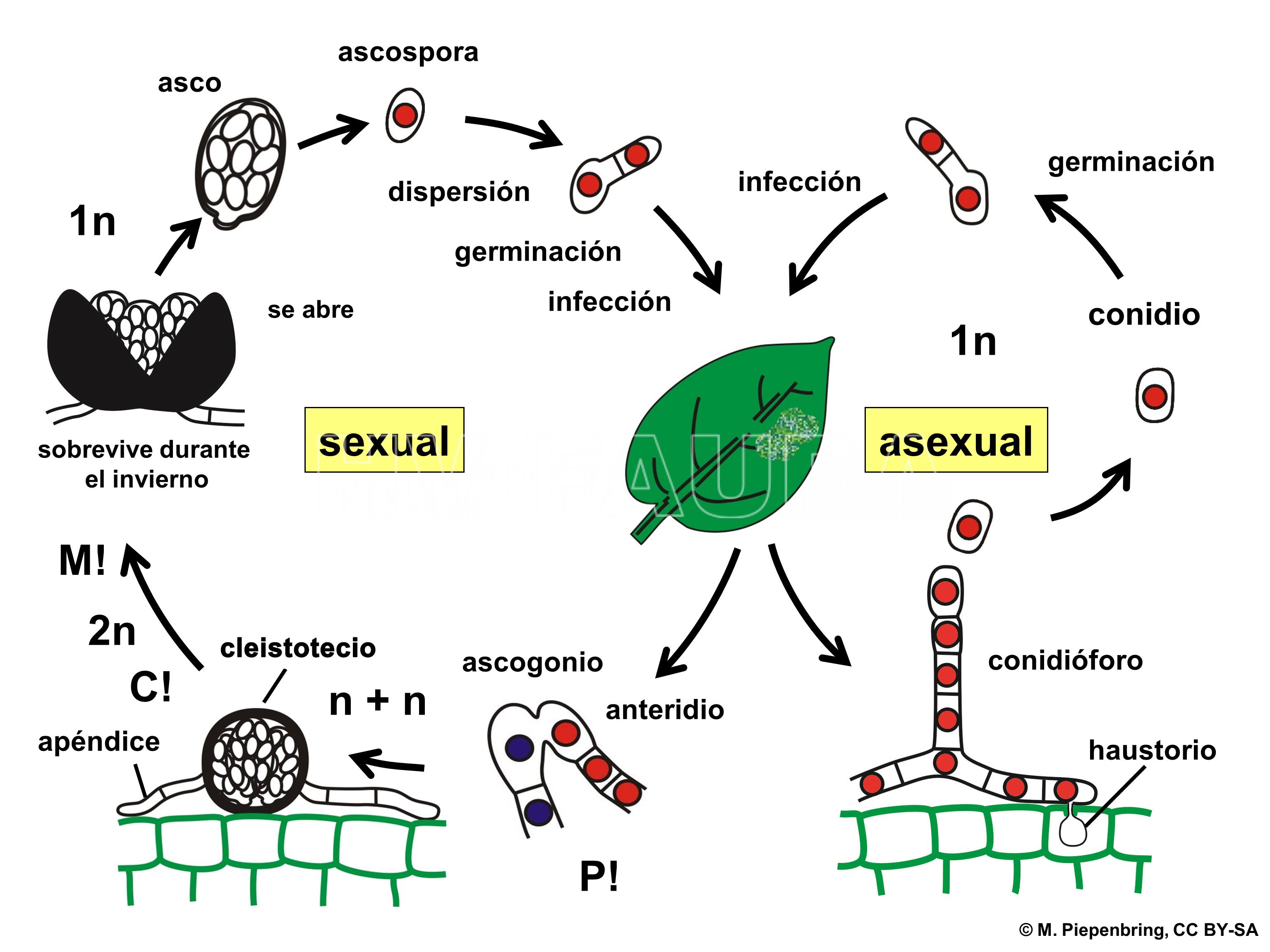
- Representación esquemática del ciclo de un oídio (Ascomycota > Erysiphales),. P! = plasmogamia; C! = cariogamia; M! = meiosis; 2n = células diploides; 1n = células haploides; n + n = células dicarióticas.
.
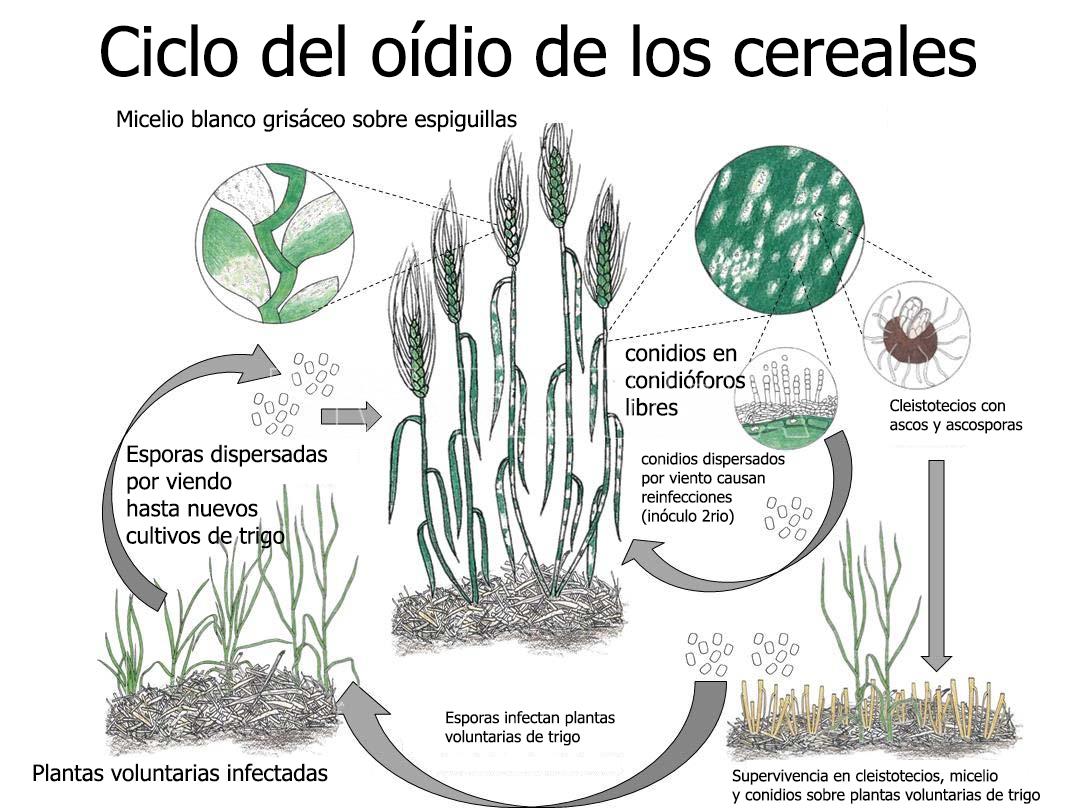
- Ciclo del oídio del trigo, causado por Blumeria graminis f. sp. tritici. Autor: Autor: Ohio State University Extension
.
Condiciones predisponentes / Factores de Riesgo:
* Uso de cultivares susceptibles
* Alta densidad de plantas,
* Excesivas dosis de nitrógeno,
* Alta humedad (84-100%) y temperaturas relativamente frescas(15-22ºC)
.
Manejo de la enfermedad
Debido a sus características epidemiológicas, las rotaciones o el manejo de los rastrojos no son medidas adecuadas. Las dos medidas preferenciales son:
* uso de cultivares resistentes- es la medida más efectiva, aunque la resistencia de ciertos cultivares puede “quebrarse”. Se han caracterizado nuevos genes de resistencia (He et al., 2020).
* eliminación de plantas guachas: es importante porque reduce el inóculo en un lote, pero por sí sola no es suficiente.
Otras:
* Tratamiento de semillas: El triadimenol, ofrece una protección a las plantas de alrededor de 30 a 45 días. En cultivares susceptibles y en regiones predisponentes, el protección vía semilla, puede resultar viable técnica y económicamente.
* Aplicación de fungicidas: Cuando se trate de cultivares susceptibles, se recomienda la aplicación de fungicidas triazoles. Los fungicidas no deben aplicarse preventivamente (en ausencia de micelio blanco).
.
- Autor: Dirceu Gassen
- Autor: Dirceu Gassen
- Autor: Dirceu Gassen
- Autor: Dirceu Gassen
- Autor: Dirceu Gassen
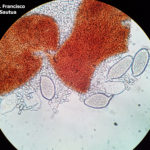
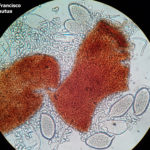
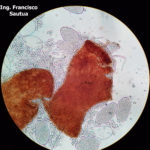
- 01 Hoja de trigo con Oídio, se observa micelio blanco y cleistotecios negros
- 02 Hoja de trigo con Oídio, se observa micelio blanco y cleistotecios negros
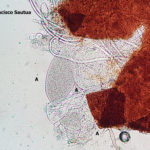
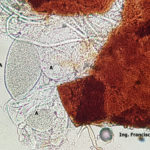
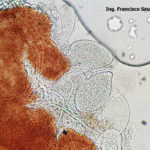
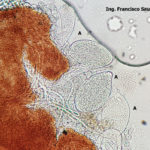
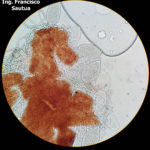
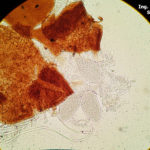
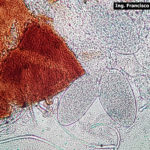
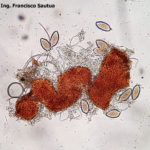
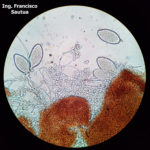
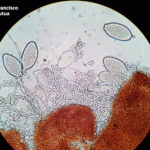
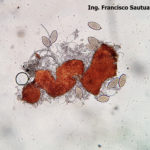
- 03 Cleistotecio de Blumeria graminis f. sp. tritici, A = ascas inmaduras saliendo del cleistotecio
- 04 Cleistotecio de Blumeria graminis f. sp. tritici, A = ascas inmaduras saliendo del cleistotecio
- 05 Cleistotecio de Blumeria graminis f. sp. tritici, A = ascas inmaduras saliendo del cleistotecio
- 06 Cleistotecio de Blumeria graminis f. sp. tritici, A = ascas inmaduras saliendo del cleistotecio
- 07 Cleistotecio de Blumeria graminis f. sp. tritici, A = ascas inmaduras saliendo del cleistotecio
- 08 Cleistotecio de Blumeria graminis f. sp. tritici, A = ascas inmaduras saliendo del cleistotecio
- 09 Cleistotecio de Blumeria graminis f. sp. tritici, A = ascas inmaduras saliendo del cleistotecio
- 10 Cleistotecio de Blumeria graminis f. sp. tritici, A = ascas inmaduras saliendo del cleistotecio
- 11 Cleistotecio de Blumeria graminis f. sp. tritici, A = ascas inmaduras saliendo del cleistotecio
- 12 Cleistotecio de Blumeria graminis f. sp. tritici, A = ascas inmaduras saliendo del cleistotecio
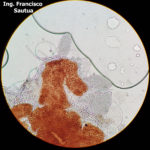
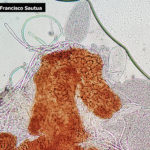
- 13 Cleistotecio de Blumeria graminis f. sp. tritici, ascas inmaduras saliendo del cleistotecio
- 14 Cleistotecio de Blumeria graminis f. sp. tritici, ascas inmaduras saliendo del cleistotecio
- 15 Cleistotecio de Blumeria graminis f. sp. tritici, ascas inmaduras saliendo del cleistotecio
- 16 Cleistotecio de Blumeria graminis f. sp. tritici, ascas inmaduras saliendo del cleistotecio
- 17 Cleistotecio de Blumeria graminis f. sp. tritici, ascas inmaduras saliendo del cleistotecio
- 18 Cleistotecio de Blumeria graminis f. sp. tritici, ascas inmaduras saliendo del cleistotecio
- 19 Cleistotecio de Blumeria graminis f. sp. tritici, ascas inmaduras saliendo del cleistotecio
.
Bibliografía
Abdelrhim A, Abd-Alla HM, Abdou ES, et al. (2018) Virulence of Egyptian Blumeria graminis f. sp. tritici Population and Response of Egyptian Wheat Cultivars. Plant Disease 102(2): 391-397. doi: 10.1094/PDIS-07-17-0975-RE
Braun U (2012) The impacts of the discontinuation of dual nomenclature of pleomorphic fungi: the trivial facts, problems, and strategies. IMA Fungus 3: 81–86. doi: 10.5598/imafungus.2012.03.01.08
Braun U (2013) (2210–2232) Proposals to conserve the teleomorph–typified name Blumeria against the anamorph–typified name Oidium and twenty–two teleomorph–typified powdery mildew species names against competing anamorph–typified names (Ascomycota: Erysiphaceae). Taxon, 62: 1328-1331. doi: 10.12705/626.20
Cao X, Yao D, Zhou Y, et al. (2016) Detection and quantification of airborne inoculum of Blumeria graminis f. sp. tritici using quantitative PCR. European Journal of Plant Pathology 146: 225-229. doi: 10.1007/s10658-016-0908-8
Chin KM, Chavaillaz D, Kaesbohrer M, et al. (2001) Characterizing resistance risk of Erysiphe graminis f. sp. tritici to strobilurins. Crop Protection 20: 87–96. doi: 10.1016/S0261-2194(00)00059-4
Dodhia KN, Cox BA, Oliver RP, et al. (2021) Rapid in situ quantification of the strobilurin resistance mutation G143A in the wheat pathogen Blumeria graminis f. sp. tritici. Scientific Reports 11: 4526. doi: 10.1038/s41598-021-83981-9
He H, Liu R, Ma P, et al. (2020) Characterization of Pm68, a new powdery mildew resistance gene on chromosome 2BS of Greek durum wheat TRI 1796. Theoretical and Applied Genetics. doi: 10.1007/s00122-020-03681-2
, , , et al. (2021) Potassium ion channel gene family provides new insights into powdery mildew responses in Triticum aestivum. Plant Pathology 00: 1– 16. doi: 10.1111/ppa.13511
Jankovics T, Komáromi J, Fábián A, et al. (2015) New Insights into the Life Cycle of the Wheat Powdery Mildew: Direct Observation of Ascosporic Infection in Blumeria graminis f. sp. tritici. Phytopathology 105(6): 797-804. doi: 10.1094/PHYTO-10-14-0268-R
Koller T, Brunner S, Herren G, et al. (2018) Pyramiding of transgenic Pm3 alleles in wheat results in improved powdery mildew resistance in the field. Theoretical and Applied Genetics 1–11. doi: 10.1007/s00122-017-3043-9
Kusch S, Frantzeskakis L, Thieron H, Panstruga R (2018) Small RNAs from cereal powdery mildew pathogens may target host plant genes. Fungal Biology (In Press, Accepted Manuscript). doi: 10.1016/j.funbio.2018.08.008
Kuska MT, Brugger A, Thomas S, et al. (2017) Spectral Patterns Reveal Early Resistance Reactions of Barley Against Blumeria graminis f. sp. hordei. Phytopathology 107(11): 1388-1398. doi: 10.1094/PHYTO-04-17-0128-R
Li F, Li Y, Cao L, et al. (2018) Simultaneous Transfer of Leaf Rust and Powdery Mildew Resistance Genes from Hexaploid Triticale Cultivar Sorento into Bread Wheat. Frontiers in Plant Science 9: 85. doi: 10.3389/fpls.2018.00085
Li S, Lin D, Zhang Y, et al. (2022) Genome-edited powdery mildew resistance in wheat without growth penalties. Nature. doi: 10.1038/s41586-022-04395-9
Li Y, Roychowdhury R, Govta L, et al. (2023) Intracellular Reactive Oxygen Species-Aided Localized Cell Death Contributing to Immune Responses Against Wheat Powdery Mildew Pathogen. Phytopathology 113(5): 884-892. doi: 10.1094/PHYTO-07-22-0271-FI
Marone D, Russo MA, Laidò G, et al. (2013) Genetic basis of qualitative and quantitative resistance to powdery mildew in wheat: from consensus regions to candidate genes. BMC Genomics 14: 562. doi: 10.1186/1471-2164-14-562
Mc Nally K (2017) Molecular and Evolutionary Studies of Race-specific Avirulence Factors from Wheat Powdery Mildew (Blumeria graminis f. sp. tritici). Doctoral Thesis, Universität Zürich. Link
Menardo F, Praz CR, Wicker T, Keller B (2017) Rapid turnover of effectors in grass powdery mildew (Blumeria graminis). BMC Evolutionary Biology 17: 223. doi: 10.1186/s12862-017-1064-2
Müller MC, Kunz L, Schudel S, et al. (2022) Ancient variation of the AvrPm17 gene in powdery mildew limits the effectiveness of the introgressed rye Pm17 resistance gene in wheat. Proc Natl Acad Sci U S A. 119(30): e2108808119. doi: 10.1073/pnas.2108808119
Robinson HL, Ridout CJ, Sierotzki H, et al. (2002) Isogamous, hermaphroditic inheritance of mitochondrion-encoded resistance to Qo inhibitor fungicides in Blumeria graminis f. sp. tritici. Fungal Genetics and Biology 36: 98–106. doi: 10.1016/S1087-1845(02)00006-3
Różewicz M, Wyzińska M, Grabiński J (2021) The Most Important Fungal Diseases of Cereals—Problems and Possible Solutions. Agronomy 11(4): 714. doi: 10.3390/agronomy11040714
Sierotzki H, Wullschleger J, Gisi U (2000) Point mutation in cytochrome b gene conferring resistance to strobilurin fungicides in Erysiphe graminis f. sp. tritici Field Isolates. Pesticide Biochemistry and Physiology 68: 107–112. doi: 10.1006/pest.2000.2506
Tucker MA, Moffat CS, Ellwood SR, et al. (2015) Development of genetic SSR markers in Blumeria graminis f. sp. hordei and application to isolates from Australia. Plant Pathology 64: 337-343. doi: 10.1111/ppa.12258
Wu P, Xie J, Hu J, et al. (2018) Development of Molecular Markers Linked to Powdery Mildew Resistance Gene Pm4b by Combining SNP Discovery from Transcriptome Sequencing Data with Bulked Segregant Analysis (BSR-Seq) in Wheat. Frontiers in Plant Science 9:95. doi: 10.3389/fpls.2018.00095
Xing L et al. (2018) Pm21 from Haynaldia villosa Encodes a CC-NBS-LRR that Confers Powdery Mildew Resistance in Wheat. Molecular Plant (In Press Accepted Manuscript). doi: 10.1016/j.molp.2018.02.013
Zou S, Wang H, Li Y, et al. (2017) The NB-LRR gene Pm60 confers powdery mildew resistance in wheat. New Phytologist (in press). doi: 10.1111/nph.14964
Zulak KG, Cox BA, Tucker MA, et al. (2018) Improved Detection and Monitoring of Fungicide Resistance in Blumeria graminis f. sp. hordei With High-Throughput Genotype Quantification by Digital PCR. Frontiers in Microbiology 9: 706. doi: 10.3389/fmicb.2018.00706