.
Condición fitosanitaria: Ausente
Grupo de cultivos: Industriales
Especie hospedante: Cacao (Theobroma cacao L.)
Rango de hospedantes: el patógeno infecta sólo los frutos de Theobroma y especies relacionadas de Herrania.
Epidemiología: monocíclica, subaguda.
Etiología: Hongo. Necrotrófico
Agente causal: Moniliophthora roreri (Cif.) H.C. Evans, Stalpers, Samson & Benny, 1978
Taxonomía: Eukaryota > Fungi > Dikarya > Basidiomycota > Agaricomycotina > Agaricales > Marasmiaceae > Moniliophthora
.
M. roreri es un hongo agárico inusual que carece de la capacidad de reproducirse sexualmente, dependiendo de una gran producción de esporas asexuales (o conidios) para su diseminación entre los campos de cacao (Díaz-Valderrama y Aime, 2016a, 2016b). El patógeno infecta sólo los frutos de Theobroma y especies relacionadas de Herrania.
.
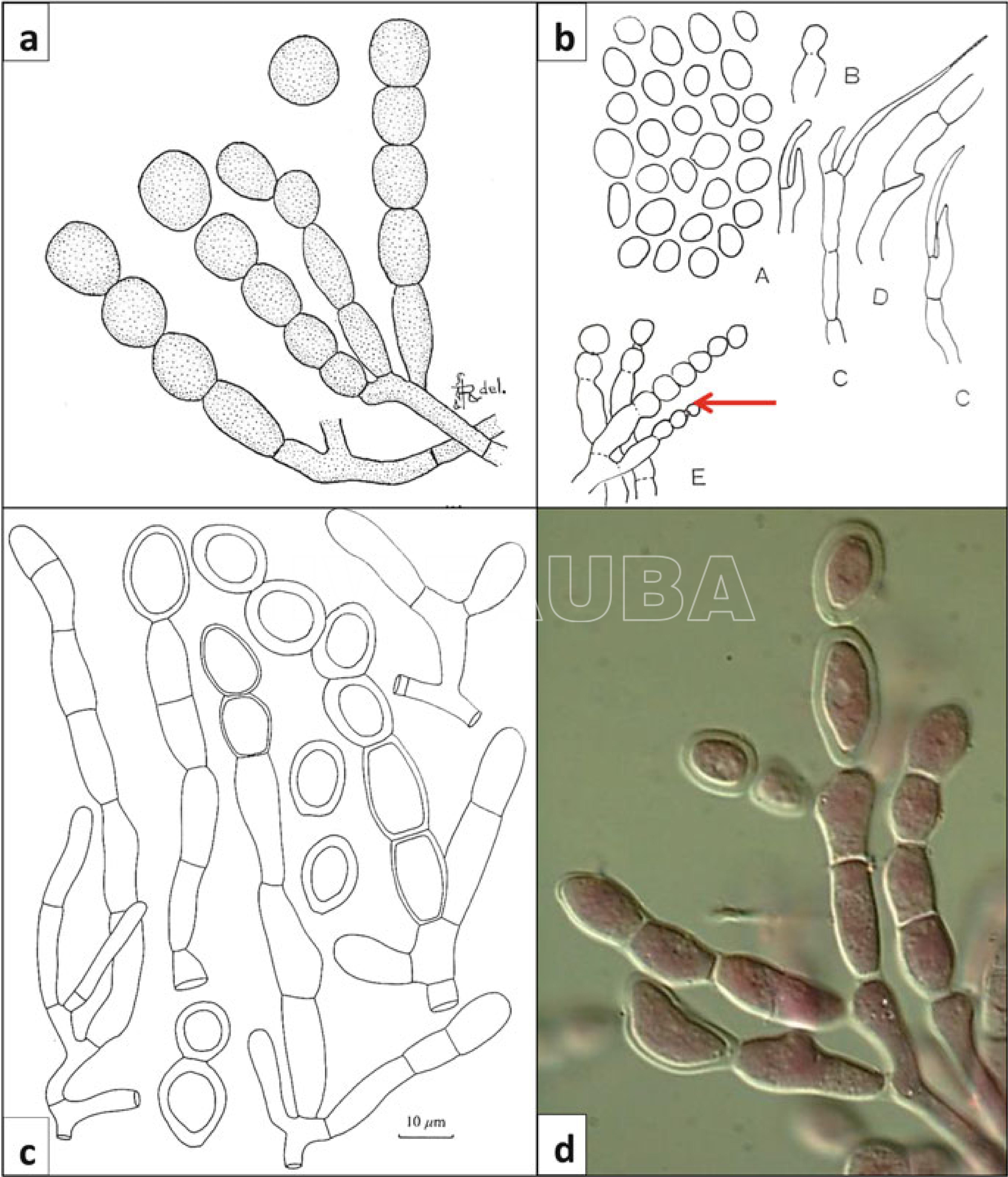
.
Esporogénesis en Moniliophthora roreri, interpretada mediante microscopía óptica. (a) Ilustración de Rorer (1918), que muestra las cadenas basipétalas, esporas más antiguas en el ápice, en lugar de las acropétalas típicas de Monilia. (b) Ilustración de Ciferri y Parodi (1933), que representa de forma ambigua cadenas mixtas basipétalas y monilioides (flecha). (c) Ilustración de Evans et al. (1978), que muestra la formación basipétala de esporas predominantemente globosas y de paredes gruesas [reproducida en Evans (1981) con autorización del Consejo Nacional de Investigación de Canadá]. (d) Microscopía de contraste de fases, para destacar la ramificación de los esporóforos y el proceso de engrosamiento de las paredes. Fuente: Evans HC, 2016.
.
.
Características morfológicas de Moniliophthora roreri. (a) Tapete micelial blanco (pseudostroma) que se desarrolla rápidamente en la vaina necrosante. (b) Pseudostroma que se fusiona para formar una película gruesa sobre la superficie de la vaina y adquiere tonos marrones al iniciarse la esporulación. (c) Floración de esporas densa, de color marrón rosado y polvorienta que cubre el pseudostroma; nótese la ausencia de esporulación en la prominente hinchazón de la vaina. (d) Microscopía de contraste de fases y tinción con acetocarmín para mostrar la pared gruesa y subhialina de la espora. (e) Cultivo de M. roreri después de un mes en agar con extracto de malta. Fuente: Evans HC, 2016.
.

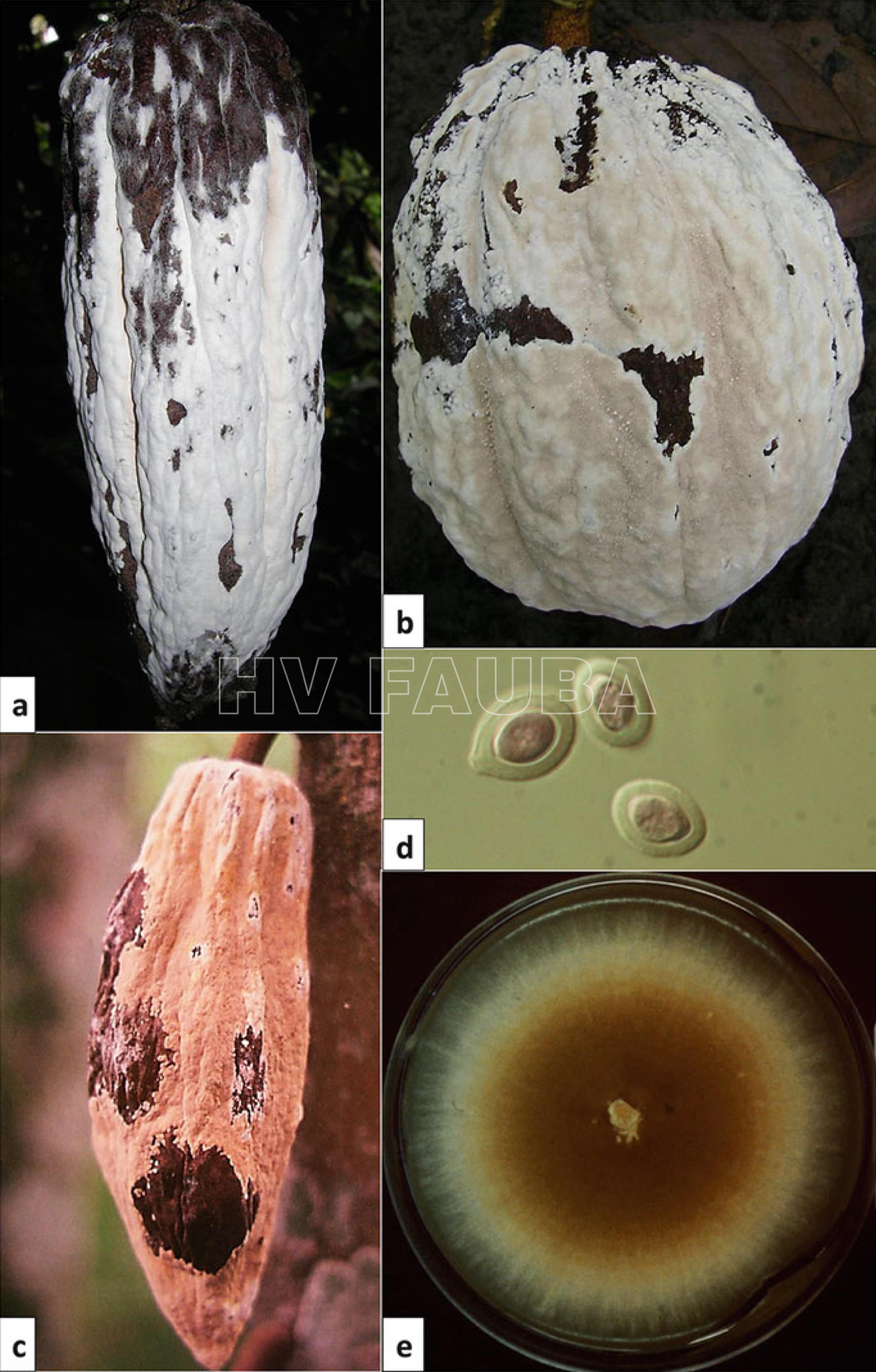
.
Sintomatología causada por Moniliophthora roreri en las fases biotrófica y necrotrófica temprana. (a) Vaina joven o cherelle (de aproximadamente un mes de edad) con hinchazón marcada; observe la cherelle sana más pequeña en el mismo cojín. (b) Vaina verde hinchada y deformada, de 2 a 3 meses de edad. (c) Vaina, de 3 a 4 meses de edad, que muestra hinchazones y fase inicial de necrosis. (d) Vaina con pseudoestroma en desarrollo, cosechada para mostrar necrosis interna con compactación y destrucción completa de la masa de frijol. (e) Lesión externa negra atípica, más típica de la infección por M. perniciosa, sin el pseudoestroma externo diagnóstico, pero con podredumbre interna húmeda o acuosa; ejemplar de Costa Rica, donde no se observa la enfermedad de la escoba de bruja. Fuente: Evans HC, 2016.
.
.
.
Antecedentes
La enfermedad ha impactado severamente la producción de cacao en América Latina desde su descubrimiento. Antes de la década de 1950, sólo se conocía en Colombia y Ecuador. Sin embargo, a partir de la década de 1970, su distribución geográfica se expandió drásticamente a la mayoría de las regiones productoras de cacao de las Américas. El origen del patógeno sigue siendo desconocido.
El primer brote documentado y registrado de la enfermedad ocurrió en Ecuador en 1895 y a fines de la década de 1910, respectivamente, pero hay informes de enfermedades del cacao sin nombre con sintomatología similar que datan al menos de 1817 en Norte de Santander, el lado colombiano de la cuenca de Maracaibo (Díaz-Valderrama et al., 2020). Antes de la década de 1950, el área de distribución geográfica conocida de M. roreri permanecía restringida a Colombia, Ecuador y el oeste de Venezuela (Phillips-Mora y Wilkinson, 2007). Posteriormente, a partir de 1956 con el primer reporte en Panamá, M. roreri se distribuyó a todos los países productores de cacao de Centroamérica (Phillips-Mora et al., 2006a; Phillips-Mora et al., 2006b; Phillips-Mora y Wilkinson, 2007), y para 2016, se había expandido hacia el este, hasta Jamaica (Johnson et al., 2017). El patógeno también se ha propagado hacia el sur, llegando al norte de Perú en 1988, al sur de Perú en 1998, a Bolivia en 2012 y, más recientemente, al estado occidental de Acre en Brasil (Hernández et al., 1990; Jiménez et al., 2022; Phillips-Mora et al., 2015; Ríos-Ruiz y Rodríguez, 1998).
La propagación de la FPR ha alterado por completo el cultivo mundial del cacao en el siglo XX. Antes del brote de la enfermedad en Ecuador en la década de 1910, el país era un importante productor mundial; actualmente, la producción total de cacao de África Occidental y el Sudeste Asiático (áreas aún libres de FPR) constituye casi el 85% de la producción mundial (Díaz-Valderrama et al., 2020).
Originalmente, se consideraba que M. roreri era originaria de Ecuador (Phillips-Mora et al., 2007), aunque estudios recientes han encontrado altos niveles de diversidad genética para M. roreri en Colombia, lo que desafía esta perspectiva (Ali et al., 2015; Jaimes et al., 2016; Phillips-Mora et al., 2007). Sin embargo, ningún estudio ha incluido un muestreo exhaustivo ni de la alta Amazonía, donde se originó el cultivo y se domesticó por primera vez (Zarrillo et al., 2018), ni de la costa de Ecuador, donde el patógeno se documentó por primera vez en 1895 (Díaz-Valderrama et al., 2020); datos necesarios para un análisis completo del origen y la propagación de M. roreri. De todas formas, la mayoría de los estudios han descubierto que M. roreri se diseminó por Centroamérica tras una o muy pocas introducciones de genotipos iguales o casi idénticos provenientes de Sudamérica (Díaz-Valderrama y Aime, 2016a; Phillips-Mora et al., 2007). Un segundo genotipo parece ser el responsable de la enfermedad en Perú (Díaz-Valderrama y Aime, 2016a). Las recientes invasiones de M. roreri en Jamaica en 2016 y Bolivia en 2012 (Johnson et al., 2017; Phillips-Mora et al., 2015) plantean la pregunta de si se trata de nuevas incursiones de los mismos genotipos invasores o de la evolución de nuevos genotipos invasores.
Aunque no se pudo establecer definitivamente un centro de origen para M. roreri, existe evidencia indirecta de que M. roreri se originó dentro del área de la Alta Amazonía que hoy se extiende por partes de los actuales Colombia, Perú y Ecuador. Desde esta región, migró, probablemente en asociación con su planta hospedera, a al menos dos áreas de cultivo intensivo —en la costa de Ecuador y en los valles interandinos de Colombia— donde la diversidad genética del patógeno aumentó e intensificó. De estos acervos genéticos, han surgido al menos dos genotipos que se adaptaron bien para volverse invasores: un linaje que se extendió hacia el norte por Centroamérica y un linaje que se ha extendido más recientemente hacia el sur. La provincia de Maynas en Perú podría albergar un tercer genotipo invasor que ha surgido más recientemente e introducido desde Colombia (Díaz-Valderrama et al., 2022).
.
Sintomatología
Los síntomas incluyen malformaciones, especialmente en frutos jóvenes, necrosis y posible momificación de frutos. Internamente, las semillas se vuelven podridas, acuosas e inútiles para la fabricación de chocolate (Aime y Phillips-Mora, 2005). Los síntomas externos tardan entre 45 y 90 días en desarrollarse después de la infección, lo que significa que las vainas infectadas que parecen asintomáticas pueden ser diseminadas a través de grandes distancias geográficas por los humanos (Phillips-Mora et al., 2007).
.
.
- Ciclo de infección de M. roreri. La figura muestra las etapas de proliferación y diseminación de M. roreri (es decir, dispersión, germinación, crecimiento biotrófico y necrotrófico, y esporulación), su duración y las condiciones ambientales favorables. Autores: Jiménez et al., 2022.
.
.
Condiciones predisponentes
Elevados valores de humedad relativa, temperatura y precipitaciones. El principal pico de cosecha de cacao usualmente coincide con el periodo lluvioso, lo que causa mayores pérdidas en los cultivos. Más aún, en los lotes con alto sombreamiento.
.
Ciclo de la enfermedad
Moniliophthora roreri es un hongo hemibiotrófico (forman inicialmente una asociación con células vivas y más tarde con tejido muerto), el proceso de infección empieza cuando los conidios o esporas reproductivas del hongo (Basidiomycota sin reproducción sexual) llegan a la superficie de las mazorcas. Allí por condiciones de alta humedad y temperatura germinan y penetran la mazorca, ocasionando daños internos en las primeras etapas de la enfermedad. Los síntomas externos aparecen después de 40 a 80 días de infección con pequeñas manchas oscuras en la superficie de las mazorcas; es decir que las mazorcas infectadas son asintomáticas (sin lesiones visibles) en las primeras etapas de la infección. Posterior a la formación de estas manchas oscuras, se forma un característico polvo blanco en la superficie de las mazorcas infectadas por la presencia de millones de conidios (44 millones por centímetro cuadrado). Este polvo le permite al hongo ser dispersado con facilidad por agua, viento y trabajadores. La incidencia de la enfermedad varía con la variedad, la edad de los frutos y las precipitaciones. En general, la mayor incidencia de la enfermedad es cuando la precipitación es alta. El hongo infecta sólo a los tejidos en crecimiento, especialmente frutos jóvenes.
.
- Ciclo de infección de M. roreri. La figura muestra las etapas de proliferación y diseminación de M. roreri (es decir, dispersión, germinación, crecimiento biotrófico y necrotrófico, y esporulación), su duración y las condiciones ambientales favorables. Autores: Jiménez et al., 2022.
.
.
Manejo Integrado
Las estrategias de control comúnmente utilizadas contra la moniliasis son el uso de variedades de cacao tolerantes y el uso de control químico, cultural o biológico. Estas prácticas buscan eliminar o reducir el inóculo del patógeno, proteger las mazorcas sanas para prevenir el desarrollo de nuevas infecciones y evitar las condiciones ambientales que favorecen la proliferación de hongos. Sin embargo, el alcance de estas prácticas de control es limitado, ya que solo reducen los daños causados por la enfermedad (Correa Álvarez et al., 2014; Ramírez, 2008).
Para las condiciones de Ecuador y Colombia se recomienda la remoción semanal de frutos enfermos; aquellos con escoba de bruja, moniliasis y mazorca negra (Phytophtora), pero esta práctica presenta bajos niveles de adopción por parte de los productores por su alta demanda en mano de obra. Aún no se disponen de variedades con un importante nivel de resistencia genética, aunque claramente existen genotipos con buena tolerancia a Moniliasis, que deben constituir un esquema de mejoramiento para explorar la transferencia de ciertas características importantes para el control de la enfermedad.
.
.
.
Videos
Esquema para el manejo integrado de la moniliasis en cacao (Theobroma cacao L.)
.
Bibliografía
Moniliasis en cacao. Croplife. Link
Aime MC, Phillips-Mora W (2005) The causal agents of witches’ broom and frosty pod rot of cacao (chocolate, Theobroma cacao) form a new lineage of Marasmiaceae. Mycologia 97: 1012–1022. doi: 10.3852/mycologia.97.5.1012
Ali SS, Shao J, Strem MD, et al. (2015) Combination of RNAseq and SNP nanofluidic array reveals the center of genetic diversity of cacao pathogen Moniliophthora roreri in the upper Magdalena Valley of Colombia and its clonality. Front Microbiol. 6: 850. doi: 10.3389/fmicb.2015.00850
Correa Alvarez J, Castro Martínez S, Coy J (2014) Estado de la Moniliasis del cacao causada por Current Genetics en Colombia. Acta Agronómica 63: 388–399.
de Oliveira Santos TL, Araújo Tavares da Silva FL, Araújo Dionízio da Silva D, Efraim P (2025), Exploring the Research Evolution of Cacao Diseases Over the Past Two Decades: A Review. Plant Pathol. doi: 10.1111/ppa.14121
(2016a) The cacao pathogen Moniliophthora roreri (Marasmiaceae) possesses biallelic A and B mating loci but reproduces clonally. Heredity: 116, 491–501. doi: 10.1038/hdy.2016.5
(2016b) The cacao pathogen Moniliophthora roreri (Marasmiaceae) produces rhexolytic thallic conidia and their size is influenced by nuclear condition. Mycoscience 57: 208–216. doi: 10.1016/j.myc.2016.01.004
, (2020) The history of cacao and its diseases in the Americas. Phytopathology 110: 1604–1619. doi: 10.1094/PHYTO-05-20-0178-RVW
, , , et al. (2022) Diversity in the invasive cacao pathogen Moniliophthora roreri is shaped by agriculture. Plant Pathology 71: 1721–1734. doi: 10.1111/ppa.13603
Evans HC (2016) Frosty Pod Rot (Moniliophthora roreri). In: Bailey B, Meinhardt L (eds) Cacao Diseases. Springer, Cham. doi: 10.1007/978-3-319-24789-2_3
, , (1990) La moniliasis del cacao en el Perú. Agrotrópica (Brasil) 2: 56–58.
Jaimes YY, Gonzalez C, Rojas J, et al. (2016) Geographic Differentiation and Population Genetic Structure of Moniliophthora roreri in the Principal Cocoa Production Areas in Colombia. Plant Dis. 100(8): 1548-1558. doi: 10.1094/PDIS-12-15-1498-RE
Jiménez DL, Alvarez JC, Mosquera S (2022) Frosty pod rot: a major threat to cacao plantations on the move. Trop. plant pathol. 47: 187–200. doi: 10.1007/s40858-021-00472-y
Johnson ES, Rutherford MA, Edgington S, et al. (2017) First report of Moniliophthora roreri causing frosty pod rot on Theobroma cacao in Jamaica. New Disease Reports, 36, 2. doi: 10.5197/j.2044-0588.2017.036.002
, , (2006) First report of frosty pod rot (moniliasis disease) caused by Moniliophthora roreri on cacao in Belize. Plant Pathology 55: 584. doi: 10.1111/j.1365-3059.2006.01378.x
, , , et al (2006) First report of Moniliophthora roreri causing frosty pod rot (moniliasis disease) of cacao in Mexico. Plant Pathology 55: 584. doi: 10.1111/j.1365-3059.2006.01418.x
(2007) Frosty pod of cacao: a disease with a limited geographic range but unlimited potential for damage. Phytopathology 97: 1644–1647. doi: 10.1094/PHYTO-97-12-1644
Phillips-Mora W, Aime MC, Wilkinson MJ (2007) Biodiversity and biogeography of the cacao (Theobroma cacao) pathogen Moniliophthora roreri in tropical America. Plant Pathology 56: 911–922. doi: 10.1111/j.1365-3059.2007.01646.x
, , (2015) First report of frosty pod rot caused by Moniliophthora roreri on cacao in Bolivia. New Disease Reports 31: 29. doi: 10.5197/j.2044-0588.2015.031.029
Ramírez SI (2008) La moniliasis un desafio para lograr la sostenibilidad del sistema cacao en México. Tecnología En Marcha 21: 97–110.
(1998) La moniliasis [Moniliophthora roreri (Cif. & Par.) Evans et al.] del cacao en la cuenca del alto Urubamba: primera ocurrencia e impacto económico esperado. In: XV Congreso Peruano de Fitopatología. Pucallpa, Peru, p. 14.
Zarrillo S, Gaikwad N, Lanaud C, et al. (2018) The use and domestication of Theobroma cacao during the mid-Holocene in the upper Amazon. Nat Ecol Evol. 2(12): 1879-1888. doi: 10.1038/s41559-018-0697-x









