.
Condición fitosanitaria: Presente
Grupo de cultivos: Frutales
Subgrupo: Cítricos
Especie hospedante: Limón (Citrus limon), Naranjo (Citrus sinenses), Mandarino (Citrus nobilus), Pomelo (Citrus paradisi), Lima Key (Citrus × aurantifolia)
Etiología: Hongo. Necrotrófico (hemibiótrofo)
Agente causal: Colletotrichum spp.; Colletotrichum gloeosporioides (Penz.) Penz. et Sacc.; Colletotrichum truncatum (Schwein.) Andrus & W.D. Moore, 1935; Colletotrichum citri F. Huang, L. Cai, K.D. Hyde & H.Y. Li, 2013; Colletotrichum fruticola Prihastuti, L. Cai & K.D. Hyde 2009 Prihastuti, L. Cai & K.D. Hyde, 2009
Colletotrichum limetticola (R.E. Clausen) Damm, P.F. Cannon & Crous, Basionym: Gloeosporium limetticola R.E. Clausen 1912
.
A nivel mundial, se han identificado varias especies de Colletotrichum como causantes de la antracnosis de los cítricos.
C. gloeosporioides (teleomorfo Glomerella cingulata) causa la enfermedad comúnmente conocida como antracnosis en un amplio rango de especies de plantas en regiones tropicales, subtropicales y templadas.
.
Taxonomía: Fungi > Ascomycota > Pezizomycotina > Sordariomycetes > Glomerellales > Glomerellaceae
Eukaryota > Fungi > Dikarya > Ascomycota > Pezizomycotina > Sordariomycetes > Glomerellales > Glomerellaceae > Colletotrichum
.
Algunas acérvulas pueden NO presentar setas, lo que dificulta su diagnóstico.
.
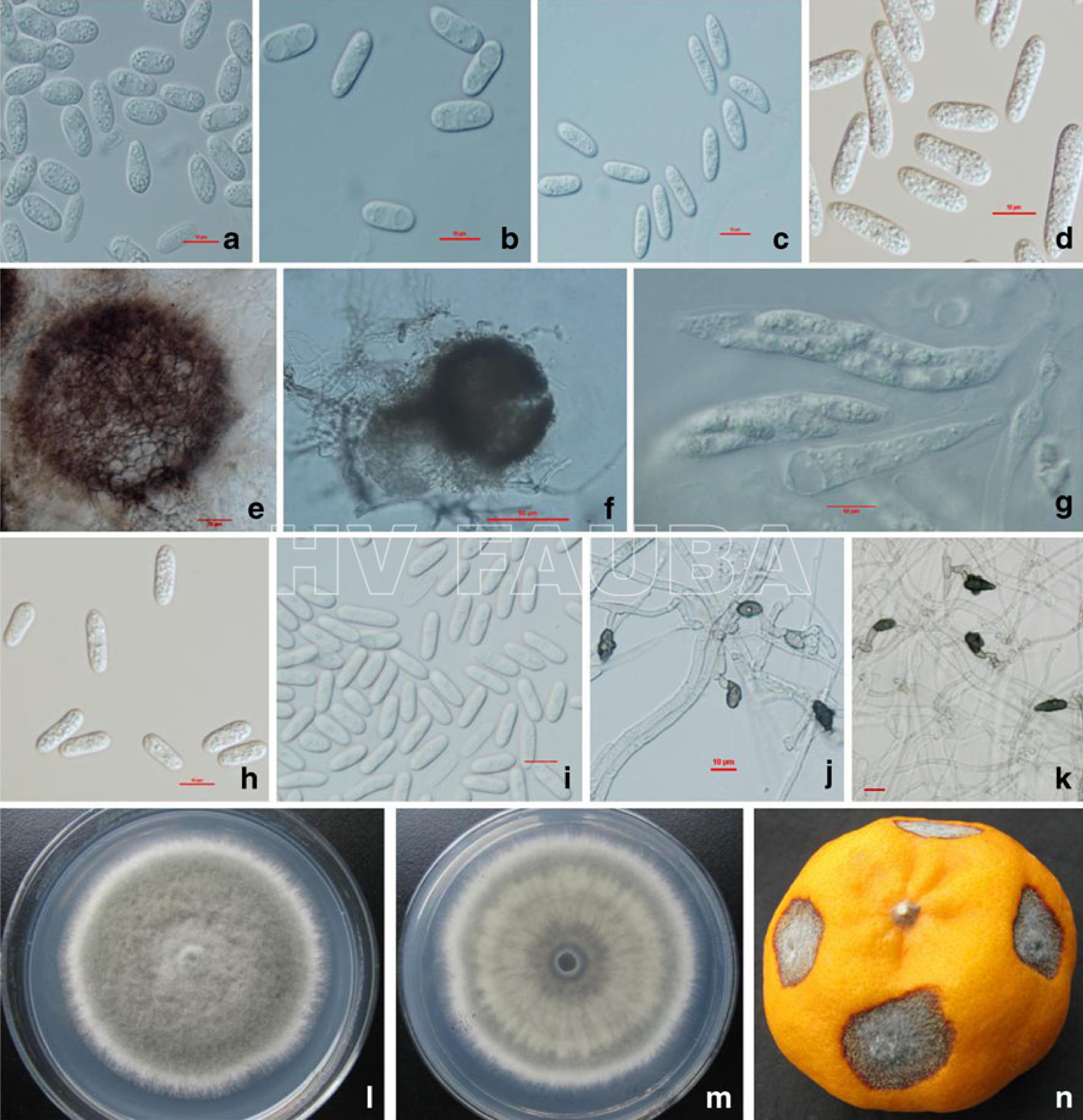
- Colletotrichum truncatum. (a) Síntoma de antracnosis causado en hoja de Limón (Citrus limon). (b) Setas en racimos. (c) Conidios. (d) Forma de colonia desde arriba. (e) Forma de la colonia desde abajo. (f) Síntomas inducidos por inoculación en cítricos (Citrus reticulata). Escala: B = 50 μm, C = 10 μm. Autor: Huan et al., 2013.
- Colletotrichum gloeosporioides : (a-d) Conidios. Colletotrichum fructicola: (e-f) Ascocarpos; (g) Asci; (h-i) Conidios; (j-k) Apresorio; (l) Colonias en medio de agar PDA, arriba; (m) reverso de l. (n) Síntomas en fruta (Citrus reticulata) inoculada. Escala: E = 20 μm, F = 50 μm, otros = 10 μm. Autor: Huang et al., 2013.
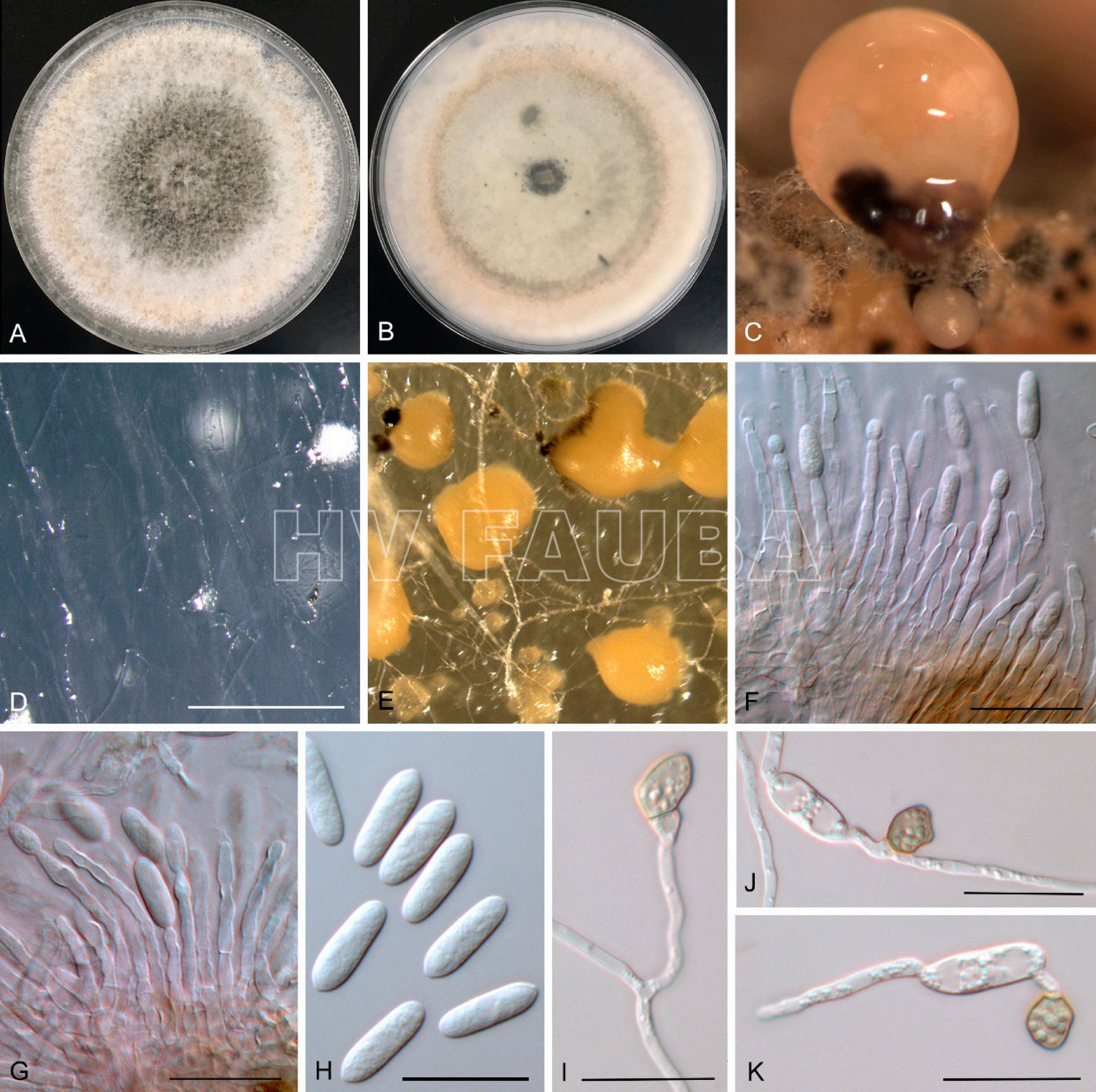
- Características morfológicas de Colletotrichum australianum sp. nov .: Cultivo de una semana en PDA (A, B), conidiomas en cáscara de mandarina (C), conidiomas en SNA (D), conidiomas en PDA (E), conidióforos (F, G), conidios (H) y apresorios (I – K). Barras de escala: D, 500 µm; F, G, H, I, J, K, 20 µm. Autor: Wang et al 2021.
.
.
Síntomas
Los síntomas de la antracnosis en los cítricos incluyen muerte regresiva de las ramitas (dieback), caída prematura de las hojas, manchas oscuras en la fruta y descomposición de la fruta poscosecha. Las hojas y ramitas moribundas se cubren con esporas oscuras por las que se disemina el patógeno.
Los síntomas más frecuentes comprenden manchas deprimidas y secas con un margen bien definido que en el centro pueden identificarse puntuaciones negras correspondientes a las fructificaciones asexuales (acérvulas).
La antracnosis puede manchar el tejido de la cáscara de las naranjas Valencia y Navel maduras, el pomelo y ocasionalmente el limón. El trastorno afecta principalmente a frutos de árboles estresados con madera vieja y muerta.
Desafortunadamente, el tejido infectado permanece asintomático y la enfermedad solo se hace evidente después de que las plantas se vuelven senescentes o han experimentado condiciones de estrés. Los síntomas de la enfermedad rara vez son evidentes en la cáscara de la fruta durante el período anterior a la cosecha, pero en «poscosecha» pueden aparecer como lesiones irregulares de color marrón oscuro que se hunden en los tejidos de la cáscara.
.
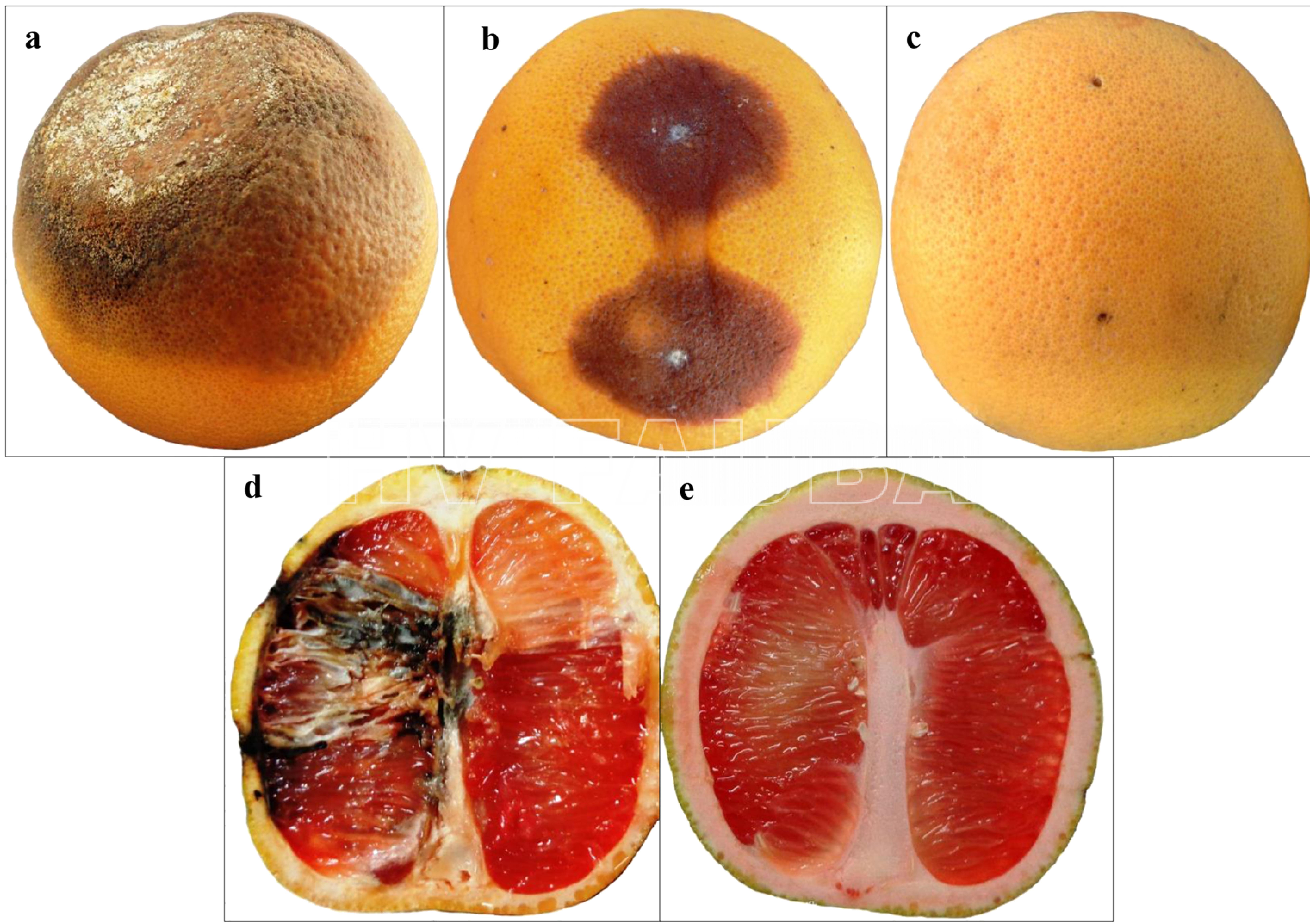
- Síntomas de antracnosis en tejidos de cítricos (a – b) Síntomas de antracnosis en hojas naturalmente infectadas: a. Citrus bergamia y b. Fortunella margarita; (c) fruto momificado de Citrus limon; (d – g) varios síntomas en frutos: (d) diversas lesiones y (e – f) lesiones hundidas en naranja y (g) en mandarina; (h) mancha de lágrima en pomelo; (I) pudrición del tallo en naranja; (j) antracnosis típica en frutos de naranja caídos; (k) punta marchita del árbol Citrus sinensis. Autor: Guarnaccia et al., 2017
.
Colletotrichum es un patógeno débil, hongo con poca capacidad patogénica, colonizador secundario. Capacidad de colonizar y fructificar sobre tejidos debilitados o muertos. Puede estar presente en tejidos sanos sin causar enfermedad.
Afecta los frutos maduros de todas las variedades cítricas; y especialmente ramas, hojas y frutos que fueron dañados por otras causas tales como frío, herbicidas u otros factores.
.
.
- Síntomas de antracnosis en pomelo (Citrus paradisi) causada por Colletotrichum gloeosporioides. (a) síntomas naturales de la antracnosis en pomelo bajo condiciones de campo. (b) síntomas inducidos por inoculación artificial con C. gloeosporioides. (c) tratamiento testigo sin inocular. (d) lesiones internas causadas por C. gloeosporioides en frutos inoculados artificialmente. (e) tratamiento testigo sin inocular al interno. Autor: Cruz-Lagunas et al., 2020.
.
.
- Síntomas en naranjo dulce. (A) Tizón de brotes y muerte regresiva de ramas enteras heridas por el viento. (B) Síntomas de tizón del brote provocado por infecciones de Colletotrichum en naranjo dulce herido por el viento. (C) Engomado asociado con el tizón de los brotes de los cítricos. (D) Colapso y necrosis del mesófilo foliar causado por viento sobre hojas. Los conidiomas de Colletotrichum son visibles en lesiones necróticas como puntuaciones negras. Autor: Riolo et al., 2021.
.
Ciclo de la enfermedad
La madera muerta y los restos de plantas son las principales fuentes de inóculos. Las ascosporas se transmiten por el aire y son importantes en la dispersión a larga distancia. Las esporas sexuales, aunque menos numerosas, son importantes para la dispersión a larga distancia debido a su capacidad de diseminarse por el aire hasta cierta distancia. Una vez que las esporas germinan, forman una estructura de reposo que les permite permanecer inactivas hasta que ocurra una lesión o hasta que pierdan el color verde. Las especies causantes de antracnosis en general son colonizadores primarios de tejido senescente y lesionado. Colletotrichum coloniza ramitas muertas y tejidos vegetales dañados y forma una abundancia de acérvulos y conidios. En condiciones de humedad, las lesiones pueden supurar masas de esporas contenidas en acérvulas y que salen al exterior envueltas en una matriz de sustancia mucilaginosa rosada. Los conidios pueden extenderse a distancias relativamente cortas por salpicaduras de lluvia, rocío intenso o riego por aspersión. Dicho movimiento deposita las esporas en tejidos susceptibles de hojas jóvenes o frutos inmaduros. Los conidios que entran en contacto con hojas, ramitas y frutos germinan para producir apresorios e infecciones inactivas que resultan en necrosis tisular. Las frutas con infecciones inactivas permanecen asintomáticas antes de la cosecha. Las lesiones y los tejidos debilitados por otros factores provocan un mayor desarrollo de infecciones inactivas para formar lesiones en la poscosecha. La enfermedad es especialmente problemática en frutas que se cosechan temprano y se maduran durante más de 24 horas porque el etileno estimula el crecimiento del hongo.
.
Manejo Integrado
* Poda de la madera muerta y la eliminación de restos de plantas infectadas para reducir la dispersión de los inóculos
* Evitar daños a la fruta durante el proceso de transporte, envasado y almacenamiento
* Aplicación de insecticidas antes de la cosecha para el control de plagas que dañan la fruta
* Tratamiento poscosecha con fungicidas registrados
* La demora en la recolección para un mejor desarrollo del color natural de la fruta podría reducir el tiempo de desverdización requerido y, posteriormente, reducirá la incidencia de enfermedades.
.
.
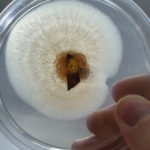
- Colonia de Colletotrichum spp. creciendo en PDA a partir de tallito infectado.
- Colonia de Colletotrichum spp. creciendo en PDA a partir de fruto de pomelo infectado con síntomas de melanosis.
- Colonia de Colletotrichum spp. creciendo en PDA a partir de hoja de pomelo infectada.
- Colonia de Colletotrichum spp. creciendo en PDA a partir de hoja de naranjo infectada, con síntomas de mancha negra.
- Colonias de Colletotrichum spp. creciendo en PDA a partir de hoja de pomelo infectadas asintomáticamente.
- Colonias de Colletotrichum spp. creciendo en PDA a partir de hoja de pomelo infectadas asintomáticamente.
- Colonia de Colletotrichum spp. creciendo en PDA a partir de hoja de pomelo infectada.
- Colonia de Colletotrichum spp. creciendo en PDA a partir de hoja de pomelo infectada.
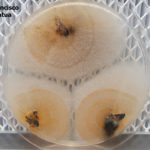
- Colonia pura de Colletotrichum spp. creciendo en PDA.
- Colonia pura de Colletotrichum spp. creciendo en PDA.
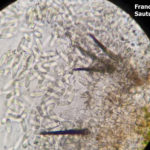
- Acérvula de Colletotrichum spp. Se observan setas y conidios.
- Acérvula de Colletotrichum spp. Se observan setas y conidios.
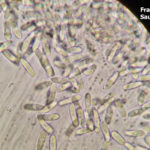
- Conidios de Colletotrichum spp.
.
.
.
Bibliografía
Citrus Anthracnose (Colletotrichum gloeosporioides) UC Pest Management Guidelines
Index Fungorum. Colletotrichum limetticola
EPPO Global Database. Colletotrichum limetticola
Ad M, D B, B A, et al. (2017) Frequent Association of Colletotrichum Species with Citrus Fruit and Leaf Spot Disease Symptoms and their Genetic Diversity in Ethiopia. J Plant Pathol Microbiol. 8(10). doi: 10.4172/2157-7471.1000425
Aiello D, Carrieri R, Guarnaccia V, et al. (2015) Characterization and Pathogenicity of Colletotrichum gloeosporioides and C. karstii Causing Preharvest Disease on Citrus sinensis in Italy. J Phytopathol 163: 168-177. doi: 10.1111/jph.12299
, , , et al. (2022) Genome evolution and transcriptome plasticity associated with adaptation to monocot and eudicot plants in Colletotrichum fungi. bioRxiv 2022.09.22.508453; doi: 10.1101/2022.09.22.508453
Belhadj Daoud H, Baraldi E, Iotti M, et al. (2019) Characterization and pathogenicity of Colletotrichum spp. causing citrus anthracnose in Tunisia. Phytopathol. Mediterr. 58: 175-185. doi: 10.14601/Phytopathol_Mediterr-23762
Ben Hadj Daoud H, Ben Salem I, Sánchez J, et al. (2019) Occurrence of Colletotrichum fruticola along with C. gloeosporioides in causing anthracnose disease on Citrus sinensis in Tunisia. Indian Phytopathology 72: 409–419. doi: 10.1007/s42360-019-00175-0
Cannon PF, Damm U, Johnston PR, Weir BS (2012) Colletotrichum – current status and future directions. Stud Mycol. 73(1): 181-213. doi: 10.3114/sim0014
Cruz-Lagunas B, Ortega-Acosta SÁ, Reyes-García G, et al. (2020) Colletotrichum gloeosporioides causes anthracnose on grapefruit (Citrus paradisi) in Mexico. Australasian Plant Dis. Notes 15: 31. doi: 10.1007/s13314-020-00401-z
Douanla-Meli C, Unger JG (2017) Phylogenetic study of the Colletotrichum species on imported citrus fruits uncovers a low diversity and a new species in the Colletotrichum gigasporum complex. Fungal Biology 121(10): 858-868. doi: 10.1016/j.funbio.2017.06.003
Dowling M, Peres N, Villani S, Schnabel G (2020) Managing Colletotrichum on Fruit Crops: A «Complex» Challenge. Plant Disease 104(9): 2301-2316. doi: 10.1094/PDIS-11-19-2378-FE
Espargham N, Mohammadi H, Gramaje D (2020) A Survey of Trunk Disease Pathogens within Citrus Trees in Iran. Plants. 9(6): 754. doi: 10.3390/plants9060754
Guarnaccia V, Groenewald JZ, Polizzi G, Crous PW (2017) High species diversity in Colletotrichum associated with citrus diseases in Europe. Persoonia 39: 32-50. doi: 10.3767/persoonia.2017.39.02
Huang F, Chen GQ, Hou X, et al. (2013) Colletotrichum species associated with cultivated citrus in China. Fungal Diversity 61(1): 61-74. doi: 10.1007/s13225-013-0232-y
Khanchouch K, Pane A, Chriki A, Cacciola SO (2017) Major and Emerging Fungal Diseases of Citrus in the Mediterranean Region, Citrus Pathology, Harsimran Gill and Harsh Garg, IntechOpen. doi: 10.5772/66943
Lima WG, Spósito MB, Amorim L, et al. (2011) Colletotrichum gloeosporioides, a new causal agent of citrus post-bloom fruit drop. Eur J Plant Pathol 131: 157. doi: 10.1007/s10658-011-9795-1
, (2023) Appressorium formation is regulated by the Msb2– and Sho1-dependent hierarchical transcriptional network in Colletotrichum gloeosporioides. Plant Pathology 00: 1–15. doi: 10.1111/ppa.13822
McGovern RJ, Seijo TE, Hendricks K, Roberts PD (2012) New report of Colletotrichum gloeosporioides causing postbloom fruit drop on citrus in Bermuda. Canadian Journal of Plant Pathology 34(2): 187-194. doi: 10.1080/07060661.2012.670137
Moges AD, Belew D, Admassu B, et al. (2017) Frequent Association of Colletotrichum Species with Citrus Fruit and Leaf Spot Disease Symptoms and their Genetic Diversity in Ethiopia. Journal of Plant Pathology & Microbiology 8: 10. doi: 10.4172/2157-7471.1000425
O’Connell, et al. (2012) Lifestyle transitions in plant pathogenic Colletotrichum fungi deciphered by genome and transcriptome analyses. Nature Genetics. doi: 10.1038/ng.2372
Peres NA, Timmer LW, Adaskaveg JE, Correll JC (2005) Lifestyles of Colletotrichum acutatum. Plant Disease 89: 784-796. doi: 10.1094/PD-89-0784
Piccirillo G, Carrieri R, Polizzi G, et al. (2018) In vitro and in vivo activity of QoI fungicides against Colletotrichum gloeosporioides causing fruit anthracnose in Citrus sinensis. Scientia Horticulturae 236: 90-95. doi: 10.1016/j.scienta.2018.03.044
Rhaiem A, Taylor PW (2016) Colletotrichum gloeosporioides associated with anthracnose symptoms on citrus, a new report for Tunisia. European Journal of Plant Pathology 146(1): 219–224. doi: 10.1007/s10658-016-0907-9
Riolo M, Aloi F, Pane A, et al. (2021) Twig and Shoot Dieback of Citrus, a New Disease Caused by Colletotrichum Species. Cells 10(2): 449. doi: 10.3390/cells10020449
Talhinhas P, Baroncelli R (2021) Colletotrichum species and complexes: geographic distribution, host range and conservation status. Fungal Diversity 110: 109–198. doi: 10.1007/s13225-021-00491-9
Timmer LW, Brown GE, Zitko SE (1998) The Role of Colletotrichum spp. in Postharvest Anthracnose of Citrus and Survival of C. acutatum on Fruit. Plant Disease 82(4): 415-418. doi: 10.1094/PDIS.1998.82.4.415
Trinh J, Li T, Franco JY, et al. (2022) Citrus relatives exhibit natural variation in perception and response magnitude to microbial features. bioRxiv 2022.07.15.500235; doi: 10.1101/2022.07.15.500235
Vitale A, Aiello D, Azzaro A, et al. (2021) An Eleven-Year Survey on Field Disease Susceptibility of Citrus Accessions to Colletotrichum and Alternaria Species. Agriculture 11(6): 536. doi: 10.3390/agriculture11060536
Wang W, de Silva DD, Moslemi A, et al. (2021) Colletotrichum Species Causing Anthracnose of Citrus in Australia. Journal of Fungi 7(1): 47. doi: 10.3390/jof7010047
, , , et al. (2024) Identification and pathogenicity of Colletotrichum species associated with twig dieback of citrus in Western Australia. Plant Pathology 00: 1–19. doi: 10.1111/ppa.13888