P.
Condición fitosanitaria: Presente
Grupo de cultivos: Frutales
Subgrupo: Cítricos
Especie hospedante: Limón (Citrus limonum), Mandarina (Citrus nobilis), Naranjo (Citrus sinensis) y Pomelo (Citrus paradisi)
Rango de hospedantes: confirmado en más de 12 especies de cítricos, solo se ha encontrado en especies de plantas en la familia Rutaceae.
Etiología: Hongo. Necrotrófico
Agente causal: Phyllosticta citricarpa (McAlpine) Aa, 1973 (anamorfo), Guignardia citricarpa Kiely 1948 (teleomorfo)
Taxonomía: Fungi > Dikarya > Ascomycota > Pezizomycotina > Dothideomycetes > incertae sedis > Botryosphaeriales > Phyllostictaceae > Phyllosticta
.
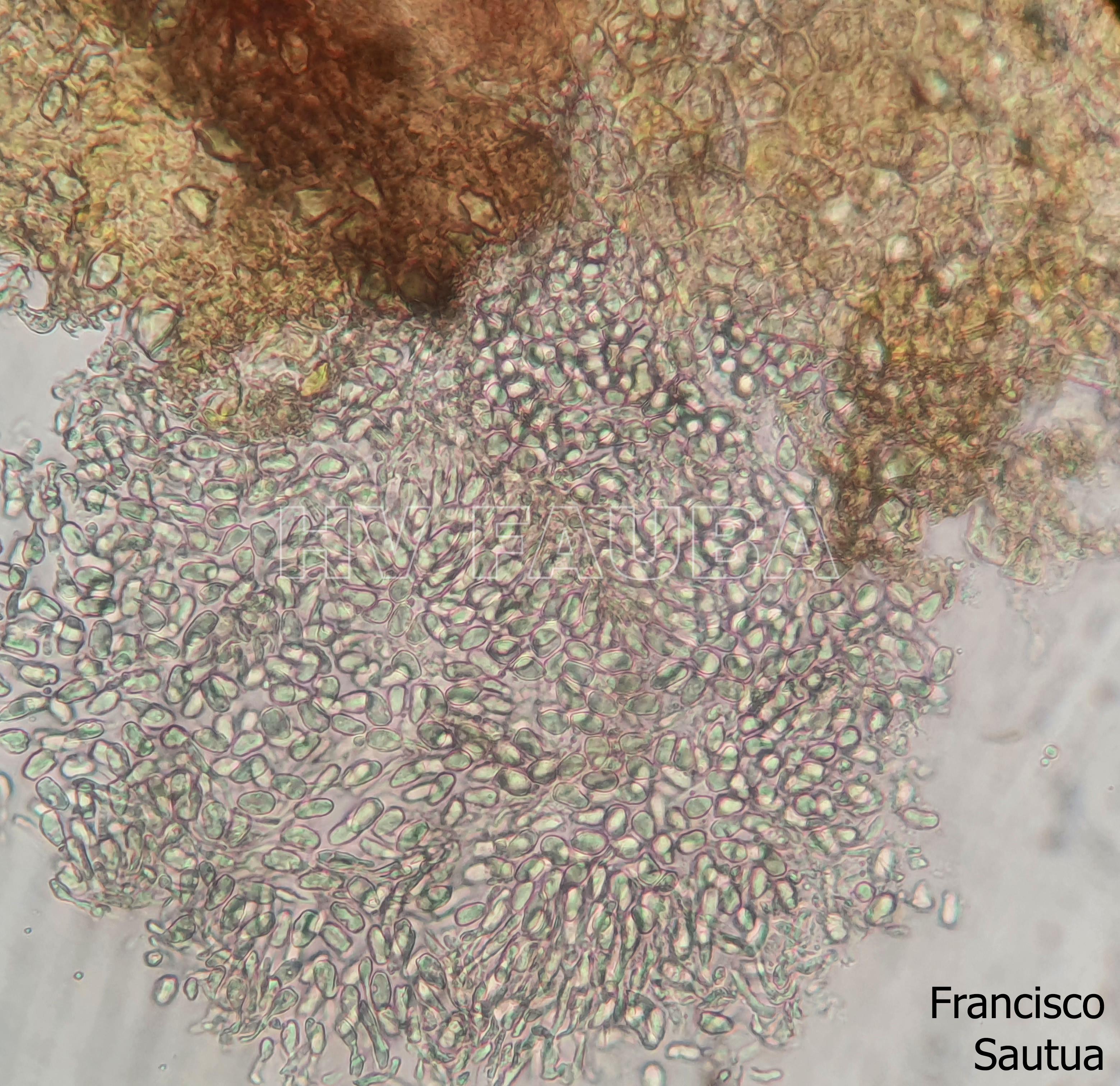
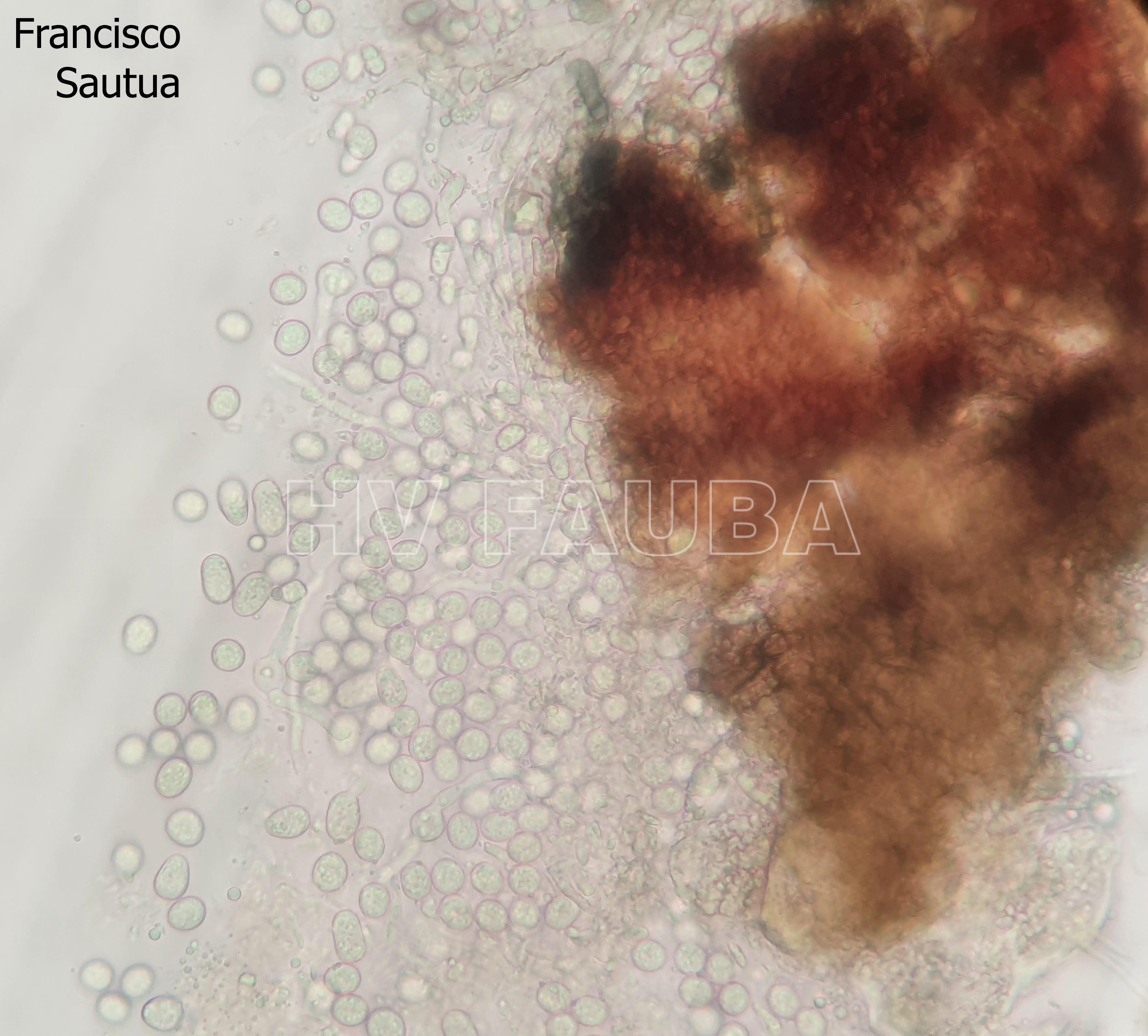
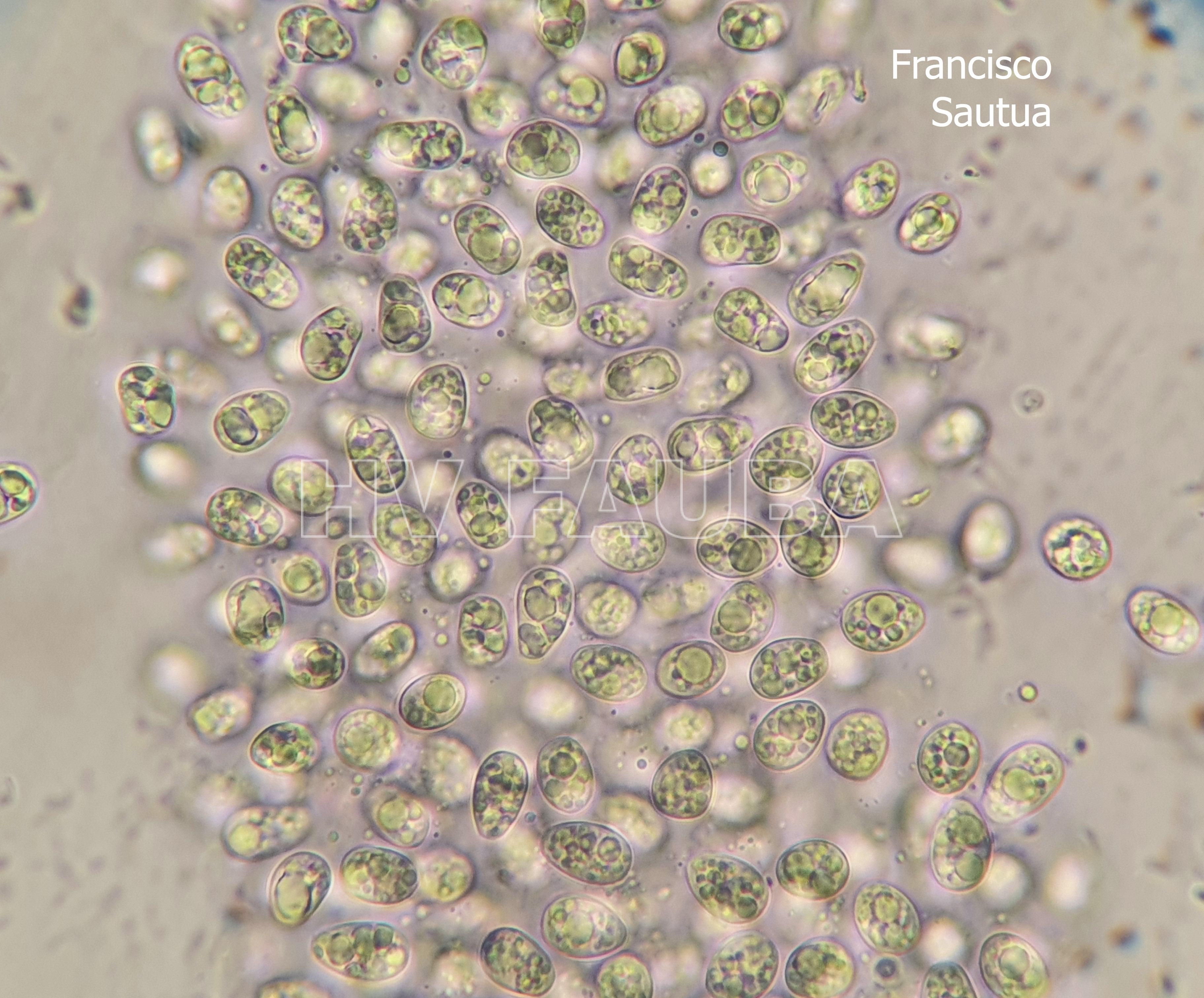
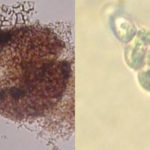
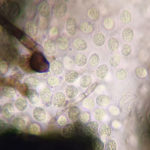
Las esporas asexuales son producidas in vitro en conidiomas picnidiales que contienen conidios hialinos, sin septos, encerrados en una capa mucoide y con un solo apéndice apical. Este es el rasgo morfológico más característico utilizado para reconocer especies de Phyllosticta (van der Aa, 1973). Sin embargo, la capa mucoide y el apéndice no siempre están presentes o visibles. La morfología sexual presenta ascomas globosos a piriformes, a menudo de forma irregular, uniloculares y con un ostiolo central. Los ascos tienen ocho ascosporas, bitunicadas, clavadas a ampliamente elipsoides, con un ápice ancho, obtusamente redondeado o ligeramente cuadrado. Las ascosporas son elipsoides a limoniformes, a veces ligeramente alargadas, aseptadas, hialinas, mostrando una gran gutula central y un casquete mucoide en ambos extremos. Las espermacias (spermatia) producidas en cultivo son hialinas, aseptadas, desde cilíndricas hasta con forma de pesa, con gutulas en cada extremo (van der Aa, 1973).
Especies endofíticas, no patógenas de Guignardia spp han sido reportadas aisladas de plantas de cítricos asintomáticas, así como de plantas hospedantes distintas de los cítricos. Se confirmó que tales cepas pertenecen a una especie distinta de G. citricarpa.
.
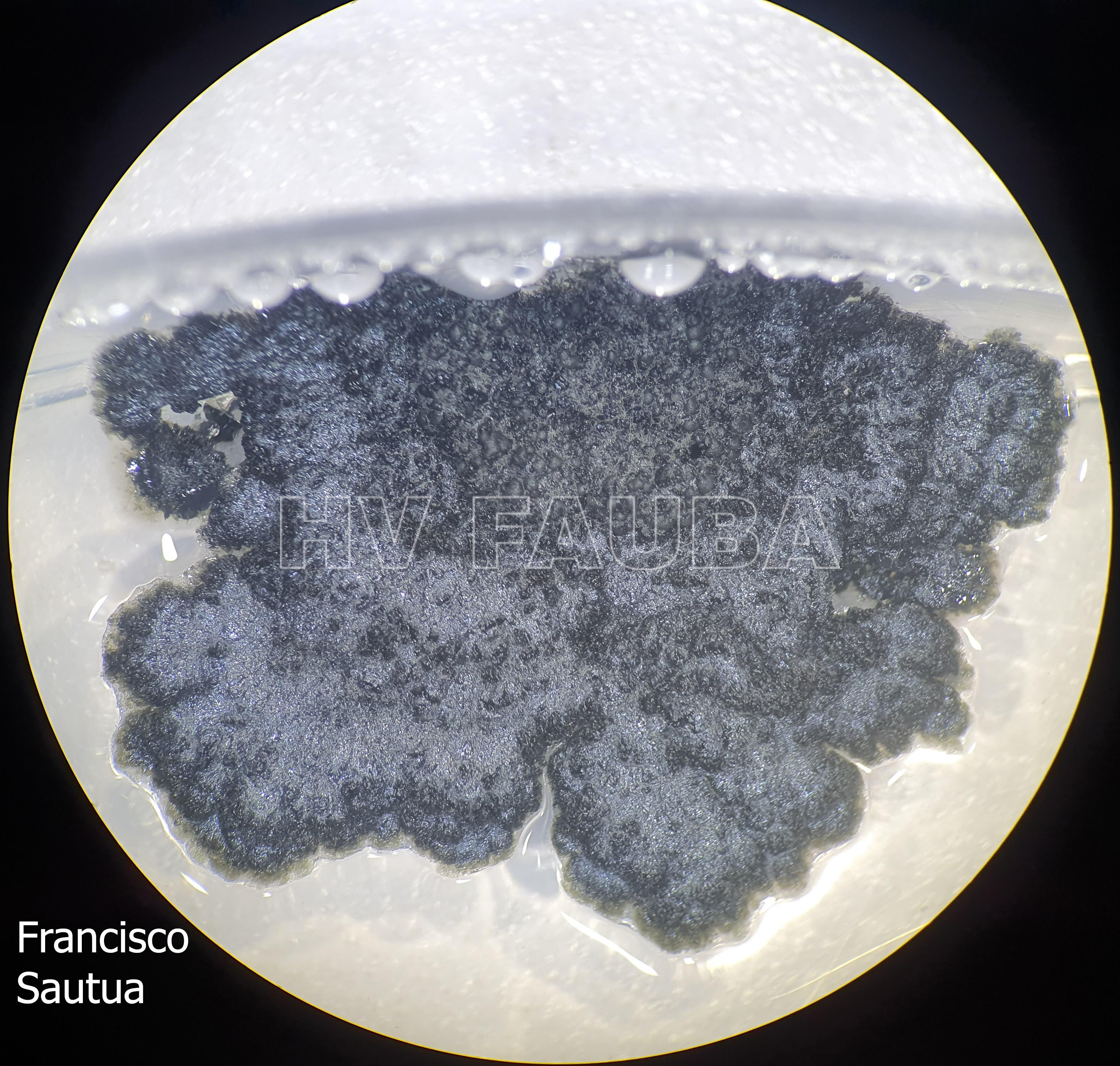
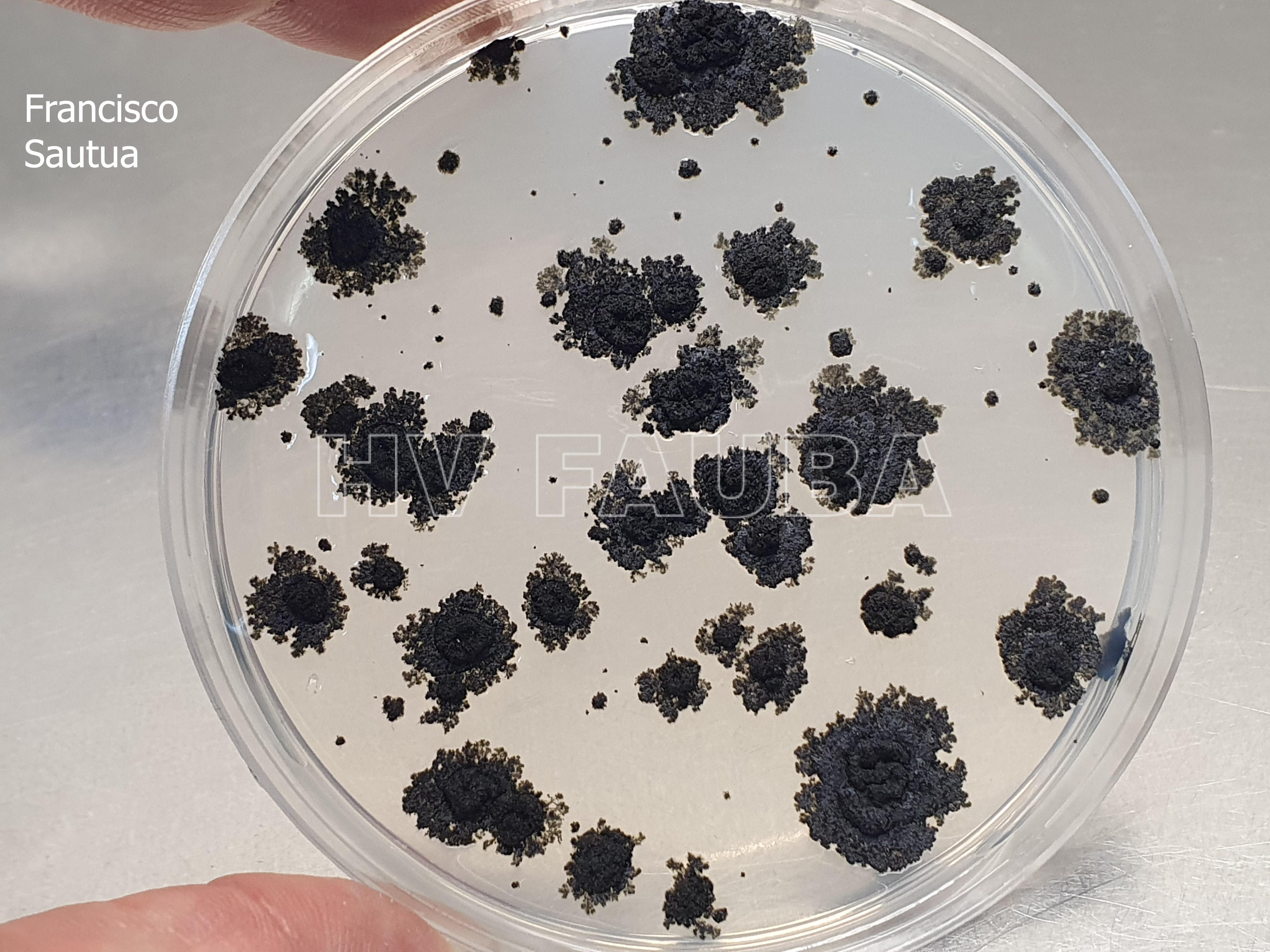
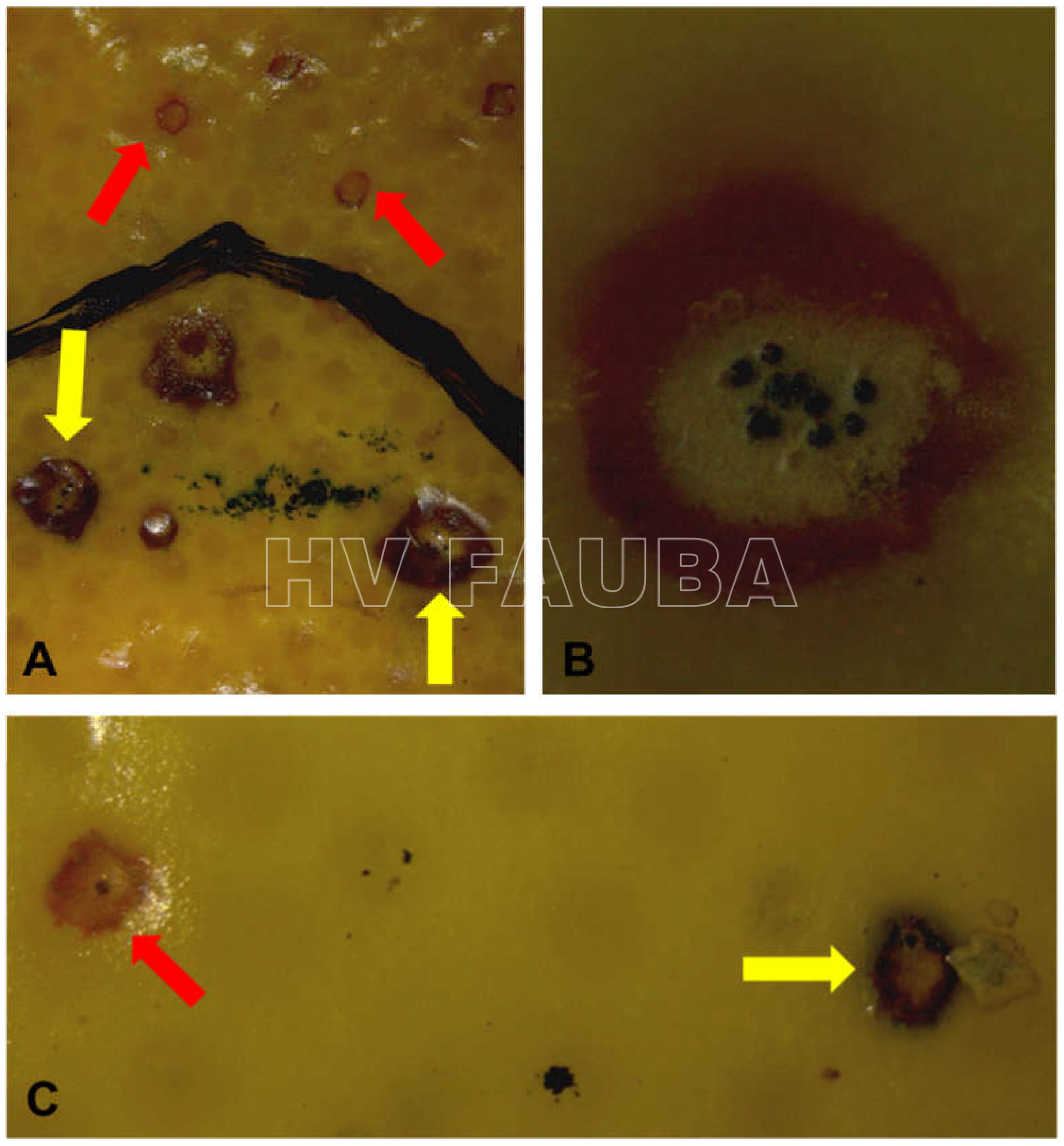
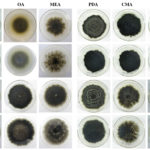
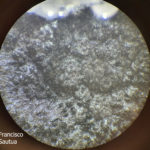
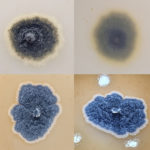
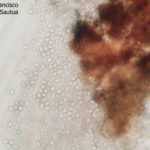
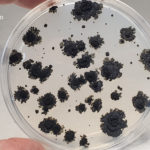
- Colonia de Phyllosticta sobre PDA.
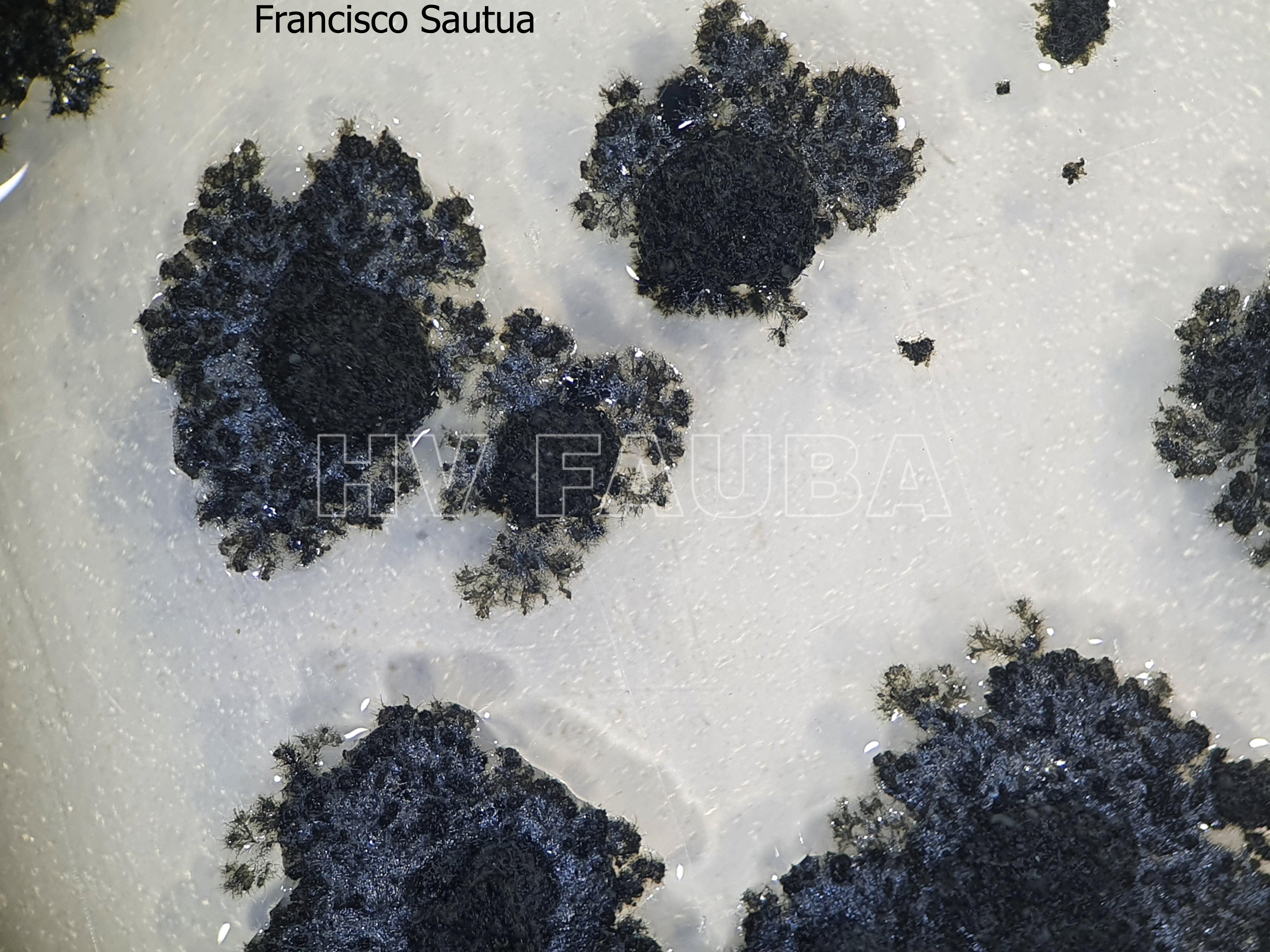
- Cirros de Phyllosticta sobre colonia creciendo en PDA.
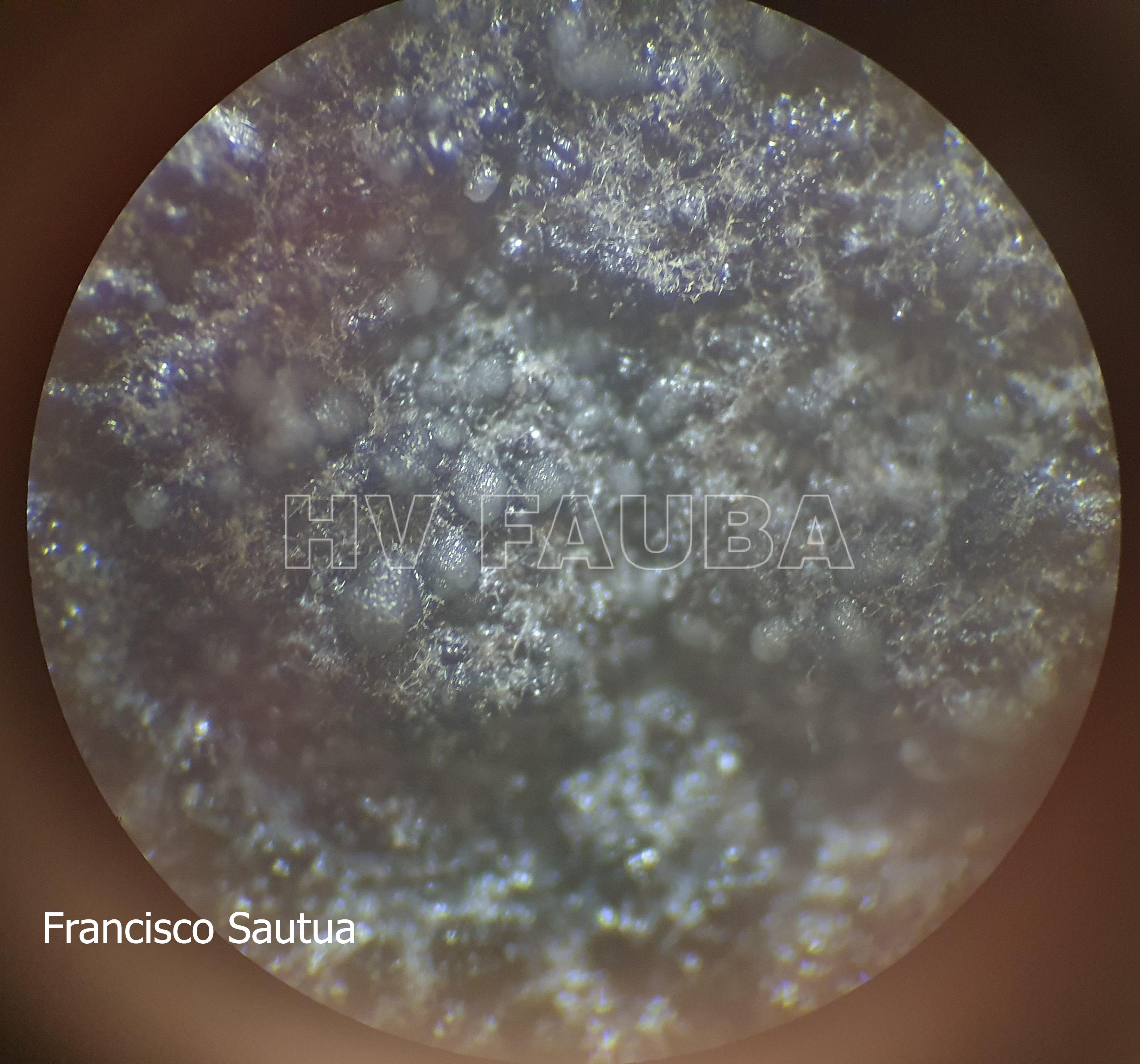
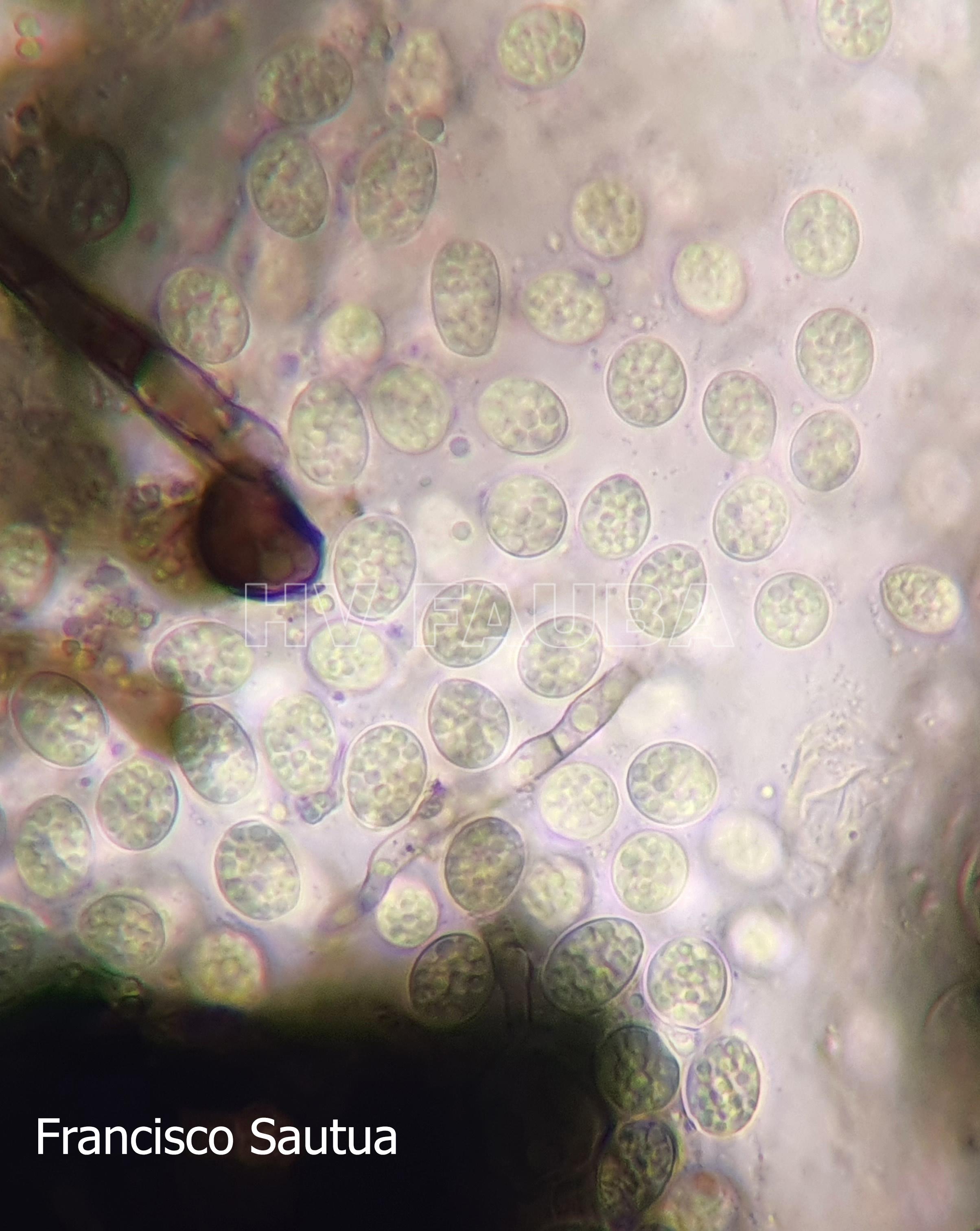
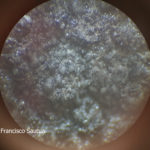
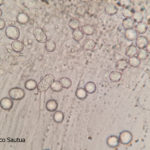
- Espermacias de Phyllosticta spp.
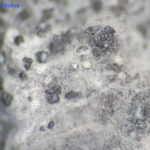
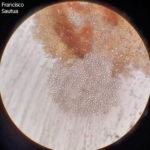
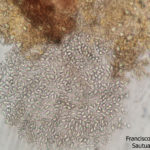
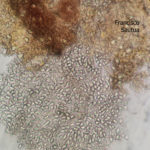
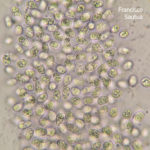
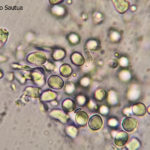
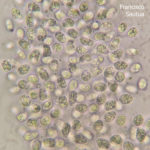
- Conidios de Phyllosticta spp.
- Conidios de Phyllosticta spp.
- Conidios de Phyllosticta spp.
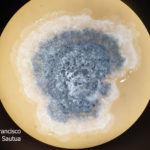
- Colonias de Phyllosticta sobre PDA, a partir de suspensión conidial.
- Colonias de Phyllosticta sobre PDA, a partir de suspensión conidial.
.
.
.
.
Antecedentes
La mancha negra de los cítricos es una enfermedad fúngica que afecta a las plantas de cítricos en climas subtropicales, provocando una reducción tanto en la cantidad como en la calidad de la fruta. Esta enfermedad también recibe el nombre de moteado negro o «citrus black spot» en Inglés. La enfermedad de la mancha negra de los cítricos se ha reportado en la mayoría de los principales países productores de cítricos, exclusivamente en áreas con climas cálidos y lluviosos en verano (Carstens et al., 2012; Magarey et al., 2015; Martínez-Minaya et al., 2018; Paul et al., 2005; Yonow et al., 2013).
El primer reporte de P. citricarpa fue en Australia a fines del siglo XIX, específicamente en las regiones costeras de Nueva Gales del Sur (Benson, 1895). Posteriormente, P. citricarpa se ha registrado en muchas áreas de cultivo de cítricos de Australia, África, Asia, América Central, del Norte y del Sur, y Europa. También se ha reportado a Phyllosticta capitalensis como endófito común de los cítricos y otros hospedantes, en todo el mundo (Baayen et al., 2002; Wikee et al., 2013). Estudios recientes también revelaron la existencia de otras especies de Phyllosticta en Citrus. En Brasil, Glienke et al. (2011) describieron P. citribraziliensis de Citrus sp. En Asia, P. citriasiana (China, Tailandia, Vietnam) y P. citrimaxima (Tailandia) se encontraron en C. maxima (Wikee et al., 2013; Wulandari et al., 2009) y P. citrichinaensis fue descrita por Wang et al. (2012) como patógeno de varios Citrus spp. en China.
.
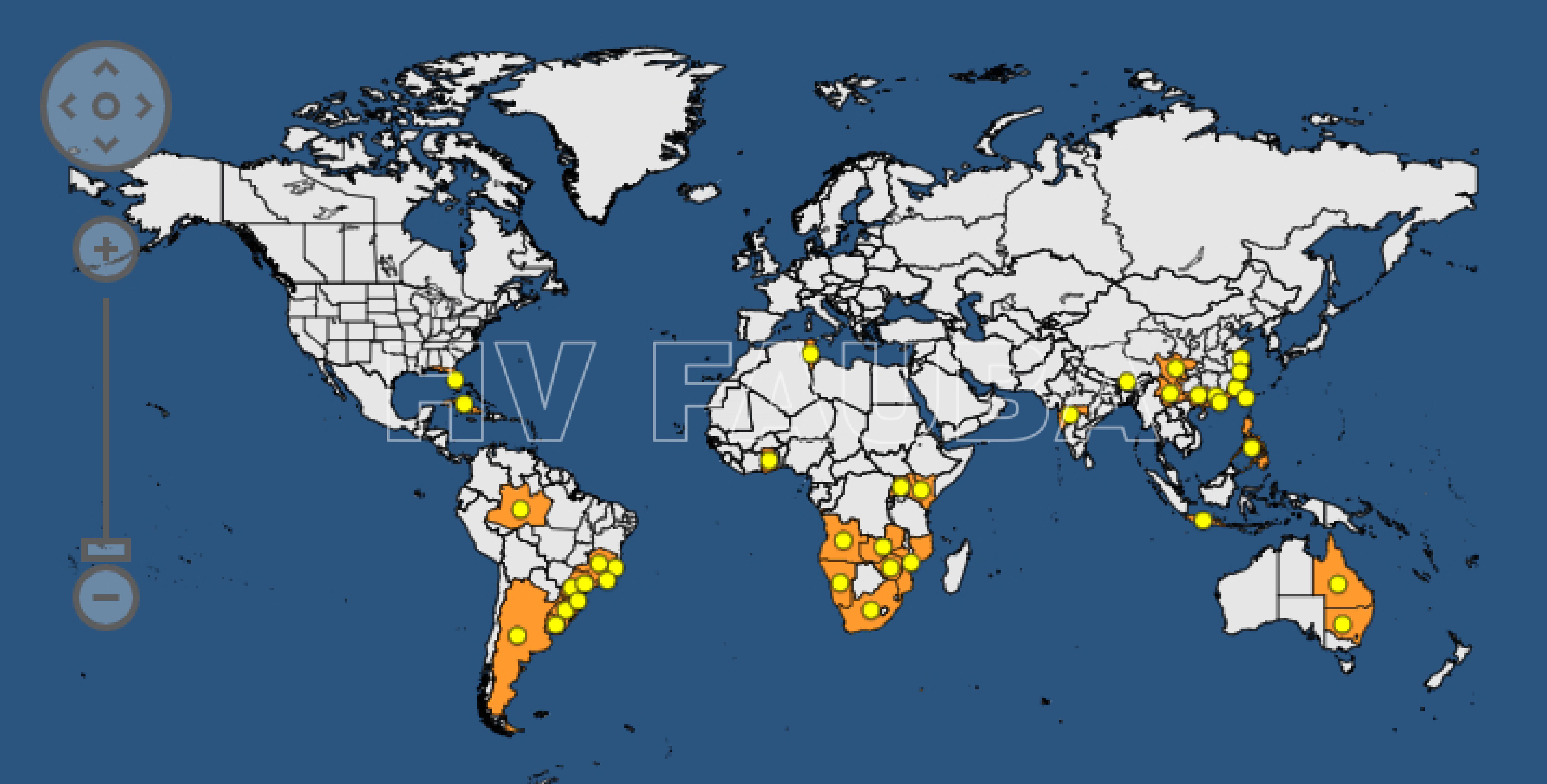
- Distribución mundial de la mancha negra de los cítricos. Fuente: https://gd.eppo.int/taxon/GUIGCI/distribution
.
Síntomas
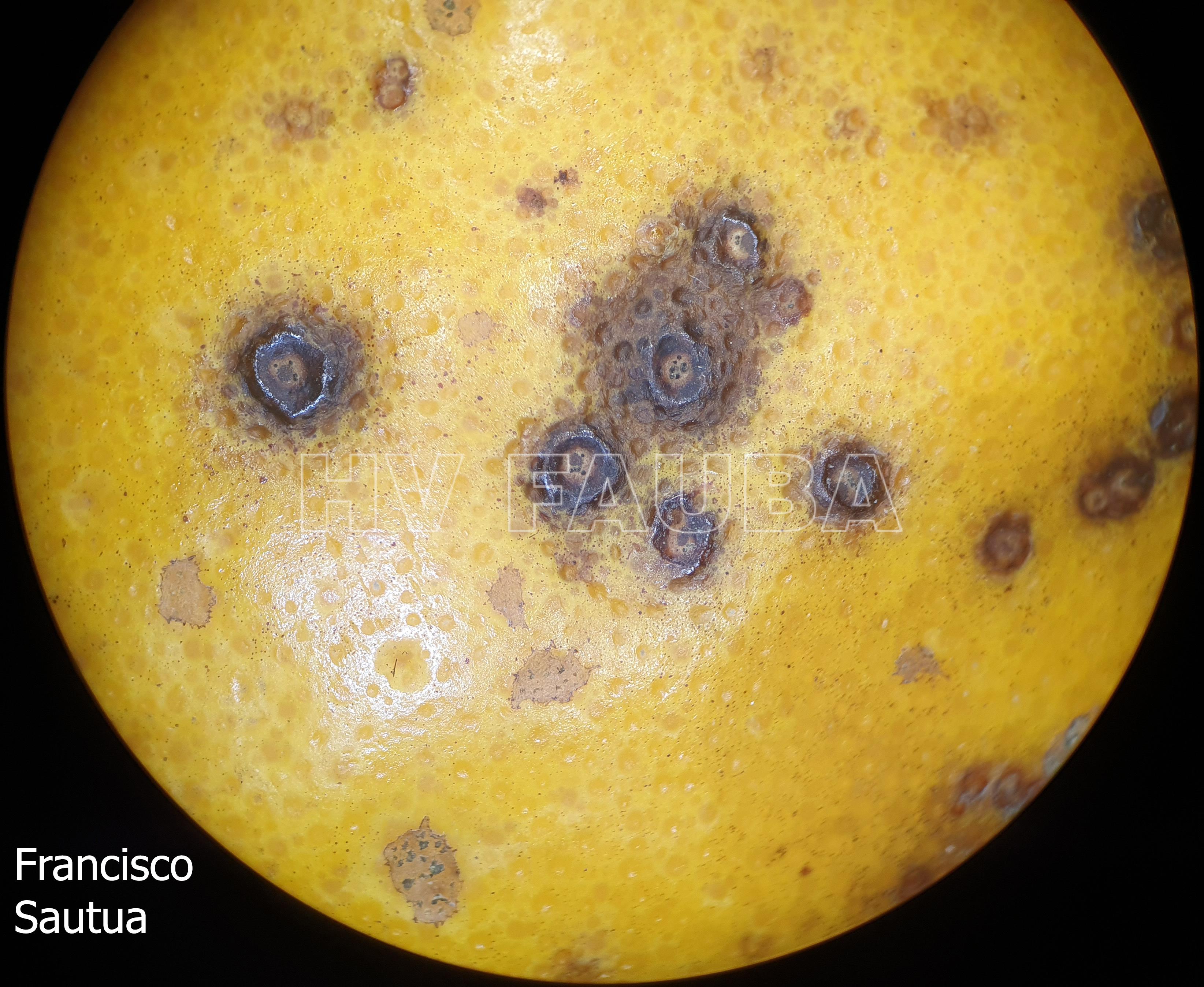
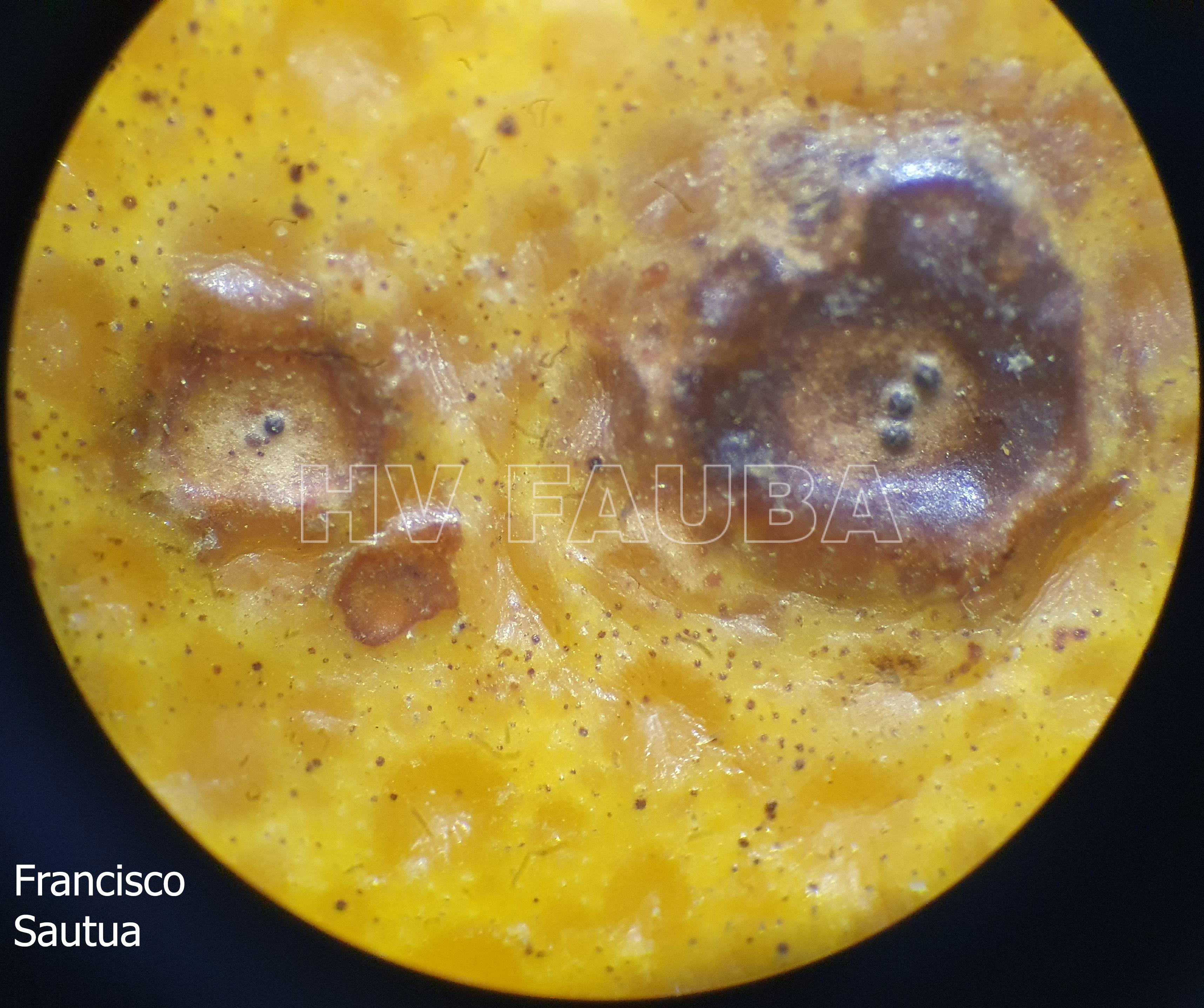
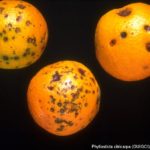
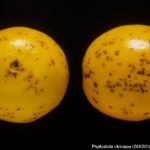
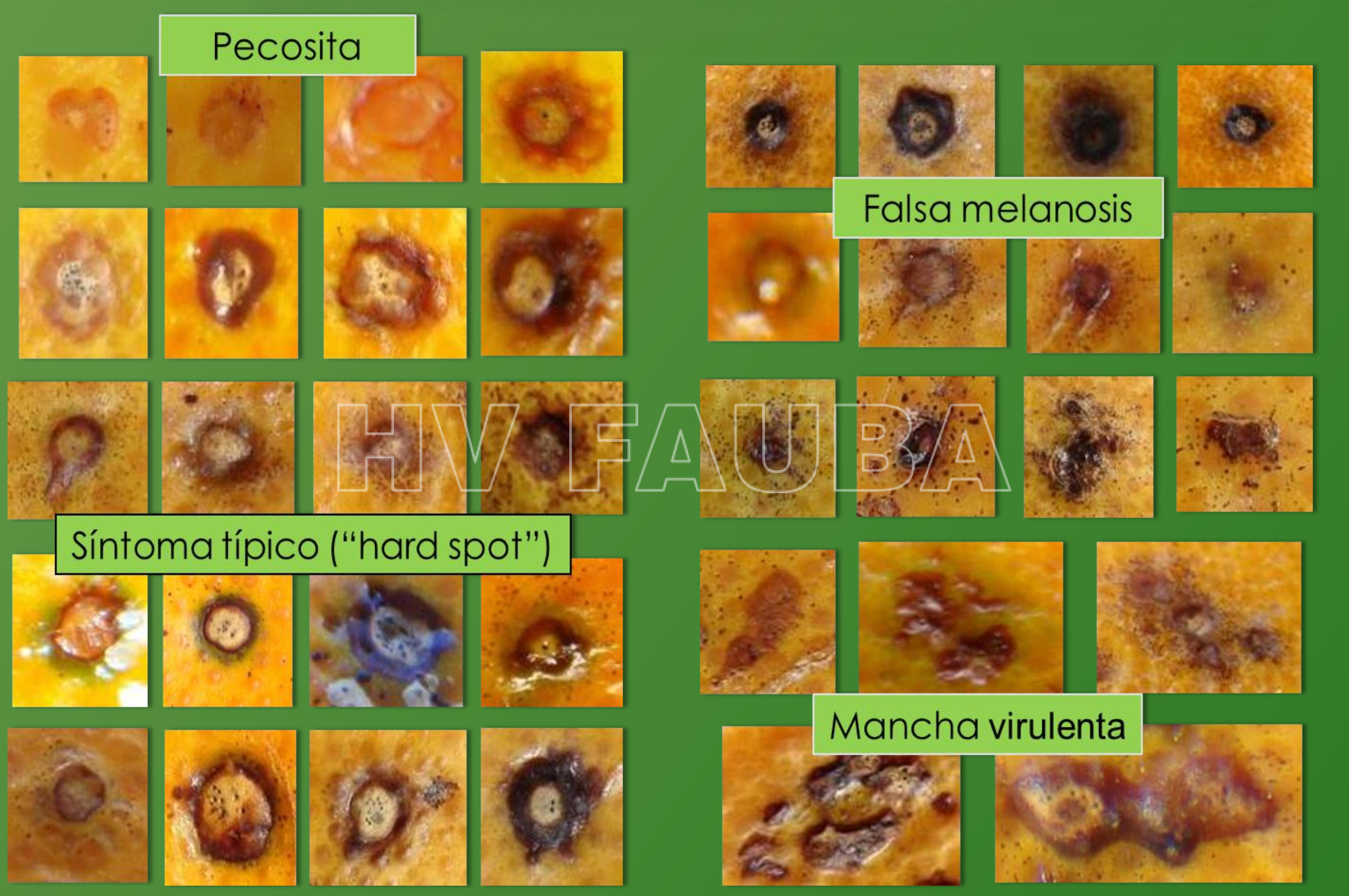
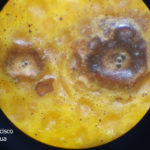
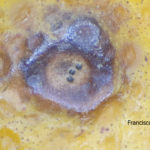
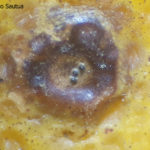
Los síntomas en los frutos pueden presentar una gran variación dependiendo de la fase fenológica y las condiciones climáticas en que se produce la infección. El patógeno infecta y ataca hojas, ramas verdes y, principalmente, frutos. De esta forma, pueden observarse puntuaciones rosadas deprimidas, puntuaciones deprimidas de coloración oscura, manchas deprimidas con centro claro y puntuaciones negras (picnidios) en su centro. En los frutos que presentan daños severos, pueden observarse manchas deprimidas castaño-negruzcas con o sin puntuaciones negras en su centro. Algunos autores, se refieren a estos síntomas como falsa melanosis, pecosas, tinta, mancha típica, mancha virulenta.
.
- Síntomas de la mancha negra en limón. Autor: Ing. Agr. Claudio Baron.
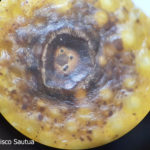
- Síntomas de mancha negra sobre naranja.
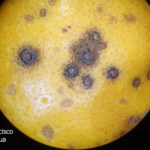
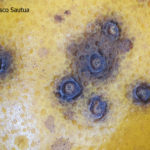
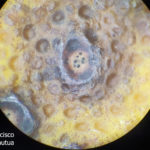
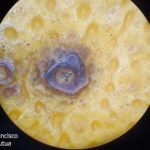
- Síntomas de mancha negra sobre naranja. Se observan picnidios de Phyllosticta citricarpa en el centro de las manchas.
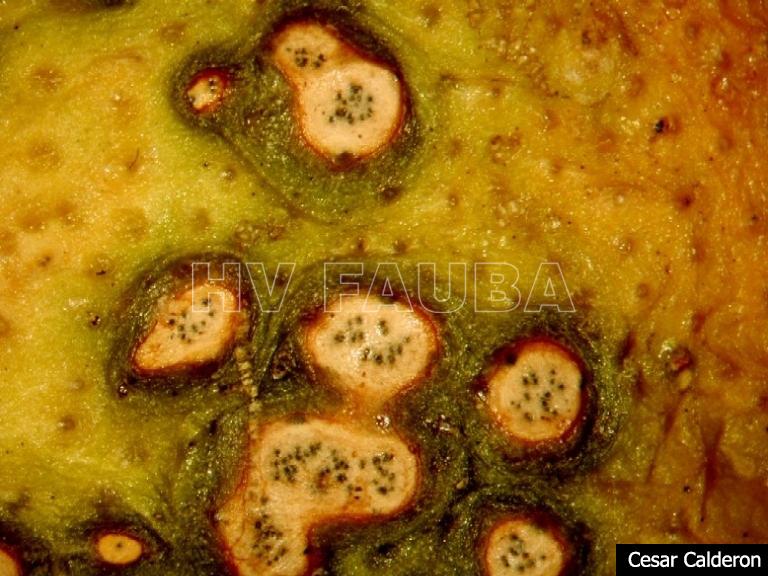
- Picnidios de Phyllosticta citricarpa en el centro de las manchas. Autor: Cesar Calderon Pathology Collection, USDA APHIS PPQ, Bugwood.org
.
La mancha negra de los cítricos es una enfermedad que afecta la calidad visual de los frutos (calidad comercial), ya que no penetra más allá del mesocarpo externo, produciendo manchas necróticas muy notorias. Por lo tanto, la calidad externa de los frutos es comprometida y se considerada una enfermedad «cosmética». Sin embargo, en variedades muy susceptibles en las que pueden producirse epidemias más severas la enfermedad puede provocar la caída prematura de frutos y afectar el rendimiento.
El Limonero es la especie más susceptible siguiéndolo en susceptibilidad la naranjas tardía (como valencia late). El naranjo agrio (Citrus aurantium) y sus híbridos son los más resistentes a la enfermedad.
La mancha negra es una enfermedad compleja y de difícil diagnóstico, ya que se producen diferentes síntomas en los frutos: mancha típica, mancha pecosa, mancha virulenta y falsa melanosis.
Después de la infección, el hongo permanece en estado quiescente hasta que el fruto ha crecido totalmente o madurado, manifestándose los síntomas muchos meses después de haberse producido la infección (Kotzé, 2000). Las hojas permanecen susceptibles a la infección desde el desarrollo hasta los 10 meses de edad (Truter et al., 2007).
.
- Lesiones de la mancha negra de los cítricos en fruta. (A) Lesiones nuevas y antiguas en naranja Valencia «Midknight» sometida a un régimen de tratamiento completo en la empacadora que consiste en lavado con cloro, inmersiones fungicidas y aplicación de cera. (B) Nueva lesión con picnidios en frutos de limón «Eureka» sin tratar. (C) Lesiones nuevas y antiguas en limón «Eureka» sin tratar. Moyo et al., 2020.
.
.
- Síntomas de la mancha negra en limón. Autor: Ing. Agr. Claudio Baron.
- Autor: Carbajo Romero et al., 2019
- Síntomas de la mancha negra en naranja (Citrus sinensis cv. Washington Navel. Autor: EPPO
- Síntomas de la mancha negra en naranja (Citrus sinensis cv. Valencia. Autor: EPPO
- Fuente: www.agronomicabr.com.br
- Síntomas y Signo de mancha negra causada por Phyllosticta citricalpa. Síntomas típicos en naranja Valencia (arriba, izquierda) y mandarina Ellendale (arriba, derecha). Manchas con picnidios en mandarina Nova (izquierda y derecha, abajo) y en naranja (centro, abajo). Autor: Myrian Rybak
- Conidiomata (picnidio) de Phyllosticta citricarpa esporulando en agar con agujas de pino. Autor: Pedro Crous.
- Estado sexual o perfecto de Phyllosticta citricalpa. Izq: peritecio (ascocarpo o cuerpo de fructificación), der: detalle de ascos con ascosporas. Autor: Myrian Rybak
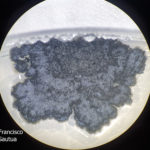
- Colonia de Phyllosticta citricarpa creciendo en PDA. Fuente: www.agronomicabr.com.br
- Características culturales de especies de Phyllosticta asociadas con cítricos cultivados. a, b, c y d muestran la vista superior de los cultivos de P. citricarpa, P. citriasiana, P. capitalensis y P. citrichinaensis, mientras que a1, b1, c1 y d1 muestran la vista inversa de los cultivos de estas especies. El medio utilizado se indica en la línea superior. Autor: Wang et al., 2011.
.
- Sintomatología en frutos de la mancha negra de los cítricos. Evolución de los síntomas. Aitpres: Garrán et al., 2015
.
Condiciones predisponentes
Las variables ambientales tales como el nivel de humedad, la intensidad de la radiación solar, la temperatura y la humedad de las hojas, entre otros factores, como la arquitectura y la orientación del monte frutal, tienen un efecto profundo en la incidencia y severidad de la mancha negra de los cítricos (Andrade et al., 2009). Temperaturas entre 15 y 35 °C y una humedad relativa ≥ 90% durante 8 horas consecutivas son conducentes a la infección de la fruta y un promedio de 98 días por año (rango: 72–123 días) cuando la fruta era susceptible a la infección (Hendricks et al., 2020).
.
Ciclo de la enfermedad y epidemiología
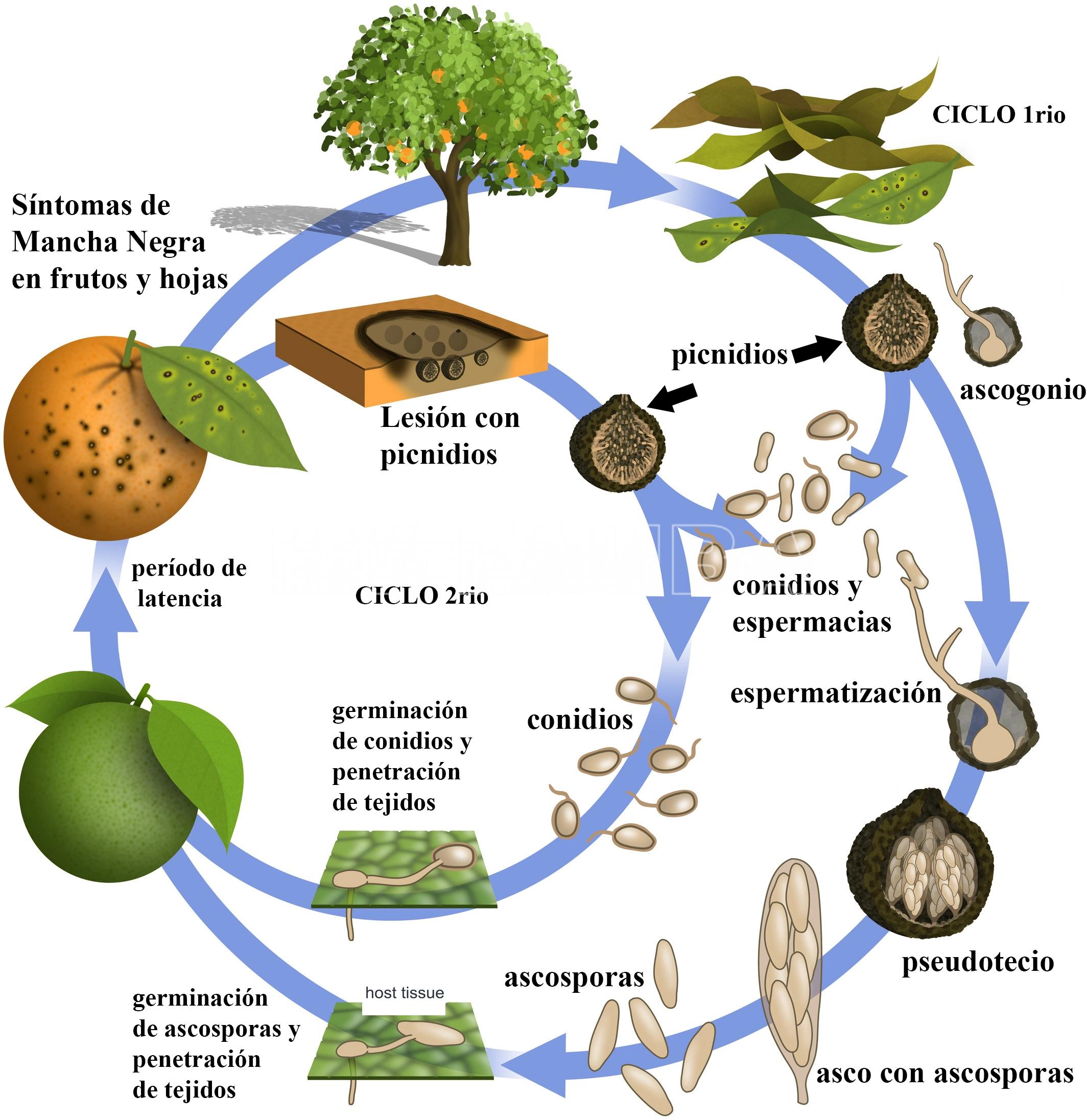
Tanto las ascosporas (esporas sexuales) como los conidios (esporas asexuales) de Phyllosticta citricarpa pueden infectar tejidos susceptibles de los hospedantes. P. citricarpa produce ascosporas en pseudotecios y conidios en picnidios como fuentes de inóculo. En general, la producción y liberación de esporas ocurren durante la temporada de lluvias (Dummel et al., 2015; Fourie et al., 2013; Kiely, 1948a; Kotzé, 1963, 1996, 2000; Reis et al., 2006).
La principal fuente de inóculo está constituida por la hojarasca ubicada debajo de las plantas afectadas. En estas hojas en proceso de descomposición, se produce la formación de las fructificaciones sexuales (pseudotecios) del hongo. Luego de las lluvias, éstos maduran y se produce la liberación de infinidad de ascosporas, las que son diseminadas por el viento y depositadas en los tejidos susceptibles, especialmente en frutos pequeños (a partir del cuaje) y durante los cuatro meses siguientes al crecimiento inicial (Contreras, 1988). Las ascosporas son la fuente más importante de inóculo primario y causan casi todas las infecciones. No se han encontrado ascosporas en lesiones de frutos o lesiones en hojas adheridas. Las ascosporas se liberan cuando la hojarasca se moja con la humedad, como el rocío intenso, la lluvia o el riego. El pseudotecio se desarrolla entre 40 y 180 días después de la caída de las hojas y en condiciones favorables, como el mojado y el secado alternos de las hojas y las fluctuaciones de temperatura de leves a cálidas, lo que induce la maduración del pseudotecio y la descarga de ascosporas (Dummel et al., 2015; Fourie et al., 2013; Hu et al., 2014; Huang y Chang, 1972; Kiely, 1948; Kotzé, 1963; Lee y Huang, 1973; McOnie, 1964; Reis et al., 2006; Truter, 2010).
Los conidios, por su parte, se forman en el centro de las lesiones de los síntomas en los frutos y las hojas. También, pueden desarrollarse en la hojarasca y en ramas secas. Esta fuente de inóculo necesita agua para dispersarse y alcanzar los tejidos susceptibles. Están recubiertos de una capa mucilaginosa y son más pesados, por lo que su dispersión es a tejidos más próximos dentro de la planta. Los conidios se consideran particularmente importantes en el caso de coexistencia de frutos maduros enfermos en un árbol con frutos jóvenes en crecimiento, en áreas con un gran número de ramitas muertas y en especies de cítricos en las que se forman manchas duras con picnidios en las hojas (Baldassari et al., 2006; Spósito et al., 2008, 2011). Las ascosporas se encuentran solo en hojas caídas (hojarasca) y no en frutas, hojas verdes y ramitas adheridas al dosel. Los conidios se pueden encontrar en ramitas muertas (no en ramitas verdes), hojas verdes (principalmente limones) y frutos enfermos, así como en hojas caídas (Baldassari et al., 2006; Kiely, 1948; Kotzé, 1963).
P. citricarpa tiene asimismo un estado asexual microconidial, que se ha descrito en el género Leptodothiorella (Kiely, 1949). Este estado microconidial, también conocido como estado “espermogonial” (Kiely, 1949), suele aparecer en las hojas caídas antes de la formación de pseudotecios. Sin embargo, sigue sin estar clara la función de los microconidios en la biología de P. citricarpa.
Varios estudios han demostrado que la dispersión debida a ascosporas ocurre a distancias de hasta 25 m, mientras que las picnidiosporas se diseminaron hacia abajo dentro del árbol solo a una distancia de 80 cm (Spósito et al., 2011). Las picnidiosporas se diseminan por el agua y no se dispersan en corrientes de aire seco (Kiely, 1948; Wager, 1949; Whiteside, 1967).
Una vez establecida la enfermedad en un monte frutal, la erradicación del hongo se considera imposible o muy poco probable.
.
- Ciclo biológico agronómico de la Mancha negra de los cítricos causada por Phyllosticta citricarpa. Autor: Guarnaccia et al., 2019.
.
.
Manejo de la enfermedad:
X Todos los cultivares comerciales son susceptibles, pero los cultivares de maduración tardía y los limoneros son los más vulnerables.
* Uso de material de propagación libre de la enfermedad.
* Uso de modelos de predicción de la intensidad de la enfermedad en función de variables climáticas (Hendricks et al., 2020; Gottwald et al., 2021). Estos modelos deben validarse rigurosamente en forma local.
* Monitorear la presencia de la enfermedad en el lote.
* Tratamientos químicos basados en el uso de fungicidas preventivos y curativos (*) (Lanza et al., 2018). Los frutos son susceptibles a partir del cuaje y durante los cuatro meses de crecimiento inicial. Las aplicaciones se realizan desde la caída de pétalos hasta enero, donde la fruta posee 2 o 3 centímetros de diámetro y el fruto se encuentra en un momento fenológico muy sensible al ataque de la enfermedad.
* Cosecha y comercialización temprana para las variedades tardías.
* Eliminar hojarasca o acelerar su descomposición (Carbajo Romero et al., 2019).
* Realizar podas sanitarias.
* Evitar el traslado de ramas o cualquier material cítrico de un lugar a otro.
* Eliminar frutos que hayan quedado sin cosechar.
* Mantener la plantación con un adecuado plan de nutrición y riego.
X No se recomienda el uso de cortinas forestales, ya que aumenta la HR dentro del canopeo
.
(*) estrobilurinas (inhibidores de la quinona externa, QoI), ditiocarbamatos y cobre (multisitios) y bencimidazoles (MBC), aplicados en mezclas con aceite mineral (Dewdney et al ., 2018; Kellerman and Kotze, 1977; Kotze, 1981, 2000; Miles et al ., 2004; Schutte et al ., 2003, 2012; Silva‐Junior et al ., 2016a, 2016b).
.
La Resolución de la Ex SAPyA N° 56/2008 aprueba el Programa de Certificación de Fruta Fresca Cítrica para exportación a la Unión Europea y mercados con similares restricciones cuarentenarias cuyo objetivo es garantizar que la fruta fresca cítrica producida en las Regiones del Noreste y Noroeste Argentino (NEA y NOA) cumpla con las exigencias fitosanitarias establecidas en la normativa de la Unión Europea. Además, establece la obligatoriedad de adoptar diferentes medidas fitosanitarias en las sucesivas etapas del cultivo y reglamenta el procedimiento en las plantas de empaque y en en el puerto.
.
.
.
- Autor: University of Florida
- Autor: University of Florida
- Fuente: www.phytoma.com
.
- Síntomas de mancha negra sobre naranja.
- Síntomas de mancha negra sobre naranja.
- Síntomas de mancha negra sobre naranja.
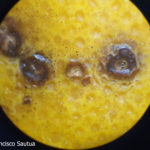
- Síntomas de mancha negra sobre naranja. Se observan picnidios en el centro de las manchas.
- Síntomas de mancha negra sobre naranja. Se observan picnidios en el centro de la mancha.
- Síntomas de mancha negra sobre naranja.
- Síntomas de mancha negra sobre naranja. Se observan picnidios de Phyllosticta citricarpa en el centro de las manchas.
- Síntomas de mancha negra sobre naranja. Se observan picnidios en el centro de las manchas.
- Síntomas de mancha negra sobre naranja. Se observan picnidios en el centro de la mancha.
- Síntomas de mancha negra sobre naranja. Se observan picnidios en el centro de la mancha.
- Síntomas de mancha negra sobre naranja. Se observan picnidios en el centro de la mancha.
- Síntomas de mancha negra sobre naranja. Se observan picnidios en el centro de la mancha.
- Picnidios de Phyllosticta spp.
- Picnidios de Phyllosticta spp. sobre naranja.
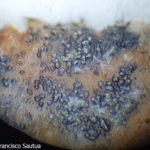
- Esporulación abundante de Phyllosticta spp. sobre naranja.
- Esporulación abundante de Phyllosticta spp. sobre naranja.
- Cirros sobre esporulación abundante de Phyllosticta spp. sobre naranja.
- Cirros sobre esporulación abundante de Phyllosticta spp. sobre naranja.
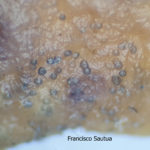
- Colonia de Phyllosticta sobre PDA.
- Cirros de Phyllosticta sobre colonia creciendo en PDA.
- Cirros de Phyllosticta sobre colonia creciendo en PDA.
- Cirros de Phyllosticta sobre colonia creciendo en PDA.
- Colonia de Phyllosticta sobre V8.
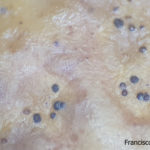
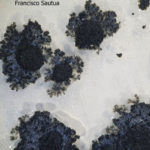
- Colonias de Phyllosticta sobre V8. Se observa el pigmento amarillo característico de cepas patógenas de Phyllosticta citricarpa. Autor: Francisco Sautua
- Espermacias de Phyllosticta spp.
- Espermacias de Phyllosticta spp.
- Espermacias de Phyllosticta spp.
- Conidios de Phyllosticta spp.
- Conidios de Phyllosticta spp.
- Conidios de Phyllosticta spp.
- Conidios de Phyllosticta spp.
- Conidios de Phyllosticta spp.
- Conidios de Phyllosticta spp.
- Colonias de Phyllosticta sobre PDA, a partir de suspensión conidial.
- Colonias de Phyllosticta sobre PDA, a partir de suspensión conidial.
- Colonias de Phyllosticta sobre PDA, a partir de suspensión conidial.
.
.
.
Fotos
Invasive.org, citrus black spot, Guignardia citricarpa Kiely
.
Videos
Enfermedades cuarentenarias en cítricos Mancha negra en cítricos del NEA, INTA Concordia. Nov 9, 2020
Citrus Black Spot Decontamination Training, FDACS DPI. Mar 28, 2019
.
.
Notas
Detección rápida de la Mancha Negra de los Cítricos
.
.
Bibliografía
Phyllosticta citricarpa. Sistema Nacional Argentino de Vigilancia y Monitoreo de plagas.
.
Agostini JP, Peres NA, Mackenzie SJ, Adaskaveg JE, Timmer LW (2006) Effect of fungicides and storage conditions on postharvest development of citrus black spot and survival of Guignardia citricarpa in fruit tissues. Plant Disease 90: 1419–1424. doi: 10.1094/PD-90-1419
Ahmed, Y., Hussein, A., Hubert, J. et al. (2020) New multiplex conventional PCR and quadruplex real-time PCR assays for one-tube detection of Phyllosticta citricarpa, Elsinoë fawcettii, Elsinoë australis, and Pseudocercospora angolensis in Citrus: development and validation. Appl Microbiol Biotechnol 104: 9363–9385. doi: 10.1007/s00253-020-10880-w
Alcoba NJ, Vigiani AR, Bejerano N, et al. (2000) Mancha Negra de los Cítricos Epidemia y Control. ISBN/ISSN: ISBN: 950-721-115-2
Amorim R, Savi DC, Ferreira-Maba L, et al. (2017) MAT gene idiomorphs suggest a heterothallic sexual cycle in the citrus pathogen Phyllosticta citricarpa. Eur J Plant Pathol 147: 325–337. doi: 10.1007/s10658-016-1005-8
Baayen RP, Bonants PJM, Verkley G, et al. (2002) Nonpathogenic isolates of the citrus black spot fungus, Guignardia citricarpa, identified as a cosmopolitan endophyte of woody plants, G. mangiferae (Phyllosticta capitalensis). Phytopathology 92: 464–477. doi: 10.1094/PHYTO.2002.92.5.464
Baldassari RB, Reis RF, De Goes A (2006) Susceptibility of fruits of the ‘Valencia’ and ‘Natal’ sweet orange varieties to Guignardia citricarpa and the influence of the coexistence of healthy and symptomatic fruits. Fitopatol. Bras. 31, 337–341. doi: 10.1590/S0100-41582006000400002
(1895) Black spot of the orange. Agric. Gaz. N.S.W. 4, 249–252.
Boughalleb-M’Hamdi N, Fathallah A, Benfradj N, et al. (2020) First report of citrus black spot disease caused by Phyllosticta citricarpa on Citrus limon and C. sinensis in Tunisia. New Disease Reports 41: 8-8. doi: 10.5197/j.2044-0588.2020.041.008
, , , et al (2024) Survey of Phyllosticta citricarpa mating type in the São Paulo citrus belt and optimization of in vitro ascospore production. Plant Pathology 00: 1–11. doi: 10.1111/ppa.13903
Buijs VA, Groenewald JZ, Haridas S, et al. (2021) Enemy or ally: a genomic approach to elucidate the lifestyle of Phyllosticta citrichinaensis. bioRxiv 2021.11.27.470207; doi: doi: 10.1101/2021.11.27.470207
Canale MC, et al. (2011) In vitro effect of UV-C irradiation on Guignardia citricarpa and on postharvest control of citrus black spot. Tropical Plant Pathology 36: 356-361. doi: 10.1590/S1982-56762011000600003
Carbajo Romero et al. (2019) Aceleración de la descomposición de las hojas de limón como estrategia para el manejo de mancha negra de los cítricos, causadas por Phyllosticta citricarpa. IX Contreso Argentino de Citricultura, 11 al 14 de junio de 2019, Tucumán, Argentina.
Carbajo Romero MS, Canteros BI (2020) Mancha negra de los cítricos, una enfermedad que preocupa al sector. INTA E.E.A. Famaillá, E.E.A. Bella Vista. LINK
Carstens E, Le Roux HF, Van Rooyen L, et al. (2012) Citrus black spot does not occur in the Western Cape, Northern Cape and Free State provinces of South Africa. S. Afr. J. Sci. 108: 56–61. Link
Contreras, J del V (1988) Mancha negra de los citrus en la provincia de Misiones. Citrusmisiones, Boletín N°21: 15 – 23.
Das AK, Nerkar S, Kumar A (2018) First Report of Phyllosticta citricarpa Causing Citrus Black Spot on Citrus sinensis and C. reticulata in India. Plant Disease 102: 1661. doi: 10.1094/PDIS-08-17-1248-PDN
de Oliveira Silva A, Savi DC, Raiser PHS, et al. (2017) Epidemiological aspects of Phyllosticta citricarpa colonization and viability in Citrus sinensis . J Plant Dis Prot 124: 73–80. doi: 10.1007/s41348-016-0046-8
de Oliveira Fialho R, Moyo P, Fourie PH, et al. (2022) Citrus black spot intensity and yield losses on sweet orange are affected by Phyllosticta citricarpa inoculum concentration and fruit developmental stage. Plant Pathol. doi: 10.1111/ppa.13586
Dummel DM, Agostini JP, Moschini R (2015) Predictive model for ascospore release of Guignardia citricarpa using climatological data. Proceedings of the XIIth International Citrus Congress, Valencia, Spain, B. Sabater-Munoz et al. Acta Horticulturae, 1065: 953–963.
Fialho OR, Moyo P, Fourie PH, et al. (2022) Citrus black spot intensity and yield losses on sweet orange are affected by Phyllosticta citricarpa inoculum concentration and fruit developmental stage. Plant Pathology, 00, 1– 13. doi: 10.1111/ppa.13586
EFSA PLH Panel (EFSA Panel on Plant Health) (2018) Scientific Opinion on the evaluation of a paper by Guarnaccia et al. (2017) on the first report of Phyllosticta citricarpa in Europe. EFSA Journal 16(1): 5114, 48 pp. doi: 10.2903/j.efsa.2018.5114
EPPO (2009) PM 7/17(2): Guignardia citricarpa. EPPO Bulletin 39: 318-327. doi: 10.1111/j.1365-2338.2009.02319.x
Er HL, Roberts PD, Marois JJ, van Bruggen AHC (2013) Potential distribution of citrus black spot in the United States based on climatic conditions. Eur. J. Plant Pathol. 137: 635-647. doi: 10.1007/s10658-013-0276-6
Fourie PH, Schutte T, Serfontein S, Swart F (2013) Modeling the effect of temperature and wetness on Guignardia pseudothecium maturation and ascospore release in citrus orchards. Phytopathology, 103: 281–292. doi: 10.1094/PHYTO-07-11-0194
Garrán S, Mousqués J, Mika R, Burdyn, Kulczycki Waskowicz C, Sosa A, Pérez E, Hochmaier V (2015) Mancha negra de los cítricos en la región del río Uruguay: Sintomatología y alternativas de control químico. XV Jornadas Fitosanitarias Argentinas 7 al 9 de octubre de 2015, ciudad de Santa Fe. Poster. LINK
Glienke C, Pereira OL, Stringari D, et al. (2011) Endophytic and pathogenic Phyllosticta species, with reference to those associated with Citrus Black Spot. Persoonia 26: 47-56. doi: 10.3767/003158511X569169
Gottwald TR, Taylor EL, Amorim L, et al. (2021) Probabilistic risk-based model for the assessment of Phyllosticta citricarpa-infected citrus fruit and illicit plant material as pathways for pathogen introduction and establishment. Crop Protection 142: 105521. doi: 10.1016/j.cropro.2020.105521
Guarnaccia V, Groenewald JZ, Li H, et al. (2017) First report of Phyllosticta citricarpa and description of two new species, P. paracapitalensis and P. paracitricarpa, from citrus in Europe. Studies in Mycology 87: 161-185. doi: 10.1016/j.simyco.2017.05.003
Guarnaccia V, Gehrmann T, Silva-Junior GJ, et al. (2019) Phyllosticta citricarpa and sister species of global importance to Citrus. Mol Plant Pathol. 20(12):1619-1635. doi: 10.1111/mpp.12861
Hendricks KE, Christman M, Roberts PD (2017) Spatial and Temporal Patterns of Commercial Citrus Trees Affected by Phyllosticta citricarpa in Florida. Scientific Reports 7(1): 1641. doi: 10.1038/s41598-017-01901-2
Hendricks KE, Christman MC, Roberts PD (2017) A Statistical Evaluation of Methods of In-Vitro Growth Assessment for Phyllosticta citricarpa: Average Colony Diameter vs. Area. PLoS ONE 12(1): e0170755. doi: 10.1371/journal.pone.0170755
Hendricks KE, Christman MC, Roberts PD (2020) The Effect of Weather and Location of Fruit within the Tree on the Incidence and Severity of Citrus Black Spot on Fruit. Sci Rep 10: 1389. doi: 10.1038/s41598-020-58188-z
Hidalgo Góngora EI, Pérez Vicente L (2010) Diferenciación morfológica, cultural y biológica de guignardia citricarpa y guignardia mangiferae en frutos cítricos de Cuba. Fitosanidad 14: 141-152. Link
Hincapie M, Wang NY, Peres NA, Dewdney MM (2014) Baseline Sensitivity of Guignardia citricarpa Isolates from Florida to Azoxystrobin and Pyraclostrobin. Plant Disease 98(6): 780-789. doi: 10.1094/PDIS-03-13-0335-RE. PMID: 30708631
Hochmaier VE, Mika RH (2020) Aportes para el manejo de enfermedades cuarentenarias en cítricos. INTA E.E.A. Concordia, C.R. Entre Ríos. Link
Hu J, Johnson EG, Wang NY, Davoglio T, Dewdney MM (2014) qPCR quantification of pathogenic Guignardia citricarpa and nonpathogenic G. mangiferae in Citrus. Plant Dis. 98: 112–120. doi: 10.1094/PDIS-04-13-0465-RE
Huang CS, Chang SL (1972) Leaf infection with citrus black spot and perithecial development in relation to ascospore discharge of Guignardia citricarpa Kiely. J. Taiwan Agric. Res. 21, 256–263.
Kiely TB (1949) Preliminary studies on Guignardia citricarpa n. sp., the ascigerous stage of Phoma citricarpa McAlp., and its relation to blackspot of citrus. Proceedings of the Linnean Society of New South Wales 73: 249-292.
Kiely TB (1949 Black spot of citrus. The Agricultural Gazette of New South Wales 60: 17-20.
Kiely TB (1960) Speckled blotch of citrus. The Agricultural Gazette of New South Wales 71: 474-476.
Kotzé J (2000) ‘Black spot’, in LW Timmer, SM Garnsey, JH Graham (eds.), Compendium of citrus diseases, 2nd edn. The American Phytopathological Society Press, St Paul, Minnesota, pp. 23–25.
Lanza FE, Metzker TG, Vinhas T, Behlau F, Silva Junior GJ (2018) Critical Fungicide Spray Period for Citrus Black Spot Control in São Paulo State, Brazil. Plant Disease 102(2): 334-340. doi: 10.1094/PDIS-04-17-0537-RE
Lee YS, Huang CS (1973) Effect of climatic factors on the development and discharge of ascospores of the citrus black spot fungus. J. Taiwan Agric. Res. 22: 135–144.
Ioos R, Puertolas A, Renault C, et al. (2023) Harnessing the power of comparative genomics to support the distinction of sister species within Phyllosticta and development of highly specific detection of Phyllosticta citricarpa causing citrus black spot by real-time PCR. PeerJ 11: e16354. doi: 10.7717/peerj.16354
, , , (2021) Citrus black spot severity related to premature fruit drop in sweet orange orchards. Plant Pathology 00: 1– 11. doi: 10.1111/ppa.13461
Magarey RD, Hong SC, Fourie PH, et al. (2015) Prediction of Phyllosticta citricarpa using an hourly infection model and validation with prevalence data from South Africa and Australia. Crop Prot. 75: 104–114. doi: 10.1016/j.cropro.2015.05.016
Martínez-Minaya J, Conesa D, López-Quílez A, et al. (2018) Spatial and climatic factors associated with the geographical distribution of citrus black spot disease in South Africa. A Bayesian latent Gaussian model approach. Eur J Plant Pathol 151: 991–1007. doi: 10.1007/s10658-018-1435-6
McOnie KC (1964) Source of inoculum of Guignardia citricarpa citrus black spot pathogen. Phytopathology 54: 64–67.
Menoni Ceriotti M (2011) Caracterización morfológica y molecular de Guignardia citricarpa, agente causal de la Mancha Negra de los cítricos. Tesis. Universidad de la Repúclica. Link
Miles AK, Smith MW, Tran NT, et al. (2019) Identification of Resistance to Citrus Black Spot Using a Novel In-field Inoculation Assay. HortScience horts 54: 1673-1681. doi: 10.21273/HORTSCI14200-19
Moyo P, Fourie PH, Masikane SL, et al. (2020) The Effects of Postharvest Treatments and Sunlight Exposure on the Reproductive Capability and Viability of Phyllosticta citricarpa in Citrus Black Spot Fruit Lesions. Plants 9(12): 1813. doi: 10.3390/plants9121813
Okane I, Nakagiri A, Ito T (2001) Identity of Guignardia sp. inhabiting ericaceous plants. Canadian Journal of Botany 79: 101-109. doi: 10.1139/b00-136
Okane I, Nakagiri A, Ito T, Lumyong S (2003) Extensive host range of an endophytic fungus, Guignardia endophyllicola (anamorph: Phyllosticta capitalensis). Mycoscience 44: 353-363. doi: 10.1007/S10267-003-0128-X
Paul I, van Jaarsveld AS, Korsten L, Hattingh V (2005) The potential global geographical distribution of Citrus Black Spot caused by Guignardia citricarpa (Kiely): likelihood of disease establishment in the European Union. Crop Protection, 24: 297–308. doi: 10.1016/j.cropro.2004.08.003
Peres NA, Harakava R, Carroll GC, Adaskaveg JE, Timmer LW (2007) Comparison of Molecular Procedures for Detection and Identification of Guignardia citricarpa and G. mangiferae. Plant Disease 91(5): 525-531. doi: 10.1094/PDIS-91-5-0525
Perryman S, Clark S, West J (2014) Splash dispersal of Phyllosticta citricarpa conidia from infected citrus fruit. Sci Rep 4: 6568. doi: 10.1038/srep06568
Possiede YM, Gabardo J, Kava-Cordeiro V, et al. (2009) Fungicide resistance and genetic variability in plant pathogenic strains of Guignardia citricarpa. Brazilian Journal of Microbiology, 40: 308–313. doi: 10.1590/S1517-838220090002000018
, (2006) Effect of temperature, leaf wetness and rainfall on the production of Guignardia citricarpa ascospores and on black spot severity on sweet orange. Fitopatol. Bras. 31: 29–34. doi: 10.1590/S0100-41582006000100005
Savi DC, Noriler SA, Ponomareva LV, et al. (2020) Dihydroisocoumarins produced by Diaporthe cf. heveae LGMF1631 inhibiting citrus pathogens. Folia Microbiol 65: 381–392. doi: 10.1007/s12223-019-00746-8
Spósito MB (2003) Dinâmica temporal e especial da mancha preta (Guignardia citricarpa) e quantifição dos danos causados à cultura dos citros. Tesis doctoral, Universidade de São Paulo, Brasil. 112 páginas.
Spósito MB, Bassanezi RB, Amorim L (2004) Resistência à Mancha Preta dos Citros Avaliada por Curvas de Progresso da Doença. Fitopatol. Bras. 29: 532-537. doi: 10.1590/S0100-41582004000500010
Spósito MB, Amorim L, Bassanezi RB, et al. (2008) Spatial pattern of black spot incidence within citrus trees related to disease severity and pathogen dispersal. Plant Pathol. 57: 103–108. doi: 10.1111/j.1365-3059.2007.01705.x
Spósito MB, Amorim L, Bassanezi RB, et al. (2011) Relative importance of inoculum sources of Guignardia citricarpa on the citrus black spot epidemic in Brazil. Crop Protect. 30: 1546-1552. doi: 10.1016/j.cropro.2011.08.007
Stammler G, Schutte GC, Speakman J, Miessner S, Crous PW (2013) Phyllosticta species on citrus: Risk estimation of resistance to QoI fungicides and identification of species with cytochrome b gene sequences. Crop Protection 48: 6-12. doi: 10.1016/j.cropro.2013.02.001
Taylor EL, Gottwald TR, Adkins S (2023) Structural changes in Florida citrus production, 1980-2021 and associated consequences of weather events and disease. Journal of Citrus Pathology, 10. doi: 10.5070/
Tibpromma S, Hyde K, Bhat J, et al. (2018) Identification of endophytic fungi from leaves of Pandanaceae based on their morphotypes and DNA sequence data from southern Thailand. MycoKeys 33: 25-67. doi: 10.3897/mycokeys.33.23670
Tomlinson JA, Ostoja-Starzewska S, Webb K, et al. (2013) A loop-mediated isothermal amplification-based method for confirmation of Guignardia citricarpa in citrus black spot lesions. Eur J Plant Pathol 136: 217–224. doi: 10.1007/s10658-013-0168-9
Tran NT, Miles AK, Dietzgen RG, et al. (2020) Inoculum Dynamics and Infection of Citrus Fruit by Phyllosticta citricarpa. Phytopathology 110(10): 1680-1692. doi: 10.1094/PHYTO-02-20-0047-R
Trinh J, Li T, Franco JY, et al. (2022) Citrus relatives exhibit natural variation in perception and response magnitude to microbial features. bioRxiv 2022.07.15.500235; doi: 10.1101/2022.07.15.500235
Truter M, Labuschagne PM, Kotzé JM, et al. (2007) Failure of Phyllosticta citricarpa pycnidiospores to infect Eureka lemon leaf litter. Australasian Plant Pathology 36: 87–93. doi: 10.1071/AP06087
Truter M (2010) Epidemiology of Citrus Black Spot Disease in South Africa and Its Impact on Phytosanitary Trade Restrictions. PhD thesis. University of Pretoria, Pretoria, South Africa. Link
Urbina H, Smith T, Jones C, et al. (2021) Validation of Quantitative and Digital Polymerase Chain Reaction Assays Targeting the Mating Types of Phyllosticta citricarpa, the Causal Agent of Citrus Black Spot. PhytoFrontiers™ 1:4, 301-313. doi: 10.1094/PHYTOFR-02-21-0011-R
(1973) Studies in Phyllosticta I. Stud. Mycol. 5: 1–110.
Wager VA (1949) The occurrence of the black-spot fungus in the citrus areas of South Africa. Farming in South Africa 24: 367-374.
Wang X, Chen G, Huang F, et al. (2012) Phyllosticta species associated with citrus diseases in China. Fungal Diversity 52: 209–224. doi: 10.1007/s13225-011-0140-y
Whiteside JO (1967) Sources of inoculum of the black spot fungus, Guignardia citricarpa in infected Rhodesian citrus orchards. Rhod. Zamb. Malawi J. Agric. Res. 5: 171-177.
Wickert E, de Macedo Lemos EG, Kishi LT, de Souza A, de Goes A. (2012) Genetic diversity and population differentiation of Guignardia mangiferae from «Tahiti» acid lime. ScientificWorldJournal. 2012: 125654. doi: 10.1100/2012/125654
Wikee S, Udayanga D, Crous PW, et al. (2011) Phyllosticta—an overview of current status of species recognition. Fungal Diversity 51: 43–61. doi: 10.1007/s13225-011-0146-5
Wikee S, Lombard L, Crous PW, et al. (2013) Phyllosticta capitalensis, a widespread endophyte of plants. Fungal Diversity 60: 91–105. doi: 10.1007/s13225-013-0235-8
Wikee S, Lombard L, Nakashima C, et al. (2013) A phylogenetic re-evaluation of Phyllosticta (Botryosphaeriales). Stud Mycol. 76(1): 1-29. doi:10.3114/sim0019
Wikee S, Jaidee P, Wongkam S, et al. (2013) Antimicrobial activity of crude extracts of Phyllosticta spp. Mycology 4: 112-117. doi: 10.1080/21501203.2013.823892
Wulandari NF, To-Anun C, Hyde KD, et al. (2009) Phyllosticta citriasiana sp. nov., the cause of citrus tan spot of Citrus maxima in Asia. Fungal Divers. 34: 23–39. Link
Yan J, Dewdney MM, Roberts PD, Ritenour MA (2016) The effects of postharvest hot water and fungicide treatments on Guignardia citricarpa growth and the development of citrus black spot symptoms on ‘valencia’ orange fruit. HortScience 51(12): 1555-1560. doi: 10.21273/HORTSCI11187-16
Yonow T, Hattingh V, De Villiers M (2013) CLIMEX modelling of the potential global distribution of the citrus black spot disease caused by Guignardia citricarpa and the risk posed to Europe. Crop Prot. 44: 18–28. doi: 10.1016/j.cropro.2012.10.006
Yonow T, Kriticos DJ (2014) Misconstrued risks from citrus black spot in colder climates: a response to Er et al. 2013. Eur. J. Plant Pathol. doi: 10.1007/s10658-014-0427-4
, , , et al. (2022) Highly specific qPCR and amplicon sequencing method for detection of quarantine citrus pathogen Phyllosticta citricarpa applicable for air samples. Plant Pathology 00: 1– 16. doi: 10.1111/ppa.13679