.
Condición fitosanitaria: Presente
Grupo de cultivos: Frutícolas (Carozo y Pepita)
Especie hospedante: Duraznero (Prunus persica), entre otros
Rango de hospedantes: no específico / amplio
Epidemiología: policíclica, subaguda.
Etiología: Hongo. Necrotrófico
Agente causal:
Monilinia fructicola (G. Wint.) Honey (teleomorph) / Monilia fructicola (anamorph)
Monilinia laxa (Aderhold & Ruhland) Honey (teleomorph) / Monilia laxa (anamorph)
Monilinia fructigena (Aderhold & Ruhland) Honey (teleomorph) / Monilia fructigena (anamorph) **
.
Taxonomía: Fungi > Dikarya > Ascomycota > Pezizomycotina > Leotiomycetes > Helotiales > Sclerotiniaceae > Monilinia (teleomorph) / Monilia (anamorph)
.
Monilinia se caracteriza por formar apotecios pedicelados, dicha fructificación en forma de copa contiene ascos con ascosporas. Estos ascocarpos se forman en los frutos momificados que han caído al suelo y quedan cubiertos por la hojarasca. . Sin embargo, en Argentina no se ha reportado la formación de esclerocios.
El género del estado conidial, asexual o anamorfo es Monilia, identificándose tres especies: Monilia fructicola (Wint.) Honey, Monilia laxa (Ehr.) Sacc.y Vogl., Monilia fructigena Pers. Los conidios son producidos en esporodoquios grisáceos. Es dificultoso distinguir las tres especies únicamente por los síntomas, signos y su morfología siendo necesario observar su comportamiento en medios de cultivo y mediante identificación molecular.
.
** Condición fitosanitaria: Plaga Cuarentenaria Ausente (M. fructigena)
.
.
Importancia económica
Se manifiesta principalmente en las regiones húmedas como el Litoral (San Pedro y su zona de influencia) y la región Mesopotámica de nuestro país.
Afecta a durazneros y nectarinas, también ciruelos, cerezo, damasco, guindo y almendro, como así también causa graves daños en frutales de pepita (manzano, peral y membrillo).
.
Síntomas
Monilinia spp. se caracteriza por producir principalmente: tizón de pimpollos, flores y ramitas y podredumbre de frutos.
Tizón de flores y ramas: Las flores presentan manchas húmedas, se produce la necrosis de las anteras, pistilos, ovarios, pétalos, sépalos y pedúnculos, se tornan marrones, marchitas y a menudo cubiertas en una masa gomosa. Asimismo las flores infectadas pueden caerse o bien permanecer adheridas al pedúnculo y cubrirse de esporodoquios grises cuando hay alta humedad relativa. El desarrollo y la intensidad de estos síntomas están relacionados con la temperatura y humedad y variando, en este sentido, según la especie que ataque.
Cancros: Una vez atacadas las flores, el hongo continúa la colonización hacia las ramas o ramitas. Los brotes y ramitas presentan manchas elípticas, pardas que se resuelven en cancros provocando la muerte del órgano desde el cancro hacia el ápice. Las hojas de la rama atacada se vuelven marrones y pueden caerse o quedar adherida a la misma. El cancro puede mostrar la esporulación del hongo causal. En este caso como en el anterior los tejidos afectados pueden ser invadidos por otros hongos agravando los síntomas.
Hojas: Las ramas atacadas muestran tizón de las hojas y en ocasiones pequeñas manchas rojas.
Frutos: Los frutos son afectados desde la maduración manifestando una típica podredumbre marrón lo que constituye el daño más común y destructivo del patógeno. Se inicia por una lesión circular de color pardo, que avanza con rapidez en extensión y profundidad. El ablandamiento de los tejidos es característico debido a la acción enzimática del hongo que degrada la pectina. La podredumbre blanda, circular y castaña puede abarcar parcial o totalmente al fruto en pocos días. Si la humedad relativa es alta, los frutos se cubren de una eflorescencia grisácea, constituida por los esporodoquios o ramilletes de conidios. Esa eflorescencia se distribuye sobre el fruto de una manera uniforme, o formando círculos concéntricos. Los frutos tanto maduros como inmaduros se pudren totalmente, la piel se arruga, se deshidratan lentamente y finalmente se momifican. Estos pueden seguir adheridos a las ramas o bien caerse. En el interior de los frutos se desarrolla intercelularmente el micelio del hongo.
.
- Síntomas y signo de pudrición morena del durazno. Autor: Ed. Sikora.
- Autor: William M. Johnson
- Autor: Ed Sikora
- Durazno momificado. Autor: Pennsylvania State University
.
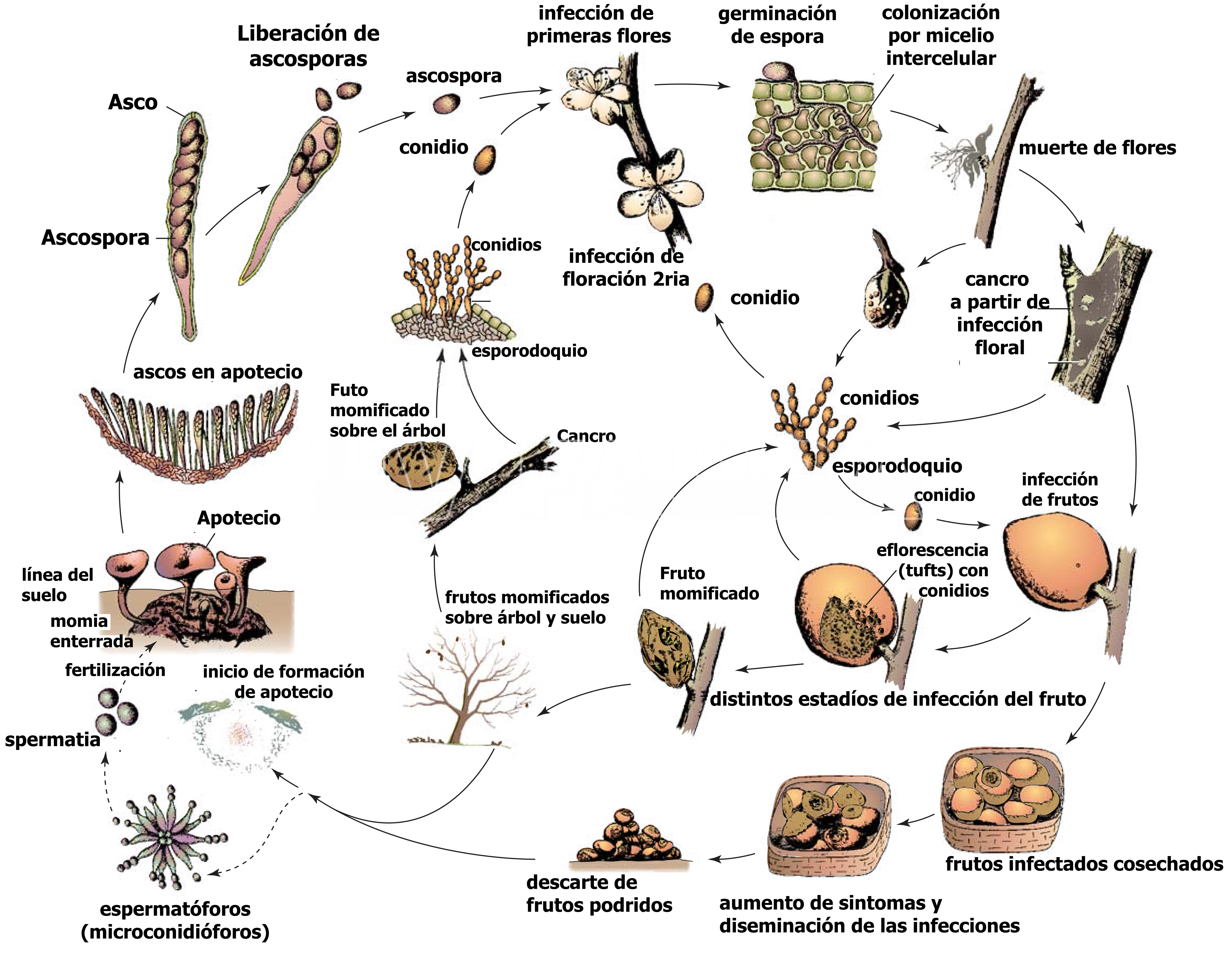
Ciclo de la enfermedad
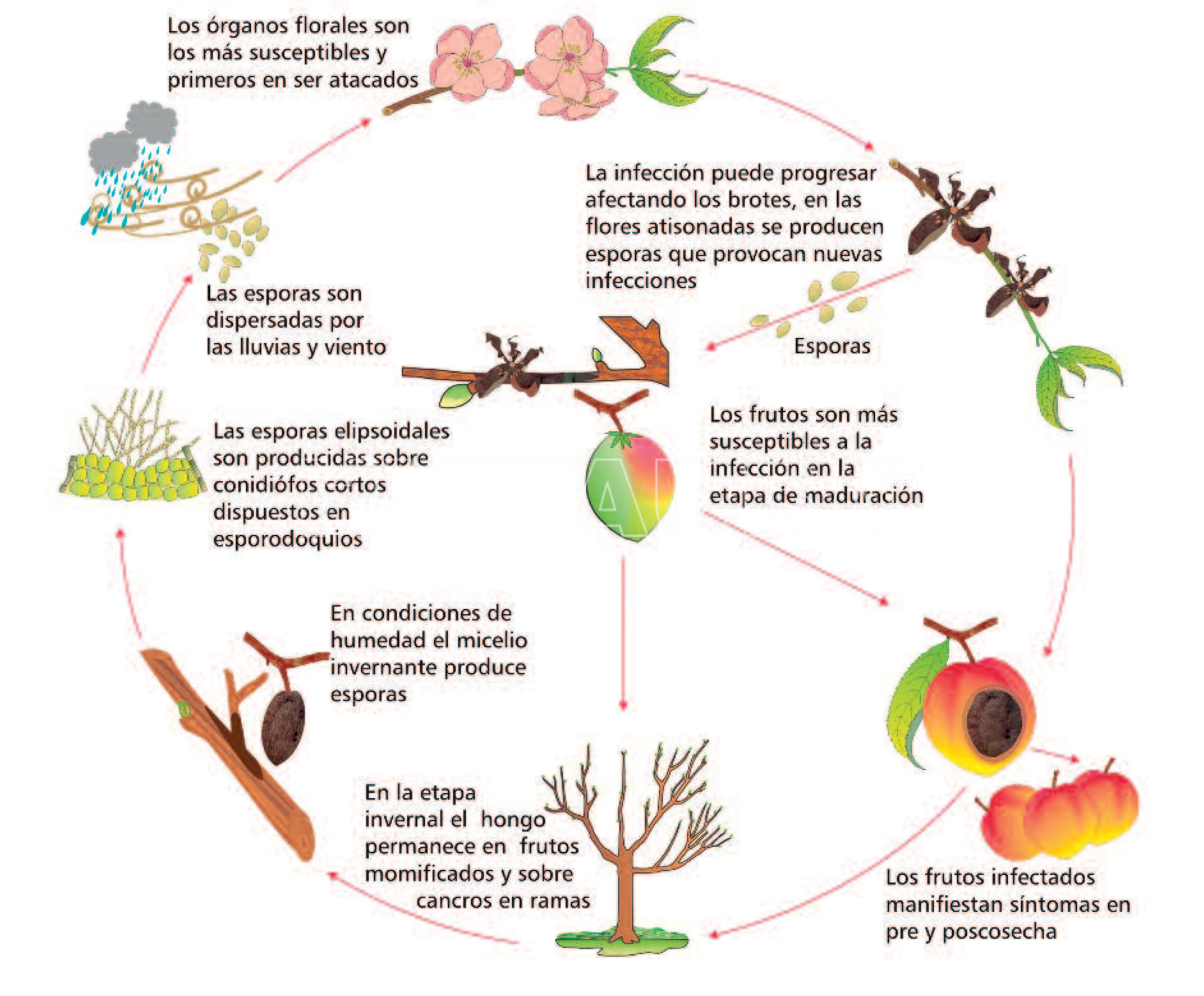
En general, el patógeno sobrevive durante el invierno como micelio en frutos momificados en el árbol y en cancros de ramitas afectadas, o como pseudoesclerotia en momias en el suelo. En la primavera, el micelio en la fruta momificada del árbol y en los cancros de las ramitas produce nuevos conidios, mientras que la pseudoesclerotia en la fruta momificada enterrada en el suelo produce apotecios, que forman ascos y ascosporas. Sin embargo, en Argentina no se ha reportado la formación de esclerocios. Por lo tanto, el inóculo primario lo constituye los conidios que se forman en las lesiones (lesiones de años anteriores en tejidos atizonados y cancros).
Tanto los conidios como las ascosporas pueden causar infecciones de las flores. Las condiciones climáticas pueden afectar el desarrollo de la estructura sexual de las especies de Monilinia. En Brasil, existen condiciones subtropicales en la mayoría de las regiones productoras de frutas, mientras que en California existe un clima templado. En Rio Grande do Sul, se han reportado el apotecio de M. fructicola, pero su ocurrencia es rara. No se ha reportado la ocurrencia de reproducción sexual en los otros estados brasileños. La supervivencia de M. fructicola en huertos brasileños se debe principalmente a frutos momificados y cancros de ramitas y la dispersión es por aire y lluvia (May De Mio et al., 2014; Fischer et al., 2016). En Argentina, tampoco se ha reportado la presencia de apotecios con ascosporas.
Los conidios son dispersados por el viento o pueden ser transportados a partes florales por salpicaduras de agua de lluvia o insectos. Las ascosporas son descargadas por fuerza de eyección por el asco, formando una nube blanquecina sobre el apotecio. Luego, las corrientes de aire transportan las ascosporas hasta las flores. Esto ocurre iniciada la floración y después de la lluvia. Los conidios se forman con temperaturas mayores a 5ºC y se dispersan por la lluvia, el viento y los insectos. Las temperaturas medias (17ºC a 22ºC) favorecen el desarrollo de los apotecios (en países o regiones en las cuales se forman). Las ascosporas son expulsadas a pocos centímetros del suelo y de allí son llevadas por las corrientes de aire hasta las flores. La combinación de la duración del mojado (horas de mojado de la superficie vegetal con agua líquida libre) y la temperatura juegan un papel fundamental en la cantidad de flores que se infectarán (período crítico de infección). Si se cumple el período de infección, los conidios y las ascosporas germinan y pueden causar infección en unas pocas horas. El micelio, especialmente en clima húmedo, produce abundante esporulación de conidios en esporodoquios en las partes florales podridas y arrugadas, a partir de las cuales se liberan y dispersan nuevas masas de conidios hacia tejido sano de la misma planta y de plantas vecinas. Mientras tanto, el micelio coloniza el tejido del hospedante avanzando rápidamente hacia los pecíolos de las flores y hacia los espolones de la fruta y las ramitas, donde puede causar cancros, deprimido, de color marrón rojizo y en forma de escudo. El cancro puede rodear la ramita, que luego se ciñe y muere. La superficie del cancro pronto se cubre con masas de conidios, los que actúan como inóculo secundario para la infección de la fruta más adelante en la temporada cuando la fruta comienza a madurar. Debido a que las ascosporas y los nuevos conidios tienen una vida corta, la infección de la fruta madura la realizan los conidios formados en los cancros de las ramas durante el clima húmedo del verano. Además, los conidios producidos en flores infectadas de frutales de carozo de floración tardía pueden ser transportados e infectar los frutos de especies o variedades de frutos de carozo de maduración temprana. Luego de la germinación de los conidios, el hongo suele penetrar la fruta a través de heridas causadas por insectos, ramitas o granizo, pero en algunos casos también acceden a través de los estomas o con penetración directa a través de la cutícula. Por lo tanto, La penetración varía según los órganos atacados y la especie patógena. En las flores se produce a través de los estigmas y las anteras (M. laxa). M. fructicola lo hace directamente a través los estomas y de la cutícula de las hojas, aunque a medida que las hojas se engrosan, esta forma de penetración disminuye. En los frutos en proceso de maduración ocurre a través de los estomas o cutícula y en las frutas maduras en la zona de inserción de los pelos, y en menor grado directamente. Al igual que M. fructigena, en esta etapa la fruta es más susceptible a la penetración por heridas causadas por labores agrícolas, resquebrajaduras, causas fisiogénicas, etc. Los insectos juegan un rol importante transportando conidios o bien produciendo picaduras por las cuales se produce la entrada del patógeno.
El hongo crece intercelularmente, colonizando los tejidos y secreta enzimas que provocan la pudrición y el pardeamiento de los tejidos infectados. El hongo invade los tejidos de la fruta con bastante rapidez, mientras que también produce esporula con conidios en el área ya podrida. Los nuevos conidios pueden ser arrastrados e infectar más frutos. Toda la fruta puede pudrirse por completo en unos pocos días, y queda adherida colgando del árbol o cae al suelo. La fruta que cae al suelo poco después de la infección suele desintegrarse por la acción de hongos y bacterias saprofitas. La fruta que queda colgando en el árbol pierde humedad, se arruga y se convierte en una “momia” seca y deformada que consiste en los restos de las células de la fruta mantenidas en su lugar por hilos miceliales entretejidos en una cáscara dura (podredumbre seca, proceso de momificación). Las momias que caen al suelo no se ven afectadas por los microorganismos del suelo y pueden persistir allí durante dos años o más.
La infección de la fruta también puede ocurrir después de la cosecha, en el almacenamiento y en tránsito. Frutos aparentemente sanos, frecuentemente están contaminados con esporas del hongo (infección quiescente) y su desarrollo puede ocurrir durante el almacenamiento y comercialización (poscosecha). Además, la fruta infectada continúa pudriéndose después de la cosecha y el micelio puede atacar directamente la fruta sana en contacto con la infectada. La fruta sana también puede ser atacada por conidios en cualquier momento entre la cosecha y el uso por parte del consumidor.
.
- Ciclo de la pudrición morena de los frutos de carozo causada por Monilinia spp. Autor: Agrios, 2005.
.
.
- Ciclo biológico de Monilia fructicola. Autor: INTA
.
.
Condiciones Predisponentes
La temperatura óptima para el desarrollo de Monilia fructicola se encuentra en el rango 20 a 25ºC con un mínimo de 3 a 5 horas de mojado para que tenga éxito la infección. Después de 24 horas de humedad la infección es independiente de la temperatura entre valores de 5 a 30ºC. Monilia laxa requiere temperaturas mayores a 13ºC (óptimo 24ºC).
La infección de las flores depende de la duración del mojado (agua liquida libre sobre la superficie vegetal) y la temperatura (período crítico de infección). Para que la infección de las flores ocurra a 10ºC, son necesarias 18 horas de mojado; en cambio, a 24ºC solo son necesarias 5 horas. El tiempo necesario para que se desarrollen los síntomas del tizón de las flores puede ser de unos pocos días a una o dos semanas, dependiendo de la temperatura. Las flores marchitas a menudo se oscurecen a medida que ocurren nuevos brotes de crecimiento de las hojas.
Las lluvias durante el período de maduración de los frutos son un factor predisponente ya que garantizan el período crítico de infección.
.

Fruto de durazno momificado. Autor: © 2021 Purdue University
.
.
Manejo Integrado
* Emplear variedades resistentes o tolerantes (cuando existan). Si se planifica la implantación de un monte nuevo contemplar la susceptibilidad frente a podredumbre morena de la variedad que se va a elegir.
* El saneamiento ayudará a prevenir los primeros ataques, esto es fundamental para evitar futuras infecciones.
* Evitar ataques intensos de bacteriosis ya que las pequeñas lesiones que la bacteria provoca en los frutos son puerta de entrada para el hongo causante de podredumbre morena.
* Eliminación del inóculo primario: Conociendo que el patógeno permanece en frutos momificados, pedúnculos y cancros, se deduce su necesaria eliminación, para reducir los niveles de inóculo inicial. Esta tarea se debe realizar a fines del verano o durante la poda invernal. Con el movimiento de las ramas en el momento de podar, algunas momias se caen al suelo; éstas pueden ser fuente de inóculo mediante la producción de apotecios. La aplicación de herbicidas en la fila reduce la producción de los mencionados órganos por la eliminación de pastos que crean un microclima favorable para su formación.
* Eliminación de inóculo secundario: Durante la floración y cuajado de frutos deben eliminarse las flores atizonadas y cancros, ya que estos son fuente de inóculo para la fruta.
Manejo de microclima: Mediante el manejo correcto de la poda se puede lograr mayor insolación y ventilación. Es importante el manejo de la fertilización, ya que un exceso en la fertilización nitrogenada favorece el desarrollo de la enfermedad. En montes con excesivo vigor donde se sombrea la entrefila, se crea un microclima húmedo que dificulta el control.
* Manejo de la cosecha: Manejo de la cosecha: Se debe evitar la producción de heridas,
– Utilizando guantes y canasto cosechero forrado
– Empleando cajones en buen estado
– Evitando que la fruta se golpee al manipularla
– Evitando que entre en contacto inóculo con los frutos cosechados, a través de una buena higiene de los cajones, de la planta de empaque y las cámaras frigoríficas.
* Es importante acondicionar la fruta cosechada para evitar condiciones favorables al desarrollo de la enfermedad. Para esto se debe remover rápidamente el calor, llevándola a temperaturas cercanas a 0ºC.
* El control químico de esta enfermedad apunta a proteger a la planta en los dos estados de máxima susceptibilidad: floración y madurez del fruto. Dada la aparición en alta frecuencia de cepas de Monilinia fructicola resistentes a carbendazim, se recomienda no usar más de una vez este principio activo ni durante todo el ciclo de cultivo. Situaciones de riesgo también son provocadas por otros fungicidas sistémicos como los inhibidores de la síntesis del ergosterol, por lo cual se sugiere su empleo con limitaciones a lo estrictamente necesario, en los momentos adecuados y en las dosis sugeridas.
Guia pulverizaciones frutales carozo (INTA)
* Monitorear la presencia de cepas resistentes a fungicidas en el monte y en el galpón de empaque.
.
-Todos los órganos florales pueden ser atacados. Los más susceptibles son los estambres y estigma. Si la humedad >80% pétalos y sépalos son invadidos. A partir del ataque a los restos florales (envolturas) avanza hacia el tejido vivo.
-Se considera que el fruto verde es resistente a la infección.
-El período de mayor susceptibilidad es el de maduración del fruto. Comienza con el cambio de color y aumenta con el grado de madurez.
-La presencia de heridas sobre los frutos ocasionadas naturalmente o por insectos incrementa la susceptibilidad.
-Los cultivares de piel blanda y de pulpa blanca son más susceptibles al igual que los nectarines.
.
.
- Autor: Ed Sikora
.
.
- 01 Sintomas y Signos de la Podredumbre morena causada por Monilinia spp. Autor: Ing. MSc. Mariela Rodriguez Romera.
- 02 Sintomas y Signos de la Podredumbre morena causada por Monilinia spp. Autor: Ing. MSc. Mariela Rodriguez Romera.
- 03 Proceso de momificación de la Podredumbre morena del duraznero causada por Monilinia spp. Autor: Ing. MSc. Mariela Rodriguez Romera.
- 04 Proceso de momificación de la Podredumbre morena del duraznero causada por Monilinia spp. Autor: Ing. MSc. Mariela Rodriguez Romera.
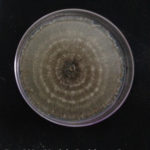
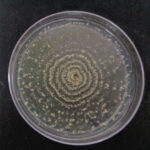
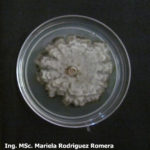
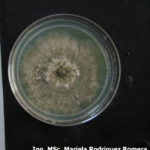
- 05 Colonia de Monilinia spp aislada de durazno, creciendo en PDA. Autor: Ing. MSc. Mariela Rodriguez Romera.
- 06 Colonia de Monilinia spp aislada de durazno, creciendo en PDA. Autor: Ing. MSc. Mariela Rodriguez Romera.
- 07 Colonia de Monilinia spp aislada de durazno, creciendo en PDA. Autor: Ing. MSc. Mariela Rodriguez Romera.
- 08 Colonia de Monilinia spp aislada de durazno, creciendo en PDA. Autor: Ing. MSc. Mariela Rodriguez Romera.
- 09 Colonia de Monilinia spp aislada de durazno, creciendo en PDA. Autor: Ing. MSc. Mariela Rodriguez Romera.
- 10 Colonia de Monilinia spp aislada de durazno, creciendo en PDA. Autor: Ing. MSc. Mariela Rodriguez Romera.
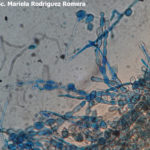
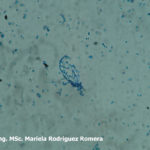
- 11 Conidios de Monilia spp aislada de durazno. Autor: Ing. MSc. Mariela Rodriguez Romera.
- 12 Conidios de Monilia spp aislada de durazno. Autor: Ing. MSc. Mariela Rodriguez Romera.
- 01 Signo (esporulación) de Monilia spp en durazno en postcosecha. Autor: Ing. Agr. José Luis Mangione
- 01 Podredumbre morena del durazno por Monilinia spp.
- 02 Podredumbre morena del durazno por Monilinia spp.
- 03 Podredumbre morena del durazno por Monilinia spp.
- 04 Podredumbre morena del durazno por Monilinia spp.
- 05 Podredumbre morena del durazno por Monilinia spp.
- 06 Podredumbre morena del durazno por Monilinia spp.
- 07 Podredumbre morena del durazno por Monilinia spp.
- Podredumbre morena en ciruelo. Autor: University of Wisconsin-Madison.
- Podredumbre morena en ciruelo. Autor: University of Massachusetts Amherst
- Podredumbre morena en ciruelo.
- Podredumbre morena en ciruelo.
- Podredumbre morena en ciruelo.
- Podredumbre morena en ciruelo. Autor: Michailides et al., 2007.
- Podredumbre morena en ciruelo. Autor: Michailides et al., 2007.
- Fruto de ciruelo momificado. Autor: Utah State University
- Autor: Khan Lab Cornell University
- Autor: Khan Lab Cornell University
- Autor: Khan Lab Cornell University
.
.
.
.
.
Bibliografía
Agrios G (2005) Plant Pathology, 5th Edition. Academic Press, eBook ISBN: 9780080473789
Balsells-Llauradó M, Echeverría G, Torres R, et al. (2022) Emission of volatile organic compounds during nectarine-Monilinia laxa interaction and its relationship with fruit susceptibility to brown rot. Postharvest Biology and Technology 192: 111997. doi: 10.1016/j.postharvbio.2022.111997
Casals C, Segarra J, De Cal A, Lamarca N, Usall J (2015) Overwintering of Monilinia spp. on Mummified Stone Fruit. Journal of Phytopathology 163: 160–167. doi: 10.1111/jph.12298
Cheon W, Kim YS, Balaraju K, Kim BS, Lee BH, Jeon Y (2016) Postharvest Control of Botrytis cinerea and Monilinia fructigena in Apples by Gamma Irradiation Combined with Fumigation. Journal of Food Protection 79(8): 1410-1417. doi: 10.4315/0362-028X.JFP-15-532
Côté MJ, Tardif MC, Meldrum AJ (2004) Identification of Monilinia fructigena, M. fructicola, M. laxa, and Monilia polystroma on Inoculated and Naturally Infected Fruit Using Multiplex PCR. Plant Disease 88(11): 1219-1225. doi: 10.1094/PDIS.2004.88.11.1219
De Miccolis Angelini RM, Landi L, Raguseo C, et al. (2022) Tracking of Diversity and Evolution in the Brown Rot Fungi Monilinia fructicola, Monilinia fructigena, and Monilinia laxa. Front. Microbiol. 13: 854852. doi: 10.3389/fmicb.2022.854852
De Miccolis Angelini RM, Landi L, Raguseo C, et al. (2023). Comparative genomics of the brown rot fungi Monilinia fructicola, M. laxa and M. fructigena. Acta Hortic. 1363: 31-38. doi: 10.17660/ActaHortic.2023.1363.5
De Mio LLM, Luo Y, Michailides T (2011) Sensitivity of Monilinia fructicola from Brazil to tebuconazole, azoxystrobin, and thiophanate-methyl and implications for disease management. Plant Disease 95: 821–7. doi: 10.1094/PDIS-07-10-0511
De Mio LLM, Garido LR, Ueno B, Fajardo TVM (2014) Doenças da cultura do pessegueiro e métodos de controle. In: Raseira MCB, Pereira JFM, Carvalho FLC, eds. Pessegueiro. Brasília, Brazil: Embrapa, 355–432. Link
Dowling ME, Schnabel G, Boatwright HG, Everhart SE (2017) Novel gene-sequence markers for isolate tracking within Monilinia fructicola lesions. Pest Management Science 73: 1822–1829. doi: 10.1002/ps.4544
Durak MR, Arslan K, Silan E, Yildiz G, Ozkilinc H (2021) A Novel Approach for in vitro Fungicide Screening and The Sensitivity of Monilinia Populations from Peach Orchards in Turkey to Respiratory Inhibitor Fungicides. Crop Protection 105688: 0261-2194. doi: 10.1016/j.cropro.2021.105688
Fan J, Luo Y, Michailides TJ, Guo L (2014) Simultaneous quantification of alleles E198A and H6Y in the β-tubulin gene conferring benzimidazole resistance in Monilinia fructicola using a duplex real-time (TaqMan) PCR. Pest Management Science 70: 245–251. doi: 10.1002/ps.3549
Fischer JMM, Savi DC, Aluizio R, et al. (2017) Characterization of Monilinia species associated with brown rot in stone fruit in Brazil. Plant Pathology 66: 423–436. doi: 10.1111/ppa.12578
Giménez R, Obi VI, Moreno MA, Gogorcena Y, Barriuso JJ, Floris E (2013) Evaluación de la tolerancia a Monilia en cultivares de melocotonero. Link
Grzegorczyk M, Żarowska B, Restuccia C, Cirvilleri G (2017) Postharvest biocontrol ability of killer yeasts against Monilinia fructigena and Monilinia fructicola on stone fruit. Food Microbiology 61: 93-101. doi: 10.1016/j.fm.2016.09.005
Guijarro B, Melgarejo P, Torres R, Lamarca N, Usall J, De Cal A (2007) Effects of different biological formulations of Penicillium frequentans on brown rot of peaches. Biological Control 42(1): 86-96. doi: 10.1016/j.biocontrol.2007.03.014
Guijarro B, Melgarejo P, De Cal A (2008) Influence of additives on adhesion of Penicillium frequentans conidia to peach fruit surfaces and relationship to the biocontrol of brown rot caused by Monilinia laxa. International Journal of Food Microbiology 126(1–2): 24-29. doi: 10.1016/j.ijfoodmicro.2008.04.018
Guijarro B, Melgarejo P, Torres R, Lamarca N, Usall J, De Cal A (2008) Penicillium frequentans population dynamics on peach fruits after its applications against brown rot in orchards. Journal of Applied Microbiology 104: 659–671. doi: 10.1111/j.1365-2672.2007.03596.x
Guven H, Everhart SE, De Miccolis Angelini RM, et al. (2021) Genetic diversity assessments of brown rot pathogen Monilinia fructicola based on the six simple sequence repeat loci. J Plant Dis Prot. doi: 10.1007/s41348-021-00504-4
Holb IJ, Schnabel G (2008) The benefits of combining elemental sulfur with a DMI fungicide to control Monilinia fructicola isolates resistant to propiconazole. Pest Management Science 64: 156–164. doi: 10.1002/ps.1492
Hu M-J, Cox KD, Schnabel G, Luo C-X (2011) Monilinia Species Causing Brown Rot of Peach in China. PLoS ONE 6(9): e24990. doi: 10.1371/journal.pone.0024990
Koball DC, Wilcox WF, Seem RC (1997) Influence of incubation-period humidity on the development of brown rot blossom blight of sour cherry. Phytopathology 87(1): 42-9. doi: 10.1094/PHYTO.1997.87.1.42
Landi L, De Miccolis Angelini RM, Pollastro S, et al. (2021). Whole-genome sequence of the brown rot fungal pathogen Monilinia fructigena Mfrg269 strain isolated in Italy. Acta Hortic. 1325: 103-108. doi: 10.17660/ActaHortic.2021.1325.17
Landi L, D’Ortenzio AL, Makau SM, et al. (2025) Validation of Monilinia fructicola Putative Effector Genes in Different Host Peach (Prunus persica) Cultivars and Defense Response Investigation. Journal of Fungi 11(1): 39. doi: 10.3390/jof11010039
Leone A, Permingeat H, Mitidieri M (2021) Effect of phosphites on the content of total phenols and chlorogenic acid in peach-Monilinia fructicola pathosystem. Agrociencia Uruguay 25(NE1): e404. Link
Lichtemberg PSF, Michailides TJ, Puckett RD, et al. (2018) Fitness costs associated with G461S mutants of Monilinia fructicola could favor the management of tebuconazole resistance in Brazil. Tropical Plant Pathology (accepted). doi: 10.1007/s40858-018-0254-9
Marcet-Houben M, Villarino M, Vilanova L, et al. (2021) Comparative Genomics Used to Predict Virulence Factors and Metabolic Genes among Monilinia Species. J Fungi (Basel) 7(6): 464. doi: 10.3390/jof7060464
Michailides T, Luo Y, Ma Z, Morgan DP (2007) Brown Rot of Dried Plum in California: New Insights on an Old Disease. Online. APSnet Features. doi: 10.1094/APSnetFeature-2007-0307
Mitidieri MS, Castillo JA (2014) Manejo de la podredumbre Morena (Monilinia fructicola y M. laxa) en huertos frutales de Uruguay, Chile, Bolivia, Brasil y Argentina. CYTED. Programa Interamericana de Ciencia y Tecnologia para el Desarrollo. Red Frut-San. Link
Mitidieri MS, et al. (2019) Evaluación del aceite esencial de limón sobre el crecimiento in vitro de Monilinia fructicola. VIII Encuentro Latinoamericano Prunus sin fronteras, INIA Las Brujas, 6-8 noviembre 2019. Link
Mondino P, Alaniz S, Leoni C (2009) Manejo integrado de las enfermedades del duraznero en Uruguay. INIA. Link
Munda A (2015) First Report of Brown Rot on Peach Caused by Monilia polystroma in Slovenia. Plant Disease 99(9): 1281. doi: 10.1094/PDIS-02-15-0178-PDN
Murray R, Candan AP, Vázquez D (2019) Manual de poscosecha de frutas. INTA Ediciones, 2a ed rev. Buenos Aires. Link
Papavasileiou A, Testempasis S, Michailides TJ, Karaoglanidis GS (2015) Frequency of brown rot fungi on blossoms and fruit in stone fruit orchards in Greece. Plant Pathology 64: 416–424. doi: 10.1111/ppa.12264
Pereira WV, Morales RGF, Bauer AIG, Kudlawiec K, May‐De‐Mio LL (2020) Discontinuance of tebuconazole in the field restores sensitivity of Monilinia fructicola in stone fruit orchards. Plant Pathology 69: 68-76. doi: 10.1111/ppa.13101
Petróczy M, Palkovics L (2009) First report of Monilia polystroma on apple in Hungary. European Journal of Plant Pathology 125(2): 343-347. doi: 10.1007/s10658-009-9476-5
Poniatowska A, Michalecka M, Puławska J (2021) Phylogenetic relationships and genetic diversity of Monilinia spp. isolated in Poland based on housekeeping- and pathogenicity-related gene sequence analysis. Plant Pathol., 70: 1640-1650. doi: 10.1111/ppa.13401
, (2024) LAMP-based detection of Monilinia fructigena, Monilinia polystroma and Monilinia fructicola in latently infected apple fruit. Plant Pathology 73: 355–365. doi: 10.1111/ppa.13820
Ritchie DF (2000) Brown rot of stone fruits. The Plant Health Instructor. doi: 10.1094/PHI-I-2000-1025-01
Updated 2005.
, , , Influence of light on the Monilinia laxa–stone fruit interaction. Plant Pathology 70: 326–335. doi: 10.1111/ppa.13294
Rossini MN, Giayetto AL, Pagella E (2012) Monilinia fructicola: un problema en la exportación de frutas de carozo argentinas. INTA Revista Fruticultura & Diversificación Nº 54. EEA Alto Valle. Link
Rozwalka LC, Thomazi-Kleina H, Zeviani WM, et al. (2023) Physicochemical properties of peach fruit assessed by non-destructive methodology related to the development of Monilinia fructicola during postharvest. The Journal of Horticultural Science and Biotechnology. doi: 10.1080/14620316.2023.2216227
Rungjindamai N, Jeffries P, Xu X (2025) Efficacy of biopesticides and fungicides against brown rot on cherry (Prunus avium) and plum (Prunus domestica). Biocontrol Science and Technology, 1–21. doi: 10.1080/09583157.2025.2473729
Shin JS, Park HS, Lee KW, et al. (2023) Advances in the Strategic Approaches of Pre- and Post-Harvest Treatment Technologies for Peach Fruits (Prunus persica). Horticulturae 9(3): 315. doi: 10.3390/horticulturae9030315
Snowden AL (1990) Post-Harvest Diseases and Disorders of Fruits and Vegetables: Volume 1: General Introduction and Fruits. CRC Press. 320 p.
Van Leeuwen GCM, Baa Yen RP, Holb IJ, Jeger MJ (2002) Distinction of the Asiatic brown rot fungus Monilia polystroma sp. nov. from M. fructigena. Mycological Research 106(4): 444-451. doi: 10.1017/S0953756202005695
Vilanova L, Valero-Jiménez CA, van Kan JAL (2021) Deciphering the Monilinia fructicola Genome to Discover Effector Genes Possibly Involved in Virulence. Genes 12(4): 568. doi: 10.3390/genes12040568
Villarino M, Melgarejo P, De Cal A (2016) Growth and aggressiveness factors affecting Monilinia spp. survival peaches. International Journal of Food Microbiology 227: 6-12. doi: 10.1016/j.ijfoodmicro.2016.01.023
Zhu X-Q, Niu C-W, Chen X-Y, Guo L-Y (2016) Monilinia species associated with brown rot of cultivated apple and pear fruit in China. Plant Disease 100: 2240-2250. doi: 10.1094/PDIS-03-16-0325-RE
Asiatic brown fruit rot – Monilia polystroma. U.S. Department of Agriculture, Agricultural Research Service
Systematic Mycology and Microbiology Laboratory – Invasive Fungi Fact Sheets