.
Condición fitosanitaria: Presente ampliamente distribuida
Grupo de cultivos: Frutales
Subgrupo: Cítricos
Especie hospedante: Mandarina (Citrus nobilis) y Naranjo (Citrus sinensis)
Rango de hospedantes: E. fawcettii causa sarna de los cítricos en varias especies e híbridos de la familia Rutaceae en todo el mundo, mientras que E. australis causa sarna principalmente en naranjo dulce y algunas mandarinas, y tiene una distribución geográfica limitada.
Etiología: Hongo. Necrotrófico
Agente causal:
Elsinoë fawcettii Bitancourt & Jenkins [as ‘fawcetti’] (1936) (anamorph: Sphaceloma fawcettii),
Elsinoë australis Bitanc. & Jenkins, 1936 (anamorph: Sphaceloma australis)
Elsinoë citricola Fan, R.W. Barreto & Crous, 2017
.
Taxonomía: Fungi > Dikarya > Ascomycota > Pezizomycotina > Dothideomycetes > Myriangiales > Elsinoaceae > Elsinoe
.
La fase sexual de E. fawcettii y E. australis solo ha sido descrita en Brasil y hasta el momento no ha sido reportada en otros lugares.
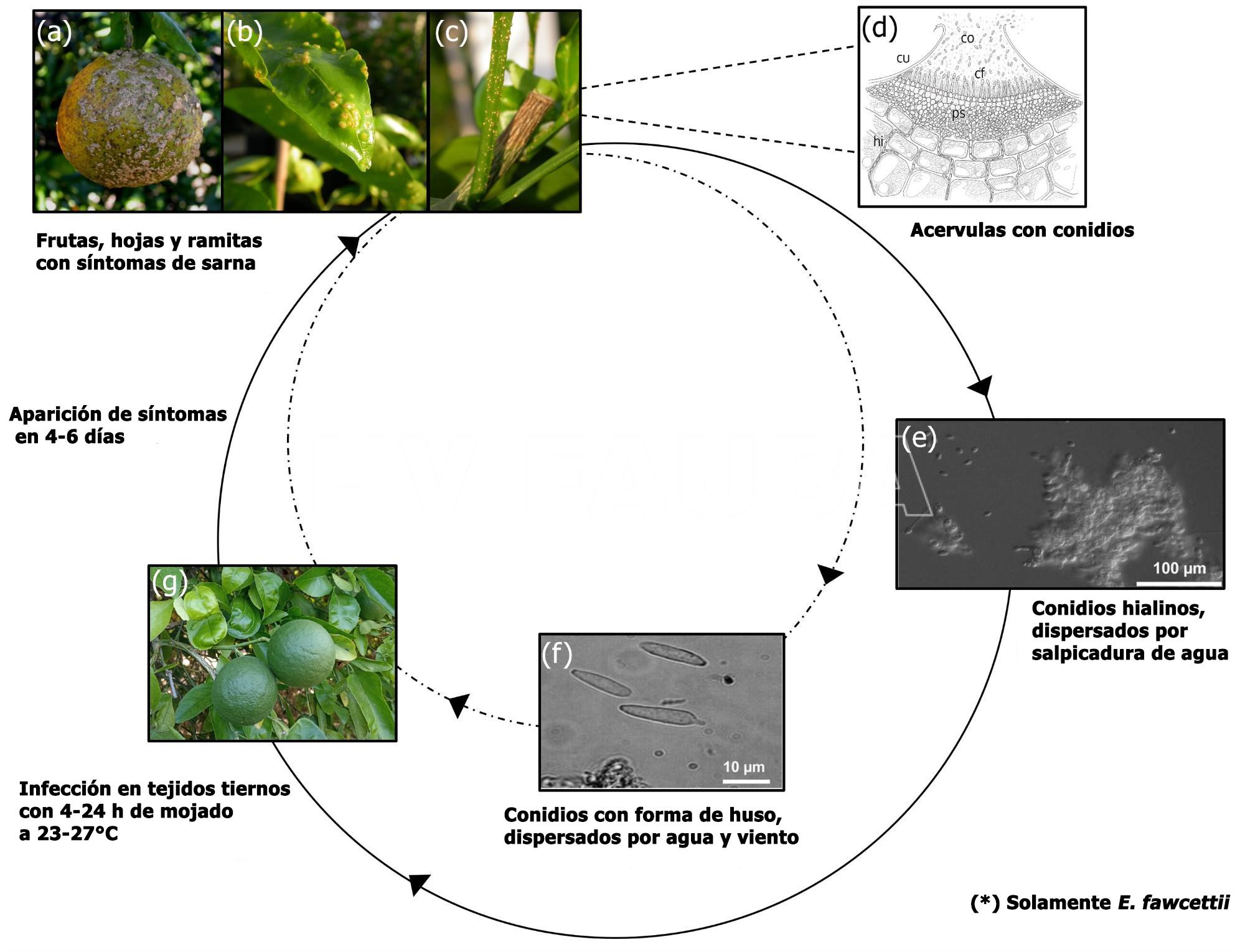
E. fawcettii se reproduce asexualmente a través de conidios en acérvulas en las pústulas de la sarna presentes en frutos, hojas y ramitas infectadas. Los conidios hialinos elípticos se producen cuando se forma una capa de agua (mojado) sobre las lesiones costrosas con acérvulas. E. fawcettii también se multiplica a través de conidios coloreados en forma de huso, que se producen en lesiones en condiciones de alta humedad relativa (>95%) (Whiteside, 1975; Timmer, 1999, 2000).
.
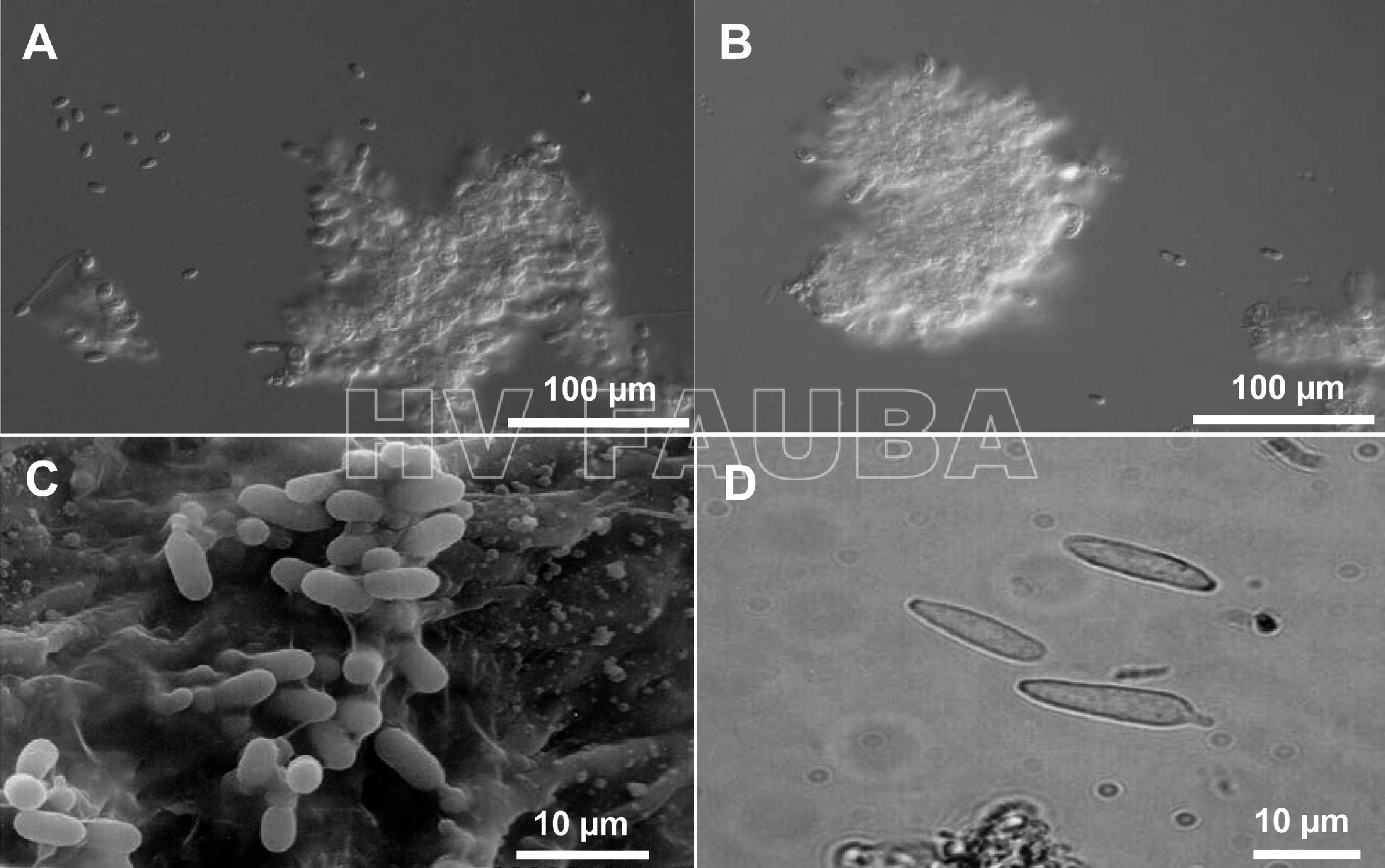
- Conidios de Elsinoe spp. (A, B) conidios hialinos de E. fawcettii y E. australis producidos en agua, respectivamente. (C) conidios hialinos en una lesión foliar de E. fawcettii observada al microscopio electrónico de barrido. (D) conidios fusiformes de E. fawcettii producidos sobre una lesión foliar. Autor: Hyun et al., 2015.
- Elsinoe citricola (a – d) Síntomas de sarna en Citrus limon; (e) Conidióforos; (f) Conidios; (g) Colonia en MEA después de 3 semanas. Barras de escala: C = 2 cm, D = 1 mm, E – F = 10 μm. Autor: Fan et al., 2017.
.
.
Antecedentes
Se encuentra presente en todas las zonas citrícolas húmedas del mundo; esta enfermedad afecta hojas y frutos de muchos tipos de mandarinos y limoneros, entre otras especies.
.
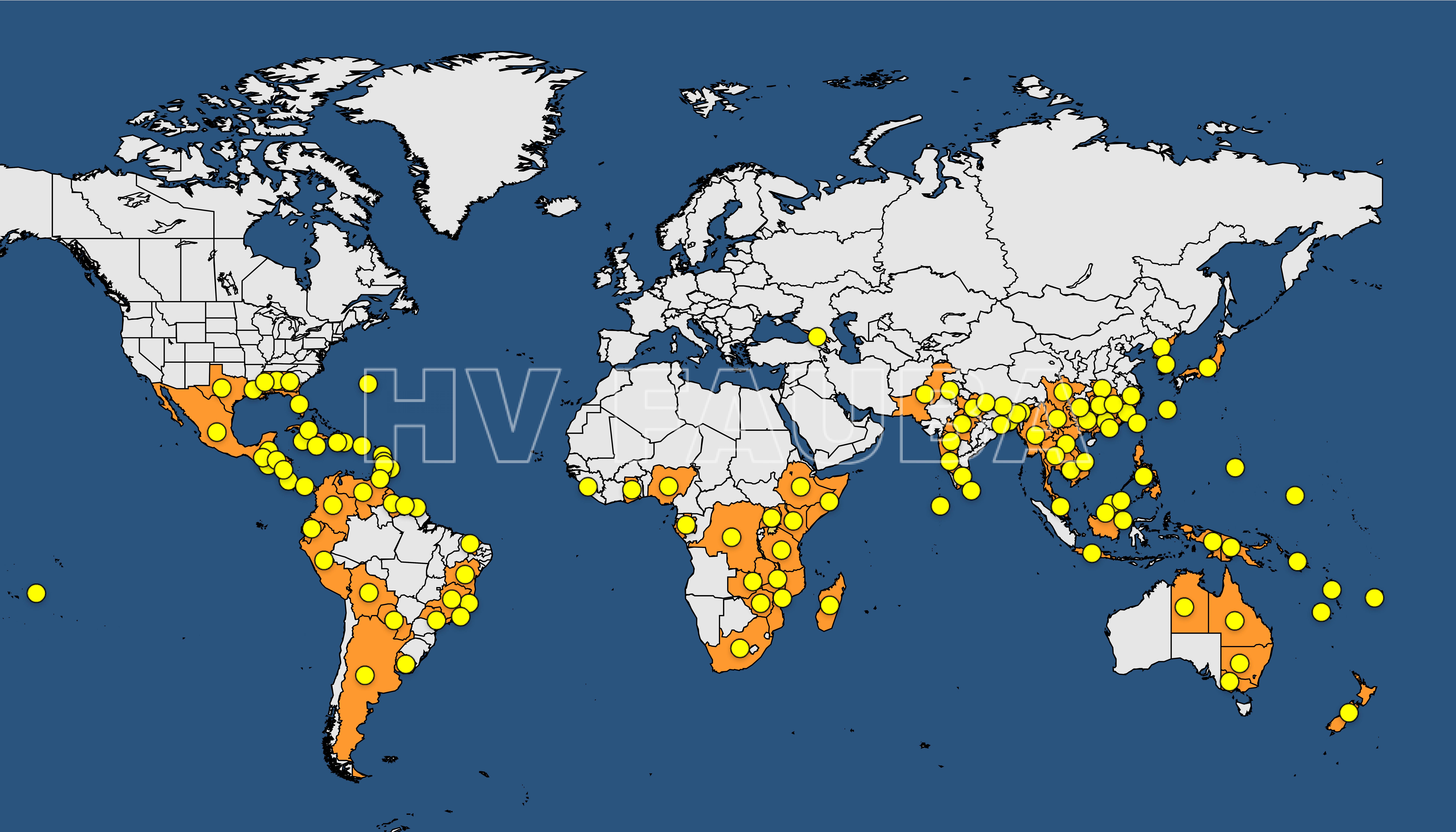
- Distribución mundial de Elsinoë fawcettii . Fuente: https://gd.eppo.int/taxon/ELSIFA/distribution
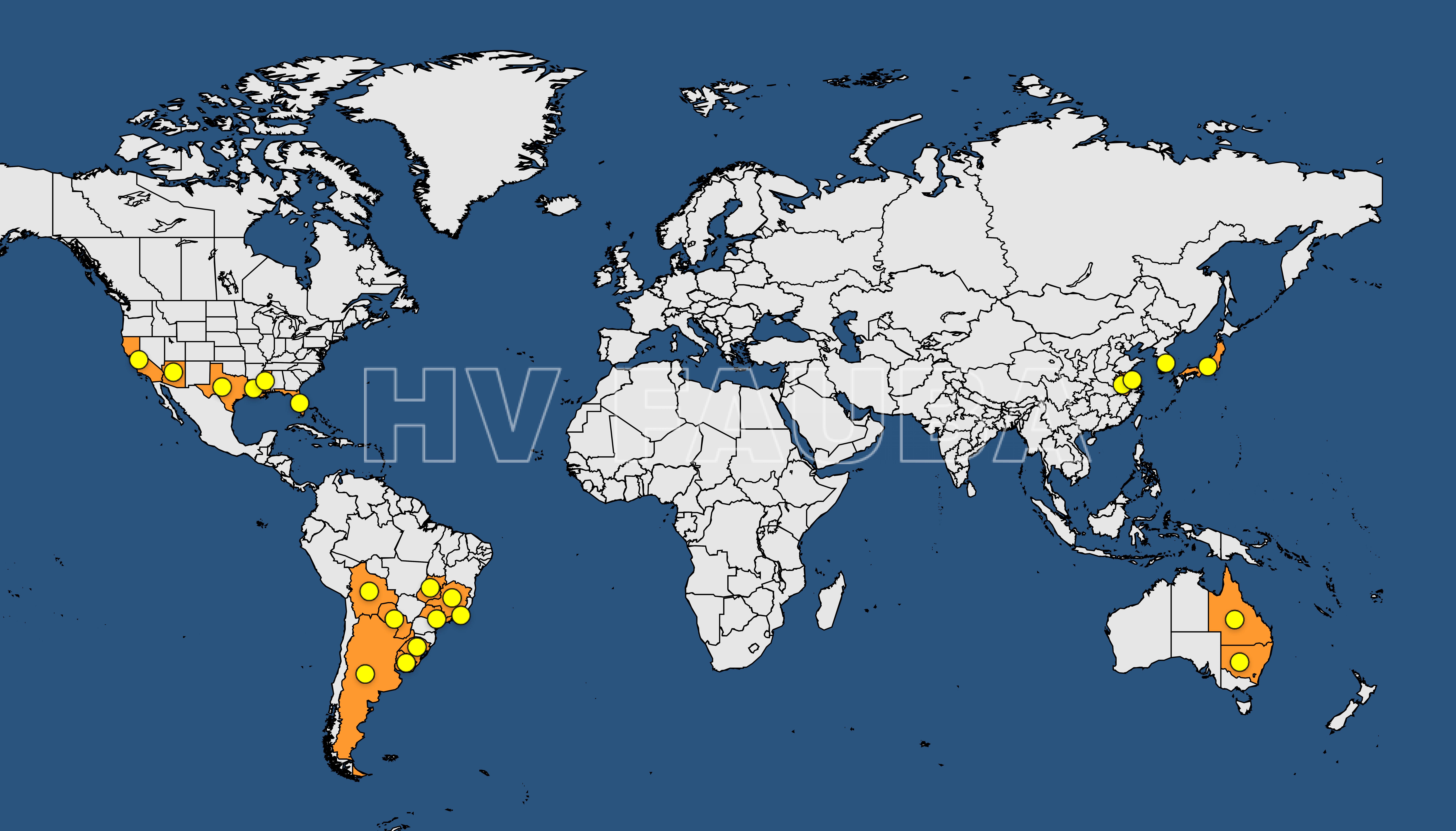
- Distribución mundial de Elsinoë australis . Fuente: https://gd.eppo.int/taxon/ELSIAU/distribution
.
Sintomatología
Los tejidos de cítricos infectados con Elsinoë generalmente presentan pústulas formadas por una costra o sarna erumpente con apariencia verrugosa. La enfermedad afecta principalmente hojas y frutos tiernos. La primera infección se observa como una lesión rosado claro que crece produciendo una protuberancia rugosa de color grisáceo. Los síntomas foliares varían de acuerdo a la especie; en pomelo, la lesión en hojas es muy prominente y de forma cónica (con una punta aguda en el haz que se corresponde con un hueco en el envés). En frutos las lesiones (pústulas o excrecencias) sobresalen cuando los frutos son pequeños pero quedan totalmente achatadas cuando los frutos maduran.
.
- Sìntomas causados por E. fawcettii en Citrus spp. Autor: Paul Fourie, South Africa (publicado en Fan et al., 2017).
.
Histopatología
Ambas especies, Elsinoë fawcettii y E. australis, producen toxinas que son pigmentos rojos o anaranjados, llamados elsinocromos (elsinochrome). El elsinocromo es una fitotoxina no selectiva del hospedante y es necesaria para la virulencia fúngica completa y la formación de lesiones. Esta toxina se agrupa junto con muchas fitotoxinas de origen fúngico que contienen perilenquinona, como compuestos fotosensibilizantes que pueden absorber energía luminosa, reaccionar con moléculas de oxígeno y producir especies reactivas de oxígeno, como superóxido y oxígeno singlete. Se ha documentado que el elsinocromo causa peroxidación de las membranas celulares e induce una rápida fuga de electrolitos de los tejidos cítricos. La biosíntesis de elsinocromo y la conidiación están reguladas de manera coordinada en E. fawcettii, y se han comenzado a dilucidar los inductores ambientales y fisiológicos comúnmente involucrados en ambos procesos (Chung, 2010).
.
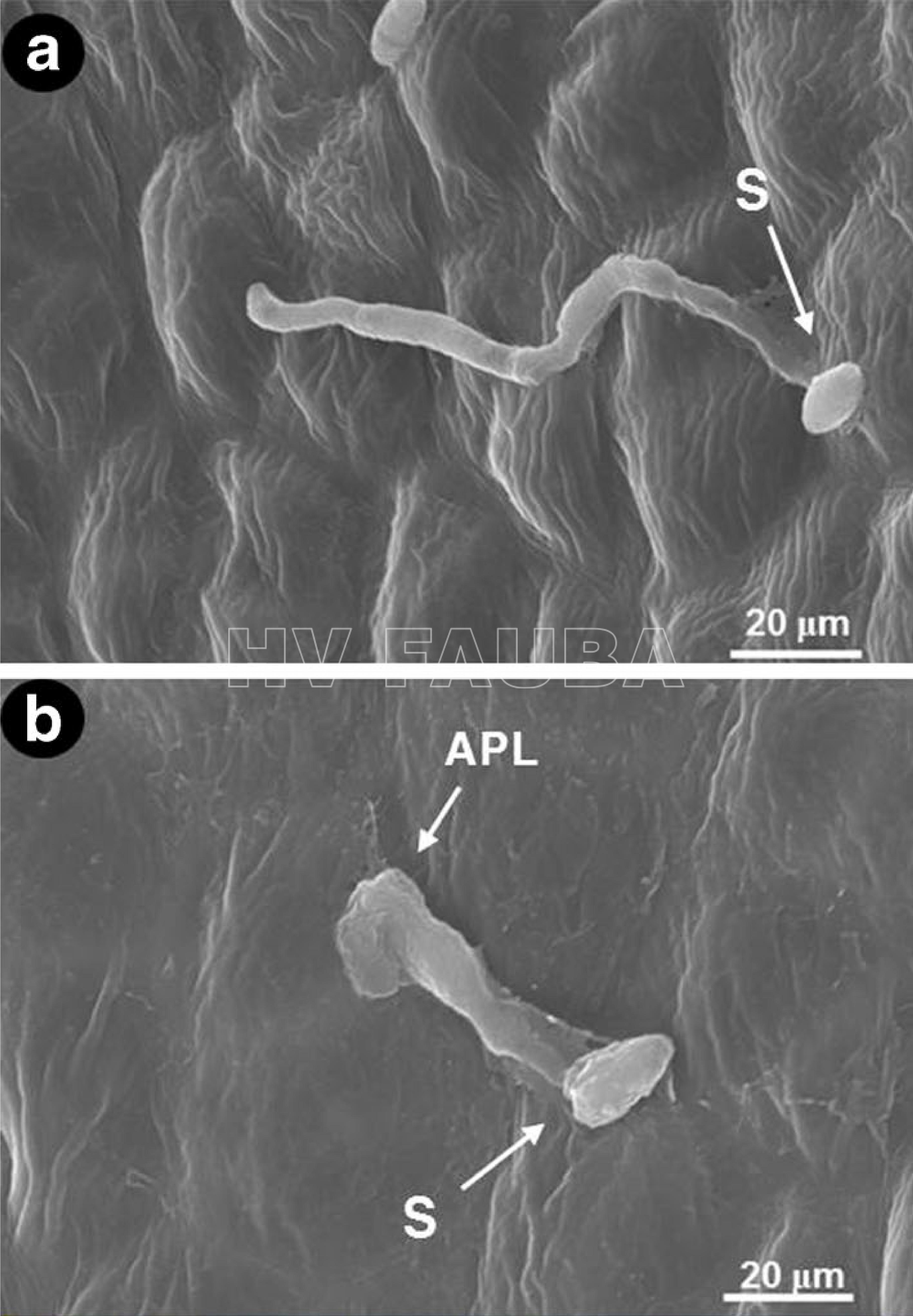
- Extensión del tubo germinativo y modificación de conidios en germinación de Elsinoë fawcettii en la superficie de una hoja de mandarina satsuma. (a) Tubo germinativo extendido observado bajo microscopio electrónico de barrido (SEM). (b) Estructura similar a un apresorio (APL) formada en la punta del tubo germinal, bajo SEM. [S: espora (conidio), APL: estructura similar a un apresorio]. Autor: Paudyal et al., 2017.
.
Ciclo de la enfermedad y epidemiología
El patógeno sobrevive dentro de las lesiones de la sarna (Timmer, 2000). E. australis y E. fawcettii se reproducen asexualmente a través de conidios en acérvulas en las lesiones de la sarna presentes en frutos, hojas y ramitas infectadas. La liberación y dispersión de los conidios hialinos elípticos se produce a través de salpicaduras de lluvia. Este tipo de conidios es muy sensible a la deshidratación y en condiciones secas pierde rápidamente su capacidad infectiva. Las conidias fusiformes y coloreadas de E. fawcettii pueden dispersarse por las salpicaduras de lluvia o por el viento, aunque en este último caso solo en distancias relativamente cortas. Este tipo de conidio es más tolerante a condiciones secas y puede sobrevivir por lo menos un día en ausencia de agua (Whiteside, 1975; Timmer, 1999, 2000).
Las temperaturas óptimas para la infección por E. fawcettii están entre 23 y 27°C; también requiere la presencia de una capa de agua en la superficie de la planta durante 4 a 24 horas (mojado), dependiendo de la temperatura (Agostini et al., 2003). En estas condiciones, las conidias forman un tubo germinativo que penetra en los tejidos epidérmicos. La infección se produce en los tejidos tiernos de las plantas. Los cítricos se consideran susceptibles durante dos meses después de la caída de los pétalos, mientras que las hojas se vuelven resistentes cuando alcanzan la mitad de su tamaño final (Timmer, 2000).
En el caso de los frutos, la planta reacciona a la infección formando una periderma alrededor de los tejidos afectados, segregando suberina para aislar la zona dañada, impidiendo que el hongo penetre en el albedo. Las lesiones de la costra son, de hecho, una mezcla de suberina y tejidos vegetales infectados (Kim et al., 2004). El período de incubación, entre la infección y la aparición de los síntomas, puede durar de 4 a 6 días (Timmer, 1999). Los síntomas aparecen entre 4-7 días después de la infección con temperaturas óptimas de 22-30ºC. Los períodos breves de lluvia y el riego por aspersión favorecen la infección, que se ve acrecentada por la presencia de brotes jóvenes. Las hojas se vuelven más resistentes cuando están totalmente expandidas. Para que los frutos sean resistentes deben alcanzar un tamaño de 3 cm de diámetro, es decir, a los 6-8 semanas después de la caída de los pétalos (Timmer, 2000). La cutícula, las células epidérmicas y el tejido del mesófilo se degradan entre 1 y 2 días después de la inoculación, se produce la colonización de hifas y entre 3 y 4 días son visibles los síntomas (Chung 2011; Paudyal y Hyun, 2015).
.
- Ciclo de la sarna de los círicos, causada por Elsinoë fawcettii y E. australis
.
- 04 Síntomas de sarna causada por Elsinoë spp en limón.
- Autor: Dra. Verónica Felipe
- Autor: Dra. Verónica Felipe
- Autor: Dra. Verónica Felipe
- Autor: Dra. Verónica Felipe
- Autor: Dra. Verónica Felipe
.
Manejo de la enfermedad
* Eliminar todos los órganos afectados (poda).
* Pulverizaciones con fungicidas usando productos sistémicos, solos o en mezclas con productos de contacto, como cobre, carbamatos. Se reportó un control de sarna satisfactorio con aplicaciones de estrobilurinas + carboxamida en la primera aplicación y ziram en la segunda (Mika R, XXXIX Jornada Citrícola Nacional 2020).
.
.
- Síntomas de sarna en mandarina Satsuma ‘Okitsu’
- Síntomas de sarna en mandarina Satsuma ‘Okitsu’
- Síntomas de sarna en mandarina Satsuma ‘Okitsu’
- Síntomas de sarna en mandarina Satsuma ‘Okitsu’
- 01 Síntomas de sarna causada por Elsinoë spp en limón.
- 02 Síntomas de sarna causada por Elsinoë spp en limón.
- 03 Síntomas de sarna causada por Elsinoë spp en limón.
- 05 Síntomas de sarna causada por Elsinoë spp en limón.
- 04 Síntomas de sarna causada por Elsinoë spp en limón.
- Autor: Claudio Baron
.—-
.——————————
Bibliografía
Elsinoë fawcetti. Sistema Nacional Argentino de Vigilancia y Monitoreo de plagas
Acuña LE, Kornowski MV, Agostini JP, et al. (2011) Control de sarna de los cítricos en mandarina Okitsu. 2º Congreso Argentino de Fitopatología. Libro de resúmenes. p. 72.
Ahmed, Y., Hussein, A., Hubert, J. et al. (2020) New multiplex conventional PCR and quadruplex real-time PCR assays for one-tube detection of Phyllosticta citricarpa, Elsinoë fawcettii, Elsinoë australis, and Pseudocercospora angolensis in Citrus: development and validation. Appl Microbiol Biotechnol 104: 9363–9385. doi: 10.1007/s00253-020-10880-w
Agostini JP, Bushong PM, Bhatia A, Timmer LW (2003) Influence of environmental factors on severity of citrus scab and melanose. Plant Disease 87: 1102–1106.
Chung KR (2011) Elsinoë fawcettii and Elsinoë australis: the fungal pathogens causing citrus scab. Mol Plant Pathol. 12(2): 123-35. doi: 10.1111/j.1364-3703.2010.00663.x
Fan XL, Barreto RW, Groenewald JZ, et al. (2017) Phylogeny and taxonomy of the scab and spot anthracnose fungus Elsinoë (Myriangiales, Dothideomycetes). Studies in Mycology 87: 1-41. doi: 10.1016/j.simyco.2017.02.001
Hou X, Huang F, Zhang TY, et al. (2014) Pathotypes and Genetic Diversity of Chinese Collections of Elsinoë fawcettii Causing Citrus Scab. Journal of Integrative Agriculture 13: 1293-1302. doi: 10.1016/S2095-3119(13)60522-5
Hyun JW, Timmer LW, Lee SC, Yun SH, Ko SW, Kim KS (2001) Pathological Characterization and Molecular Analysis of Elsinoe Isolates Causing Scab Diseases of Citrus in Jeju Island in Korea. Plant Disease 85(9): 1013-1017. doi: 10.1094/PDIS.2001.85.9.1013
Hyun JW, Paudyal DP, Hwang RY (2015) Improved Method to Increase Conidia Production from Isolates of Different Pathotypes of Citrus Scab Pathogen Elsinoe spp. Res. Plant Dis. 21(3): 231-234. doi: 10.5423/RPD.2015.21.3.231
Jeffress S, Arun-Chinnappa K, Stodart B, Vaghefi N, Tan YP, Ash G (2020) Genome mining of the citrus pathogen Elsinoë fawcettii; prediction and prioritisation of candidate effectors, cell wall degrading enzymes and secondary metabolite gene clusters. PLoS ONE 15(5): e0227396. doi: 10.1371/journal.pone.0227396
Jenkins AE (1931) Development of the citrus-scab organism. Journal of Agricultural Research 42: 545–559.
Jenkins AE (1933) A Sphaceloma attacking Navel orange from Brazil. Phytopathology 23: 538–545.
Kim KW, Hyun JW, Park EW (2004) Cytology of cork layer formation of citrus and limited growth of Elsinoe fawcettii in scab lesions. European Journal of Plant Pathology 110: 129–138.
Miles AK, Tan YP, Shivas RG, et al. (2015) Novel Pathotypes of Elsinoë australis Associated with Citrus australasica and Simmondsia chinensis in Australia. Trop. plant pathol. 40: 26–34. doi: 10.1007/s40858-015-0005-0
Paudyal DP, Hyun JW (2015) Physical Changes in Satsuma Mandarin Leaf after Infection of Elsinoë fawcettii Causing Citrus Scab Disease. The Plant Pathology Journal 31(4): 421-7. doi: 10.5423/PPJ.NT.05.2015.0086
Paudyal DP, Hyun J, Hwang R (2017) Infection and symptom development by citrus scab pathogen Elsinoë fawcettii on leaves of satsuma mandarin. European Journal of Plant Pathology 148: 807–816. doi: 10.1007/s10658-016-1136-y
Shanmugam G, Jeon J, Hyun JW (2020) Draft Genome Sequences of Elsinoë fawcettii and Elsinoë australis Causing Scab Diseases on Citrus. Mol Plant Microbe Interact. 33(2): 135-137. doi: 10.1094/MPMI-06-19-0169-A
Shin K, Paudyal DP, Lee SC, Hyun JW (2021) Different Phytohormonal Responses on Satsuma Mandarin (Citrus unshiu) Leaves Infected with Host-Compatible or Host-Incompatible Elsinoë fawcettii. Plant Pathol J. 37(3): 268-279. doi: 10.5423/PPJ.OA.12.2020.0224
Taylor EL, Gottwald TR, Adkins S (2023) Structural changes in Florida citrus production, 1980-2021 and associated consequences of weather events and disease. Journal of Citrus Pathology, 10. doi: 10.5070/
Timmer LW, Priest M, Broadbent P, Tan MK (1996) Morphological and pathological characterization of species of Elsinoë causing scab disease of citrus. Phytopathology 86: 1032–1038.
Timmer LW (1999) Diseases of fruit and foliage. In: Timmer, LW and Duncan LW (eds). Citrus Health Management. APS Press, St Paul, MN, pp. 107–115.
Timmer LW (2000) Scab diseases. In: Timmer LW, Garnsey SM and Graham JH (eds). Compendium of Citrus Diseases (2nd edition). APS Press, St Paul, MN, pp 31–32.
Trinh J, Li T, Franco JY, et al. (2022) Citrus relatives exhibit natural variation in perception and response magnitude to microbial features. bioRxiv 2022.07.15.500235; doi: 10.1101/2022.07.15.500235
Whiteside JO (1975) Biological characteristics of Elsinoë fawcettii pertaining to the epidemiology of sour orange scab. Phytopathology 65: 1170–1175.
Whiteside JO (1988) Factors contributing to the rare occurrence of scab of sweet orange in Florida. Plant Disease 72: 626–628.
Zhao L, Xiao H, Ma X, Cheng Q (2020) Elsinoë australis Causing Spot Anthracnose on Poplar in China. Plant Disease 104(8): 2202-2209. doi: 10.1094/PDIS-11-19-2349-RE