.
Condición fitosanitaria: presente
Grupo de cultivos: Industriales
Especie hospedante: Olivo (Olea europaea ssp. europaea L. )
Etiología: Hongo. Hemibiotrófico
Agente causal: Colletotrichum spp (Penz.) Penz. et Sacc.
Taxonomía: Fungi > Dikarya > Ascomycota > saccharomyceta > Pezizomycotina > leotiomyceta > sordariomyceta > Sordariomycetes > Hypocreomycetidae > Glomerellales > Glomerellaceae > Colletotrichum
.
La Antracnosis del olivo es la enfermedad más destructiva y ampliamente distribuida en muchas regiones de cultivo de olivo del mundo. Es causada por un complejo de especies fúngicas del género Colletotrichum spp., entre las que se incluyen: Colletotrichum acutatum sensu lato (s. lat.), C. boninense s. lat., y C. gloeosporioides s. lat. Además, C. karstii, una especie perteneciente al complejo C. boninense también se ha asociado con la enfermedad (Schena et al., 2014). Las especies de C. gloeosporioides s.l. rara vez se han asociado con brotes epidémicos, aunque algunas especies de este complejo han demostrado un alto nivel de virulencia en frutos inoculados artificialmente (Schena et al., 2014). En cualquier caso, las especies económicamente más relevantes pertenecen al complejo de C. acutatum s.l. Entre estos, C. godetiae syn. C. clavatum ha sido tradicionalmente considerado el patógeno causante de la antracnosis del olivo más prevalente en Italia y otros países del Mediterráneo central (Faedda et al., 2011; Cacciola et al., 2012; Talhinhas et al., 2011, 2015). En España, C. simmondsii es la especie dominante en Cataluña, mientras que C. godetiae parece prevalecer en Andalucía (Moral et al., 2014). En Portugal, la especie predominante es C. nymphaeae seguida de C. simmondsii y C. godetiae (Talhinhas et al., 2005, 2011, 2015). Otra especie importante, C. acutatum s.s. hasta hace unos años se había informado solamente en la región del Algarve en Portugal, y parecía ser la especie predominante en aceitunas en Australia y Sudáfrica (Talhinhas et al., 2005, 2011, 2015).
.
- Variabilidad en las colonias de aislados representativos de Colletotrichum pertenecientes a los siguientes complejos de especies: (a–l) Colletotrichum acutatum; (m,n) C. boninense; (o–t) C. gloeosporioides. Autor: Moral et al., 2021.
.
.
.
Importancia económica
La antracnosis de la olivo (Olea europaea ssp europaea L.), causada por un complejo de especies del hongo Colletotrichum spp, es considerada la enfermedad más importante del cultivo del olivo en todo el mundo, lo que resulta en grandes pérdidas económicas. Es una enfermedad grave que causa pudrición de la fruta y muerte regresiva de las ramas (branch dieback), cuyas epidemias dependen en gran medida de la susceptibilidad del cultivar y las condiciones ambientales.
.
Síntomas
Las drupas de olivo afectadas muestran necrosis oscura seguida de pudrición de la fruta y momificación. En condiciones húmedas, se producen abundantes masas de conidios anaranjadas en la superficie de las drupas infectadas, mientras que, bajo condiciones secas, las frutas se momifican y pierden peso debido a la deshidratación. Las frutas infectadas caen prematuramente al suelo y solo unas pocas momias permanecen unidas al árbol. La enfermedad suele ser grave en las frutas maduras, pero las drupas verdes de los cultivares susceptibles también pueden infectarse en condiciones favorables. La calidad del aceite de las drupas infectadas está muy comprometida debido a un color rojizo, alta acidez y una importante reducción de polifenoles, α-tocoferol y β-sitosterol (Moral et al., 2014, 2017). Las especies de Colletotrichum spp. también pueden infectar otros órganos de la aceituna, incluyendo hojas, pedúnculos de frutas y flores, pero la relevancia económica de estas infecciones se considera de importancia secundaria (Cacciola et al., 2012).
.
- Síntomas típicos de la antracnosis del olivo. (a) Progresión de la enfermedad en frutos de olivo infectados naturalmente (I: síntomas incipientes; II: lesiones deprimidas, redondas y de color marrón ocre; III: frutos podridos con masas anaranjadas de conidios producidas por Colletotrichum spp.); (b) detalle de masas de conidios anaranjadas (flechas rojas) en frutos de olivo infectados; (c, d) frutos momificados que permanecen en la copa del árbol causando el tizón de las flores y las hojas; (e, f) muerte regresiva de brotes y ramas causada por Colletotrichum spp. en olivos. Autor: Moral et al., 2021.
.
La infección de la aceituna se produce en todas las etapas de su desarrollo, desde la emergencia de las yemas florales hasta la maduración (Moral et al., 2009). Estas infecciones ocurren principalmente por conidios salpicados por el agua. Además, el ciclo de la antracnosis puede estar influenciado por la actividad de la mosca del olivo (B. oleae), que puede aumentar la susceptibilidad de la fruta al causar heridas o actuar directamente como un portador de esporas (Malacrinò et al., 2015). La madurez del fruto aumenta la susceptibilidad de la fruta a la antracnosis (Moral et al., 2008), y la fruta no desarrollada (o en desarrollo) es muy resistente al patógeno, independientemente del cultivar (Moral et al., 2008; Cacciola et al., 2012; y Trapero, 2012).
.
- 01 Frutos de olivo con síntomas y signos de Antracnosis. Autor: Ing. Mónica Roca.
- 02 Frutos de olivo con síntomas y signos de Antracnosis. Autor: Ing. Mónica Roca.
- 03 Frutos de olivo con síntomas y signos de Antracnosis. Autor: Ing. Mónica Roca.
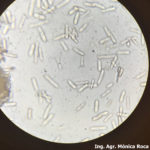
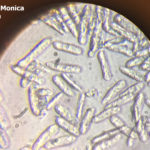
- 04 Conidios de Colletotrichum spp, aislados de olivo. Autor: Ing. Mónica Roca.
- 05 Conidios de Colletotrichum spp, aislados de olivo. Autor: Ing. Mónica Roca.
.
.
.
Manejo Integrado
El manejo de la antracnosis de aceituna generalmente se basa en enfoques de Manejo Integrado de Enfermedades (MIE), que incluyen tratamientos químicos, selección de cultivares resistentes y cosecha temprana para escapar de infecciones secundarias (Cacciola et al., 2012). El control de los ataques de la mosca del olivo también puede ser útil para reducir la enfermedad ya que la mosca puede actuar como vector y facilitar la infección a través de heridas de oviposición (Malacrinò et al., 2015; 2017). En las zonas de cultivo de olivos donde la antracnosis es endémica, las lluvias frecuentes en el otoño y la alta humedad pueden reducir la persistencia de los tratamientos con fungicidas. Por lo tanto, se necesitan varios tratamientos fungicidas para controlar la enfermedad. Además, la necesidad de evitar los residuos de fungicidas en el aceite de oliva y cumplir con la regulación sobre los intervalos de los fungicidas antes de la cosecha (período de carencia) puede dejar a las drupas desprotegidas en una etapa de desarrollo de elevada susceptibilidad y en una época en que las condiciones ambientales son propicias para la enfermedad. En Calabria, Italia, por ejemplo, dos o tres tratamientos preventivos desde finales de septiembre hasta finales de diciembre con formulados de cobre se consideran bastante efectivos contra la enfermedad, mientras que condiciones de alta humedad pueden reducir significativamente la eficacia de los tratamientos (Agosteo et al., 2007). En Australia, los fungicidas a base de cobre y las estrobilurinas aplicados en condiciones de campo no lograron controlar la enfermedad de la antracnosis, independientemente del momento de la aplicación (Sergeeva, 2011). Recientemente, dos formulaciones comerciales que contienen trifloxistrobin + tebuconazol y piraclostrobin se han registrado en Italia en aceituna solo para su aplicación durante la primavera y el comienzo del verano, respectivamente.
La resistencia del cultivar se evalúa inoculando fruta de color verde amarillento con una suspensión de esporas del patógeno (Moral et al., 2008; Talhinhas et al., 2015). En cualquier caso, el uso de esta escala de calificación en condiciones de campo para evaluar la reacción del cultivar al patógeno proporciona un ahorro económico importante (> 20 veces) con respecto al método de inoculación artificial (Moral, 2009). Sin embargo, la evaluación correcta de los cultivares de olivo bajo condiciones de campo solo puede realizarse durante temporadas epidémicas (Moral y Trapero, 2009).
.
.
Bibliografía
Agosteo GE, Scolaro L, Previtera G (2007) Non-conventional chemical control of olive anthracnose. IOBC/WPRS Bull. 30: 245-248.
Agosteo GE, Sanzani SM, Carmela M, et al. (2015) Olive leachates affect germination of Colletotrichum godetiae conidia and the development of appressoria. Phytopathologia Mediterranea 54: 35-44. doi: 10.14601/Phytopathol_Mediterr-14302
, , , et al. (2022) Genome evolution and transcriptome plasticity associated with adaptation to monocot and eudicot plants in Colletotrichum fungi. bioRxiv 2022.09.22.508453; doi: 10.1101/2022.09.22.508453
Cacciola SO, Faedda R, Sinatra F, et al. (2012) Olive anthracnose. Journal of Plant Pathology 94: 29–44.
Faedda R, Agosteo GE, Schena L, et al. (2011) Colletotrichum clavatum sp. nov. identified as the causal agent of olive Anthracnose in Italy. Phytopathologia Mediterranea 50: 283–302. doi: 10.14601/Phytopathol_Mediterr-9547
, (2023) Appressorium formation is regulated by the Msb2– and Sho1-dependent hierarchical transcriptional network in Colletotrichum gloeosporioides. Plant Pathology 00: 1–15. doi: 10.1111/ppa.13822
Malacrinò A, Schena L, Campolo O, et al. (2015) Molecular analysis of the fungal microbiome associated with the olive fruit fly Bactrocera oleae. Fungal Ecology 18: 67–74. doi: 10.1016/j.funeco.2015.08.006
Malacrinò A, Schena L, Campolo O, et al. (2017) A metabarcoding survey on the fungal microbiota associated to the olive fruit fly. Microbial Ecology 73: 677-684. doi: 10.1007/s00248-016-0864-z
Moral J, Bouhmidi K, Trapero A (2008) Influence of fruit maturity, cultivar susceptibilitity, and inoculation method on infection of olive fruit by Colletotrichum acutatum. Plant Disease 92: 1421–1426. doi: 10.1094/PDIS-92-10-1421
Moral J (2009) Etiología, Epidemiología, y Resistencia Varietal en la Antracnosis del olivo Causada por Colletotrichum spp. Ph.D. Thesis, Universidad de Córdoba, Córdoba.
Moral J, Oliveira R, Trapero A (2009) Elucidation of the disease cycle of olive anthracnose caused by Colletotrichum acutatum. Phytopathology 99: 548–556. doi: 10.1094/PHYTO-99-5-0548
Moral J, Trapero A (2009) Assessing the susceptibility of olive cultivars to anthracnose caused by Colletorichum acutatum. Plant Disease 93: 1028-1036. doi: 10.1094/PDIS-93-10-1028
Moral J, Xaviér C, Roca LF, et al. (2014) La Antracnosis del olivo y su efecto en la calidad del aceite. Grasas y Aceites 65: e028. doi: 10.3989/gya.110913
Moral J, Xaviér CJ, Viruega JR, et al. (2017) Variability in Susceptibility to Anthracnose in the World Collection of Olive Cultivars of Cordoba (Spain). Frontiers in Plant Science 8: 1892. doi: 10.3389/fpls.2017.01892
Moral J, Agustí-Brisach C, Raya MC, et al. (2021) Diversity of Colletotrichum Species Associated with Olive Anthracnose Worldwide. Journal of Fungi 7(9): 741. doi: 10.3390/jof7090741
O’Connell, et al. (2012) Lifestyle transitions in plant pathogenic Colletotrichum fungi deciphered by genome and transcriptome analyses. Nature Genetics. doi: 10.1038/ng.2372
Pangallo S, Li Destri Nicosia MG, Agosteo GE, et al. (2017) Evaluation of a Pomegranate Peel Extract as an Alternative Means to Control Olive Anthracnose. Phytopathology 107(12): 1462-1467. doi: 10.1094/PHYTO-04-17-0133-R
Pesce VM, Guerra C, Nally MC, et al. (2012) Biocontrol de Colletotrichum gloeosporioides, Agente Causal de la Antracnosis en Olivo, Mediante Levaduras, in Vitro. I Congreso de Ciencia y Tecnología Ambiental, Asociación Argentina de Tecnologia de Alimentos; 2012, Mar del Plata, 28 de Mayo-1 de Junio de 2012.
Reveglia P, Agudo-Jurado FJ, Barilli E, et al. (2023) Uncovering Phytotoxic Compounds Produced by Colletotrichum spp. Involved in Legume Diseases Using an OSMAC–Metabolomics Approach. Journal of Fungi. 9(6): 610. doi: 10.3390/jof9060610
Schena L, Mosca S, Cacciola SO, et al. (2014) Species of the Colletotrichum gloeosporioides and C. boninense complexes associated with olive anthracnose. Plant Pathology 63: 437–446. doi: 10.1111/ppa.12110
Schena L, Abdelfattah A, Mosca S, et al. (2017) Quantitative detection of Colletotrichum godetiae and C. acutatum sensu stricto in the phyllosphere and carposphere of olive during four phenological phases. European Journal of Plant Pathology 149: 337–347. doi: 10.1007/s10658-017-1185-x
Sergeeva V (2011) Anthracnose in olives: symptoms, disease cycle and management. In: Proc. of 4th 15 International Conference for Olive Tree and Olive Products (Olivebiotech); Crete, Greece October 31st – November 4th. Chartzoulakis K.S. Ed., Vol. I: 269-274.
Talhinhas P, Sreenivasaprasad S, Neves-Martins J, Oliveira H (2005) Molecular and phenotypic analyses reveal association of diverse Colletotrichum acutatum groups and a low level of C. gloeosporioides with olive anthracnose. Applied and Environmental Microbiology 71: 2987–2998. doi: 10.1128/AEM.71.6.2987-2998.2005
Talhinhas P, Mota-Capitao C, Martins S, et al. (2011) Epidemiology, histopathology and aetiology of olive anthracnose caused by Colletotrichum acutatum and C. gloeosporioides in Portugal. Plant Pathology 60: 483-495. doi: 10.1111/j.1365-3059.2010.02397.x
Talhinhas P, Gonçalves E, Sreenivasaprasad S, Oliveira H (2015) Virulence diversity of anthracnose pathogens (Colletotrichum acutatum and C. gloeosporioides species complexes) on eight olive cultivars commonly grown in Portugal. European Journal of Plant Pathology 142: 73–83. doi: 10.1007/s10658-014-0590-7
Talhinhas P, Baroncelli R (2021) Colletotrichum species and complexes: geographic distribution, host range and conservation status. Fungal Diversity 110: 109–198. doi: 10.1007/s13225-021-00491-9
Trapero A, López-Doncel L (2005) Resistencia y susceptibilidad al Repilo. In: Variedades de Olivo en España, eds L. Rallo, D. Barranco, J. M. Caballero, C. del Río, A. Martín, J. Tous, and I. Trujillo (Madrid: Junta de Andalucía and Mundi-Prensa), 323–328.