.
Condición fitosanitaria: Presente ampliamente distribuida
Grupo de cultivos: Hortícolas
Especie hospedante: Papa (Solanum tuberosum subsp. tuberosum)
Rango de hospedantes: no específico / amplio. Infecta muchos cultivos de importancia económica como el arroz, la soja, la papa, el maíz, la remolacha azucarera, el repollo, el tomate y la lechuga (Yang y Li, 2012). R. solani AG3 se ha aislado a partir de varias malezas como: Chenopodium album, Diplotaxis erucoides, Solanum nigrum, Sorghum halepense; y plantas silvestres como: Capsella bursa-pastoris; Cirisum arvense; Elytrichia repens; Fumaria officinalis; Matricaria recutita.
Epidemiología: monocíclica, subaguda.
Etiología: Hongo. Necrotrófico
Agente causal: Rhizoctonia solani J.G. Kühn 1858 ) [teleomorph Thanatephorus cucumeris (A. B. Frank) Donk]
Taxonomía: Fungi > Dikarya > Basidiomycota > Agaricomycotina > Agaricomycetes > Agaricomycetes incertae sedis > Cantharellales > Ceratobasidiaceae > Rhizoctonia
.
.
R. solani es un complejo de especies de varios grupos llamados grupos de anastomosis (AG), algunos de los cuales se subdividen en subgrupos adicionales (Ogoshi, 1987; Garcia et al., 2006). Las hifas de aislamientos pertenecientes al mismo AG pueden anastomosarse. En medicina humana, generalmente quiere decir una conexión creada entre estructuras tubulares, como los vasos sanguíneos o las asas del intestino. Por ejemplo, cuando se remueve quirúrgicamente parte de un intestino, los dos extremos restantes se cosen o se engrapan juntos (anastomosan). En micología, la anastomosis es la fusión entre ramas de la misma o diferentes hifas. Por tanto, las hifas fúngicas que se bifurcan pueden formar verdaderas redes reticulantes. Para los hongos, la anastomosis también es un componente de la reproducción. En algunos hongos, dos tipos de apareamiento haploides diferentes, si son compatibles, se fusionan. En total, se han descrito 13 AG diferentes de R. solani con sus subgrupos que difieren en características morfológicas y genéticas (Ajayi-Oyetunde OO, Bradley CA, 2018; Carling et al., 2002). Los miembros de los diferentes AG y los diversos subgrupos muestran un grado distinto en la especificidad del hospedante (Sharon et al., 2008; Wibberg et al., 2015). Las cepas AG-3 están especializadas en infectar Solanum tuberosum (Wibberg et al., 2017; Zrenner et al., 2020); y en numerosos trabajos de investigación Rhizoctonia solani AG3 resultó ser el AG predominante asociado con la papa (Campion et al., 2003; Woodhall et al., 2007; Lehtonen et al., 2008; Tsror, 2010; Fiers et al., 2011).
.
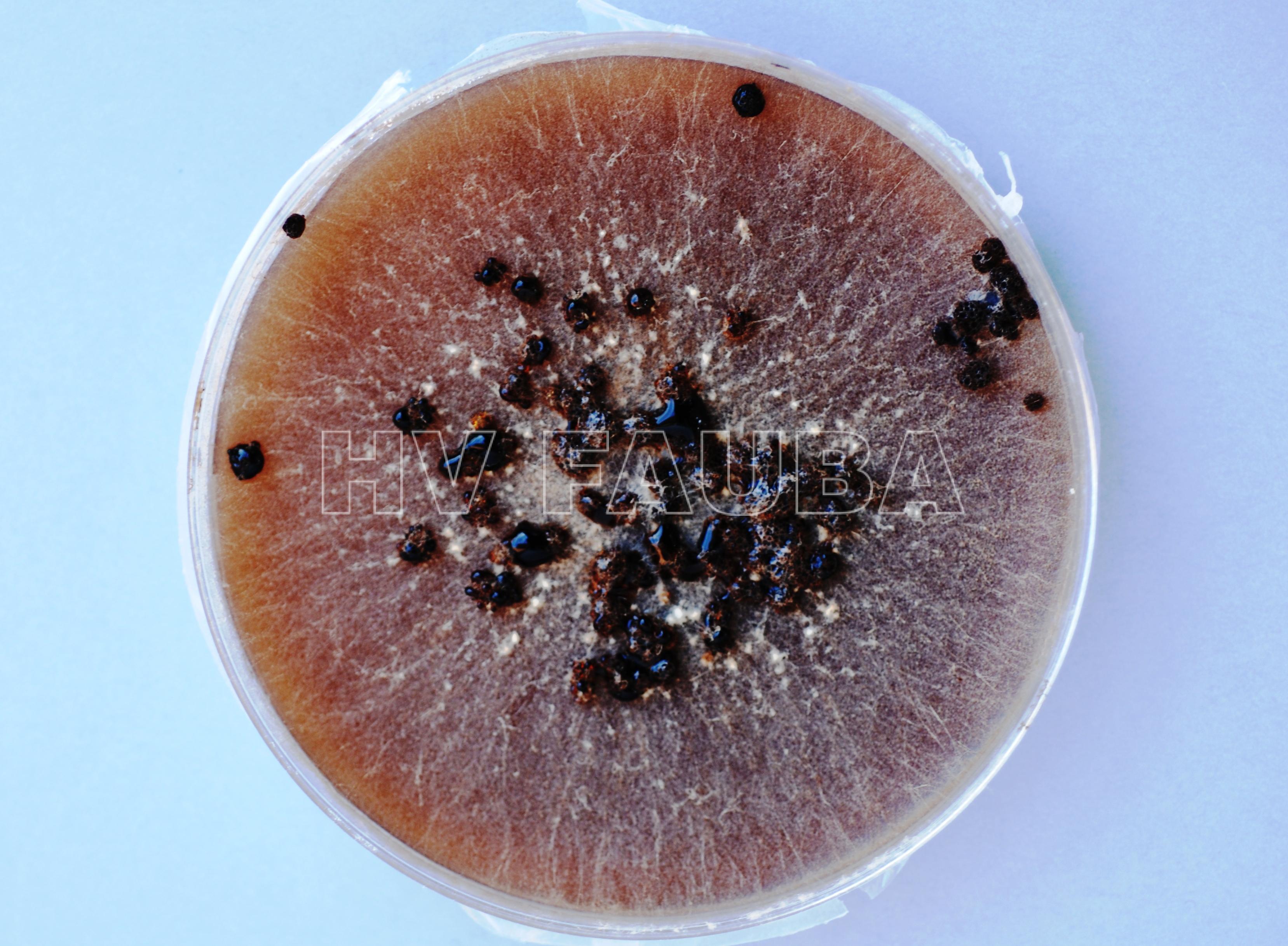
- Colonia de Rhizoctonia solani con esclerocios. Autor: Louisiana State University
- Colonia de Rhizoctonia solani con esclerocios. Autor: Louisiana State University
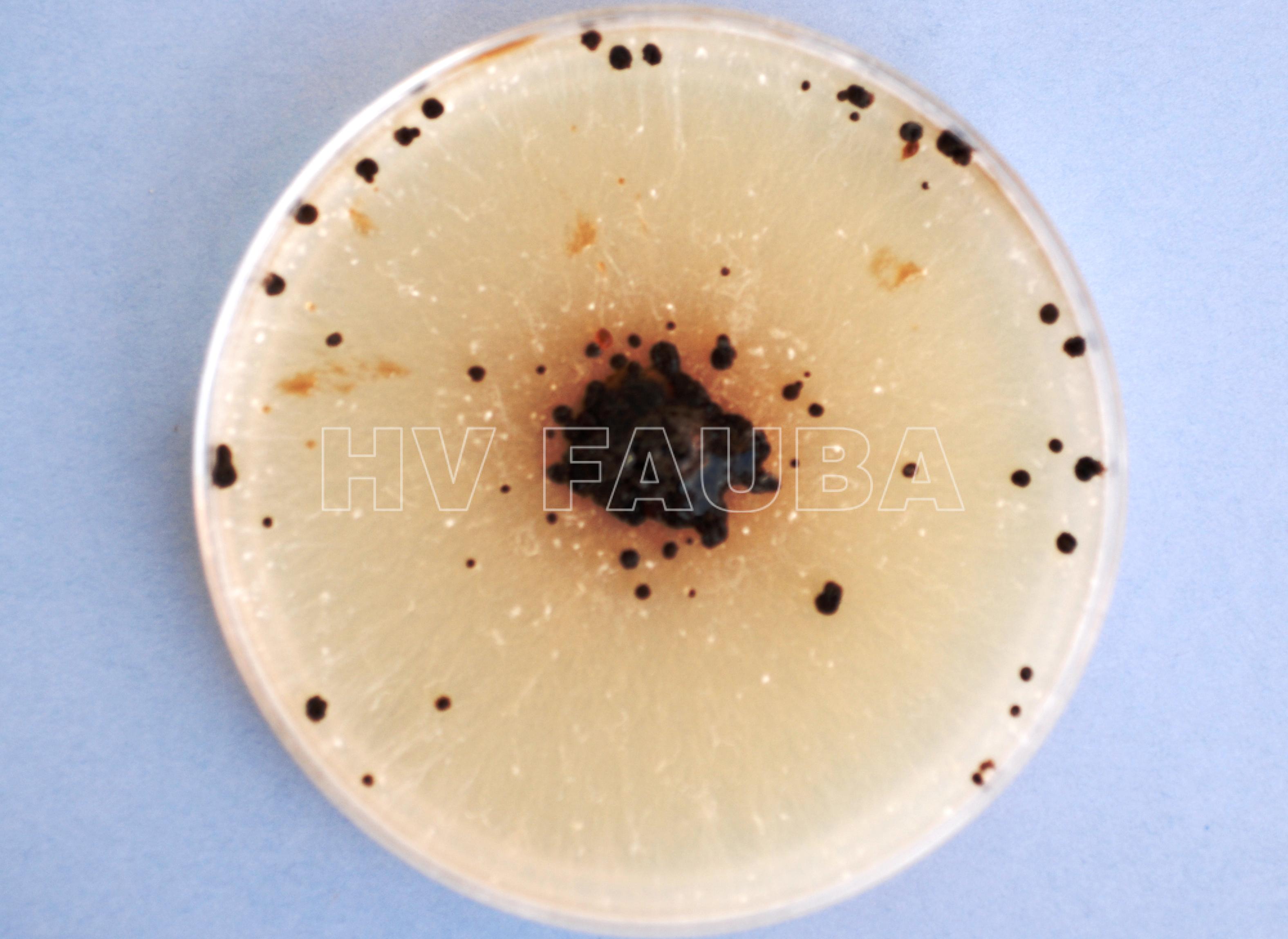
- Colonia de Rhizoctonia solani con esclerocios. Autor: Uppala y Zhou, 2018.
.
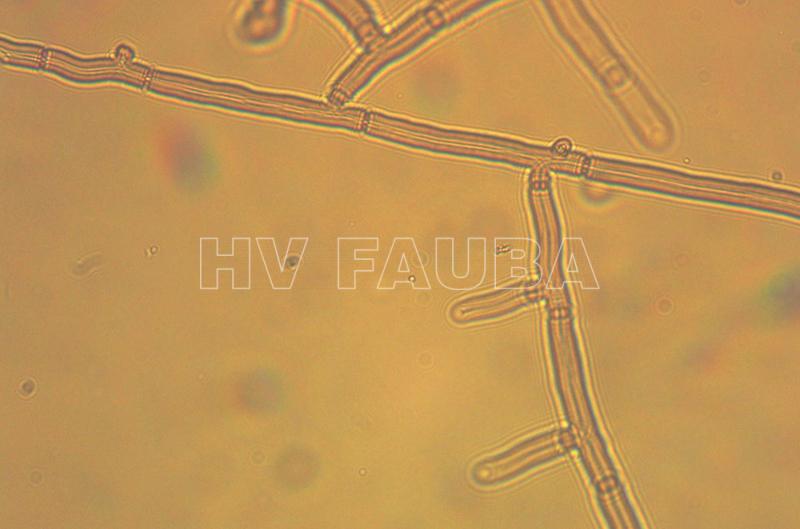
R. solani no produce esporas ni conidios asexuales. El hongo infecta las plantas mediante micelios vegetativos o esclerocios en germinación que producen hilos de hifas. El micelio es blanco cuando es joven pero se vuelve amarillento o marrón claro con la edad, produce células largas multinucleadas que crecen aproximadamente en ángulo recto con la hifa principal con una ligera constricción en la unión de la hifa principal y las ramas. Las células de la hifa están separadas por un tabique que contiene un poro que permite el movimiento de las mitocondrias, los núcleos y el citoplasma de una célula a otra.
.
- Hifas con angulo recto de Rhizoctonia solani. Autor: Uppala y Zhou, 2018.
.
.
.
Antecedentes
Esta enfermedad puede afectar desde la emergencia y durante el crecimiento del cultivo provocando la reducción del rendimiento a campo. La sarna negra reviste gran importancia cuando el tubérculo es utilizado como semilla. Las enfermedades de la papa causadas por R. solani ocurren en todas las áreas donde se cultivan las papas y afectan el rendimiento cualitativo y cuantitativo de los tubérculos de papa. Se han reportado pérdidas de rendimiento de tubérculos de alrededor del 30% (Banville, 1989).
.
Síntomas y signo
El síntoma característico de esta enfermedad es la formación de una costra negra debido a la presencia de esclerocios en la superficie del tubérculo. Se observan cancros marrones, negros en ramas, estolones y tallos que con el paso del tiempo y el avance de la enfermedad pueden provocar su estrangulamiento. Los síntomas de la parte aérea de la planta involucran la producción de tubérculos aéreos, amarillamientos y enrulamiento de las hojas. Se observa menor vigor en los brotes secundarios afectando la homogeneidad del lote. Si las infecciones de los estolones se producen al inicio del ciclo del cultivo, puede afectar directamente la formación y el crecimiento de los tubérculos observando deformaciones, protuberancias y sarna negra. El hongo sobrevive saprofíticamente en el suelo o sobre la superficie de los tubérculos. Los síntomas de esta enfermedad podrían ser confundidos con la presencia de tierra.
.
.
- Autor: Ing. Claudio Baron
- Autor: Bayer
- Autor: Syngenta
- Esclerocios de Rhizoctonia solani en papa colorada. Autor: Ed Sikora
.
.
Condiciones predisponentes
Suelos fríos con alta humedad, bajas temperaturas.
.
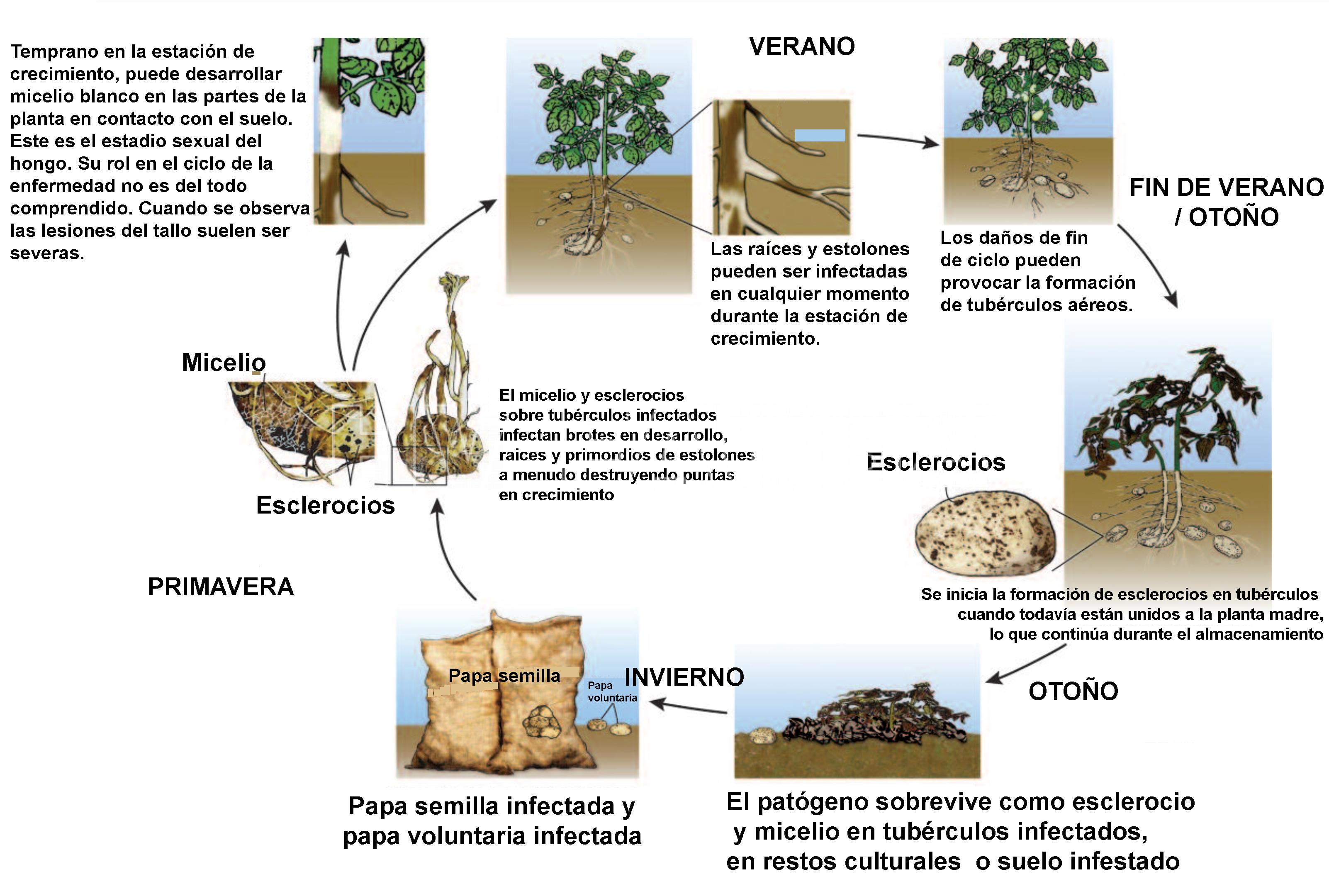
Ciclo de la enfermedad
Rhizoctonia sobrevive en el suelo en forma de esclerocio y micelio. El micelio es capaz de sobrevivir a partir de células vegetales muertas.
.
.
- Ciclo de la sarna negra de la papa, causada por Rhizoctonia solani. Autor: Phillip Wharton y Elisabeth Wood
.
.
Medidas de Prevención
Actualmente no es posible lograr el control completo de la enfermedad, pero mediante la combinación de distintas herramientas de manejo, se puede atenuar su intensidad. A pesar que las medidas de mayor importancia son las culturales, el control químico también debería formar parte del manejo integrado.
** Control cultural
* Uno de los puntos clave para minimizar la enfermedad es plantar papa semilla certificada libre de enfermedad, de calidad, sin esclerocios visibles y tratada con fungicidas sistémicos. En algunos casos, el inóculo en los tubérculos puede ser más importante que el inóculo en el suelo, como fuente de inóculo primario.
* Acelerar el tiempo de la emergencia (prebrotado) y del desarrollo de la planta, evitar iniciar el cultivo con baja temperatura y alta humedad en el suelo. Seguir prácticas que no retrasan la emergencia en la primavera minimiza el daño a los brotes y estolones y disminuye la posibilidad de infección. La siembra superficial de papa semilla en suelo cálido (por encima de 8 ° C) y el aporque gradual acelera el brote y el desarrollo y la emergencia del tallo y reduce el riesgo de cancro del tallo. Plantar primero los campos con suelos de textura gruesa porque es menos probable que se aneguen y se calienten más rápido.
* Rhizoctonia no compite excepcionalmente bien con otros microbios del suelo. El aumento de la tasa de descomposición de los residuos de cultivos disminuye la tasa de crecimiento de Rhizoctonia. La descomposición de residuos también libera dióxido de carbono, lo que reduce la capacidad competitiva del patógeno. El hongo no es un descomponedor de celulosa eficiente, por lo que las poblaciones del suelo se reducen en gran medida por la competencia de la microflora y se observan menos enfermedades.
* La papa debería cosecharse tan pronto como la piel esté madura, de manera de reducir la sarna y minimizar el daño. El porcentaje de tubérculos cubiertos de esclerocios aumenta a medida que aumenta el intervalo entre la madurez y la cosecha. No arrojar tubérculos infestados en futuros campos de papa, ya que pueden convertirse en fuentes de inóculo.
* Se recomiendan rotaciones largas (3 años o más) con gramíneas como avena o cebada, para reducir la densidad de inóculo en el suelo. Se deben evitar cultivos hospedantes en la rotación, como por ejemplo la remolacha.
.
** Control químico
* Tratamiento de papa semilla
* Aplicación de fungicida en la línea de siembra
.
** Control biológico
* Aplicación de Bacillus subtilis (Ben Khedher et al., 2015)
.
.
- Autor: Ing. Claudio Baron
.
Bibliografía
Ajayi-Oyetunde OO, Bradley CA (2018) Rhizoctonia solani: taxonomy, population biology and management of rhizoctonia seedling disease of soybean. Plant Pathol 67: 3-17. doi: 10.1111/ppa.12733
Al-Fadhal FA, AL-Abedy AN, Alkhafije DA (2019) Isolation and molecular identification of Rhizoctonia solani and Fusarium solani isolated from cucumber (Cucumis sativus L.) and their control feasibility by Pseudomonas fluorescens and Bacillus subtilis. Egypt J Biol Pest Control 29: 47. doi: 10.1186/s41938-019-0145-5
Alfiky A, L’Haridon F, Abou-Mansour E, Weisskopf L (2022) Disease inhibiting effect of strain Bacillus subtilis EG21 and its metabolites against potato pathogens Phytophthora infestans and Rhizoctonia solani. Phytopathology. doi: 10.1094/PHYTO-12-21-0530-R
Banville GJ (1989) Yield losses and damage to potato plants caused by Rhizoctonia solani Kuhn. Am. Potato J. 66: 821–834. doi: 10.1007/BF02853963
Ben Khedher S, Kilani-Feki O, Dammak M, et al. (2015) Efficacy of Bacillus subtilis V26 as a biological control agent against Rhizoctonia solani on potato. C R Biol. 338(12): 784-792. doi: 10.1016/j.crvi.2015.09.005
Campion C, Chatot C, Perraton B, et al. (2003) Anastomosis Groups, Pathogenicity and Sensitivity to Fungicides of Rhizoctonia solani Isolates Collected on Potato Crops in France. European Journal of Plant Pathology 109: 983–992. doi: 10.1023/B:EJPP.0000003829.83671.8f
Carling DE, Kuninaga S, Brainard KA (2002) Hyphal Anastomosis Reactions, rDNA-Internal Transcribed Spacer Sequences, and Virulence Levels Among Subsets of Rhizoctonia solani Anastomosis Group-2 (AG-2) and AG-BI. Phytopathology 92(1): 43-50. doi: 10.1094/PHYTO.2002.92.1.43
Ceresini PC, Shew DH, Vilgalys RJ, Cubeta MA (2002) Genetic diversity of Rhizoctonia solani AG-3 from potato and tobacco in North Carolina. Mycologia 94: 437-449. doi: 10.1080/15572536.2003.11833209
Fiers M, Edel-Hermann V, Héraud C, et al. (2011) Genetic diversity of Rhizoctonia solani associated with potato tubers in France. Mycologia 103: 1230–1244. doi: 10.3852/10-231
Fiers M, Edel-Hermann V, Chatot C, et al. (2012) Potato soil-borne diseases. A review. Agron. Sustain. Dev. 32: 93–132. doi: 10.1007/s13593-011-0035-z
Garcia VG, Onco MAP, Susan VR (2006) Review. Biology and systematics of the form genus Rhizoctonia. Span. J. Agric. Res. 4: 55–79. Link
Hao J, Ashley K (2021) Irreplaceable Role of Amendment-Based Strategies to Enhance Soil Health and Disease Suppression in Potato Production. Microorganisms 9(8): 1660. doi: 10.3390/microorganisms9081660
Huang Y, Wu Z, He Y, et al. (2017) Rhizospheric Bacillus subtilis Exhibits Biocontrol Effect against Rhizoctonia solani in Pepper (Capsicum annuum). Biomed Res Int. 2017: 9397619. doi: 10.1155/2017/9397619
Jayaraman, S., Naorem, A., Lal, R. et al. (2021) Disease-Suppressive Soils—Beyond Food Production: a Critical Review. J Soil Sci Plant Nutr 21: 1437–1465. doi: 10.1007/s42729-021-00451-x
Kaur R, Kalia A, Lore JS, et al. (2021) Trichoderma sp. endochitinase and β‐1,3‐glucanase impede Rhizoctonia solani growth independently, and their combined use does not enhance impediment. Plant Pathol. 70: 1388-1396. doi: 10.1111/ppa.13381
Lehtonen MJ, Somervuo P, Valkonen JP (2008) Infection with Rhizoctonia solani induces defense genes and systemic resistance in potato sprouts grown without light. Phytopathology 98: 1190–1198. doi: 10.1094/PHYTO-98-11-1190
Muzhinji N, Woodhall JW, Truter M, van der Waals JE (2018) Variation in Fungicide Sensitivity Among Rhizoctonia Isolates Recovered from Potatoes in South Africa. Plant Disease 102(8): 1520-1526. doi: 10.1094/PDIS-09-17-1470-RE
Ogoshi A (1987) Ecology and pathogenicity of anastomosis and intraspecific groups of Rhizoctonia solani Kuhn. Annu. Rev. Phytopathol. 25: 125–143. doi: 10.1146/annurev.py.25.090187.001013
Sharon M, Kuninaga S, Hyakumachi M, et al. (2008) Classification of Rhizoctonia spp. using rDNA-ITS sequence analysis supports the genetic basis of the classical anastomosis grouping. Mycoscience 49: 93–114. doi: 10.1007/S10267-007-0394-0
Sumner D.R. (1996) Sclerotia Formation by Rhizoctonia Species and their Survival. In: Sneh B, Jabaji-Hare S, Neate S, Dijst G (eds) Rhizoctonia Species: Taxonomy, Molecular Biology, Ecology, Pathology and Disease Control. Springer, Dordrecht. doi: 10.1007/978-94-017-2901-7_18
Sun H, Jiao WB, Krause K, et al. (2022) Chromosome-scale and haplotype-resolved genome assembly of a tetraploid potato cultivar. Nat Genet. doi: 10.1038/s41588-022-01015-0
Tsror L (2010) Biology, Epidemiology and Management of Rhizoctonia solani on Potato. Journal of Phytopathology 158: 649-658. doi: 10.1111/j.1439-0434.2010.01671.x
Uppala S, Zhou X-G (2018) Rice Sheath Blight. The Plant Health Instructor. doi: 10.1094/PHI-I-2018-0403-01
Wibberg D, Rupp O, Blom J, et al. (2015) Development of a Rhizoctonia solani AG1-IB Specific Gene Model Enables Comparative Genome Analyses between Phytopathogenic R. solani AG1-IA, AG1-IB, AG3 and AG8 Isolates. PLoS One 10(12): e0144769. doi: 10.1371/journal.pone.0144769
Wibberg D, Genzel F, Verwaaijen B, et al. (2017) Draft genome sequence of the potato pathogen Rhizoctonia solani AG3-PT isolate Ben3. Arch Microbiol. 199(7): 1065-1068. doi: 10.1007/s00203-017-1394-x
Woodhall JW, Lees AK, Edwards SG, Jenkinson P (2007) Characterization of Rhizoctonia solani from potato in Great Britain. Plant Pathology 56: 286-295. doi: 10.1111/j.1365-3059.2006.01545.x
Wu Z, Huang Y, Li Y, et al. (2019) Biocontrol of Rhizoctonia solani via Induction of the Defense Mechanism and Antimicrobial Compounds Produced by Bacillus subtilis SL-44 on Pepper (Capsicum annuum L.). Front. Microbiol. 10: 2676. doi: 10.3389/fmicb.2019.02676
Yang G, Li C (2012) General description of Rhizoctonia species complex. In Plant Pathology, ed C.J. Cumagun.
Zhang X, Li D, Huo H, et al. (2021) Improving evaluation of potato resistance to Rhizoctonia solani infection by optimizing inoculum-based method combined with toxin-based assay. Crop Protection 144: 105544. doi: 10.1016/j.cropro.2021.105544
Zohora U, Ano T, Rahman M (2016) Biocontrol of Rhizoctonia solani K1 by Iturin A Producer Bacillus subtilis RB14 Seed Treatment in Tomato Plants. Advances in Microbiology 6: 424-431. doi: 10.4236/aim.2016.66042.
Zrenner R, Genzel F, Verwaaijen B, et al. (2020) Necrotrophic lifestyle of Rhizoctonia solani AG3-PT during interaction with its host plant potato as revealed by transcriptome analysis. Sci Rep 10: 12574. doi: 10.1038/s41598-020-68728-2