.
Condición fitosanitaria: Presente
Grupo de cultivos: Frutales
Especie hospedante: Vid (Vitis vinifera)
Rango de hospedantes: específico / estrecho
Etiología: Hongo. Biotrófico
Agente causal: Plasmopara viticola (Berk. & M. A. Curtis) Berl. & De Toni 1888
Taxonomía: Eukaryota > Stramenopiles > Oomycetes > Peronosporales > Peronosporaceae > Plasmopara
.
.
.
Sintomas
El patógeno ataca todas las partes verdes de la planta: hojas, sarmientos y racimos, y la infección puede ocurrir en cualquier etapa del ciclo vegetativo. Después del cuaje, cuando la infección ocurre en granos pequeños, éstos se cubren de una eflorescencia grisácea. Cuando los granos son más grandes toman una coloración castaña y se arrugan.
Inicialmente la enfermedad se observa en la cara adaxial (haz) de las hojas como pequeñas manchas redondeadas, de 4 a 8 mm de diámetro, de color verde, brillante traslúcidas al principio, luego al avanzar el ataque toman coloración castaño claro. En correspondencia con las manchas, en la cara abaxial (envez) o inferior de las hojas aparecen las fructificaciones del oomycete que se manifiestan como una eflorescencia blanca brillante.
.
- Esporulación (zoosporangios con zoosporas) de Plasmopara viticola en la cara abaxial de Vitis vinifera. Autor: Jerzy Opioła; Fuente: www.commons.wikimedia.org
.
.
En hojas viejas esta enfermedad produce manchas amarillas que pasan a rojo o marrón, estas lesiones son pequeñas y poligonales formando un mosaico. En ataques severos la enfermedad puede provocar defoliación. En los sarmientos, la enfermedad se desarrolla solo en los herbáceos, con una mancha de color castaño oscuro que con el tiempo se necrosa y forma cancros. Estos sarmientos no soportan heladas.
En el racimo el ataque puede afectar la inflorescencia y las bayas hasta un tamaño de 5 mm. En la inflorescencia esta enfermedad se manifiesta formando fructificaciones produciendo el marchitamiento de la inflorescencia, luego se ennegrece y toma una forma de «S», finalmente se seca. En el fruto se observa una eflorescencia grisáceo-blanquecina. Cuando los granos son más grandes toman una coloración castaña y se arrugan. En el raquis y en el pedicelo los síntomas son similares a los del sarmiento.
.
- Esporulación (zoosporangios con zoosporas) de Plasmopara viticola en racimos de Vitis vinifera. Fuente: https://gd.eppo.int/taxon/PLASVI/photos
.
.
Daños
El ataque produce pérdidas de producción y defoliación. La calidad de vino producido también se ve afectado.
.
Condiciones predisponentes
La intensidad de la infección primaria depende de la cantidad de inóculo inicial (oosporas) en el lote. Las temperaturas mayores a 20 ºC y las lluvias de invierno e inicio de primavera son conducentes para la enfermedad.
Para que se manifieste la infección secundaria, que es la que asegura la diseminación de la enfermedad durante el ciclo vegetativo, el rocío nocturno de 6 o más horas, las temperaturas entre 6 y 27ºC, y las lluvias infectantes son necesarias.
.
- Ciclo 2rio del Mildew de la Vid, causado por el pseudohongo Plasmopara viticola. Autor: Peng et al., 2023
.
.
Ciclo de la enfermedad. Epidemiología
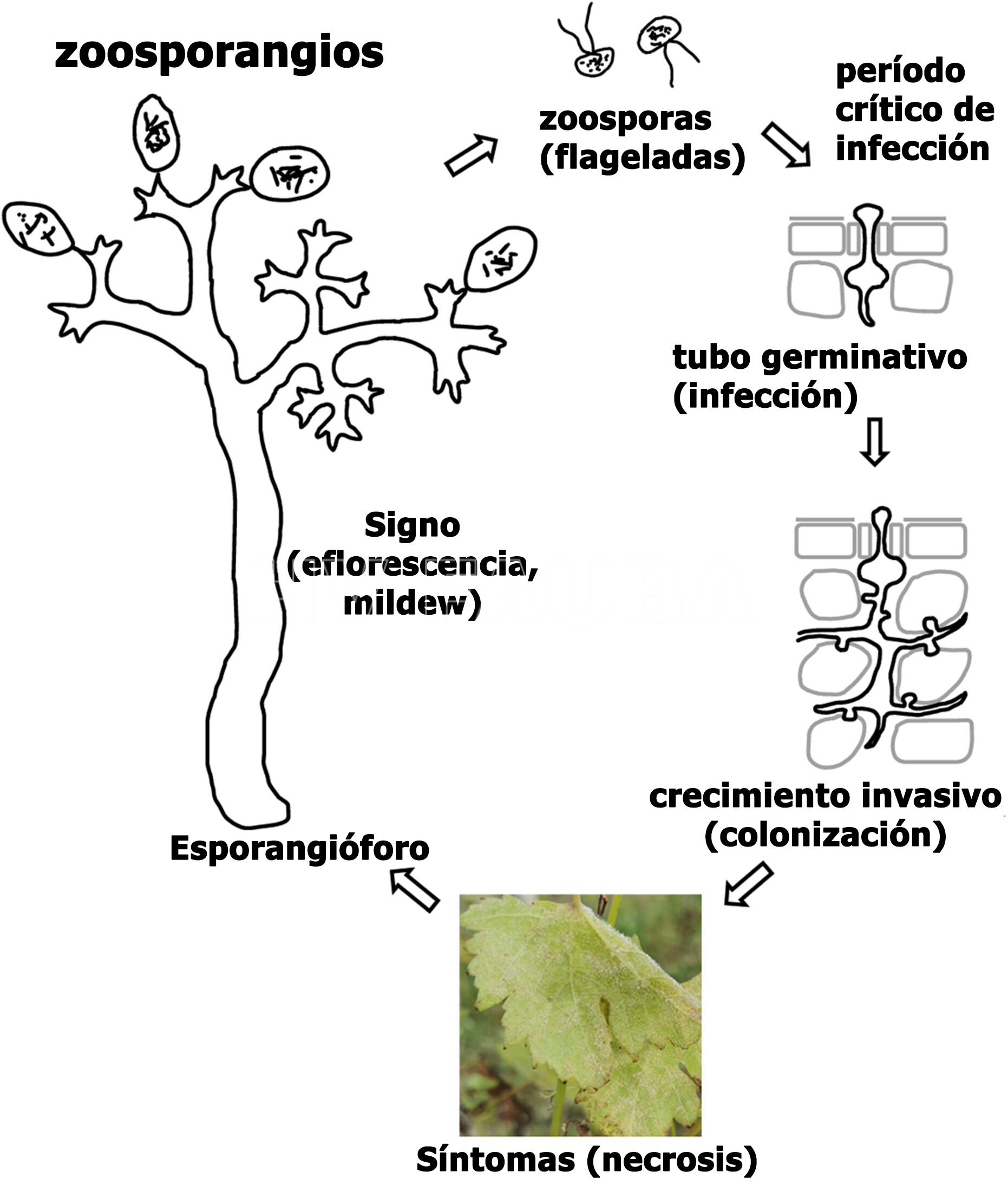
P. viticola es un patógeno obligado que sobrevive como oosporas (estructuras de reproducción sexual) sobre hojas caídas. Las oosporas son las responsables de la infección primaria. La infección que se produce durante el ciclo vegetativo (infección secundaria) es producida por las zoosporas, contenidas en los zoosporangios, estructuras asexuales. En el otoño, en las hojas afectadas se forman las oosporas de P. viticola, que se mantienen dentro de ellas, en el suelo, durante todo el invierno. En la primavera con temperaturas y humedad favorables, las oosporas germinan, originando zoosporangios y éstos a su vez zoosporas, que infectan los tejidos verdes de la vid, penetrando en su interior por los estomas o por la epidermis en forma directa (apresorio).
P. viticola generalmente infecta a su hospedante por zoosporas biflageladas liberadas de esporangios producidos asexualmente. Las salpicaduras de agua distribuyen los esporangios hacia la parte inferior de las hojas de parra y otras partes de la planta. En presencia de humedad, las zoosporas nadan de manera dirigida hacia los estomas, donde se enquistan en el borde y desarrollan un tubo germinativo que ingresa a la cavidad subestomática. A continuación, se forma una vesícula subestomática que inicia la proliferación del patógeno con un micelio tubular diploide no segmentado. Crece intercelularmente y recupera nutrientes parasitando las células del hospedante a través de haustorios. Los haustorios se desarrollan debajo de los apresorios y surgen de clavijas de penetración.
P. viticola puede infectar a su hospedante de forma sistémica. Puede propagarse desde infecciones originales en los estomas de las hojas o frutos muy jóvenes hasta los pecíolos y los brotes, respectivamente, hasta las bayas en desarrollo. Este tipo de infección también se observa en Botrytis cinerea (teleomorfo Botryotinia fuckeliana), el agente causal del moho gris. Un criterio explícito para distinguir los dos patógenos a nivel microscópico es la formación de haustorios en P. viticola. Las hifas en forma de abanico descritas aquí también forman estos haustorios. Por el contrario, B. cinerea nunca produce haustorios. Por tanto, se puede descartar cualquier posible confusión con la infección por B. cinerea. Además, la secuencia de la región ITS amplificada confirma la identidad de P. viticola en las hojas.
El desarrollo de la enfermedad es muy dependiente de las condiciones ambientales (lluvias, rocío, temperaturas).
.
- Síntomas del mildew de la vid causado por Plasmopara viticola: (a) síntoma de mancha “de aceite”; (b) lesiones foliares necróticas viejas; (c) esporulación característica del patógeno del envés de la hoja; (d) lesiones necróticas en el haz de la hoja; (e,f) esporulación característica en el raquis; (g,h) infecciones en bayas jóvenes. Autor: Zhang et al., 2017.
.
.
Manejo Integrado
* Aplicación de fungicidas (oomiceticidas). En Brasil se ha reportado resistencia multiple a fungicidas con diferente modo de acción (Santos et al., 2020).
* Evitar aumentar la humedad y el mojado foliar durante la noche para mitigar la infección secundaria. Siempre que sea posible, se debe evitar o programar el uso de riego por aspersión para que las hojas se sequen rápidamente. La reducción de la hojarasca y la poda pueden reducir la cantidad de inóculo de invernancia.
* Todas las variedades de vid son consideradas susceptibles, sin embargo, algunas son más susceptibles que otras. Se debe contar con esta información para priorizar las pulverizaciones y el monitoreo en los lotes plantados con las variedades más susceptibles.
.
- 01 Síntomas del Mildew de la Vid, causado por Plasmopara viticola. Autor: Ing. Agr. Mariela Rodriguez
- 02 Signo del Mildew de la Vid, causado por Plasmopara viticola. Autor: Ing. Agr. Mariela Rodriguez
- 03 Síntomas del Mildew de la Vid, causado por Plasmopara viticola. Autor: Ing. Agr. Mariela Rodriguez
- 04 Signo del Mildew de la Vid, causado por Plasmopara viticola. Autor: Ing. Agr. Mariela Rodriguez
.
Bibliografía
Plasmopara viticola. Sistema Nacional Argentino de Vigilancia y Monitoreo de plagas
Míldio – Plasmopara viticola. Uvas Viníferas para Processamento em Regiões de Clima Temperado. Doenças Fúngicas. EMBRAPA
Arias MF, Escoriaza G (2016) Control de enfermedades de la vid durante la temporada 2015-2016. Laboratorio de Fitopatología de INTA EEA Mendoza
Ash G (2000) Downy mildew of grape. Updated 2017. The Plant Health Instructor. doi: 10.1094/PHI-I-2000-1112-01
Bi Q, Ma Z (2016) Sensitivity, resistance stability, and cross-resistance of Plasmopara viticola to four different fungicides. Crop Protection 89: 265-272. doi: 10.1016/j.cropro.2016.07.030
, , , et al. (2021) First report of oospore formation in Plasmopara viticola, the causal agent of grapevine downy mildew, in highland regions of southern Brazil. Plant Pathol. 00: 1– 11. doi: 10.1111/ppa.13431
Bleyer K, Bleyer G, Schumacher S (2023) Using ontogenetic resistance of grapevine for fungicide reduction strategies. Eur J Plant Pathol 165: 115–124. doi: 10.1007/s10658-022-02592-w
Bradshaw MJ, Boufford D, Braun U, et al. (2024) An In-Depth Evaluation of Powdery Mildew Hosts Reveals One of the World’s Most Common and Widespread Groups of Fungal Plant Pathogens. Plant Dis. 108(3): 576-581. doi: 10.1094/PDIS-07-23-1471-RE
Brilli M, Asquini E, Moser M, et al. (2018) A multi-omics study of the grapevine-downy mildew (Plasmopara viticola) pathosystem unveils a complex protein coding- and noncoding-based arms race during infection. Scientific Reports 8(1): 757. doi: 10.1038/s41598-018-19158-8
Campbell SE, Brannen PM, Scherm H, Brewer MT (2020) Fungicide Sensitivity Survey of Plasmopara viticola Populations in Georgia Vineyards. Plant Health Progress 21: 256-261. doi: 10.1094/PHP-05-20-0039-RS
Campbell SE, Brannen PM, Scherm H, et al. (2021) Efficacy of fungicide treatments for Plasmopara viticola control and occurrence of strobilurin field resistance in vineyards in Georgia, USA. Crop Protection 139: 105371. doi: 10.1016/j.cropro.2020.105371
Clippinger JI, Dobry EP, Laffan I, et al. (2024) Traditional and Emerging Approaches for Disease Management of Plasmopara viticola, Causal Agent of Downy Mildew of Grape. Agriculture 14(3): 406. doi: 10.3390/agriculture14030406
Colcol JF, Baudoin AB (2016) Sensitivity of Erysiphe necator and Plasmopara viticola in Virginia to QoI Fungicides, Boscalid, Quinoxyfen, Thiophanate Methyl, and Mefenoxam. Plant Disease 100(2): 337-344. doi: 10.1094/PDIS-01-15-0012-RE
Cruz-Silva A, Figueiredo A, Sebastiana M (2021) First Insights into the Effect of Mycorrhizae on the Expression of Pathogen Effectors during the Infection of Grapevine with Plasmopara viticola. Sustainability 13(3):1226. doi: 10.3390/su13031226
Fröbel S and Zyprian E (2019) Colonization of Different Grapevine Tissues by Plasmopara viticola—A Histological Study. Front. Plant Sci. 10: 951. doi: 10.3389/fpls.2019.00951
Gessler C, Pertot I, Perazzolli M (2011) Plasmopara viticola: a review of knowledge on downy mildew of grapevine and effective disease management. Phytopathologia Mediterranea 50: 3−44. doi: 10.14601/Phytopathol_Mediterr-9360
, , , Temporal disease dynamics and relative importance of sexual and asexual reproduction of grape downy mildew (Plasmopara viticola) in an isolated vineyard in the North Georgia Mountains, USA. Plant Pathology 69: 1721– 1730. doi: 10.1111/ppa.13263
Kanaley K, Combs DB, Paul A, et al. (2024) Assessing the Capacity of High-Resolution Commercial Satellite Imagery for Grapevine Downy Mildew Detection and Surveillance in New York State. Phytopathology 114: 2536-2545. doi: 10.1094/PHYTO-11-23-0432-R
Lazazzara V, Bueschl C, Parich A, et al. (2018) Downy mildew symptoms on grapevines can be reduced by volatile organic compounds of resistant genotypes. Nature Scientific Reports 8, Article number: 1618. doi: 10.1038/s41598-018-19776-2
Liu Y, Lan X, Song S, et al. (2018) In Planta Functional Analysis and Subcellular Localization of the Oomycete Pathogen Plasmopara viticola Candidate RXLR Effector Repertoire. Front. Plant Sci. 9:286. doi: 10.3389/fpls.2018.00286
Liu GT, Wang BB, Lecourieux D, et al. (2021) Proteomic analysis of early-stage incompatible and compatible interactions between grapevine and P. viticola. Horticulture Research 8: 100. doi: 10.1038/s41438-021-00533-y
Longone V, Arias F, Césari C, Escoriaza G. Estrategias de manejo para el control de enfermedades de vid en época de cosecha. INTA San Juan
, , , et al. (2021) Plasmopara viticola effector PvRXLR111 stabilizes VvWRKY40 to promote virulence. Molecular Plant Pathology 22: 231– 242. doi: 10.1111/mpp.13020
Maddalena G, Russo G and Toffolatti SL (2021) The Study of the Germination Dynamics of Plasmopara viticola Oospores Highlights the Presence of Phenotypic Synchrony With the Host. Front. Microbiol. 12: 698586. doi: 10.3389/fmicb.2021.698586
Massi F, Torriani SFF, Borghi L, Toffolatti SL (2021) Fungicide Resistance Evolution and Detection in Plant Pathogens: Plasmopara viticola as a Case Study. Microorganisms 9(1): 119. doi: 10.3390/microorganisms9010119
Mouafo-Tchinda RA, Fall ML, Beaulieu C, Carisse O (2022) Competition Between Plasmopara viticola Clade riparia and Clade aestivalis: A Race to Lead Grape Downy Mildew Epidemics. Plant Dis. 106(11): 2866-2875. doi: 10.1094/PDIS-11-21-2465-RE
Nanni IM, Pirondi A, Contaldo N, Collina M (2016) Screening of sensitivity to mandipropamid of Plasmopara viticola populations from Italian vineyards by molecular and biological methods. Lett Appl Microbiol. 63(4): 268-73. doi: 10.1111/lam.12613
Negrel L, Halter D, Wiedemann-Merdinoglu S, et al. (2018) Identification of Lipid Markers of Plasmopara viticola Infection in Grapevine Using a Non-targeted Metabolomic Approach. Front. Plant Sci. 9:360. doi: 10.3389/fpls.2018.00360
Oerke EC, Juraschek L, Steiner U (2022) Hyperspectral mapping the response of grapevine cultivars to Plasmopara viticola infection on the tissue scale. Journal of Experimental Botany: erac390. doi: 10.1093/jxb/erac390
, , , et al. (2023) Advances in understanding grapevine downy mildew: From pathogen infection to disease management. Molecular Plant Pathology 00: 1–21. doi: 10.1111/mpp.13401
Qu J, Liu L, Zheng C, et al. (2025) Plasmopara viticola Effector PvRXLR10 Targets a Host Phospholipase VvipPLA-IIδ2 to Suppress Plant Immunity in Grapevine. Mol Plant Pathol 26: e70095. doi: 10.1111/mpp.70095
Rashad YM, El-Sharkawy HHA, Belal BEA, et al. (2021) Silica Nanoparticles as a Probable Anti-Oomycete Compound Against Downy Mildew, and Yield and Quality Enhancer in Grapevines: Field Evaluation, Molecular, Physiological, Ultrastructural, and Toxicity Investigations. Front. Plant Sci. 12: 763365. doi: 10.3389/fpls.2021.763365
, , , et al. Multiple resistance of Plasmopara viticola to QoI and CAA fungicides in Brazil. Plant Pathology 69: 1708– 1720. doi: 10.1111/ppa.13254
Santos RF, Ciampi-Guillardi M, Fraaije BA, et al. (2020) The Climate-Driven Genetic Diversity Has a Higher Impact on the Population Structure of Plasmopara viticola Than the Production System or QoI Fungicide Sensitivity in Subtropical Brazil. Front. Microbiol. 11:575045. doi: 10.3389/fmicb.2020.575045
Taylor AS, Lazar K, White D, et al. (2017) Evaluation of microsatellite primers developed for grapevine downy mildew, Plasmopara viticola, on Australian isolates. Australasian Plant Pathology (online) 1–5. doi: 10.1007/s13313-017-0534-8
Ungureanu C, Soare LC, Vizitiu D, et al. (2019) Isolation of Plasmopara viticola from Grapevine Leaves. Proceedings 29: 34. doi: 10.3390/proceedings2019029034
Valsesia G, Gobbin D, Patocchi A, et al. (2005) Development of a High-Throughput Method for Quantification of Plasmopara viticola DNA in Grapevine Leaves by Means of Quantitative Real-Time Polymerase Chain Reaction. Phytopathology 95(6): 672-8. doi: 10.1094/PHYTO-95-0672
Valleggi L, Carella G, Perria R, et al. (2023) A Bayesian model for control strategy selection against Plasmopara viticola infections. Front. Plant Sci. 14: 1117498. doi: 10.3389/fpls.2023.1117498
Yacoub A, Haidar R, Mesguida O, et al. (2023) Deciphering Plant-Induced Responses toward Botrytis cinerea and Plasmopara viticola Attacks in Two Grapevine Cultivars Colonized by the Root Biocontrol Oomycete, Pythium oligandrum. Journal of Fungi.9(5): 511. doi: 10.3390/jof9050511
, , , et al. (2024) Exploring the association between latent Plasmopara viticola infection and downy mildew epidemic in commercial vineyards: Application of qPCR assay. Plant Pathology 73: 378–389. doi: 10.1111/ppa.13808
Zhang W, Manawasinghe IS, Zhao W, et al. (2017) Multiple gene genealogy reveals high genetic diversity and evidence for multiple origins of Chinese Plasmopara viticola population. Sci Rep 7: 17304. doi: 10.1038/s41598-017-17569-7
Zorrilla JG, Giovannini O, Nadalini S, et al. (2024) Suppressive Activity of Glechoma hederacea Extracts against the Phytopathogenic Oomycete Plasmopara viticola, and First Screening of the Active Metabolites. Agriculture 14(1): 58. doi: 10.3390/agriculture14010058