.
Condición fitosanitaria: Presente
Grupo de cultivos: Legumbres
Especie hospedante: Garbanzo (Cicer arietinum L.)
Rango de hospedantes: específico / estrecho *
Etiología: Hongo. Necrotrófico
Agente causal: Ascochyta rabiei [Pass.] Labrousse / Teleomorfo: Didymella rabiei (Kovacheski) (syn. Mycosphaerella rabiei Kovacheski)
Taxonomía: Eukaryota > Fungi > Dikarya > Ascomycota > Pezizomycotina > Dothideomycetes > Pleosporales > Didymellaceae > Ascochyta
.
* A. rabiei se aisló previamente de plantas voluntarias asintomáticas de arveja, lentejas y otras leguminosas que crecen en campos previamente cultivados con garbanzos. La colonización de plantas no hospedantes podría ser de importancia epidemiológica donde se utilizan otras leguminosas y trigo en rotaciones de cultivos para romper el ciclo de la enfermedad causada por Ascochyta (Hernandez-Bello et al., 2007).
.
.
Antecedentes
Es la enfermedad más destructiva del garbanzo y las experiencias en otros países como Australia, o España, informan pérdidas de hasta el 100%. En Argentina Ascochyta rabiei fue reportada por primera vez en el año 2012 (Viotti et al., 2012). La introducción de este patógeno al país fue seguramente a través de las semillas, ya que la diseminación a larga distancia sólo ocurre por esta vía. En los lotes afectados la Incidencia fue del 100%, con síntomas severos en hojas, vainas, tallos y semillas. Durante el ciclo 2011/12, productores de Córdoba y del sudeste de Buenos Aires fueron afectados por la presencia de un rápido marchitamiento, tizón y muerte de plantas de garbanzo en parches o rodales. Las primeras detecciones (visualización de los síntomas) coincidieron con el inicio de formación de vainas en el mes de noviembre de 2011. Plantas provenientes del partido de Lobería (Buenos Aires) y de Río Primero y Río Segundo (Córdoba) se analizaron para identificar el organismo causal. Las características morfológicas de las fructificaciones estudiadas, la manifestación típica de los síntomas en las plantas, y las infecciones logradas a través de inoculaciones artificiales con una suspensión de esporas, permiten concluir en forma precisa que se trata del hongo Ascochyta rabiei, no registrado hasta el presente en Argentina. Esta identificación se informó inmediatamente a SENASA.
.
Sintomatología
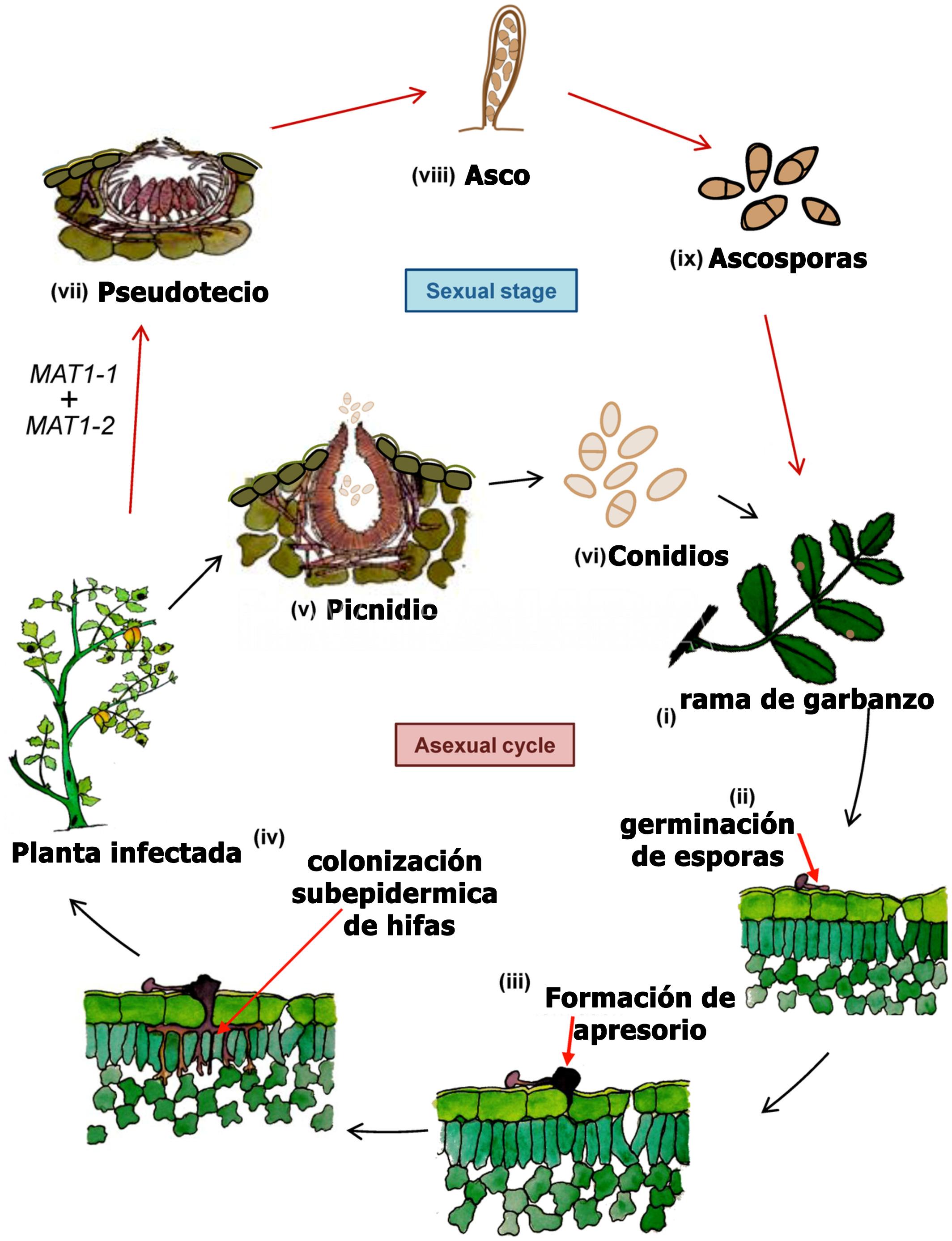
Ascochyta rabiei ataca todas las partes aéreas de la planta, hojas, tallos, pecíolos, vainas y semillas de garbanzo; los síntomas iniciales son pequeñas manchas necróticas en las hojas o tallos nuevos. La necrosis es producida por la acción de tres potentes fitotoxinas, cuya producción se correlaciona con la agresividad de las distintas cepas del organismo causal. Las semillas infectadas interna o superficialmente pueden o no mostrar síntomas. Las semillas muy afectadas pueden presentar reducción de calibre, arrugamiento y lesiones oscuras de diversas formas y tamaños. En algunos casos, sobre estas lesiones, se pueden observar signos del hongo constituidos por las fructificaciones (picnidios). Además afecta la germinación y por lo tanto el stand de plántulas; Estas plántulas, presentan lesiones marrones en la base del tallo, las que se agrandan, rodean el tallo y causan el quebrado del hipocótilo y la muerte.
.
Epidemiología
El garbanzo es el principal hospedante de A. rabiei, sin embargo se infectó artificialmente lenteja (Lens culinaris), caupí (Vigna unguiculata), arveja (Pisum sativum) y poroto (Phaseolus spp.), entre otros. Se informó como hospedantes a la alfalfa (Medicago sativa) y melilotus (Melilotus spp.). Se puede aislar con baja frecuencia de mostaza negra (Brassica nigra), ortiga mansa (Lamiun amplexicaule) y trigo (Triticum aestivum. De manera general se considera que en otros hospedantes que no sean garbanzo, la enfermedad se presenta escasamente o lo hace en forma latente (asintomática), o con síntomas leves y podrían ser reservorios o “puente verde” del patógeno. La infección se produce con una temperatura óptima de 20ºC asociada a 5-6 horas de mojado foliar. Bajo condiciones altamente conductivas, temperaturas frescas (15-25°C), alta humedad relativa de 98-100% durante 6-12 horas de mojado), las lesiones aumentan de tamaño. En las hojas y vainas son de forma circular u ovalmientras que en los tallos son alargadas, elípticas. Las manchas generalmente contienen gran cantidad de picnidios oscuros dispuestos concéntricamente, que cuando se hidratan liberan una masa viscosa que poseen miles de conidios. El hongo puede penetrar fácilmente la pared de las vainas e instalarse en la semilla, pudiendo así diseminar, introducir y permitir la supervivencia del patógeno con elevada eficiencia.Estas semillas permitirán el ingreso del patógeno al campo a través del proceso de la transmisión generando los primeros focos de la enfermedad y futuras diseminaciones dentro del lote. La infección primaria se origina en el rastrojo o semillas infectadas; los pseudotecios (forma sexual) pueden sobrevivir por muchos años en los restos vegetales. Se informó inicialmente la existencia de 6 razas y actualmente se mencionan 14 patotipos o formas virulentas; los aislamientos también presentan alto grado de variabilidad molecular que no se correlaciona con los patotipos o localizaciones geográficas de aislamiento.
.
- Ciclo de la rabia del garbanzo. Autor: Singh et al., 2022
.
.
Manejo de la rabia
En Argentina será necesario comenzar con acciones específicas por parte de todos los actores del sistema productivo desarrollando en forma urgente un programa de Manejo Integrado de la enfermedad. Por ello es de fundamental importancia, difundir masivamente la importancia de la enfermedad y su manejo, además de capacitaciones a técnicos y productores para exigir el análisis sanitario de las semillas, reconocimiento de síntomas y signos y detección temprana a campo.
- Análisis sanitario de semillas: es una medida imprescindible, antes de la siembra fundamentalmente para la próxima campaña. Semillas asintomáticas, pueden estar infectadas como sucede con otros importantes patógenos en otros cultivos. Se debería considerar que en numerosos casos las infecciones a campo de este ciclo 2011/12, han pasado desapercibidas, ya sea porque ocurrieron al final del ciclo del cultivo o porque no se visualizaron por falta de experiencia. Esto remarca aún más la necesidad del análisis de semillas, ya que no se debería recomendar la siembra de lotes de semillas con niveles críticos de infección. Asimismo sería necesario implementar medidas de restricción de introducción de semillas que no estén analizadas e inspeccionadas previamente, por los organismos nacionales de referencia.
- Rotación de cultivos: al menos 2 o 3 años son necesarios para disminuir la fuente de inóculo inicial que es el rastrojo, por ser fuente de supervivencia del patógeno.
- Tratamiento de semillas: con moléculas fungicidas eficientes, entre ellos los bencimidazoles han mostrado en otros países para el control del patógeno; la mezcla de dos o más principios activos pueden aumentar la eficacia de control y evitar la generación de resistencia por parte del patógeno, por ejemplo carbendazim o thiabendazole a los que se les puede sumar difenoconazole o ipconazole, thiram, iprodione, estrobilurinas, y como así también carboxin + thiram. Será necesario desarrollar ensayos específicos para valorar la eficacia de estas y otras moléculas en semillas en nuestro país
- Densidad de plantas: Sería importante determinar cuál /cuáles son las densidades óptimas del cultivo en nuestro país y si las mismas afectan o no a la epidemiología de la enfermedad
- Nutrición: el uso de inoculantes específicos, la aplicación de potasio y fósforo en suelos con alto contenido de nitrógeno pueden contribuir a reducir los niveles de enfermedad.
- Uso de fungicidas foliares: recientemente en EEUU y Canadá se informó tal como sucede para Cercospora sojina(mancha ojo de rana en soja), la aparición de cepas resistentes a las estrobilurinas como consecuencia del uso individual de estas moléculas. Por ello no deberían utilizarse principios activos únicos, sino una mezcla de fungicidas con diferentes mecanismos de acción. Algunas experiencias locales han mostrado muy buen comportamiento de las mezclas de estrobilurinas con triazoles aplicados ante la presencia de síntomas a inicio de formación de vainas; en algunos casos el agregado de fosfitos (inductor de defensas) a la mezcla de fungicidas ha dado resultados satisfactorios mejorando la supervivencia de las plantas. Se deberán iniciar investigaciones específicas en esta enfermedad para optimizar las técnicas de diagnosis como el tratamiento de las semillas y el uso de fungicidas en órganos aéreos.
- Resistencia genética: es relevante conocer el comportamiento de las diferentes variedades frente a los aislamientos locales del patógeno para recomendar la siembra de aquellas resistentes o con moderada resistencia.
.
.
.
Bibliografía
Amin M, Melkamu F (2014) Management of Ascochyta Blight (Ascochyta rabiei) in Chickpea Using a New Fungicide. Research in Plant Sciences 2(1): 27-32. doi: 10.12691/plant-2-1-6
Bar I, Sambasivam PT, Davidson J, et al. (2021) Current population structure and pathogenicity patterns of Ascochyta rabiei in Australia. Microb Genom. 7(7). doi:
Bayraktar H, Özer G, Aydoğan A, Palacıoğlu G (2016) Determination of Ascochyta blight disease in chickpea using real-time PCR. Journal of Plant Diseases and Protection 123(3): 109-117. doi: 10.1007/s41348-016-0017-0
Chen X, Ge J, Ma D, Ma L, Liu W, Qiang S (2017) Characterization and Identification of an Epidemic Strain of Ascochyta rabiei on Chickpeas in Northwest China. Journal of Phytopathology 165: 355–360. doi: 10.1111/jph.12568
Chongo G, Buchwaldt L, Gossen BD, Lafond GP, May WE, Johnson EN, et al. (2003) Foliar fungicides to manage ascochyta blight [Ascochyta rabiei] of chickpea in Canada. Canadian Journal of Plant Pathology 25(2): 135-142 doi: 10.1080/07060660309507061
Crociara C, Valetti L, Pastor S (2020) Presence of both mating types of Ascochyta rabiei in Argentina suggests potential for sexual reproduction. Australasian Plant Dis. Notes 15, 43 (2020). doi: 10.1007/s13314-020-00411-x
Harveson RM, Markell SG, Goswami R, Urrea CA, Burrows ME, Dugan F, Chen W, Skoglund LG (2011) Ascochyta blight of chickpeas. Plant Health Progress (Online). doi: 10.1094/PHP-2011-0103-01-DG
Hernandez-Bello MA, Chilvers MI, Akamatsu H, Peever TL (2007) Host Specificity of Ascochyta spp. Infecting Legumes of the Viciae and Cicerae Tribes and Pathogenicity of an Interspecific Hybrid. Phytopathology 96(10): 1148-56. doi: 10.1094/PHYTO-96-1148
Jamil FF, Sarwar N, Sarwar M, Khan JA, Geistlinger J, KahI G (2000) Genetic and pathogenic diversity within Ascochyta rabiei (Pass.) Lab. populations in Pakistan causing blight of chickpea (Cicer arietinum L.). Physiological and Molecular Plant Pathology 57(6): 243-254. doi: 10.1006/pmpp.2000.0303
Khan MSA, Ramsey MD, Scott ES (1999) Host range studies with an Australian isolate of Ascochyta rabiei . Australasian Plant Pathology 28: 170–173. doi: 10.1071/AP99028
Li Y, Ruperao P, Batley J, Edwards D, Davidson J, Hobson K, Sutton T (2017) Genome Analysis Identified Novel Candidate Genes for Ascochyta Blight Resistance in Chickpea Using Whole Genome Re-sequencing Data. Frontiers in Plant Science 8: 359. doi: 10.3389/fpls.2017.00359
Manjunatha L, Saabale PR, Srivastava AK, et al. (2018) Present status on variability and management of Ascochyta rabiei infecting chickpea. Indian Phytopathology 1–16. doi: 10.1007/s42360-018-0002-6
Mehmood Y, Sambasivam P, Kaur S, Davidson J, Leo AE, Hobson K, Linde CC, Moore K, Brownlie J, Ford R (2017) Evidence and Consequence of a Highly Adapted Clonal Haplotype within the Australian Ascochyta rabiei Population. Frontiers in Plant Science 8:1029. doi: 10.3389/fpls.2017.01029
Newman TE, Jacques S, Grime C, Kamphuis FL, Lee RC, Berger J, Kamphuis LG (2021) Identification of Novel Sources of Resistance to Ascochyta Blight in a Collection of Wild Cicer Accessions. Phytopathology 111(2): 369-379. doi: 10.1094/PHYTO-04-20-0137-R
Owati AS, Agindotan B, Pasche JS and Burrows M (2017) The Detection and Characterization of QoI-Resistant Didymella rabiei Causing Ascochyta Blight of Chickpea in Montana. Frontiers in Plant Science 8: 1165. doi: 10.3389/fpls.2017.01165
Rubiales D, Fondevilla S, Chen W, Davidson J (2018) Editorial: Advances in Ascochyta Research. Frontiers in Plant Science 9: 22. doi: 10.3389/fpls.2018.00022
Sagi MS, Deokar AA, Tar’an B (2017) Genetic Analysis of NBS-LRR Gene Family in Chickpea and Their Expression Profiles in Response to Ascochyta Blight Infection. Frontiers in Plant Science 8: 838. doi: 10.3389/fpls.2017.00838
Singh R, Kumar K, Purayannur S, et al. (2022) Ascochyta rabiei: A threat to global chickpea production. Mol Plant Pathol. doi: 10.1111/mpp.13235
Sivachandra Kumar NT, Banniza S (2017) Assessment of the Effect of Seed Infection with Ascochyta pisi on Pea in Western Canada. Frontiers in Plant Science 8: 933. doi: 10.3389/fpls.2017.00933
Sudheesh S, Rodda MS, Davidson J, Javid M, Stephens A, Slater AT, Cogan NOI, Forster JW, Kaur S (2016) SNP-Based Linkage Mapping for Validation of QTLs for Resistance to Ascochyta Blight in Lentil. Frontiers in Plant Science 7: 1604. doi: 10.3389/fpls.2016.01604
Sun SL, Zhu ZD, Xu DX (2016) Occurrence of Ascochyta Blight Caused by Ascochyta rabiei on Chickpea in North China. Plant Disease 100(7): 1494. doi: 10.1094/PDIS-12-15-1406-PDN
Verma S, Gazara RK, Nizam S, Parween S, Chattopadhyay D, Verma PK (2016) Draft genome sequencing and secretome analysis of fungal phytopathogen Ascochyta rabiei provides insight into the necrotrophic effector repertoire. Nature Scientific Reports 6, Article number: 24638. doi: 10.1038/srep24638
Verma S, Gazara RK, Verma PK (2017) Transcription Factor Repertoire of Necrotrophic Fungal Phytopathogen Ascochyta rabiei: Predominance of MYB Transcription Factors As Potential Regulators of Secretome. Frontiers in Plant Science 8: 1037. doi: 10.3389/fpls.2017.01037
Viotti G, Carmona M, Scandiani M, Formento N, Luque A (2012) First Report of Ascochyta rabiei Causing Ascochyta Blight of Chickpea in Argentina. Plant Disease 96(9): 1375. doi: 10.1094/PDIS-02-12-0153-PDN
Wise KA, Bradley CA, Pasche JS, Gudmestad NC (2009) Resistance to QoI fungicides in Ascochyta rabiei from chickpea in the Northern Great Plains. Plant Disease 93: 528-536. doi: 10.1094/PDIS-93-5-0528
Wise KA, Henson RA, Bradley CA (2009) Fungicide Seed Treatment Effects on Seed-borne Ascochyta rabiei in Chickpea. HortTechnology 19(3): 533-537.