.
Condición fitosanitaria: Presente ampliamente distribuida
Grupo de cultivos: Oleaginosas
Especie hospedante: Girasol (Helianthus annuus)
Rango de hospedantes: no específico / amplio. S. sclerotiorum es un hongo polífago con un amplio rango de hospedantes y de amplia difusión mundial, siendo el agente causal de podredumbres en diversos cultivos de importancia económica. Se han reportado más de 408 especies de plantas atacadas por S. sclerotiorum, de 278 géneros, en 75 familias. La mayoría de estas especies son dicotiledóneas, aunque también son hospedantes varias plantas monocotiledóneas de importancia agrícola (Boland & Hall, 1994; Bolton et al., 2006; Derbyshire et al., 2022). El grado de susceptibilidad a S. sclerotiorum en las poblaciones de plantas hospedantes a menudo varía considerablemente. Sin embargo, no existe una resistencia completa a S. sclerotiorum en ninguna especie hospedante.
Se han reportado más de 408 especies de plantas atacadas por S. sclerotiorum, de 278 géneros, en 75 familias (Boland & Hall, 1994). Entre las Familias de plantas hospedantes de Scleorotinia sclerotiorum se encuentran:
Actinidiaceae, Aizoaceae, Amaranthaceae, Annonaceae, Apocynaceae, Araliaceae, Aristolochiaceae, Asclepiadaceae, Begoniaceae, Berberidaceae, Boraginaceae, Campanulaceae, Capparidaceae, Caryophyllaceae, Chenopodiaceae, Compositae, Convolvulaceae, Cruciferae, Cucurbitaceae, Dipsacaceae, Euphorbiaceae, Fagaceae, Fumariaceae, Gentianaceae, Geraniaceae, Gesneriaceae, Gramineae, Hippocastanaceae, Iridaceae, Labiatae, Lauraceae, Leguminosae, Liliaceae, Linaceae, Malvaceae, Martyniaceae, Moraceae, Musaceae, Myoporaceae, Myrtaceae, Oleaceae, Onagraceae, Orobanchaceae, Papaveraceae, Passifloraceae, Pinaceae, Plantaginaceae, Polemoniaceae, Polygonaceae, Portulacaceae, Ranunculaceae, Rosaceae, Rutaceae, Saxifragaceae, Scrophulariaceae, Solanaceae, Theaceae, Tilliaceae, Tropaeolaceae, Umbelliferae, Urticaceae, Valerianaceae, Violaceae, Vitaceae.
Epidemiología: monocíclica, subaguda.
Etiología: Hongo. Necrotrófico, con capacidad de supervivencia en el suelo.
Agente causal: Sclerotinia sclerotiorum (Lib.) de Bary (1884)
Taxonomía: Eukaryota > Fungi > Dikarya > Ascomycota > Pezizomycotina > Leotiomycetes > Helotiales > Sclerotiniaceae > Sclerotinia
.
.
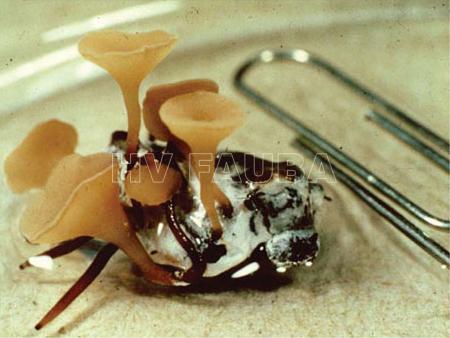
- Apotecios, a partir de esclerocios o esclerotos de Sclerotinia sclerotiorum. Autor: Kloppers FJ, Pannar Seed.
.
Sclerotinia es un hongo ascomycota que solo se reproduce en forma sexual mediante ascosporas (contenidas en ascos, dentro de apotecios que germinan a partir de esclerocios). No forma conidios.
.
.
Antecedentes
Debido al carácter polífago de este patógeno, sumado a su alto poder destructivo, a las condiciones climáticas predisponentes en nuestro país y a las características genéticas de los materiales utilizados, la PHC y PHT es una de las enfermedades más importantes del cultivo de girasol.
.
Sintomatología
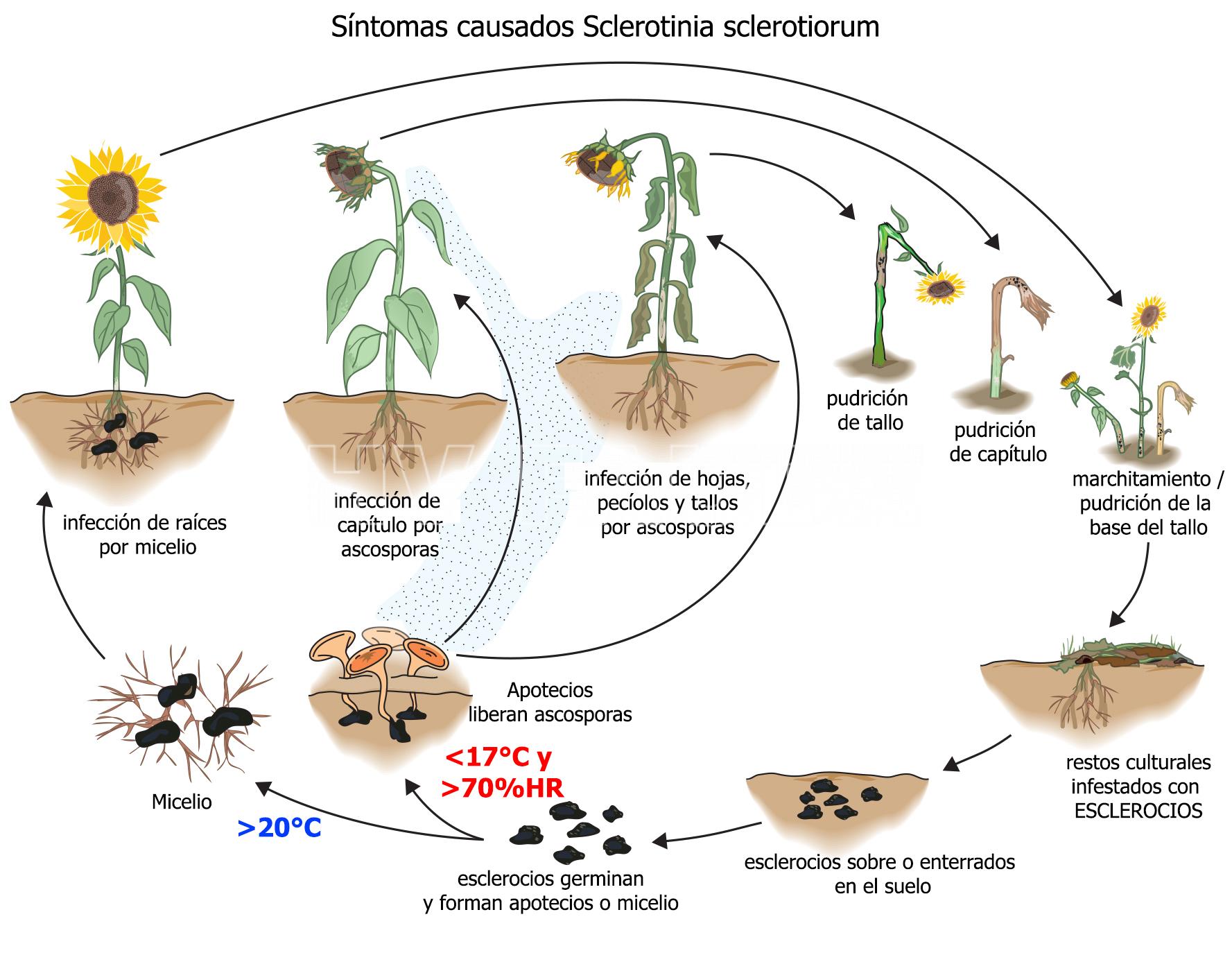
Sclerotinia sclerotiorum produce distintos síntomas en girasol. La infección micelial (fase vegetativa) es responsable de la podredumbre de la raíz y base del tallo, mientras que la ascospórica (fase sexual) es responsable de la podredumbre del capítulo y la podredumbre del tallo.
.
* Podredumbre del capítulo: los síntomas se observan desde floración hasta madurez, a partir de infecciones iniciadas por ascosporas liberadas por los apotecios. Comienzan como lesiones húmedas en el tallo y receptáculo, con decoloración del tejido afectado, que se torna castaño. Si la enfermedad avanza, la podredumbre puede abarcar todo el capítulo y provocar su caída total o parcial, dejando en la parte superior del tallo, un manojo de fibras aisladas pendientes de la planta. En condiciones de alta humedad ambiental las lesiones se cubren de micelio blanco algodonoso y de esclerocios. Estos adoptan la forma del lugar donde se originan, pudiendo ser alargados (interior de tallos), redondeados (exterior de tallos e interior de aquenios) o formar un “enrejado” entre los aquenios. Los granos que llegan a formarse son de menor tamaño, y en muchos casos vanos, con esclerocios en su interior.
.
- Síntomas de podredumbre de capítulo de girasol y signos (micelio blanco) de Sclerotinia sclerotiorum. Autor: Leite, 2014.
- Campo de girasol en Canadá devastado por Sclerotinia sclerotiorum. Autor: Khalid RASHID | Ph.D. U niversity of Manitoba | AAFC
.
* Podredumbre de la raíz y base del tallo: (marchitamiento): Esta enfermedad aparece anualmente a partir de los esclerocios presentes en el suelo, de su número dependerá la cantidad de plantas atacadas. Los esclerocios producen micelio que penetra a través del sistema radical, el cual se debilita disminuyendo gradualmente su función y ocasionando marchitamiento que puede llegar a la muerte de la planta. Las plantas atacadas son fáciles de ser arrancadas y/o quebradas a nivel del suelo debido a la destrucción de tejidos. En condiciones de alta humedad ambiental, las bases de las plantas se cubren de micelio blanquecino sobre el que se producen esclerocios, aumentando la densidad de inóculo del suelo.
.
- Pudrición húmeda del tallo de girasol por Sclerotinia sclerotiorum. Autor: Eduardo Mizubuti
- Signos de la enfermedad (micelio y esclerocios). Autor: Lisa Rothmann, University of the Free State (UFS) in South Africa
.
.
- Síntomas de la podredumbre del capítulo y del tallo del girasol por S. sclerotiorum. (A) pudrición del capítulo, (B) pudrición del tallo, donde se observan lesiones necróticas y micelio blanco (signo), (C) podredumbre del capítulo en crecimiento donde se observa micelio blanco (signo), (D) pudrición a mitad del tallo, lo que frecuentemente causa quebrado/vuelco. Autor: Gulya et al., 2016
- Síntomas de la podredumbre del capítulo y del tallo del girasol por S. sclerotiorum. (A) Crecimiento micelial grisáceo del patógeno Rhizopus que emerge en el lado de la flor de un capítulo de girasol infectado, (B) Tejidos del capítulo con síntomas de pudrición y destrozo debido a la pudrición del capítujlo por Rhizopus, (C) Trituración y decapitación de un capítulo de girasol debido a la pudrición avanzada por Sclerotinia., (D) Planta de girasol con síntomas de marchitamiento debido a la infección basal del tallo por Sclerotinia. Autor: Gulya et al., 2019
.
.
- 01 Infección de capítulo de girasol por Sclerotinia sclerotiorum. Autor: André Nel, ARC-GCI.
- 02 Micelio de Sclerotinia sclerotiorum infectando capítulo de girasol. El peso del micelio de Sclerotinia que infecta el capítulo del girasol hace que caiga hacia el suelo. Autor: André Nel, ARC-GCI.
- 03 Pudrición de capítulo de girasol por Sclerotinia sclerotiorum . Se observan hebras fibrosas en el extremo superior del tallo y el capítulo, como resultado del daño de la pudrición del capítulo por Sclerotinia. Autor: André Nel, ARC-GCI.
- 04 Esclerocios de Sclerotinia sclerotiorum en capítulo de girasol. Autor: André Nel, ARC-GCI.
- 05 Tallo de girasol mostrando síntomas de pudrición y esclerocios de Sclerotinia sclerotiorum. Autor: André Nel, ARC-GCI.
- 06 Esclerocios de Sclerotinia sclerotiorum
.
Ciclo de vida del patógeno y Epidemiología
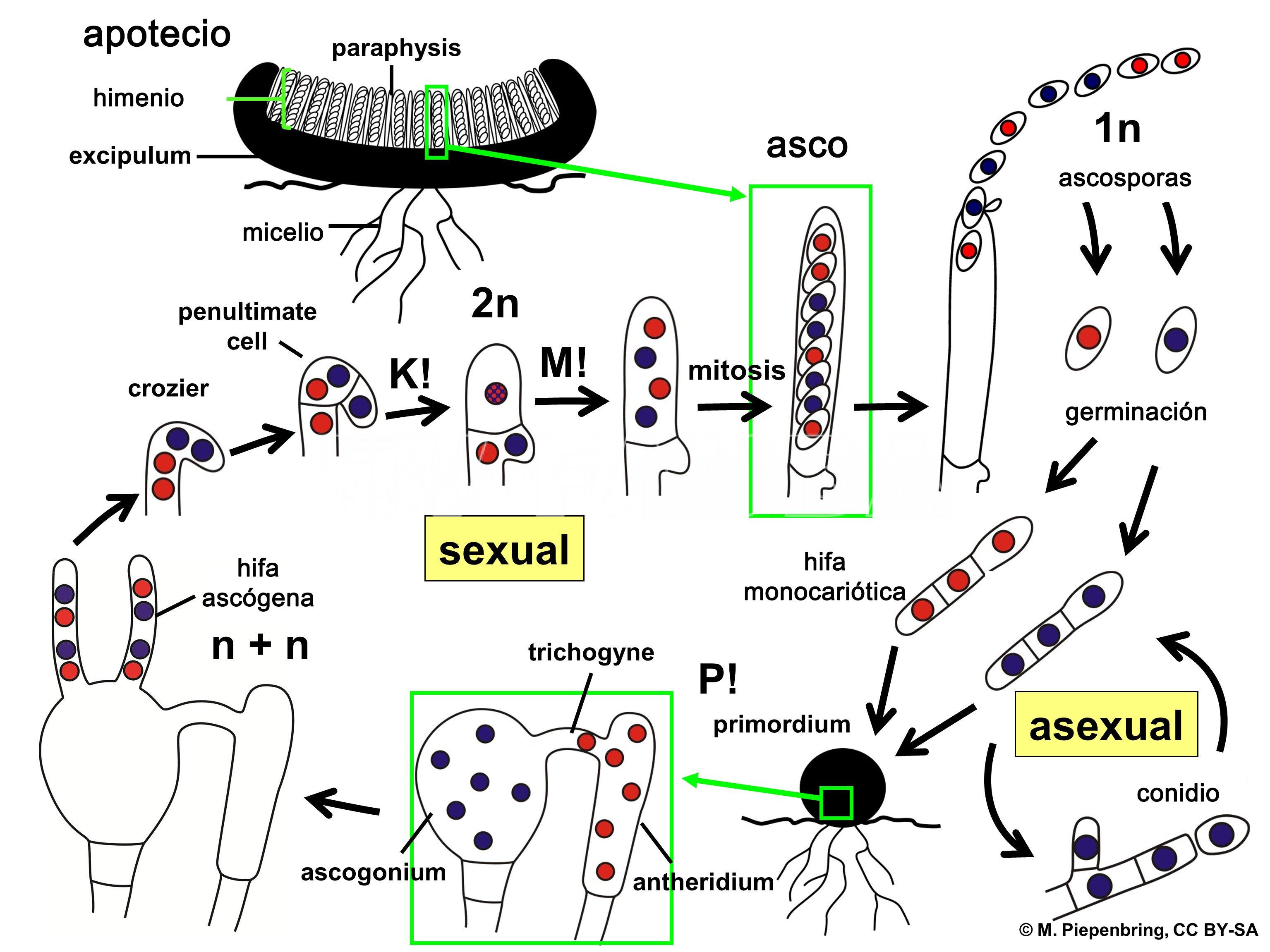
Sclerotinia sclerotiorum es un hongo ascomycota, necrotrófico, cuya forma de supervivencia y resistencia es mediante esclerocios o esclerotos en el suelo, los que están además presentes en semillas, rastrojos y malezas. Las especies de Sclerotinia spp. no se reproducen en forma asexual (no forman conidios). Los esclerocios son la fuente de inóculo más importante (por su cantidad y capacidad de supervivencia ante condiciones adversas). La pérdida de viabilidad y degradación de los mismos depende de varios factores: altas temperaturas, condiciones extremas de alternancia de humedad y la profundidad a la que se encuentran en el suelo. La sobrevivencia de los esclerocios es mayor cuando están ubicados entre los 2 y 30 cm por debajo de la superficie del suelo, siendo los ubicados sobre la superficie los de más rápida degradación. Los esclerocios, según condiciones específicas de temperatura y humedad, producen una germinación micelial o carpogénica (dando apotecios); esta última es la de mayor importancia epidemiológica. Las condiciones óptimas para la producción de apotecios son: alta humedad en los primeros cm del suelo, temperaturas frescas (< 20ºC) y canopeo cerrado. La producción de ascosporas ocurre con valores cercanos al 70% HR. Las ascosporas son expulsadas a unos pocos cm de altura pudiendo ser trasladadas por el viento a considerables distancias (la mayoría entre los 100 a 150 m), depositándose luego sobre la superficie del hospedante. Las ascosporas no infectan los tejidos vivos directamente, sino que colonizan tejidos senescentes o muertos, desde donde se extienden rápidamente al resto de la planta. En la mayor parte de los casos las estructuras florales proveen el material para la colonización inicial. La penetración del hongo se produce por presión mecánica y por disolución enzimática de los tejidos. En la infección micelial, los esclerocios bajo condiciones de alta humedad y temperaturas (más de 20°C) germinan produciendo un micelio blanco, que mediante la lisis (por enzimas y toxinas) de los tejidos radicales, coloniza el órgano atacado. Avanzada la etapa de colonización, el micelio se anastomosa formando los esclerocios, reiniciándose el ciclo. Las plantas afectadas producen esclerocios que quedan en los rastrojos, caen al suelo, o se diseminan con la semilla. Las cubiertas del aquenio de girasol pueden estar infectados con micelio del patógeno y de esa forma se introduce la enfermedad en campos donde previamente no existía.S. sclerotiorum no produce inóculo secundario capaz de reinfectar durante el mismo ciclo, por lo cual las enfermedades que causa son de naturaleza monocíclica.
.
- Representación esquemática del ciclo de vida de Sclerotinia sclerotiorum. P! = plasmogamia; K! = cariogamia; M! = meiosis; 2n = células diploides; 1n = células haploides; n + n = células dicarióticas. Autor: M. Piepenbring
.
- Ciclo de la podredumbre del capítulo y podredumbre de la raíz y base del tallo, causados por Sclerotinia sclerotiorum. Autor: Mathew et al., 2020.
.
.
.
Daños
Los daños más importantes se deben a pérdidas de producción por la caída de los capítulos, al deterioro de la calidad por el aumento de los cuerpos extraños y de la acidez del aceite. Los ataques a las plántulas, raíces o base del tallo, en la mayoría de los casos conducen a la muerte de las plantas y las que no mueren disminuyen su rendimiento.
.
Las Medidas de Manejo Integrado de la enfermedad incluyen:
* Elección de genotipos tolerantes (resistencia poligénica o cuantitativa o no específica o general). Es conveniente consultar las publicaciones anuales de comportamiento de híbridos RED INTA-ASAGIR / Red Nacional de cultivares de girasol (ej. Campaña 2019- 2020), en donde el INTA evalúa el comportamiento de los híbridos frente a la inoculación artificial de Sclerotinia sclerotiorum, registrando la incidencia (%) de la PHC. (*)
* Utilizar semilla libre del patógeno, producida en campos no infectados
* Usar semilla de alto poder germinativo tratada con fungicidas
* Rotación prolongadas con cultivos de gramíneas
* Historia del lote: evitar lotes con registros de epidemias previas de la enfermedad
* Elección de la fecha de siembra que permita escapar del ambiente predisponerte durante el momento de mayor susceptibilidad del cultivo (evitar que la floración ocurra en condiciones favorables al patógeno)
* Manejo de la densidad y uniformidad, evitando generar un microambiente favorable para el desarrollo de la enfermedad en el canopeo
* Regular el riego para evitar períodos de alta humedad relativa durante el momento de mayor susceptibilidad del cultivo
* Nutrición balanceada (N)
* Limpieza de la maquinaria
* Control biológico (ej Trichoderma)
* Activación de defensas
* Control químico (carbedazim, fluazinam, tebuconazole, entre otros)
(*) Los programas de mejoramiento genético de girasol están orientados a la obtención de resistencia a la podredumbre húmeda del capítulo (PHC). La resistencia genética a la podredumbre basal ha sido comprobada en numerosos trabajos y en otros países hay programas específicos que la utilizan. En nuestro país, debido a la menor incidencia de esta enfermedad en la disminución de los rendimientos, no existen programas especiales de mejoramiento genético para la PHT. La Estación Experimental Balcarce del INTA publica anualmente la lista de híbridos de girasol de buen comportamiento, de acuerdo con ensayos con inoculación artificial. Los materiales detectados como de intermedio o buen comportamiento son los híbridos recomendados ante ataques de moderada intensidad.
.
- Síntomas de la podredumbre del tallo y del capítulo de girasol por Sclerotinia sclerotiorum. Autor: Khalid RASHID | Ph.D. U niversity of Manitoba | AAFC
.
.
.
.
Bibliografía
Albert D, Dumonceaux T, Carisse O, et al. (2022) Combining Desirable Traits for a Good Biocontrol Strategy against Sclerotinia sclerotiorum. Microorganisms 10(6): 1189. doi: 10.3390/microorganisms10061189
Amselem J, Cuomo CA, van Kan JAL, et al. (2011) Genomic analysis of the necrotrophic fungal pathogens Sclerotinia sclerotiorum and Botrytis cinerea. PLoS Genetics 7, e1002230. doi: 10.1371/journal.pgen.1002230
Bán R, Baglyas G, Virányi F, et al. (2017) The chemical inducer, BTH (benzothiadiazole) and root colonization by mycorrhizal fungi (Glomus spp.) trigger resistance against white rot (Sclerotinia sclerotiorum) in sunflower. Acta Biologica Hungarica 68(1): 50-59. doi: 10.1556/018.68.2017.1.5
Baniasadi F, Shahidi Bonjar GH, Baghizadeh A, et al. (2009) Biological Control of Sclerotinia sclerotiorum, Causal Agent of Sunflower Head and Stem Rot Disease, by Use of Soil borne Actinomycetes Isolates. American Journal of Agricultural and Biological Sciences 4(2): 146-151. doi : 10.3844/ajabssp.2009.146.151
Bazzalo ME, Dimarco P, Martinez F, et al. (1991) Indicators of resistance of sunflower plant to basal stalk rot (Sclerotinia sclerotiorum): Symptomatological, biochemical, anatomical, and morphological characters of the host. Euphytica 57(3): 195–205. doi: 10.1007/BF00039666
Boland GJ, Hall R (1994) Index of plant hosts of Sclerotinia sclerotiorum. Canadian Journal of Plant Pathology 16: 93-108. doi: 10.1080/07060669409500766
Bolton MD, Thomma BPHJ, Nelson BD (2006) Sclerotinia sclerotiorum (Lib.) de Bary: biology and molecular traits of a cosmopolitan pathogen. Molecular Plant Pathology 7: 1-16. doi: 10.1111/j.1364-3703.2005.00316.x
Cao Y, Zhang X, Song X, et al. (2024) Efficacy and toxic action of the natural product natamycin against Sclerotinia sclerotiorum. Pest Manag Sci. 10.1002/ps.7930
Ćosić J, Jurković D, Vrandečić K, Kaučić D (2014) Survival of buried Sclerotinia sclerotiorum sclerotia in undisturbed soil. HELIA 35(56): 73–78. doi: 10.2298/hel1256073c
Dean R, Van Kan JAL, Pretorius ZA, et al. (2012) The Top 10 fungal pathogens in molecular plant pathology. Molecular Plant Pathology 13: 414–430. doi: 10.1111/j.1364-3703.2011.00783.x
Delgado SG, Castaño F, Cendoya MG, et al. (2020) Analysis of genetic determination of partial resistance to white rot in sunflower. Helia 43: 1-14. doi: 10.1515/helia-2020-0009
, , (2022) The evolutionary and molecular features of the broad-host-range plant pathogen Sclerotinia sclerotiorum. Molecular Plant Pathology 00: 1– 16. doi: 10.1111/mpp.13221
Ebrahimi R, Rahmanpour S, Ghoosta Y, Ghaffari M (2014) Reaction and survival of four types of sunflowers against Sclerotinia sclerotiorum under controlled conditions. Archives of Phytopathology and Plant Protection 47(16): 2033-2042. doi: 10.1080/03235408.2013.868694
Ekins MG, Hayden HL, Aitken EAB, et al. (2011) Population structure of Sclerotinia sclerotiorum on sunflower in Australia. Australasian Plant Pathology 40(2): 99–108. doi: 10.1007/s13313-010-0018-6
El-Ashmony RMS, Zaghloul NSS, Milošević M, et al. (2022) The Biogenically Efficient Synthesis of Silver Nanoparticles Using the Fungus Trichoderma harzianum and Their Antifungal Efficacy against Sclerotinia sclerotiorum and Sclerotium rolfsii. Journal of Fungi. 8(6): 597. doi: 10.3390/jof8060597
Fass MI, Rivarola M, Ehrenbolger GF, et al. (2020) Exploring sunflower responses to Sclerotinia head rot at early stages of infection using RNA-seq analysis. Scientific Reports 10, 13347. doi: 10.1038/s41598-020-70315-4
Filippi CV, Zubrzycki JE, Di Rienzo JA, et al. (2017) Phenotyping Sunflower Genetic Resources for Sclerotinia Head Rot Response: Assessing Variability for Disease Resistance Breeding. Plant Disease 101(11): 1941-1948. doi: 10.1094/PDIS-12-16-1784-RE
Filippi CV, Zubrzycki JE, Di Rienzo JA, et al. (2020) Unveiling the genetic basis of Sclerotinia head rot resistance in sunflower. BMC Plant Biol 20: 322. doi: 10.1186/s12870-020-02529-7
Fusari CM, Di Rienzo JA, Troglia C, et al. (2012) Association mapping in sunflower for Sclerotinia Head Rot resistance. BMC Plant Biology 12: 93. doi: 10.1186/1471-2229-12-93
Gambhir N, Kamvar ZN, Higgins R, et al. (2020) Spontaneous and Fungicide-Induced Genomic Variation in Sclerotinia sclerotiorum. Phytopathology. doi: 10.1094/PHYTO-10-20-0471-FI
Garg H, Li H, Sivasithamparam K, Barbetti MJ (2013) Differentially Expressed Proteins and Associated Histological and Disease Progression Changes in Cotyledon Tissue of a Resistant and Susceptible Genotype of Brassica napus Infected with Sclerotinia sclerotiorum. PLoS ONE 8(6): e65205. doi: 10.1371/journal.pone.0065205
Gulya TJ, Mathew F, Harveson R, et al. (2016) Diseases of Sunflower. In: McGovern R., Elmer W. (eds) Handbook of Florists’ Crops Diseases. Handbook of Plant Disease Management. Springer, Cham. doi: 10.1007/978-3-319-32374-9_27-1
Gulya T, Harveson R, Mathew F, et al. (2019) Comprehensive Disease Survey of U.S. Sunflower: Disease Trends, Research Priorities and Unanticipated Impacts. Plant Disease 103(4): 601-618. doi: 10.1094/PDIS-06-18-0980-FE
Hossain MM, Sultana F, Rubayet MT, et al. (2025) White Mold: A Global Threat to Crops and Key Strategies for Its Sustainable Management. Microorganisms 13(1): 4. doi: 10.3390/microorganisms13010004
, , , Genome‐wide alternative splicing profiling in the fungal plant pathogen Sclerotinia sclerotiorum during the colonization of diverse host families. Mol Plant Pathology 22: 31– 47. doi: 10.1111/mpp.13006
Kamal MM, Savocchia S, Lindbeck KD, et al. (2016) Biology and biocontrol of Sclerotinia sclerotiorum (Lib.) de Bary in oilseed Brassicas. Australasian Plant Pathology 45(1): 1–14. doi: 10.1007/s13313-015-0391-2
Kusch S, Larrouy J, Ibrahim HMM, et al. (2021) Transcriptional response to host chemical cues underpins the expansion of host range in a fungal plant pathogen lineage. ISME J. doi: 10.1038/s41396-021-01058-x
Lehner MDS, Alves K, Del Ponte EM, Pethybridge SJ (2021) Comparing the Fungicide Sensitivity of Sclerotinia sclerotiorum Using Mycelial Growth and Ascospore Germination Assays. Plant Disease. doi: 10.1094/PDIS-06-21-1234-SC
Leite RMVBC (2014) Disease Management in Sunflowers, Chapter 7, pp. 165-186. In: Arribas JI (Ed.) Sunflowers: Growth and Development, Environmental Influences and Pests/Diseases. Nova Science Publishers Inc. ISBN: 978-1-63117-347-9
Liang X, Rollins JA (2018) Mechanisms of Broad Host Range Necrotrophic Pathogenesis in Sclerotinia sclerotiorum. Phytopathology 108(10): 1128-1140. doi: 10.1094/PHYTO-06-18-0197-RVW
Liu J, Zhang Y, Meng Q, et al. (2017) Physiological and biochemical responses in sunflower leaves infected by Sclerotinia sclerotiorum. Physiological and Molecular Plant Pathology 100: 41-48. doi: 10.1016/j.pmpp.2017.06.001
, , , et al (2024) In-field climatic factors driving Sclerotinia head rot progression across different sunflower planting dates. Plant Pathology 00: 1–15. doi: 10.1111/ppa.13873
Mathew F, Harveson R, Block C, et al. (2020) Sclerotinia sclerotiorum Diseases of Sunflower (White mold). Plant Health Instructor. doi: 10.1094/PHI-I-2020-1201-01
Mbengue M, Navaud O, Peyraud R, et al. (2016) Emerging Trends in Molecular Interactions between Plants and the Broad Host Range Fungal Pathogens Botrytis cinerea and Sclerotinia sclerotiorum. Frontiers in Plant Science 7: 422. doi: 10.3389/fpls.2016.00422
Mei J, Ding Y, Li Y, et al. (2016) Transcriptomic comparison between Brassica oleracea and rice (Oryza sativa) reveals diverse modulations on cell death in response to Sclerotinia sclerotiorum. Sci Rep 6: 33706. doi: 10.1038/srep33706
Monazzah M, Tahmasebi Enferadi S, Rabiei Z (2018) Enzymatic activities and pathogenesis‐related genes expression in sunflower inbred lines affected by Sclerotinia sclerotiorum culture filtrate. Journal of Applied Microbiology 125: 227-242. doi: 10.1111/jam.13766
Musa-Khalifani K, Darvishzadeh R, Abrinbana M (2021) Resistance against Sclerotinia basal stem rot pathogens in sunflower. Trop. plant pathol. 46: 651–663. doi: 10.1007/s40858-021-00463-z
Na R, Luo Y, Bo H, et al. (2018) Responses of sunflower induced by Sclerotinia sclerotiorum infection. Physiological and Molecular Plant Pathology 102: 113-121. doi: 10.1016/j.pmpp.2017.12.004
Nicot PC, Avril F, Duffaud M, et al. (2018) Differential susceptibility to the mycoparasite Paraphaeosphaeria minitans among Sclerotinia sclerotiorum isolates. Tropical Plant Pathology 1–12. doi: 10.1007/s40858-018-0256-7
O’Sullivan CA, Belt K, Thatcher LF (2021) Tackling Control of a Cosmopolitan Phytopathogen: Sclerotinia. Front. Plant Sci. 12: 707509. doi: 10.3389/fpls.2021.707509
Peluffo L, Lia V, Troglia C, et al. (2010) Metabolic profiles of sunflower genotypes with contrasting response to Sclerotinia sclerotiorum infection. Phytochemistry 71(1): 70-80. doi: 10.1016/j.phytochem.2009.09.018
(1979) Sclerotinia sclerotiorum: history, diseases and symptomatology, host range, geographic distribution, and impact. Phytopathology 69: 875–880. doi: 10.1094/Phyto-69-875
(2022) Predicting field diseases caused by Sclerotinia sclerotiorum: A review. Plant Pathology 00: 1– 16. doi: 10.1111/ppa.13643
, , , et al. (2024) Predicting airborne ascospores of Sclerotinia sclerotiorum through machine learning and statistical methods. Plant Pathology 00: 1–16. doi: 10.1111/ppa.13902
Rönicke S, Hahn V, Vogler A, Friedt W (2005) Quantitative Trait Loci Analysis of Resistance to Sclerotinia sclerotiorum in Sunflower. Phytopathology 95(7): 834-839. doi: 10.1094/PHYTO-95-0834
Rothmann LA, McLaren Neal W (2018) Sclerotinia sclerotiorum disease prediction: A review and potential applications in South Africa. South African Journal of Science 114(3-4 ): 1-9. doi: 10.17159/sajs.2018/20170155
Saharan GS, Mehta N (2008) Sclerotinia Diseases of Crop Plants: Biology, Ecology and Disease Management. Springer, Dordrecht. 485 p. doi: 10.1007/978-1-4020-8408-9
Seifbarghi S, Borhan MH, Wei Y, et al. (2017) Changes in the Sclerotinia sclerotiorum transcriptome during infection of Brassica napus. BMC Genomics 18: 266. doi: 10.1186/s12864-017-3642-5
Seiler GJ, Misar CG, Gulya TJ, et al. (2017) Identification of Novel Sources of Resistance to Sclerotinia Basal Stalk Rot in South African Sunflower Germplasm. Plant Health Progress (online). doi: 10.1094/PHP-01-17-0007-RS
, , , et al (2024) The schizotrophic lifestyle of Sclerotinia sclerotiorum. Molecular Plant Pathology 25: e13423. doi: 10.1111/mpp.13423
Singh M, Avtar R, Lakra N, et al. (2021) Genetic and Proteomic Basis of Sclerotinia Stem Rot Resistance in Indian Mustard [Brassica juncea (L.) Czern & Coss.]. Genes 12(11): 1784. doi: 10.3390/genes12111784
Smolińska U, Kowalska B (2018) Biological control of the soil-borne fungal pathogen Sclerotinia sclerotiorum – a review. J Plant Pathol 100: 1–12. doi: 10.1007/s42161-018-0023-0
Talukder ZI, Underwood W, Misar CG, et al. (2021) Unraveling the Sclerotinia Basal Stalk Rot Resistance Derived From Wild Helianthus argophyllus Using a High-Density Single Nucleotide Polymorphism Linkage Map. Front. Plant Sci. 11: 617920. doi: 10.3389/fpls.2020.617920
Taylor A, Coventry E, Handy C, et al. (2018) Inoculum potential of Sclerotinia sclerotiorum sclerotia depends on isolate and host plant. Plant Pathology (in press). doi: 10.1111/ppa.12843
Vuong TD, Hoffman DD, Diers BW, et al. (2004) Evaluation of Soybean, Dry Bean, and Sunflower for Resistance to Sclerotinia sclerotiorum. Crop Science 44(3): 777-783. doi: 10.2135/cropsci2004.7770
Wang Z, Ma L-Y, Cao J, et al. (2019) Recent Advances in Mechanisms of Plant Defense to Sclerotinia sclerotiorum. Front. Plant Sci. 10:1314. doi: 10.3389/fpls.2019.01314
Wei W, Xu L, Peng H, et al. (2022) A fungal extracellular effector inactivates plant polygalacturonase-inhibiting protein. Nat Commun 13: 2213. doi: 10.1038/s41467-022-29788-2
Xu L, Li G, Jiang D, Chen W (2018) Sclerotinia sclerotiorum: An Evaluation of Virulence Theories. Annual Review of Phytopathology 56: 311-338. doi: 10.1146/annurev-phyto-080417-050052
Zeng W, Wang D, Kirk W, Hao J (2012) Use of Coniothyrium minitans and other microorganisms for reducing Sclerotinia sclerotiorum. Biol Control 60: 225–232. doi: 10.1016/j.biocontrol.2011.10.009
Zubrzycki JE (2014) Estudio de la resistencia a Sclerotinia sclerotiorum en líneas endocriadas de girasol. Tesis doctoral, Facultad de Farmacia y Bioquímica, Universidad de Buenos Aires. Link
Zubrzycki JE, Maringolo CA, Filippi CV, et al. (2017) Main and epistatic QTL analyses for Sclerotinia Head Rot resistance in sunflower. PLoS ONE 12(12): e0189859. doi: 10.1371/journal.pone.0189859