.
Condición fitosanitaria: Presente ampliamente distribuida
Grupo de cultivos: Cereales
Especie hospedante: Cebada (Hordeum vulgare; Hordeum vulgare var. distichon (L.) Hook.f., 1896) y avena (Avena sativa)
Rango de hospedantes: específico / estrecho
Epidemiología: monocíclica, subaguda.
Etiología: Hongo. Biotrófico
Agente causal: Ustilago hordei (Pers.) Lagerh. 1889
Taxonomía: Fungi > Basidiomycota > Ustilaginomycotina > Ustilaginomycetes > Ustilaginales > Ustilaginaceae > Ustilago
.
Para una infección exitosa, dos esporidios haploides de tipos de apareamiento opuestos se fusionan para formar un filamento dicariótico infeccioso, que posteriormente se diferencia para formar un apresorio, una célula de hifa hinchada que conduce a la penetración directa de las células epidérmicas del hospedante. Durante la colonización de plantas, U. hordei prolifera tanto extra como intracelularmente y forma estructuras de alimentación similares a haustorios en las células hospedante (Ökmen et al., 2018). U. hordei alcanza y se establece en el meristema del hospedante y luego crece con la planta hasta que el meristema floral desarrolla espiguillas, lo que probablemente da una señal al hongo para que se multiplique y esporule. La proliferación masiva y la esporulación del hongo patógeno en la inflorescencia de la cebada se muestran mediante la producción masiva de teliosporas de carbón marrón oscuro (Hu et al., 2002).
.
.
Síntomas y signos
Destrucción total de la flor. Sólo queda el raquis cubierto por una masa pulverulenta de esporas negras.
.
- Carbón en Andreia, Bigand, Sta Fe. Autores: Silvana Di Nubila, Marcelo Carmona
- Carbón en Andreia, Bigand, Sta Fe. Autores: Silvana Di Nubila, Marcelo Carmona
- Carbón en Andreia, Bigand, Sta Fe. Autores: Silvana Di Nubila, Marcelo Carmona
.
.
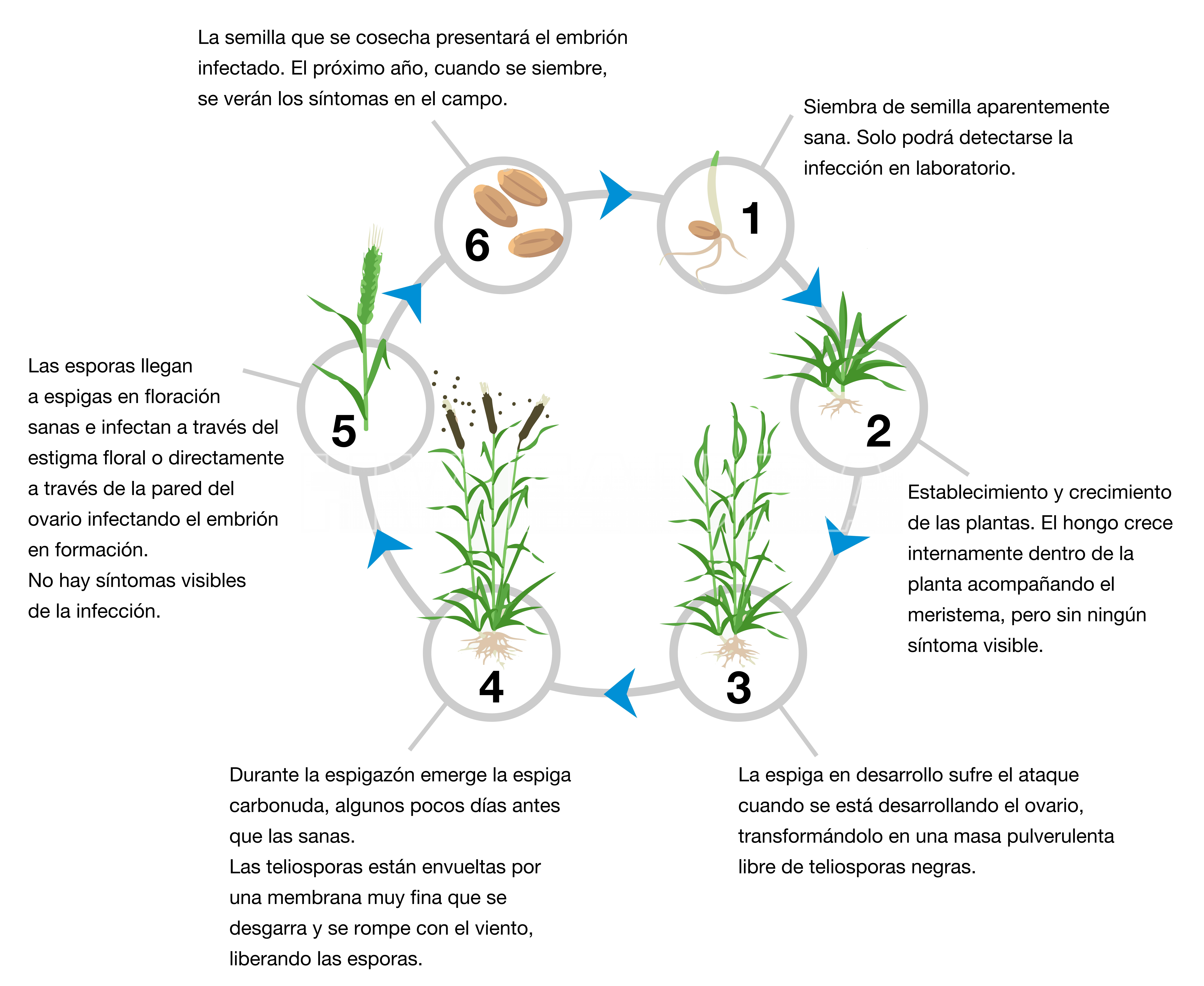
Ciclo de la enfermedad y epidemiología
La infección ocurre durante la floración.
Los granos infectados tienen apariencia normal pero en su interior (embrión) se aloja el micelio del hongo (en dormición). Si la semilla infectada se siembra, la espiga aparecerá con los síntomas descriptos anteriormente.
.
- Ciclo biológico-agronómico del carbón volador de los cereales (Ustilago spp.). Fuente: Carmona y Sautua, 2020.
.
Condiciones predisponentes
Alto porcentaje de semillas contaminadas.
.
Antecedentes
Puede ser considerada una enfermedad secundaria. Se presenta con bajos valores de incidencia, principalmente por el uso de fungicidas eficientes como curasemillas. Si el curado de las semillas no es efectivo, puede haber pérdidas.
.
Manejo
Evitar el empleo de semillas con 10% o más de infección. Debido al relativamente elevado umbral de daño económico de esta enfermedad (2 % de espigas carbonudas), el esquema de control debería estar dirigido principalmente a los lotes destinados a semilla. Las muestras a sembrar deberían ser analizadas en laboratorios especializados para determinar el nivel de infección especialmente si provienen de campos donde hubo carbón volador. La protección química contra carbón, debería ser llevada a cabo en el caso de contar con una infección en semillas que justifique la aplicación (por ej. 0.5 % de embriones infectados). En el mercado existe una oferta muy amplia de productos.
.
- Carbón de la cebada. Oro Verde, Paraná (ER). 15-10-2020. Autor: Dra. Norma Formento
- Carbón de la cebada. Oro Verde, Paraná (ER). 15-10-2020. Autor: Dra. Norma Formento
- Carbón de la cebada. Oro Verde, Paraná (ER). 15-10-2020. Autor: Dra. Norma Formento
- Carbón de la cebada. Oro Verde, Paraná (ER). 15-10-2020. Autor: Dra. Norma Formento
- Carbón de la cebada. Oro Verde, Paraná (ER). 15-10-2020. Autor: Dra. Norma Formento
.
.
Bibliografía
Alfaro M, Oguiza JA, Ramírez L, Pisabarro AG (2014) Comparative analysis of secretomes in basidiomycete fungi. J Proteomics. 102: 28-43. doi: 10.1016/j.jprot.2014.03.001
Ali S, Laurie JD, Linning R, et al. (2014) An immunity-triggering effector from the Barley smut fungus Ustilago hordei resides in an Ustilaginaceae-specific cluster bearing signs of transposable element-assisted evolution. PLoS Pathog. 10(7): e1004223. doi: 10.1371/journal.ppat.1004223
Begerow D, Stoll M, Bauer R (2006) A phylogenetic hypothesis of Ustilaginomycotina based on multiple gene analyses and morphological data. Mycologia 98(6): 906-16. doi: 10.1080/15572536.2006.11832620
Gaudet DA, Wang Y, Penniket C, et al. (2010) Morphological and molecular analyses of host and nonhost interactions involving barley and wheat and the covered smut pathogen Ustilago hordei. Mol. Plant–Microbe Interact. 23: 1619–1634. doi: 10.1094/MPMI-11-09-0271
Hu GG, Linning R, Bakkeren G (2002) Sporidial mating and infection process of the smut fungus, Ustilago hordei, in susceptible barley. Canadian Journal of Botany. doi: 10.1139/b02-098
Ökmen B, Mathow D, Hof A, et al. (2018) Mining the effector repertoire of the biotrophic fungal pathogen Ustilago hordei during host and non-host infection. Molecular Plant Pathology 19: 2603-2622. doi: 10.1111/mpp.12732
Ökmen B, Schwammbach D, Bakkeren G, et al. (2021) The Ustilago hordei-Barley Interaction Is a Versatile System for Characterization of Fungal Effectors. J Fungi (Basel) 7(2): 86. doi: 10.3390/jof7020086
Ökmen B, Jaeger E, Schilling L, et al. (2022) A conserved enzyme of smut fungi facilitates cell-to-cell extension in the plant bundle sheath. Nat Commun 13: 6003. doi: 10.1038/s41467-022-33815-7
Rancelis V, Žilinskaite S, Vaitkuniene V, et al. (1994) Immunodeficiency of barley allelic mutants ‘tweaky spike’.1. Susceptibility to Ustilago nuda (Jens.) Rostr. and Claviceps purpurea Tul. Biologija 4: 14–22.
Schuster M, Schweizer G, Kahmann R (2018) Comparative analyses of secreted proteins in plant pathogenic smut fungi and related basidiomycetes. Fungal Genet Biol. 112: 21-30. doi: 10.1016/j.fgb.2016.12.003
Ullmann L, Wibberg D, Busche T, et al. (2022) Seventeen Ustilaginaceae High-Quality Genome Sequences Allow Phylogenomic Analysis and Provide Insights into Secondary Metabolite Synthesis. J Fungi (Basel) 8(3): 269. doi: 10.3390/jof8030269
Wunderle J, Leclerque A, Schaffrath U, et al. (2012) Assessment of the loose smut fungi (Ustilago nuda and U. tritici) in tissues of barley and wheat by fluorescence microscopy and real-time PCR. Eur J Plant Pathol 133: 865–875. doi: 10.1007/s10658-012-0010-9
Xia W, Yu X, Ye Z (2020) Smut fungal strategies for the successful infection. Microbial Pathogenesis 142: 104039. doi: 10.1016/j.micpath.2020.104039
Zuo W, Ökmen B, Depotter JRL, et al. (2019) Molecular Interactions Between Smut Fungi and Their Host Plants. Annual Review of Phytopathology 57: 411-430. doi: 10.1146/annurev-phyto-082718-100139