.
Condición fitosanitaria: Presente ampliamente distribuida
Grupo de cultivos: Oleaginosas
Especie hospedante: Soja (Glycine max)
Rango de hospedantes: intermedio, infecta soja, pero también se demostró que puede infectar hospedantes alternativos como Conyza bonariensis (Bonacci et al., 2020).
Prácticamente todas las familias botánicas cultivadas son susceptibles a una o más especies de Colletotrichum y es uno de los hongos fitopatógenos más estudiados (Baroncelli et al., 2017).
Etiología: Hongo. Necrotrófico (Hemibiotrófico)
Agente causal: Colletotrichum spp (teleomorfo Glomerella glycines) **
Colletotrichum truncatum (Schwein.) Andrus & W.D. Moore, 1935
.
Taxonomía: Eukaryota > Fungi > Dikarya > Ascomycota > Pezizomycotina > Sordariomycetes > Glomerellales > Glomerellaceae > Colletotrichum
.
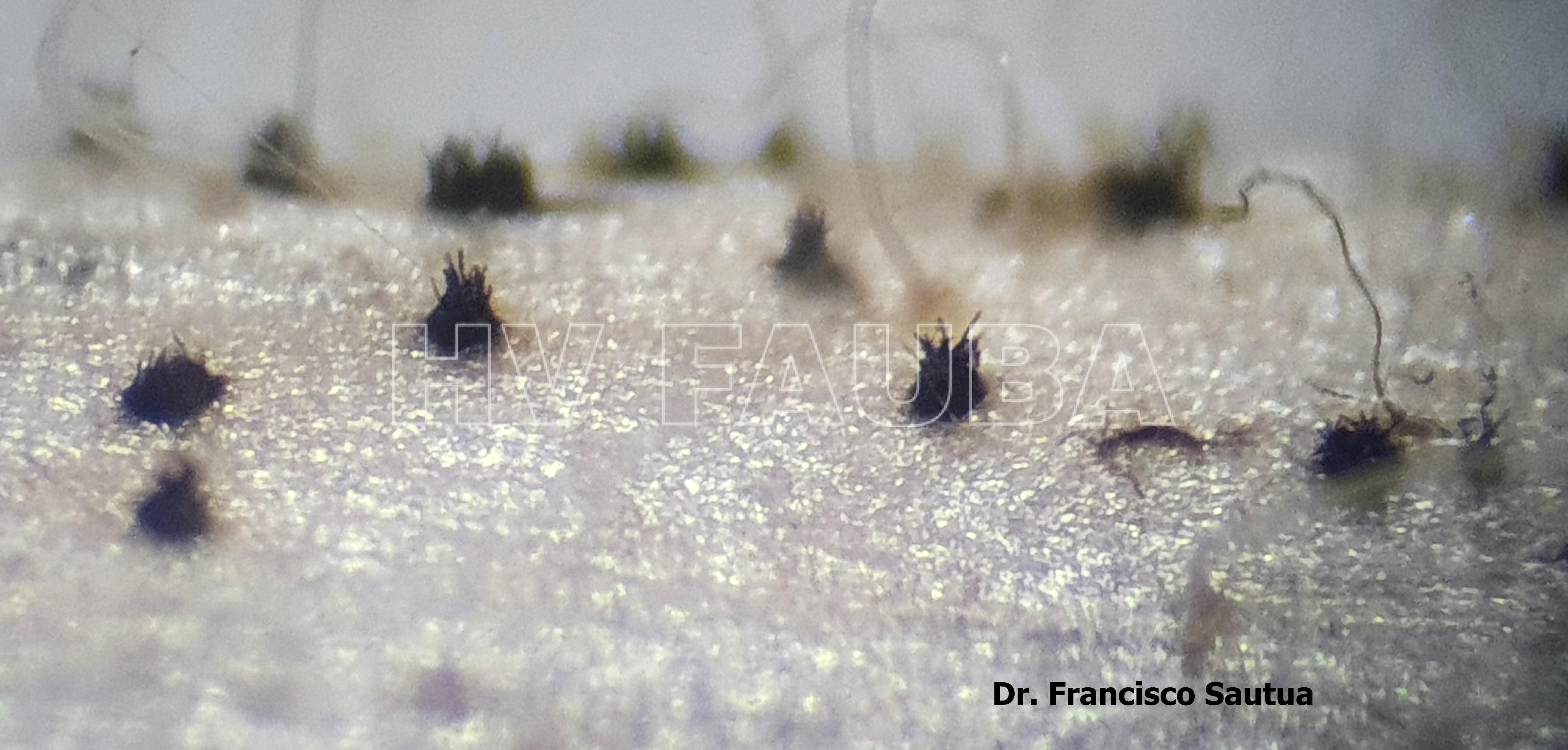
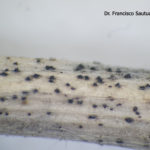
- Acérvulas de Colletotrichum spp. sobre tallo de soja. Autor: Dr. Francisco Sautua
- Acérvulas de Colletotrichum spp. sobre tallo de soja. Autor: Dr. Francisco Sautua
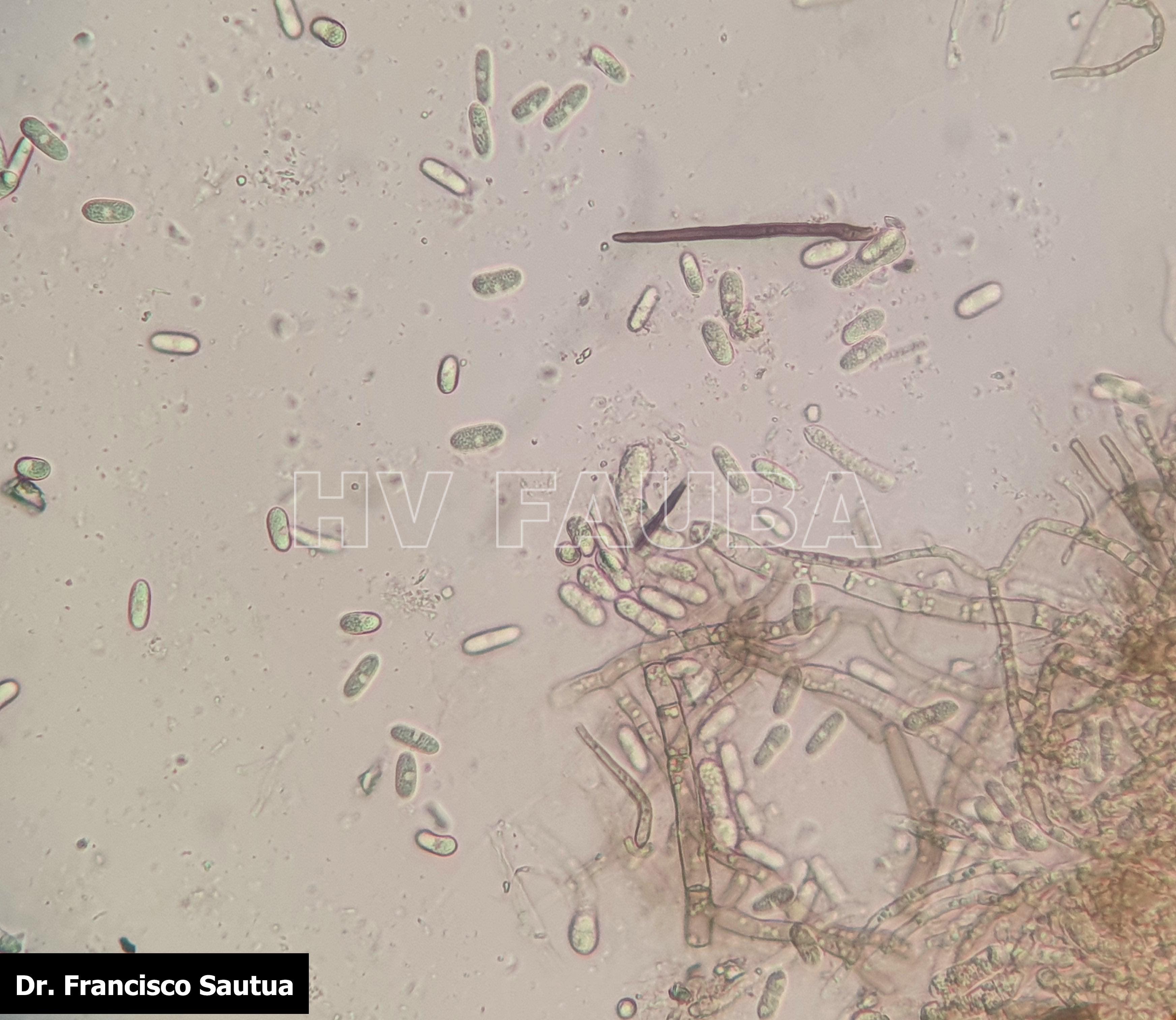
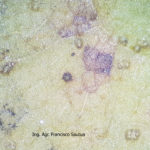
- Conidios de Colletotrichum spp. saliendo a partir de acérvulas sobre tallo de soja. Autor: Dr. Francisco Sautua
.
.
** Si bien C. truncatum se considera la principal especie asociada con la antracnosis de la soja, recientemente se ha informado que otras especies son patógenas en este hospedante (Boufleur et al., 2021). Los hongos del género Colletotrichum se distribuyen en complejos de especies, s.c. (da Silva et al., 2020). Hasta ahora, no es del todo claro si la asociación de nuevas especies de Colletotrichum con la enfermedad está relacionada con especies emergentes o si se debe a los cambios en la taxonomía del género. La falta de características morfológicas confiables ha hecho que la identificación de Colletotrichum spp. un desafío importante a lo largo de los años, lo que ha provocado una considerable confusión taxonómica. Después del advenimiento de la caracterización basada en el ADN, la taxonomía y nomenclatura de Colletotrichum spp. sufrió muchas revisiones. Una correcta identificación de especies requiere un enfoque filogenético multilocus, con distintos s.c. exigiendo diferentes loci para ser analizados (Marin-Felix et al., 2017).
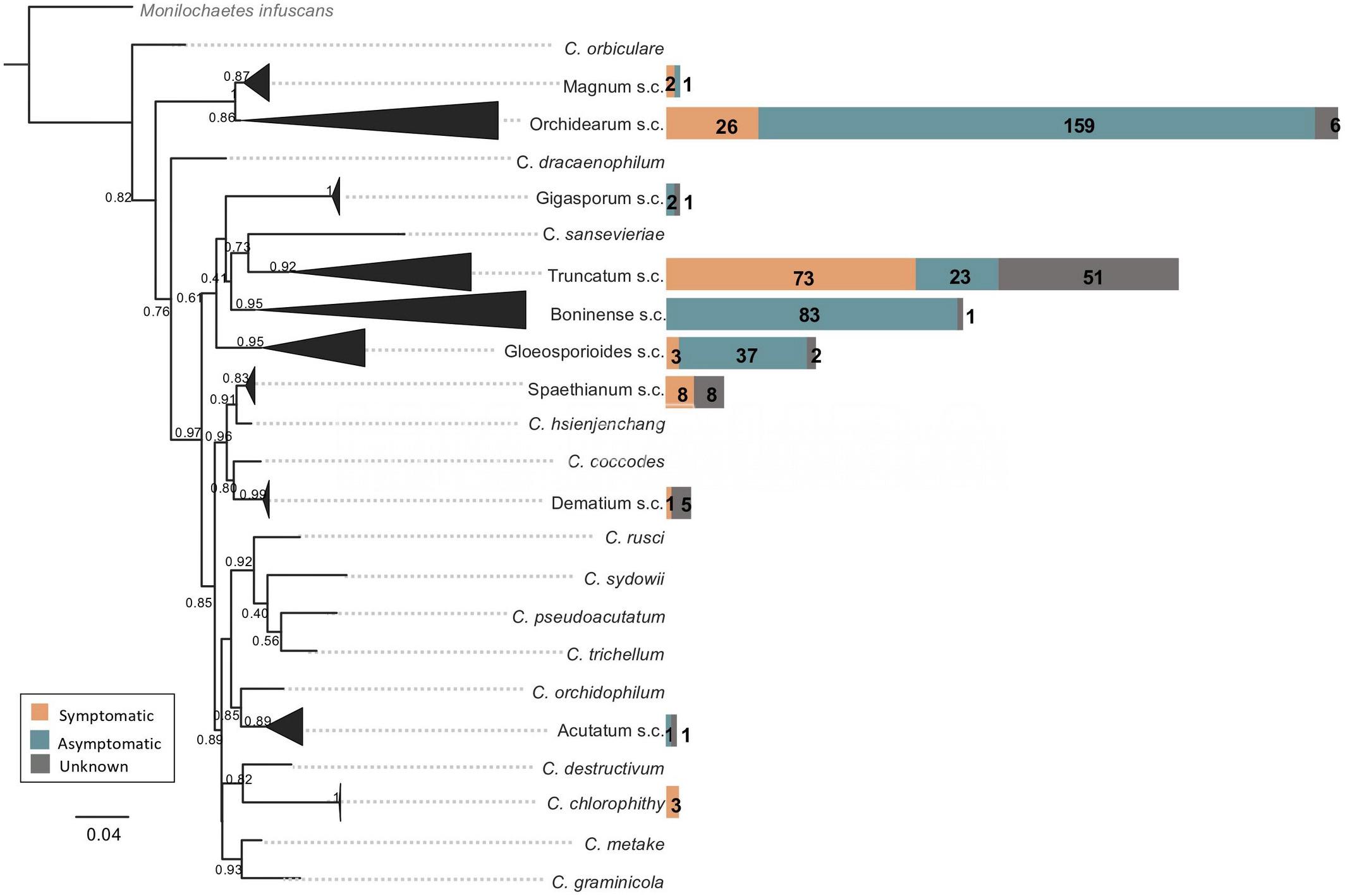
De acuerdo con los análisis de Boufleur et al. (2021), las cepas de Colletotrichum aisladas de soja pertenecen a nueve s.c. (C. acutatum, C. boninense, C. dematium, C. gloeosporioides, C. gigasporum, C. magnum, C. orchidearum, C. spaethianum, and C. truncatum) y una especie única (C. chlorophyti).
Se ha reportado que algunas especies asociadas con la antracnosis de la soja, como C. sojae, C. plurivorum y C. musicola, experimentan el estado sexual (Boufleur et al., 2020; Damm et al., 2019; Ramos et al., 2013). Glomerella glycines (ahora C. sojae) se consideró la forma sexual de al menos tres especies de Colletotrichum en el pasado, creando una confusión taxonómica que fue resuelta por Damm et al. (2019), mientras que otros como C. truncatum y C. destructivum solo ocurren en la forma asexual (Cannon et al., 2012; Damm et al., 2014). Por lo tanto, aún quedan sin respuesta preguntas como: ¿Pueden las especies con un estado sexual tener una mayor capacidad de supervivencia en hospedantes alternativos? ¿Puede la recombinación genética jugar un papel en la supervivencia o ser una fuente importante de variabilidad en estas especies? ¿Podrían las esporas sexuales propagarse de manera diferente a los conidios? ¿Las ascosporas y conidias infectan los tejidos de la soja de la misma manera? Estas son algunas de las preguntas sobre la epidemiología del patógeno que aún necesitan respuestas, ya que impactan directamente en el manejo de la enfermedad.
.
.
- Complejos de especies de Colletotrichum (s.c.) asociados con la soja identificados en todo el mundo sobre la base de un análisis filogenético bayesiano de secuencias espaciadoras transcritas internas (ITS). Los Colletotrichum s.c. asociados con plantas de soja sintomáticas, asintomáticas y desconocidas se indican mediante barras de distintos colores. Autor: Boufleur et al., 2021.
.
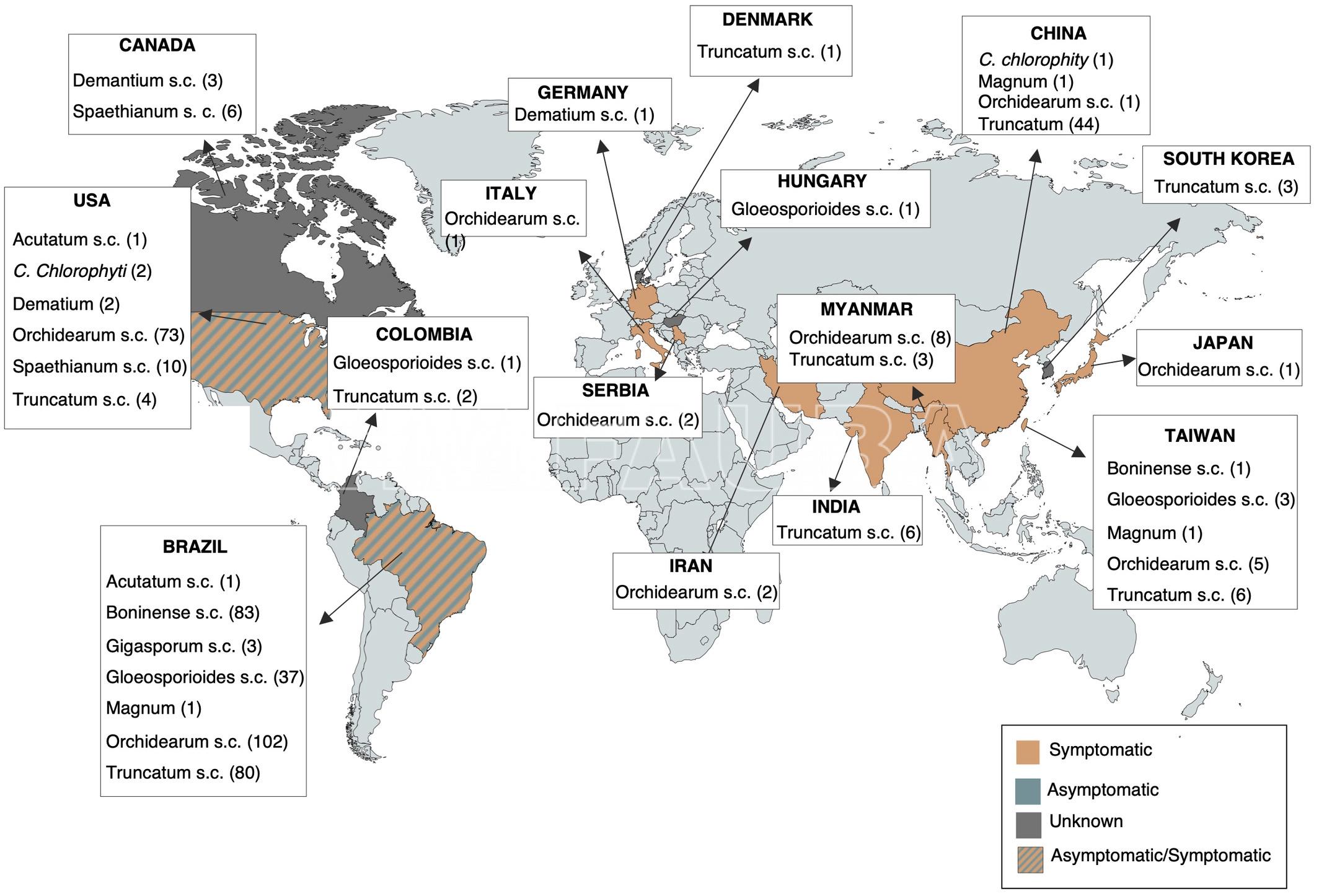
- Distribución global de los complejos de especies de Colletotrichum (s.c.) asociados a la soja en base a la información descargada con secuencias de GenBank. El número de aislamientos en cada país o región se presenta al lado de los nombres del complejo de especies respectivo. Los países o regiones con presencia de plantas de soja sintomáticas, asintomáticas y desconocidas se indican con diferentes colores. Autor: Boufleur et al., 2021.
.
Síntomas
Los síntomas se pueden observar en hojas, tallos, vainas y semillas. Las semillas infectadas pueden ocasionar plántulas enfermas, debilitadas y/o tizón de plántulas. Sobre los cotiledones es posible observar lesiones marrones. En hojas los síntomas no son tan comunes como en tallos y vainas, y se observan generalmente con temperaturas más altas, como necrosis en las nervaduras. En vainas y tallos se observan parches negros o áreas marrones indefinidas con presencia de acérvulas y peritecios. La presencia de setas (proyecciones con aspecto de “espinas”) en las acérvulas, visibles con lupa de 20x, las distingue de los picnidios de Phomopsis.
.
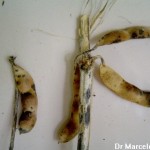
- Tallos de soja con síntomas de antracnosis. Fuente: APS Press.
.
Condiciones ambientales predisponentes para el establecimiento de la enfermedad
Temperaturas superiores a 25ºC y lluvias abundantes a la madurez del cultivo favorecen el desarrollo de esta enfermedad y la infección de la semilla.
.
Importancia relativa
Moderada a alta, según la zona. Si bien los síntomas en tallos y vainas se observan en todas las zonas de cultivo, los síntomas foliares (causantes de mermas de rendimiento) y la infección de la semilla (merma de calidad) es mayor con altas temperaturas.
.
- Fuente: www.cropprotectionnetwork.org
.
Manejo de la enfermedad
* Siembra de semilla sana o tratadas con fungicidas
* Rotación de cultivos
* Aplicación de fungicidas foliares
.
- Síntomas de la Antracnosis de la soja, causada por Colletotrichum spp (teleomorfo Glomerella spp).
- Síntomas de la Antracnosis de la soja, causada por Colletotrichum spp (teleomorfo Glomerella spp).
- Síntomas de la Antracnosis de la soja, causada por Colletotrichum spp (teleomorfo Glomerella spp).
- Acervulas de Colletotrichum spp en soja
- Signos de Antracnosis de la soja, Pozo del Molle, Córdoba. Autor: Daiana Demarchi
- Signos de Antracnosis de la soja, Pozo del Molle, Córdoba. Autor: Daiana Demarchi
- Signos de Antracnosis de la soja, Pozo del Molle, Córdoba. Autor: Daiana Demarchi
- Signos de Antracnosis de la soja, Pozo del Molle, Córdoba. Autor: Daiana Demarchi
- Colletotrichum spp. sobre tallos de soja. Autor: Dr. Francisco Sautua
- Colletotrichum spp. sobre tallos de soja. Autor: Dr. Francisco Sautua
- Acérvulas de Colletotrichum spp. sobre tallos de soja. Autor: Dr. Francisco Sautua
- 01 Acérvulas de Colletotrichum spp. en hoja de soja
- 02 Conidios de Colletotrichum spp.
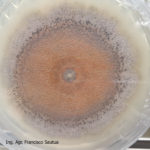
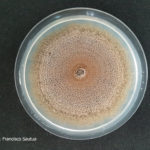
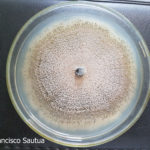
- 03 Colonia de Colletotrichum spp., creciendo sobre APG.
- 04 Colonia de Colletotrichum spp., creciendo sobre APG, con abundantes secreciones mucilaginosas desde las acérvulas (similares a cirros de picnidios).
- 05 Colonia de Colletotrichum spp., creciendo sobre APG, con abundantes secreciones mucilaginosas desde las acérvulas (similares a cirros de picnidios).
- Masas de conidios de Colletotrichum spp. saliendo a partir de acérvulas, envueltas en sustancia mucilaginosa. Autor: Dr. Francisco Sautua
- Masas de conidios de Colletotrichum spp. saliendo a partir de acérvulas, envueltas en sustancia mucilaginosa. Autor: Dr. Francisco Sautua
- Autor: Dirceu Gassen
- Autor: Dirceu Gassen
- Autor: Dirceu Gassen
- Autor: Dirceu Gassen
- Autor: Dirceu Gassen
- Autor: Dirceu Gassen
- Autor: Dirceu Gassen
- Autor: Dirceu Gassen
- Autor: Dirceu Gassen
- Autor: Dirceu Gassen
- Autor: Dirceu Gassen
- Autor: Dirceu Gassen
- Autor: Dirceu Gassen
- Autor: Dirceu Gassen
- Autor: Dirceu Gassen
- Autor: Dirceu Gassen
- Autor: Dirceu Gassen
- Autor: Dirceu Gassen
- Autor: Dirceu Gassen
- Autor: Dirceu Gassen
- Autor: Dirceu Gassen
- Autor: Dirceu Gassen
- Autor: Dirceu Gassen
- Autor: Dirceu Gassen
.
.
.
Bibliografía
Barcelos QL, Pinto JMA, Vaillancourt LJ, Souza EA (2014) Characterization of Glomerella Strains Recovered from Anthracnose Lesions on Common Bean Plants in Brazil. PLoS ONE 9(3): e90910. doi: 10.1371/journal.pone.0090910
Baroncelli R, Talhinhas P, Pensec F, Sukno SA, Le Floch G and Thon MR (2017) The Colletotrichum acutatum Species Complex as a Model System to Study Evolution and Host Specialization in Plant Pathogens. Front. Microbiol. 8:2001. doi: 10.3389/fmicb.2017.02001
, , , et al. (2022) Genome evolution and transcriptome plasticity associated with adaptation to monocot and eudicot plants in Colletotrichum fungi. bioRxiv 2022.09.22.508453; doi: 10.1101/2022.09.22.508453
Bestor NRC, Robertson AE, Mueller DS (2014) Effect of foliar fungicides on late-season anthracnose stem blight on soybean. Plant Health Progress (online). doi: 10.1094/PHP-RS-14-0013
Bonacci M, Formento Á, Morales M, Orlando J, Ibáñez F, Sartori M, Etcheverry M, Nesci A, Barros G (2020) Conyza bonariensis as an alternative host for Colletotrichum species in Argentina. J Appl Microbiol. doi: 10.1111/jam.14879
Boufleur TR et al. (2020) First report of Colletotrichum musicola causing soybean anthracnose in Brazil. Plant Disease 104: 1858. doi: 10.1094/PDIS-12-19-2627-PDN
Boufleur TR, Ciampi‐Guillardi M, Tikami Í, et al. (2021) Soybean anthracnose caused by Colletotrichum species: Current status and future prospects. Molecular Plant Pathology 22: 393– 409. doi: 10.1111/mpp.13036
Boufleur TR, Massola Júnior NS, Tikami Í, et al. (2021) Identification and Comparison of Colletotrichum Secreted Effector Candidates Reveal Two Independent Lineages Pathogenic to Soybean. Pathogens. 10(11): 1520. doi: 10.3390/pathogens10111520
Boufleur TR, Massola Júnior NS, Becerra S, et al. (2022) Comparative transcriptomic provides novel insights into the soybean response to Colletotrichum truncatum infection. Front. Plant Sci. 13: 1046418. doi: 10.3389/fpls.2022.1046418
, , (2012) Colletotrichum – current status and future directions. Studies in Mycology, 73: 181–213. doi: 10.3114/sim0014
Chen LS, Chu C, Liu CD, Chen RS, Tsay JG (2006) PCR-based Detection and Differentiation of Anthracnose Pathogens, Colletotrichum gloeosporioides and C. truncatum, from Vegetable Soybean in Taiwan. Journal of Phytopathology 154: 654–662. doi: 10.1111/j.1439-0434.2006.01163.x
da Silva LL, Moreno HLA, Correia HLN, et al. (2020) Colletotrichum: species complexes, lifestyle, and peculiarities of some sources of genetic variability. Appl Microbiol Biotechnol 104: 1891–1904. doi: 10.1007/s00253-020-10363-y
da Silva Junior MB, de Resende MLV, Pozza EA, et al. (2021) Phosphites for the management of anthracnose in soybean pods. J Plant Pathol 103: 611–617. doi: 10.1007/s42161-021-00747-y
, , (2014) The Colletotrichum destructivum species complex – hemibiotrophic pathogens of forage and field crops. Studies in Mycology 79: 49–84. doi: 10.1016/j.simyco.2014.09.003
Damm U, Sato T, Alizadeh A, Groenewald JZ, Crous PW (2019) The Colletotrichum dracaenophilum, C. magnum and C. orchidearum species complexes. Stud Mycol. 92: 1-46. doi: 10.1016/j.simyco.2018.04.001
Dias MD, Pinheiro VF, Café-Filho AC (2016) Impact of anthracnose on the yield of soybean subjected to chemical control in the north region of Brazil. Summa Phytopathologica 42(1): 18-23. doi: 10.1590/0100-5405/2114
Dias MD, Dias-Neto JJ, Santos MD, Formento AN, Bizerra LV, Fonseca MEN, Boiteux LS, Café-Filho AC (2019) Current Status of Soybean Anthracnose Associated with Colletotrichum truncatum in Brazil and Argentina. Plants 8: 459. doi: 10.3390/plants8110459
Doyle VP, Oudemans PV, Rehner SA, Litt A (2013) Habitat and Host Indicate Lineage Identity in Colletotrichum gloeosporioides s.l. from Wild and Agricultural Landscapes in North America. PLoS ONE 8(5): e62394. doi: 10.1371/journal.pone.0062394
Ford R, Banniza S, Photita W, Taylor PW (2004) Morphological and molecular discrimination of Colletotrichum truncatum causing anthracnose on lentil in Canada. Australasian Plant Pathology 33(4): 559-569. doi: 10.1071/AP04058
Ghosh R, Bhadra S, Bandyopadhyay M (2016) Morphological and molecular characterization of Colletotrichum capsici causing leaf-spot of Soybean. Tropical Plant Research 3(3): 481-490. doi: 10.22271/tpr.2016.v3.i3.064
, (2023) Appressorium formation is regulated by the Msb2– and Sho1-dependent hierarchical transcriptional network in Colletotrichum gloeosporioides. Plant Pathology 73: 301–315. doi: 10.1111/ppa.13822
Mahmodi F, Kadir JB, Wong MY, et al. (2013) First Report of Anthracnose Caused by Colletotrichum gloeosporioides on Soybean (Glycine max) in Malaysia. Plant Disease 97(6): 841-841. doi: 10.1094/PDIS-10-12-0944-PDN
Marin-Felix Y, Groenewald JZ, Cai L, et al. (2017) Genera of phytopathogenic fungi: GOPHY 1. Stud Mycol. 86: 99-216. doi: 10.1016/j.simyco.2017.04.002
Masi M, Castaldi S, Sautua F, et al. (2022) Truncatenolide, a Bioactive Disubstituted Nonenolide Produced by Colletotrichum truncatum, the Causal Agent of Anthracnose of Soybean in Argentina: Fungal Antagonism and SAR Studies. Journal of Agricultural and Food Chemistry. doi: 10.1021/acs.jafc.2c02502
Münch S, Lingner U, Floss DS, Ludwig N, Sauer N, Deising HB (2008) The hemibiotrophic lifestyle of Colletotrichum species. Journal of Plant Physiology 165: 41-51. doi: 10.1016/j.jplph.2007.06.008
O’Connell, et al. (2012) Lifestyle transitions in plant pathogenic Colletotrichum fungi deciphered by genome and transcriptome analyses. Nature Genetics. doi: 10.1038/ng.2372
Ohtsu M, Jennings J, Johnston MG, et al. (2023) Assaying effector cell-to-cell mobility in plant tissues identifies hypermobility and indirect manipulation of plasmodesmata. Mol Plant Microbe Interact. doi: 10.1094/MPMI-05-23-0052-TA
Poti T, Thitla T, Imaiam I, et al. (2023) Development of colorimetric loop-mediated isothermal amplification (LAMP) assay for detecting the azoxystrobin-resistant isolates in Colletotrichum truncatum. Crop Protection 173: 106358. doi: 10.1016/j.cropro.2023.106358
, , (2023) Development of a colorimetric loop-mediated isothermal amplification (LAMP) assay to facilitate monitoring of carbendazim-resistant isolates of Colletotrichum truncatum based on the β-tubulin E198A mutation. Journal of Phytopathology 171: 744–753. doi: 10.1111/jph.13237
, , , (2013) Molecular characterization of Colletotrichum species causing soybean anthracnose in Argentina. Mycotaxon, 123: 457–465. doi: 10.5248/123.457
Reveglia P, Agudo-Jurado FJ, Barilli E, et al. (2023) Uncovering Phytotoxic Compounds Produced by Colletotrichum spp. Involved in Legume Diseases Using an OSMAC–Metabolomics Approach. Journal of Fungi. 9(6): 610. doi: 10.3390/jof9060610
Rogério F, Gladieux P, Massola NS Jr, Ciampi-Guillardi M (2019) Multiple Introductions Without Admixture of Colletotrichum truncatum Associated with Soybean Anthracnose in Brazil. Phytopathology 109(4): 681-689. doi: 10.1094/PHYTO-08-18-0321-R
, , , et al (2024). Multiple resistance of Colletotrichum truncatum from soybean to QoI and MBC fungicides in Brazil. Journal of Phytopathology 172: e13341. doi: 10.1111/jph.13341
Shi N, Qiu D, Chen F, et al. (2023) Analysis of the difenoconazole-resistance risk and its molecular basis in Colletotrichum truncatum from soybean. Plant Disease. doi: 10.1094/PDIS-12-22-2983-RE
Talhinhas P, Baroncelli R (2021) Colletotrichum species and complexes: geographic distribution, host range and conservation status. Fungal Diversity 110: 109–198. doi: 10.1007/s13225-021-00491-9
Talhinhas P, Baroncelli R (2023) Hosts of Colletotrichum. Mycosphere 14(2): 158–261. Link
Vaillancourt L, Wang J, Hanau R (2000) Genetic regulation of sexual compatibility in Glomerella graminicola. In Colletotrichum: Host specificity, Pathology, and Host-pathogen Interaction; Prusky D, Freeman S, Dickman MB, Eds.; APS Press: St. Paul, MN, USA; pp. 29–44.
Yang HC, Haudenshield JS, Hartman GL (2014) Colletotrichum incanum sp. nov., a curved-conidial species causing soybean anthracnose in USA. Mycologia 106(1): 32-42. doi: 10.3852/13-013
Yang HC, Haudenshield JS, Hartman GL (2015) Multiplex Real-time PCR Detection and Differentiation of Colletotrichum Species Infecting Soybean. Plant Disease 99(11): 1559-1568. doi: 10.1094/PDIS-11-14-1189-RE
Yukari Takaki Ino P, Valeriano I, Penachio Gonçalves M, et al. (2024) First report of Colletotrichum chlorophyti causing soybean anthracnose in Brazil. Plant Disease. doi: 10.1094/PDIS-01-24-0242-PDN