.
Condición fitosanitaria: Presente / Presente
Grupo de cultivos: Oleaginosas
Especie hospedante: Soja (Glycine max)
Etiología: Hongo. Necrotrófico
Agente causal:
a) Diaporthe aspalathi Janse van Rensburg, Castlebury & Crous, nom. et. stat. nov. (MycoBank MB500803), Rensburg et al., 2006 (Cancro meridionalis), denominado anteriormente como Diaporthe phaseolorum var. meridionalis Fernandez,
b) Diaporthe caulivora (Athow & Caldwell) J.M. Santos, Vrandecic & A.J.L. Philips, comb – stat. o nov.(MycoBank MB518520) (Santos et al., 2011) (Cancro caulivora), conocido como Diaporthe phaseolorum var. caulivora K.L. Athow & R.M. Caldwell.
c) Diaporthe ueckerae Udayanga & Castl., 2014, puede infectar humanos inmunodepresivos (micetoma)
.
Taxonomía: Eukaryota > Fungi > Dikarya > Ascomycota > Pezizomycotina > Sordariomycetes > Diaporthales > Diaporthaceae > Diaporthe
.
- D. caulivora. (a) Vista superficial de los cultivos en APD acidificado después de 1 mes. (b) Vista trasera de los cultivos. (c) Cuellos peritheciales en APDA después de 2 meses. (d) Cuellos peritheciales en tallo de soja en cultivo. (e) Ascos (flecha) y ascosporas (punta de flecha). (f) Ascosporas. Barras de escala (c, d) 500 μm, (e) 20 μm, (f) 10 μm. Autor: Hosseini et al., 2020.
.
.
.
Sintomatología
Las plantas presentan lesiones necróticas (cancros) bien definidos en el tallo con tonalidades castaño claro en el centro y bordes pronunciados pardo rojizos, las cuales comienzan en la zona de inserción del pecíolo y se extienden luego sobre el tallo. Estas lesiones pueden causar la muerte de las ramificaciones afectadas e incluso de las plantas, si se localizan en la base de los tallos.
.
Condiciones ambientales predisponentes para el establecimiento de la enfermedad
El cancro causado por DPM es más frecuente en zonas templado-cálidas, mientras que DPC es más observado en zonas templadas-frescas. La intensidad del ataque depende fundamentalmente de la presencia de rastrojo proveniente de un cultivo enfermo, susceptibilidad genética del material, del estadio de crecimiento del cultivo y ocurrencia de abundantes lluvias en las primeras etapas del cultivo, período en el cual se producen las infecciones a partir de los residuos, las cuales no se detectan rápidamente por el largo período de latencia de la enfermedad.
.
Manejo de la enfermedad
El o los agentes causales de la enfermedad pertenecen al grupo de los necrotróficos y como muchos de ellos, su supervivencia ocurre en los rastrojos y semillas. La rotación de cultivos (maíz u otras gramíneas) es una medida imprescindible para aquéllos lotes que presentaron la enfermedad, lo que permitirá la descomposición de los restos de soja infectados y la eliminación del patógeno por inanición. Si bien el porcentaje de transmisión por semillas es bajo, la siembra de semilla infectada determina la introducción de la enfermedad en los lotes, por lo cual es fundamental utilizar semilla sana o tratada químicamente. Actualmente se dispone de cultivares tolerantes o resistentes. La selección de genotipos resistentes a DPM no garantiza necesariamente la obtención de resistencia a DPC.
.
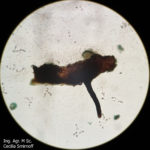
- Peritecio de Diaporthe spp
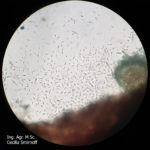
- Ascosporas de Diaporthe spp
.
.
.
Bibliografía
Abdelmagid A, Hafez M, Lawley Y, et al. (2019) First Report of Northern Stem Canker Caused by Diaporthe caulivora on Soybean in Western Canada. Plant Disease 103: 372-372. doi: 10.1094/PDIS-07-18-1185-PDN
Brumer BB, Lopes-Caitar VS, Chicowski AS, et al. (2018) Morphological and molecular characterization of Diaporthe (anamorph Phomopsis) complex and pathogenicity of Diaporthe aspalathi isolates causing stem canker in soybean. Eur J Plant Pathol 151: 1009–1025. doi: 10.1007/s10658-018-1436-5
Cabeza MS, Gómez A, Sasoni N, et al. (2022) Black grain eumycetoma due to Diaporthe ueckerae. Taxonomical update of previous agents of infections due to Diaporthe spp. Med Mycol Case Rep. 39: 1-4. doi: 10.1016/j.mmcr.2022.11.001
Gao Y, Liu F, Duan W, et al. (2017) Diaporthe is paraphyletic. IMA Fungus. 8(1): 153-187. doi: 10.5598/imafungus.2017.08.01.11
Ghimire K, Petrović K, Kontz BJ, et al. (2019) Inoculation Method Impacts Symptom Development Associated with Diaporthe aspalathi, D. caulivora, and D. longicolla on Soybean (Glycine max). Plant Disease 103(4): 677-684. doi: 10.1094/PDIS-06-18-1078-RE
Kandel YR, Phillips XA, Gaska JM, et al. (2021) Effect of Planting Population on Stem Diseases of Soybean in Iowa and Wisconsin. Plant Health Progress 22: 108-112. doi: 10.1094/PHP-07-20-0062-RS
Li S, Song Q, Martins AM, Cregan P (2016) Draft genome sequence of Diaporthe aspalathi isolate MS-SSC91, a fungus causing stem canker in soybean. Genom Data. 7: 262-263. doi: 10.1016/j.gdata.2016.02.002
López-Cardona N, Guevara YA, Gañán-Betancur L, Amaya Gomez CV (2021) First report of Diaporthe ueckerae causing stem canker on soybean (Glycine max L.) in Colombia. Plant Dis. doi: 10.1094/PDIS-04-21-0718-PDN
Maldonado dos Santos JV, Ferreira EGC, Passianotto ALdL, et al. (2019) Association mapping of a locus that confers southern stem canker resistance in soybean and SNP marker development. BMC Genomics 20: 798. doi: 10.1186/s12864-019-6139-6
Mena E, Stewart S, Montesano M, Ponce de León I (2020) Soybean Stem Canker Caused by Diaporthe caulivora; Pathogen Diversity, Colonization Process, and Plant Defense Activation. Front. Plant Sci. 10: 1733. doi: 10.3389/fpls.2019.01733
Mena E, Garaycochea S, Stewart S, et al. (2022) Comparative genomics of plant pathogenic Diaporthe species and transcriptomics of Diaporthe caulivora during host infection reveal insights into pathogenic strategies of the genus. BMC Genomics 23: 175. doi: 10.1186/s12864-022-08413-y
Mena E, Reboledo G, Stewart S, et al. (2023) Comparative analysis of soybean transcriptional profiles reveals defense mechanisms involved in resistance against Diaporthe caulivora. Sci Rep 13: 13061. doi: 10.1038/s41598-023-39695-1
, , (2023) Current understanding of the Diaporthe/Phomopsis complex causing soybean stem canker: A focus on molecular aspects of the interaction. Plant Pathology 73: 31–46. doi: 10.1111/ppa.13803
Petrovic K, Skaltsas D, Castlebury L, et al. (2020) Diaporthe seed decay of soybean [Glycine max (L.) Merr.] is endemic in the United States, but new fungi are involved. Plant Disease. doi: 10.1094/PDIS-03-20-0604-RE
Petrović K, Skaltsas D, Castlebury LA, et al. (2021) Diaporthe Seed Decay of Soybean [Glycine max (L.) Merr.] Is Endemic in the United States, But New Fungi Are Involved. Plant Dis. 105(6): 1621-1629. doi: 10.1094/PDIS-03-20-0604-RE
Petrović K, Šućur Elez J, Crnković M, et al. (2023) The Biochemical Response of Soybean Cultivars Infected by Diaporthe Species Complex. Plants 12(16): 2896. doi: 10.3390/plants12162896
Pioli RN, Morandi EN, Martínez MC, et al. (2003) Morphologic, Molecular, and Pathogenic Characterization of Diaporthe phaseolorum Variability in the Core Soybean-Producing Area of Argentina. Phytopathology 93: 136-46. doi: 10.1094/PHYTO.2003.93.2.136
Rossman AY, Adams GC, Cannon PF, et al. (2015) Recommendations of generic names in Diaporthales competing for protection or use. IMA Fungus 6: 145–154. doi: 10.5598/imafungus.2015.06.01.09
Rothrock CS, Hobbs TW, Phillips DV (1985) Effects of Tillage and Cropping System on Incidence and Severity of Southern Stem Canker of Soybean. Phytopathology 75: 1156-1159. doi: 10.1094/Phyto-75-1156
Udayanga D, Liu X Z, McKenzie EHC, et al. (2011) The genus Phomopsis: biology, applications, species concepts and names of common phytopathogens. Fungal. Divers. 50: 189–225. doi: 10.1007/s13225-011-0126-9
Udayanga D, Liu XZ, Crous PW, et al. (2012) A multi-locus phylogenetic evaluation of Diaporthe (Phomopsis). Fungal. Divers. 56: 157–171. doi: 10.1007/s13225-012-0190-9
Udayanga D, Castlebury LA, Rossman AY, et al. (2015) The Diaporthe sojae species complex: Phylogenetic re-assessment of pathogens associated with soybean, cucurbits and other field crops. Fungal Biology 119: 383-407. doi: 10.1016/j.funbio.2014.10.009