.
Condición fitosanitaria: Presente ampliamente distribuida
Grupo de cultivos: Oleaginosas
Especie hospedante: Soja (Glycine max)
Rango de hospedantes: estrecho, específico.
En inoculaciones artificiales, C. sojina puede infectar otras leguminosas como Phaseolus lunatus, Vigna unguiculata, Arachis hypogaea, Vicia villosa, Vicia faba, Vigna unguiculata subsp. sesquipedalis, Phaseolus coccineus, Lens culinaris, Phaseolus vulgaris, y otras malezas tales como Ambrosia artemisiifolia, Ambrosia trifida, Amaranthus tuberculatus, Amaranthus palmeri, Amaranthus hybridus, Ipomoea spp, Abutilon theophrasti, Chenopodium album, Gossypium spp. (Zhang et al., 2014).
Etiología: Hongo. Necrotrófico
Agente causal: Cercospora sojina (Hara)
Taxonomía: Eukaryota > Fungi > Dikarya > Ascomycota > Pezizomycotina > Dothideomycetes > Capnodiales > Mycosphaerellaceae > Cercospora
.
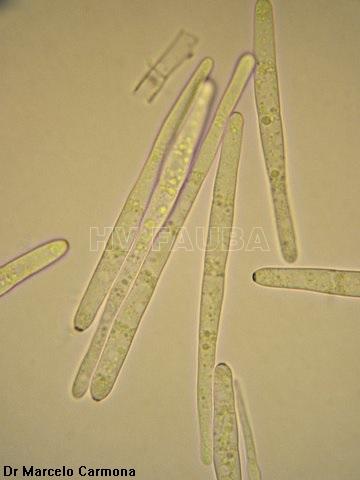
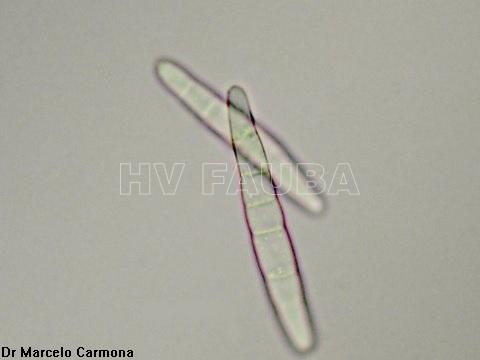
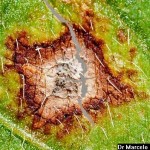
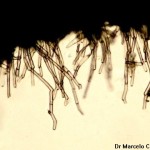
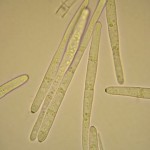
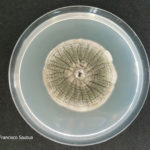
- Conidios de Cercospora sojina. Autor: Dr. Marcelo Carmona
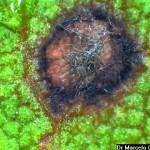
- Conidios de Cercospora sojina. Autor: Dr. Marcelo Carmona
.
.
.
Antecedentes
Esta enfermedad mancha ojo de rana (MOR) fue detectada por primera vez en Japón en el año 1915 (Hara, 1915).
La primera aparición de C. sojina causando MOR en soja en los Estados Unidos fue en el estado de Carolina del Sur en 1924 (Melchers, 1925). Después de 1924, la MOR también se encontró en Mississippi y Louisiana (Haskell, 1926; Lehman, 1928). Desde 1929, la MOR se ha observado en varios estados productores de soja en varios momentos (Athow y Probst, 1952). La MOR también se ha informado de Australia, Canadá, China, Alemania, Japón y Rusia (Athow y Probst, 1952). En países como Brasil, Argentina, Sudáfrica, Nigeria y Zimbabue, la MOR puede causar graves pérdidas de rendimiento.
En nuestro país, fue detectado en la Región del Noroeste – NOA en la campaña 1998-1999 principalmente en lotes de Salta y Tucumán. Con posterioridad a esa campaña, su aparición fue esporádica pero se observó su prevalencia en otras provincias como Entre Ríos, Córdoba, Santa Fe y Buenos Aires.
Durante la campaña 2009 se sucedieron intensos ataques principalmente en la provincia de Córdoba.
.
Sintomatología
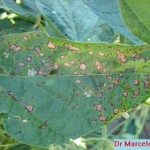
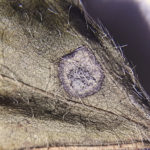
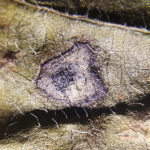
Pequeñas manchas circulares de 1 a 5 mm, en forma de «ojo». En los estadios iniciales del desarrollo de la enfermedad los síntomas consisten en manchas circulares a angulares, de 1 a 2 mm, de centro color gris ceniza y borde marrón-rojizo, sin halo clorótico. Se presentan principalmente en las hojas, aunque también se pueden observar en menor medida en tallos, vainas y semillas. Los primeros síntomas pueden observarse tanto en estadios vegetativos como reproductivos. Las lesiones se observan primero en la cara superior de la hoja, pero luego también en la inferior (con centro más oscuro y abundante esporulación en condiciones de alta humedad). Las hojas jóvenes son más afectadas. Hojas: se distingue un centro pajizo grisáceo rodeado de un halo marrón rojizo sin clorosis. Las lesiones pueden coalescer y generar defoliación. Tallos: manchas alargadas rojizas con bordes marrón oscuro. Posteriormente el hongo invade las vainas para alcanzar las semillas. Semillas: cambios de coloración, con irregularidades y rajaduras sobre la cubierta seminal.
.
- Autor: Daren S Mueller, Iowa State University.
- Autor: Daren S Mueller, Iowa State University.
.
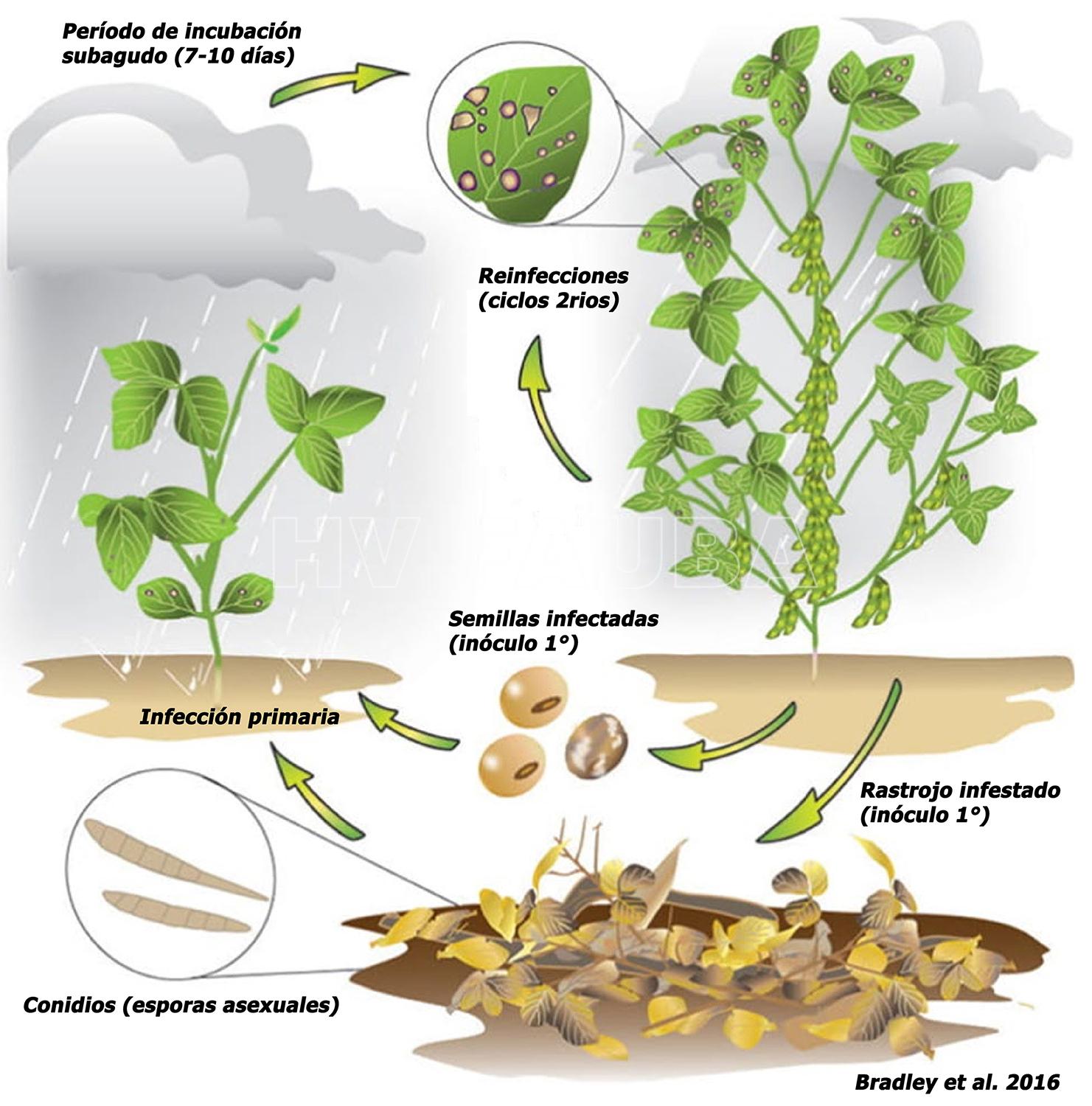
Ciclo de la enfermedad
enfermedad policíclica. Sobrevivencia del patógeno: principalmente como micelio en rastrojo y semillas. Fuente de inóculo primario: rastrojo del cultivo de soja anterior y semilla infectada. Desde la semilla el patógeno se transmite hacia los cotiledones y hojas. En varias oportunidades se observaron plántulas débiles, manchadas en los cotiledones corroborando la transmisión del hongo y permitiendo la introducción del patógeno en campos donde antes no existía.
.
- Ciclo biológico agronómico de la mancha ojo de rana de la soja, causado por Cercospora sojina. Autores: Bradley et al. 2016
.
.
Condiciones predisponentes
variedades susceptibles, monocultivo con siembra directa, altas temperaturas nocturnas (20°C o superior), elevado % de humedad, tiempo cálido y húmedo, abundantes lluvias, formación de rocío.
.
Manejo integrado de la enfermedad
* Variedades resistentes
* semilla sana o tratada con fungicidas
* Utilizar semilla de alta calidad libre del patógeno
* Rotación de cultivos con hospedantes no susceptibles
* Aplicación foliar de fungicida cuando se alcance el UDE
* Cosecha diferenciada de lotes con MOR y lotes sanos (No mezclar las semillas)
.
- 01 Colonia Csojina PDA
- Autor: Ed Sikora
- Autor: Tom Allen
- Autor: Tom Allen
.
.
.
Bibliografía
Agaras BC, Scandiani S, Luque A, et al. (2015) Quantification of the potential biocontrol and direct plant growth promotion abilities based on multiple biological traits distinguish different groups of Pseudomonas spp. isolates. Biological Control 90: 173-186. doi: 10.1016/j.biocontrol.2015.07.003
Akem C, Dashiell K (1994) Effect of planting date on severity of frogeye leaf spot and grain yield of soybeans. Crop Prot. 13: 607–610. doi: 10.1016/0261-2194(94)90006-X
Athow KL, Probst AH (1952) The inheritance of resistance to frogeye leaf spot of soybean. Phytopathology 42, 660–662.
Baker WA, Weaver DB, Qui J, Pace PF (1999) Genetic Analysis of Frogeye Leaf Spot Resistance in PI54610 and Peking Soybean. Crop Science 39: 1021-1025. doi: 10.2135/cropsci1999.0011183X003900040010x
Barro J, Del Ponte EM, Allen T, et al. (2023) Modeling the Severity-Yield Relationships in Soybean Frogeye Leaf Spot Epidemics. Plant Dis. doi: 10.1094/PDIS-03-23-0440-RE
Barro JP, Neves DL, Del Ponte EM, et al. (2023) Frogeye leaf spot caused by Cercospora sojina: A review. Trop. plant pathol. doi: 10.1007/s40858-023-00583-8
(2012) Genetic diversity of Cercospora sojina revealed by amplified fragment length polymorphism markers. Canadian Journal of Plant Pathology 34: 410-416. doi: 10.1080/07060661.2012.711775
Bradley C, Chilvers M, Freije A, et al. (2016) An overview of frogeye leaf spot. Crop Protection Network. doi: 10.31274/cpn-20190620-013
Bradley CA, Allen T, Sisson AJ, et al. (2021) Soybean yield loss estimates due to diseases in the United States and Ontario, Canada, from 2015 to 2019. Plant Health Progress 22: 483–495. doi: 10.1094/PHP-01-21-0013-RS
Carmona M, Scandiani M, Luque A (2009) Severe outbreaks of Soybean Frogeye Leaf Spot in the Pampean Region, Argentina. Plant Disease 93(9): 966. doi: 10.1094/PDIS-93-9-0966B
Carmona M, Formento N, Scandiani M (2010) Mancha ojo de rana. Ed. Horizonte A, 48 pp.
Carmona M (2011) Damages caused by frogeye leaf spot and late season disease in soybean in Argentina and control criteria. Tropical Plant Pathology 36: 1356-1358.
Carmona M, Sautua F, Reis EM (2015) Soybean frogeye leaf spot (Cercospora sojina): First economic damage threshold determination. Advances in Applied Agricultural Science 3: 01-07.
Gu X, Ding J, Liu W, et al. (2020) Comparative genomics and association analysis identifies virulence genes of Cercospora sojina in soybean. BMC Genomics 21: 172. doi: 10.1186/s12864-020-6581-5
Gu X, Yang S, Yang X, et al. (2020) Comparative transcriptome analysis of two Cercospora sojina strains reveals differences in virulence under nitrogen starvation stress. BMC Microbiol 20, 166. doi: 10.1186/s12866-020-01853-0
Han Y, Zhao X, Cao G, et al. (2015) Genetic characteristics of soybean resistance to HG type 0 and HG type 1.2.3.5.7 of the cyst nematode analyzed by genome-wide association mapping. BMC Genom. 16: 598. doi: 10.1186/s12864-015-1800-1
Hara K (1915) Spot disease of soybean. Agr.Cuntry 9: 28.
Haskell RJ (1926) Diseases of cereal and forage crops in the United States in 1925. U.S. Dept. Agr. PL. Dis. Ret. Supl. 48: 375-376.
Kim JS, Lee YS, Kim SK, et al. (2011) Differential responses of soybean cultivars to Cercospora sojina isolates, the causal agent of frogeye leaf spot in Korea. Plant Pathology Journal. 27(2): 183-186. doi: 10.5423/PPJ.2011.27.2.183
Kim H, Newell AD, Cota-Sieckmeyer RG, et al. (2013) Mating-type distribution and genetic diversity of Cercospora sojina populations on soybean from Arkansas: evidence for potential sexual reproduction. Phytopathology 103: 1045–1051. doi: 10.1094/PHYTO-09-12-0229-R
Lehman SG (1928) Frog-eye leaf spot of soybean caused by Cercospora diazu Miura. J. Agr. Res. [U.S.] 36: 811-833.
Lin B, Kelly H (2018) Frogeye Leaf Spot of Soybean. The Plant Health Instructor. doi: 10.1094/PHI-I-2018-1018-01
Luo X, Cao J, Huang J, et al. (2018) Genome sequencing and comparative genomics reveal the potential pathogenic mechanism of Cercospora sojina Hara on soybean. DNA Res. 25(1): 25-37. doi: 10.1093/dnares/dsx035
Melchers LE (1925) Disease of cereal and forage crops in the United States in 1924. U.S. Dept. Agr. PL. Dis. Ret.Supl. 40: 186.
Mengistu A, Bond J, Mian R, et al. (2012) Resistance to Frogeye Leaf Spot in Selected Soybean Accessions in MG I through MG VI. Plant Health Progress 13: 1. doi: 10.1094/PHP-2012-0521-02-RS
Mengistu A, Kelly H, Bellaloui N, et al. (2014) Tillage, fungicide, and cultivar effects on frogeye leaf spot severity and yield in soybean. Plant Dis. 98: 1476–1484. doi: 10.1094/PDIS-12-13-1268-RE
Mengistu A, Kelly HM, Arelli PR, et al. (2018) Quantifying the Effects of Fungicides and Tillage on Cercospora sojina Severity and Yield of Soybean. Plant Health Progress 19(3): 226-232. doi: 10.1094/PHP-04-18-0017-RS
Mengistu A, Ray JD, Kelly HM, et al. (2019) Pathotype grouping of Cercospora sojina isolates on soybean and sensitivity to QoI fungicides. Plant Dis. 104: 373–380. doi: 10.1094/PDIS-02-19-0368-RE
Mian MAR, Wang T, Phillips DV, et al. (1999). Molecular mapping of the Rcs3 gene for resistance to frogeye leaf spot in soybean. Crop Sci. 39: 1687–1691. doi: 10.2135/cropsci1999.3961687x
Mian MAR, Missaoui AM, Walker DR, et al. (2008) Frogeye leaf spot of soybean: a review and proposed race designations for isolates of Cercospora sojina Hara. Crop Science 48(1): 14–24. doi: 10.2135/cropsci2007.08.0432
Mian R, Bond J, Joobeur T, et al. (2009) Identification of Soybean Genotypes Resistant to Cercospora sojina by Field Screening and Molecular Markers. Plant Dis. 93(4): 408-411. doi: 10.1094/PDIS-93-4-0408
Missaoui A, Ha BK, Phillips DV, Boerma HR (2007) Single nucleotide polymorphism detection of the Rcs3 gene for resistance to frogeye leaf spot in soybean. Crop Sci. 47: 1681–1690. doi: 10.2135/cropsci2006.11.0711
Nascimento KJT, Debona D, Rezende D, et al. (2018) Changes in leaf gas exchange and chlorophyll a fluorescence on soybean plants supplied with silicon and infected by Cercospora sojina. Journal of Phytopathology 166: 747–760. doi: 10.1111/jph.12757
Neves DL, Bradley CA (2020) Baseline sensitivity of Cercospora sojina and Corynespora cassiicola to pydiflumetofen. Crop protection, 105461. doi: 10.1016/j.cropro.2020.105461
Neves DL, Webster RW, Smith DL, Bradley CA (2022) The G143A Mutation in the Cytochrome b Gene Is Associated with Quinone Outside Inhibitor Fungicide Resistance in Cercospora sojina from Soybean Fields in Wisconsin. Plant Health Progress 23: 241-242. doi: 10.1094/PHP-09-21-0115-BR
Neves DL, Berghuis BG, Halvorson JM, et al. (2022) First Detection of Frogeye Leaf Spot in Soybean Fields in North Dakota and the G143A Mutation in the Cytochrome b Gene of Cercospora sojina. Plant Health Progress 23: 269-271. doi: 10.1094/PHP-10-21-0132-BR
Nian J, Yu M, Bradley CA, Zhao Y (2021) Lysobacter enzymogenes strain C3 suppresses mycelium growth and spore germination of eight soybean fungal and oomycete pathogens and decreases disease incidences. Biological Control 152: 104424. doi: 10.1016/j.biocontrol.2020.104424
Pham A-T, Harri SD, Buck J, et al. (2015) Fine mapping and characterization of candidate genes that control resistance to Cercospora sojina K. hara in two Soybean germplasm accessions. PLoS One 10: e0126753. doi: 10.1371/journal.pone.0126753
Phillips XA, Kandel YR, Mueller DS (2021) Impact of Foliar Fungicides on Frogeye Leaf Spot Severity, Radiation Use Efficiency and Yield of Soybean in Iowa. Agronomy 11(9): 1785. doi: 10.3390/agronomy11091785
Piñeros-Guerrero N, Neves DL, Bradley CA, Telenko DEP (2023) Determining the Distribution of QoI Fungicide-Resistant Cercospora sojina on Soybean from Indiana. Plant Dis.: PDIS08221744SR. doi: 10.1094/PDIS-08-22-1744-SR
Probst AH, Athow KL, Laviolette FA (1965) Inheritance of resistance to race 2 of Cercospora sojina in Soybeans1. Crop Sci. 5:332. doi: 10.2135/cropsci1965.0011183X000500040013x
Sautua FJ, Scandiani MM, Gordo M. et al. (2018) Detection and chemical control of Cercospora sojina infecting soybean seed in Argentina. Trop. plant pathol. 43, 552–558. doi: 10.1007/s40858-018-0245-x
Scandiani MM, Ferri B, Ferrari N, et al. (2012) First Report of races 11 and 12 of Cercospora sojina, the causal agent of Soybean Frogeye Leaf Spot, in Argentina. Plant Disease 96(7): 1067. doi: 10.1094/PDIS-02-12-0154-PDN
Shrestha SK, Cochran A, Mengistu A, et al. (2017) Genetic diversity, QoI fungicide resistance, and mating type distribution of Cercospora sojina—Implications for the disease dynamics of frogeye leaf spot on soybean. PLoS ONE 12(5): e0177220. doi: 10.1371/journal.pone.0177220
Silva ACd, Gregorio da Silva DC, Ferreira EGC, et al. (2025) Genetic diversity, population structure in a historical panel of Brazilian soybean cultivars. PLoS ONE 20(1): e0313151. doi: 10.1371/journal.pone.0313151
Sun M, Na C, Jing Y, et al. (2022) Genome-Wide Association Analysis and Gene Mining of Resistance to China Race 1 of Frogeye Leaf Spot in Soybean. Front. Plant Sci. 13: 867713. doi: 10.3389/fpls.2022.867713
Tonelli ML, Magallanes-Noguera C, Fabra A (2017) Symbiotic performance and induction of systemic resistance against Cercospora sojina in soybean plants co-inoculated with Bacillus sp. CHEP5 and Bradyrhizobium japonicum E109. Archives of Microbiology 199(9): 1283–1291. doi: 10.1007/s00203-017-1401-2
Vasconcelos MI, Morais JKS, Siebra EA, et al. (2008) SBTX, a new toxic protein distinct from soyatoxin and other toxic soybean [Glycine max] proteins, and its inhibitory effect on Cercospora sojina growth. Toxicon 51(6): 952-963. doi: 10.1016/j.toxicon.2007.10.005
Viggers JN, Kandel YR, Mueller DS (2022) The Impact of Fungicide Application Method on Soybean Canopy Coverage, Frogeye Leaf Spot, and Yield. Plant Health Progress 23: 409-414. doi: 10.1094/PHP-03-22-0024-RS
Zeng F, Wang C, Zhang G, et al. (2017) Draft genome sequence of Cercospora sojina isolate S9, a fungus causing frogeye leaf spot (FLS) disease of soybean. Genomics Data 12: 79-80. doi: 10.1016/j.gdata.2017.02.014
Zhang G, Bradley CA (2014) Survival of Cercospora sojina on soybean leaf debris in Illinois. Plant Health Progress 15: 92–96.
Zhang G, Reuter-Carlson U, Pedersen D, Bradley C (2014) Host range evaluation of Cercospora sojina, causal agent of frogeye leaf spot of soybean. Phytopathology. American Phytopathological Society. Link
Zhang G, Bradley CA (2017) Comparison of quinone outside inhibitor fungicide-resistant and -sensitive isolates of Cercospora sojina. Crop Protection 94: 59-63. doi: 10.1016/j.cropro.2016.12.007
Zhang G, Allen TW, Bond JP, et al. (2018) Widespread occurrence of quinone outside inhibitor fungicide-resistant isolates of Cercospora sojina, causal agent of Frogeye leaf spot of soybean, in the United States. Plant Health Progress 19: 295–302.
Zhang G, Neves DL, Krausz K, Bradley CA (2021) Sensitivity of Cercospora sojina to demethylation inhibitor and methyl benzimidazole carbamate fungicides. Crop Protection 149: 105765. doi: 10.1016/j.cropro.2021.105765