.
Condición fitosanitaria: Presente
Grupo de cultivos: Hortícolas
Especie hospedante: Frutilla ( Fragaria × ananassa)
Rango de hospedantes: no específico / amplio
Epidemiología: monocíclica, subaguda.
Etiología: Hongo. Necrotrófico
Agente causal: Macrophomina phaseolina (Tassi) Goidanish
Taxonomía: Eukaryota > Fungi > Dikarya > Ascomycota > Pezizomycotina > Dothideomycetes > Dothideomycetes incertae sedis > Botryosphaeriales > Botryosphaeriaceae > Macrophomina
.
.
.
Antecedentes
Los primeros registros de la Podredumbre carbonosa de corona y raíz en frutilla se encontraron en India y Egipto, donde prevalecen altas temperaturas (33 a 47°C) y condiciones de baja humedad del suelo (Maas, 1998). Sin embargo, se han registrado brotes adicionales de la enfermedad en regiones más frías y más templadas (temperaturas del suelo de 8 a 27°C) como en España y Francia (Baudry & Morzieres, 1993; Avilés et al., 2008). Además, se han informado incidentes más recientes de epidemias en frutilla en los Estados Unidos, específicamente en California (Koike 2008) y Florida (Mertely et al., 2005), así como en Israel (Zveibil y Freeman, 2005) y en otras partes del Mediterráneo, como Turquía (Benlioğlu y otros, 2004) y Grecia (Tjamos et al., 2006).
M. phaseolina fue detectado en Tucumán, Argentina, en 2007 en cultivo comercial de frutilla afectando al cultivar ‘Camarosa’ en lalocalidad de Lules.
.
Síntomas
Los síntomas de la enfermedad pueden ocurrir en todas las etapas del cultivo de frutilla. Las semillas infectadas usualmente originan plántulas débiles que mueren a los pocos días. Las plántulas infectadas suelen mostrar una decoloración marrón rojiza en la porción emergente del hipocótile. El área decolorada se torna marrón oscura o negra y las plántulas afectadas pueden morir bajo condiciones ambientales cálidas y secas. Infecciones posteriores al estado de plántula suelen provocar síntomas no visibles hasta etapas más avanzadas del ciclo del cultivo. Las plantas inicialmente muestran síntomas no específicos, tales como menor tamaño de hojas, menor altura y otros relacionados a pérdida de vigor. A partir de floración aparecen los síntomas más característicos de la enfermedad: en tejidos epidérmicos y subepidérmicos de raíces y parte inferior del tallo se observa una coloración grisácea correspondiente a la presencia de numerosos microesclerocios oscuros. Cuando las plantas comienzan a morirse los microesclerocios aumentan notablemente en cantidad.
.
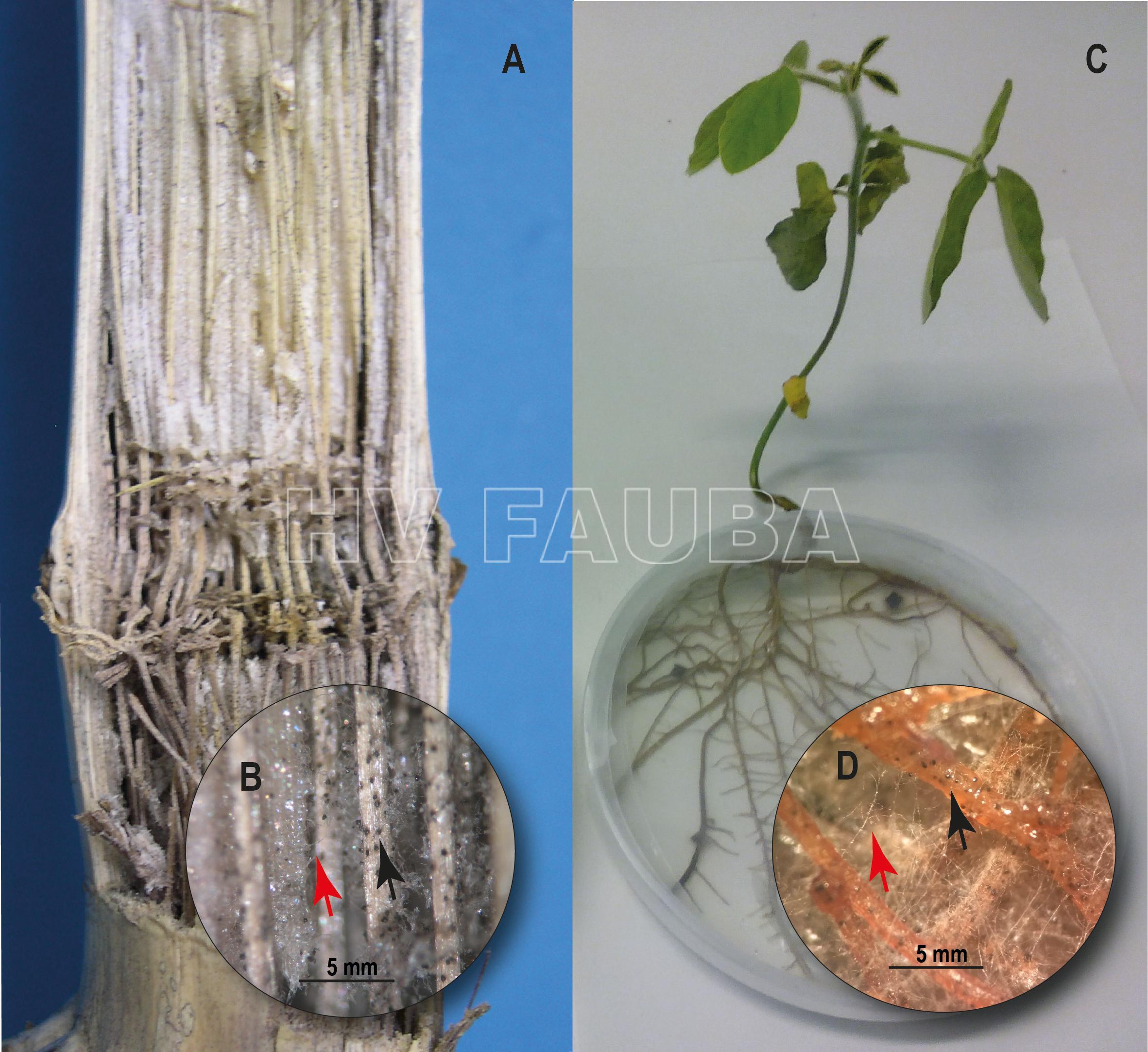
- Pudrición carbonosa en maíz (Zea mays L.) y soja (Glycine max). (A) Interior del tallo del maíz que muestra una decoloración grisáceo-negra y desgarro de los haces vasculares. (B) Se desarrollaron hifas de M. phaseolina (flecha roja) y microesclerocios en los ases vasculares del tallo del maíz (flecha negra). (C) Planta de soja de 10 días después de la inoculación con M. phaseolina en condiciones de cultivo in vitro. (D) Hifas de M. phaseolina (flecha roja) y microesclerocios desarrollados en raíces de soja (flecha negra). Autor: Marquez et al., 2021.
.
Variabilidad genética
Macrophomina phaseolina es un hongo de suelo, necrotrófico que presenta una alta variación en la patogenicidad y/o diversidad genética. A pesar de su observada variabilidad, no se ha podido definir subespecies o razas fisiológicas basadas en caracterizaciones morfológicas o bases de datos de secuencias de aislamientos de diferentes hospedantes. Viejobueno et al. (2017) caracterizaron morfológica, cultural y molecularmente 21 aislamientos de M. phaseolina provenientes de 13 cultivares de frutilla ‘Camarosa’(Fru-Cam), ‘Carmela’ (Fru-Car), ‘Camino Real’ (Fru-CR), ‘Albion’ (Fru-Alb), ‘Pájaro’ (Fru-Paj),‘Macarena’ (Fru-Mac), ‘Treasure’ (Fru-Trea), ‘Fortuna’ (Fru-For), ‘Sweet Ann’ (Fru-SWA), ‘Sabrina’(Fru-Sab), ‘Festival’ (Fru-Fes), ‘Erlibrite’ (Fru-Erli), ‘Elyana’ (Fru-Ely); uno de arándano: Ar-SB; uno de soja: Soj-Bal; uno de poroto: Por-Lea y 5 de girasol: Gi-AG4, Gi-A963, Gi-ACA 885, Gi-PAN 1031, GiP65A25, de Argentina. La caracterización molecular permitió agrupar varios aislamientos de otros hospedantes en los mismos clusters que algunos aislamientos de frutilla. Por ejemplo, en el mismo cluster en donde se ubicó en Fru-Fes, se encuentra Ar-SB. Estos resultados reafirman la gran variabilidad existente en las características y comportamiento de los diferentes aislamientos de este patógeno. Dicha variabilidad dificulta su clasificación en subespecies o razas fisiológicas.
Condiciones predisponentes
* Condiciones de estrés para las plantas
* Temperaturas altas (28 a 35ºC) y baja humedad edáfica o sequía, especialmente durante los períodos reproductivos de las plantas.
* Alta relación carbono-nitrógeno, lo que favorece al hongo.
.
Hospedantes Susceptibles
M. phaseolina es un hongo polífago con un amplio rango de hospedantes y de amplia difusión mundial, que es capaz de infectar más de 500 hospedantes, entre los que se encuentran:
- Ajo (Allium spp)
- Alfalfa (Medicago sativa)
- Algodón (Gossypium spp)
- Arveja (Pisum spp)
- Amaranthus (Amaranthu spp)
- Avena (Avena sativa)
- Begonia (Begonia spp)
- Berenjena (Solanum melongena)
- Cannabis (Cannabis spp)
- Caupí (Vigna sinensis)
- Cítricos (Citrus spp)
- Crisantemo (Chrysanthemum spp)
- Esparrago (Asparagus spp)
- Frutales de carozo (Prunus spp)
- Frutilla (Fragaria spp)
- Garbanzo (Cicer arietinum)
- Girasol (Helianthus annuus)
- Haba (Vicia spp)
- Lechuga (Lactuca spp)
- Lilium (Lilium spp)
- Lino (Linum usitatissimum)
- Loto (Lotus corniculatus)
- Maiz (Zea mays)
- Maní (Arachis hypogaea)
- Melilotus (Melilotus spp)
- Melón (Citrullus lanatus)
- Nabo (Brassica spp)
- Olivo (Olea europaea)
- Papa (Solanum tuberosum)
- Pepino (Cucumis spp)
- Pimiento (Capsicum annuum)
- Poroto (Phaseolus vulgaris)
- Pino (Pinus spp)
- Remolacha (Beta vulgaris)
- Roble (Quercus spp)
- Salvia (Salvia hispanica)
- Sésamo (Sesamum indicum)
- Soja (Glycine max)
- Sorgo (Sorghum bieolor)
- Tabaco (Nicotiana tabacum)
- Tomate (Solanum lycopersicum)
- Trébol (Trifolium spp)
- Vid (Vitis spp)
- Zapallo (Cucurbita spp)
.
.
.
- 01 Síntomas de la Podredumbre carbonosa de corona y raíz en pecíolos y hojas de frutilla, causada por Macrophomina phaseolina. Autor: Lic. en Biotecnología Josefina Viejobueno, CONICET, INTA Famaillá, Tucumán.
- 02 Plantas de frutilla inoculadas con Macrophomina phaseolina sin síntomas aún. Autor: Lic. en Biotecnología Josefina Viejobueno, CONICET, INTA Famaillá, Tucumán.
- 03 Ensayo de patogenicidad, mostrando plantas vivas y muertas por Macrophomina phaseolina. Autor: Lic. en Biotecnología Josefina Viejobueno, CONICET, INTA Famaillá, Tucumán.
- 04 Ensayo de patogenicidad, mostrando plantas muertas por Macrophomina phaseolina. Autor: Lic. en Biotecnología Josefina Viejobueno, CONICET, INTA Famaillá, Tucumán.
- 05 Macrophomina phaseolina creciendo en Agar papa glucosa. Autor: Lic. en Biotecnología Josefina Viejobueno, CONICET, INTA Famaillá, Tucumán.
- 06 Síntomas de marchites y colapso en plantas de frutilla debido a la pudrición carbonosa causada por Macrophomina phaseolina. Fuente: UF / IFAS
- 07 Síntomas internos de la pudrición carbonosa, incluyendo áreas necróticas de color marrón rojizo en los márgenes y anillo vascular leñoso de la corona. Fuente: UF / IFAS
.
Ciclo de la enfermedad y Epidemiología
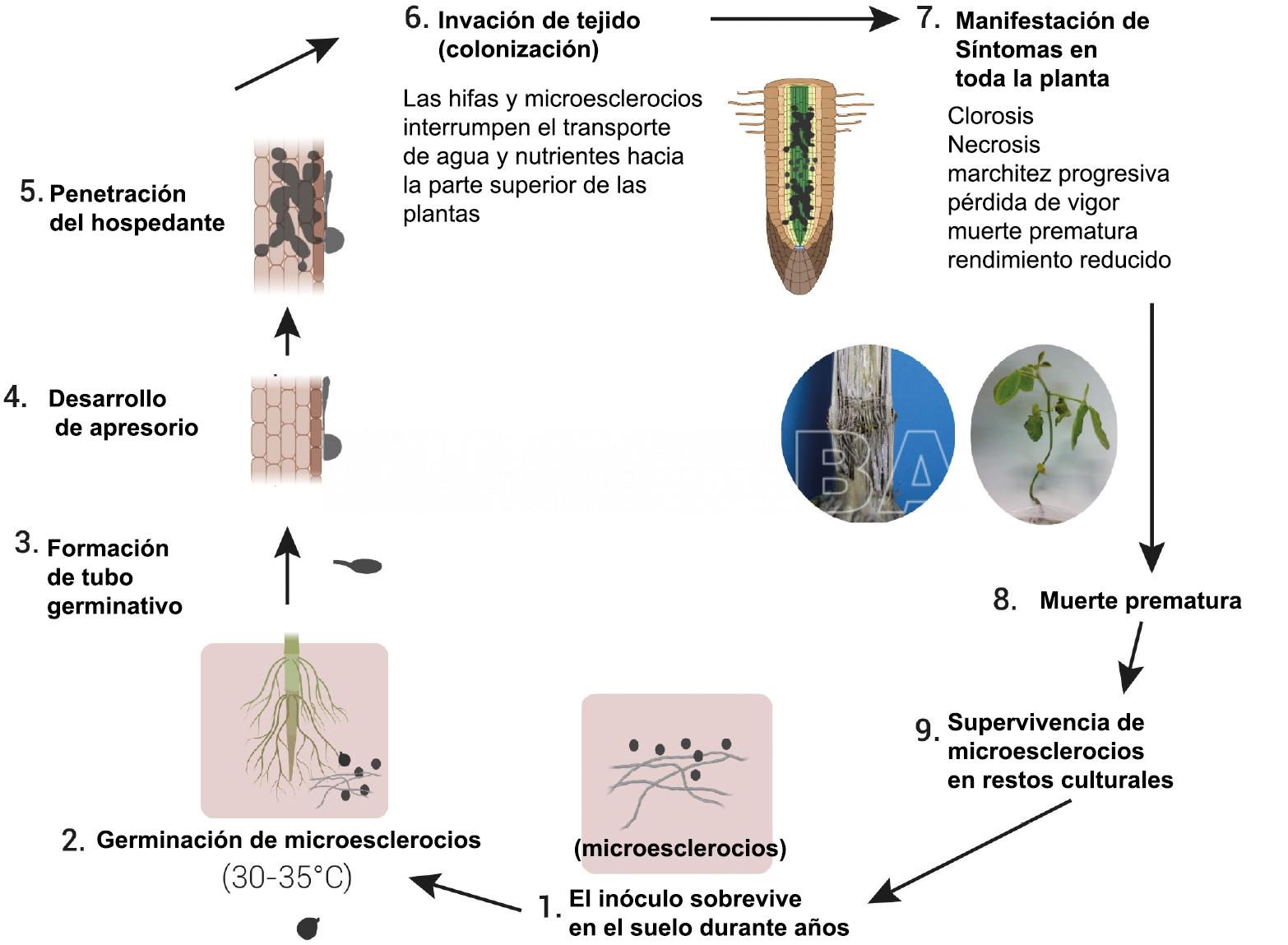
Los microesclerocios constituyen el principal medio de supervivencia del hongo, y los microesclerocios que sobreviven en el suelo constituyen la principal fuente de inóculo. Los residuos de plantas infectadas pueden permanecer en el suelo hasta la siguiente temporada de crecimiento y, por lo tanto, servir como una fuente potencial de inóculo primario para nuevos cultivos (Freeman & Gnayem 2004; Freeman & Gnayem 2005). Los microesclerocios presentes en el suelo son la principal fuente de inóculo. Éstos germinan a 30–35°C y forman un tubo germinativo seguido del desarrollo de una apresorio que penetra a través de la epidermis del hospedante. Una vez en las raíces, el hongo afecta el sistema vascular, interrumpiendo el transporte de agua y nutrientes a las partes superiores de las plantas. Esto provoca el marchitamiento de la planta y una apariencia gris típica de los tejidos del tallo debido a la abundancia de microesclerocios. En ataques severos y condiciones ambientales favorables, a menudo ocurre una muerte prematura de la planta hospedante. Los microesclerocios en los restos de raíces y tallos regresan al suelo y pueden comenzar un nuevo ciclo de enfermedad o sobrevivir en el suelo hasta 15 años.
.
- Ciclo de enfermedad de la pudrición carbonosa causada por Macrophomina phaseolina. Enfermedad monocíclica. Autor: Márquez et al., 2021.
.
Manejo de la enfermedad
El control de M. phaseolina es difícil debido, en parte, al amplio rango de hospedantes y a la tolerancia al calor que posee el patógeno, y al hecho de que los microesclerocios son estructuras de resistencia elásticas (McCain et al., 1982). La práctica estándar de la fumigación del suelo antes de establecer plantas de frutilla en vivero y trasplantes en los campos de producción se ha basado en la disponibilidad de bromuro de metilo (Freeman y Nicoli, 1999). Sin embargo, la prohibición de uso de este fumigante en la mayoría de los países desarrollados parece haber conducido a un aumento en la incidencia de infecciones por M. phaseolina en los cultivos de frutilla. Recientemente, las combinaciones de enmiendas y la solarización del suelo han demostrado ser prometedoras para el control del patógeno en condiciones de campo árido (Lodha et al., 1997; Ndiaye et al., 2007). Sin embargo, el uso de medidas alternativas a la fumigación con bromuro de metilo no siempre ha sido efectivas (McCain y cols., 1982; Smith y Krugman, 1967).
.
Videos
Charcoal rot in Strawberries (FOTOS)
Strawberry disease – Charcoal Rot (Macrophomina phaseolina)
Macrophomina phaseolina Isolation & CFU Quantification Protocol. Purdue Field Crop Pathology
.
.
Bibliografía
Macrophomina phaseolina. Sistema Nacional Argentino de Vigilancia y Monitoreo de plagas
Aguirre CM, Ramallo AC, Salazar CM, et al. (2011) Obtención y caracterización de aislamientos de Macrophomina phaseolina de frutilla en Tucumán, Argentina. Libro de resúmenes del 2º Congreso Argentino de Fitopatología. 1. Página/s: 96. ISBN/ISSN: ISBN 978-987-544-389-1.
Aguirre CM, Ramallo AC, Salazar SM, et al. (2013) Evaluación de cultivares de frutilla (Fragaria ananassa Duch.) resistentes a Macrophomina phaseolina. XXXVI Congreso Argentino de Horticultura. Página/s: 303.
Alam S, Abbas HK, Sulyok M, et al. (2022) Pigment Produced by Glycine-Stimulated Macrophomina phaseolina Is a (−)-Botryodiplodin Reaction Product and the Basis for an In-Culture Assay for (−)-Botryodiplodin Production. Pathogens 11(3): 280. doi: 10.3390/pathogens11030280
Alizadeh M, Khodadadi Manesh S, Fathi P, et al. (2025) Biology and Host Ranges of the Plant Pathogenic Fungus Macrophomina Phaseolina: a Comprehensive Review. Journal of Crop Health 77: 50. doi: 10.1007/s10343-024-01106-4
Avilés M, Castillo S, Bascon J, et al. (2008) First report of Macrophomina phaseolina causing crown and root rot of strawberry in Spain. Plant Pathology 57: 382. doi: 10.1111/j.1365-3059.2007.01717.x
Baino O, Ramallo A, Heredia M, et al. (2008) Macrophomina phaseolina causante de podredumbre de raíz y de corona de frutilla en Tucumán, Argentina. Editor/es: Asociación Argentina de Fitopatólogos. Libro de resúmenes. 1er Congreso Argentino de Fitopatología. 28-29 y 30 mayo. Ciudad de Córdoba. Página/s: 83. ISBN/ISSN: 978-987-24373-0-51
Bellaloui N, Mengistu A, Smith JR, et al. (2023) Soybean Seed Sugars: A Role in the Mechanism of Resistance to Charcoal Rot and Potential Use as Biomarkers in Selection. Plants 12(2): 392. doi: 10.3390/plants12020392
Bhattacharya D, Dhar TK, Ali E (1992) An enzyme immunoassay of phaseolinone and its application in estimation of the amount of toxin in Macrophomina phaseolina-infected seeds. Appl. Environ. Microbiol. 58: 1970-1974. doi: 10.1128/aem.58.6.1970-1974.1992
Bhattacharya D, Dhar TK, Siddiqui KAI, Ali E (1994) Inhibition of seed germination by Macrophomina phaseolina is related to phaseolinone production. Journal of Applied Bacteriology 77: 129–133. doi: 10.1111/j.1365-2672.1994.tb03055.x
Baudry A, Morzieres JP (1993) First report of charcoal rot of strawberry in France. ISHS Acta Horticulturae 348: II International Strawberry Symposium: 485-488. doi: 10.17660/ActaHortic.1993.348.99
Benegas A, Cubilla-Ríos AA, Flores-Giubi ME, et al. (2022) Extracción de proteínas secretadas por el fitopatógeno Macrophomina phaseolina: Selección de un método eficiente que incluye estímulo con tejido de su hospedero. Scientia Agropecuaria 13(2): 185-192. doi: 10.17268/sci.agropecu.2022.017
Benlioğlu S, Yildiz A, Döken T (2004) Studies to determine the causal agents of soil-borne fungal diseases of strawberries in Aydin and to control them by soil disinfestation. J. Phytopathol. 152: 509-513.
Burkhardt A, Ramon ML, Smith B, et al. (2018) Development of Molecular Methods to Detect Macrophomina phaseolina from Strawberry Plants and Soil. Phytopathology. doi: 10.1094/PHYTO-03-18-0071-R
Castaldi S, Masi M, Sautua F, et al. (2021) Pseudomonas fluorescens Showing Antifungal Activity against Macrophomina phaseolina, a Severe Pathogenic Fungus of Soybean, Produces Phenazine as the Main Active Metabolite. Biomolecules 11(11): 1728. doi: 10.3390/biom11111728
Castaldi S, Petrillo C, Donadio G, et al. (2021) Plant Growth Promotion Function of Bacillus sp. Strains Isolated from Salt-Pan Rhizosphere and Their Biocontrol Potential against Macrophomina phaseolina. International Journal of Molecular Sciences 22(7): 3324. doi: 10.3390/ijms22073324
Chamorro M, Domínguez P, Medina JJ, et al. (2015) Assessment of chemical and biosolarization treatments for the control of Macrophomina phaseolina in strawberries. Scientia Horticulturae 192: 361-368. doi: 10.1016/j.scienta.2015.03.029
Chamorro M, Miranda L, Domínguez P, et al. (2015) Evaluation of biosolarization for the control of charcoal rot disease (Macrophomina phaseolina) in strawberry. Crop Protection 67: 279-286. doi: 10.1016/j.cropro.2014.10.021
Chamorro M, Seijo TE, Noling JC, et al. (2016) Efficacy of fumigant treatments and inoculum placement on control of Macrophomina phaseolina in strawberry beds. Crop Protection 90: 163-169. doi: 10.1016/j.cropro.2016.08.020
Chowdhury S, Basu A, Kundu S (2017) Biotrophy-necrotrophy switch in pathogen evoke differential response in resistant and susceptible sesame involving multiple signaling pathways at different phases. Scientific Reports 7, 17251. doi: 10.1038/s41598-017-17248-7
Cohen R, Elkabetz M, Paris HS, et al. (2022) Occurrence of Macrophomina phaseolina in Israel: Challenges for Disease Management and Crop Germplasm Enhancement. Plant Dis. 106(1): 15-25. doi: 10.1094/PDIS-07-21-1390-FE
Danish M, Shahid M, Abul Farah M, et al. (2024) Synergistic interactions of biocontrol agents and chemical fungicides enhance the disease resistance in Vigna radiata (L.) against Macrophomina phaseolina-associated with dry root rot. Physiological and Molecular Plant Pathology 134: 102441. doi: 10.1016/j.pmpp.2024.102441
Dhar TK, Siddiqui KAI, Ali E (1982) Structure of phaseolinone, a novel phytotoxin from Macrophomina phaseolina. Tetrahedron Letters 23(51): 5459-5462. doi: 10.1016/0040-4039(82)80157-3
Fang X, Phillips D, Li H, et al. (2011) Comparisons of virulence of pathogens associated with crown and root diseases of strawberry in Western Australia with special reference to the effect of temperatura. Scientia Horticulturae 131: 39-48. doi: 10.1016/j.scienta.2011.09.025
Freeman S, Nicoli G (1999) Implementation of IPM: strawberries. Pages 454-472 in: Integrated Pest and Disease Management in Greenhouse Crops. L. Gullino, J. van Lenteren, and Y. Elad, eds. Kluwer Academic Publishers, Dordrecht, The Netherlands.
Freeman S, Gnayem N (2004) Effect of plasticulture on strawberry plant production. Small Fruits Res. 4: 21-32.
Freeman S, Gnayem N (2005) Use of Plasticulture for Strawberry Plant Production. Small Fruits Review 4: 21-32. doi: 10.1300/J301v04n01_04
Gao Y, Xie M, Yu C, et al. (2021) Heterologous Expression of Macrollins from Phytopathogenic Macrophomina phaseolina Revealed a Cytochrome P450 Mono-oxygenase in the Biosynthesis of β-Hydroxyl Tetramic Acid. J Agric Food Chem. 69(50): 15175-15183. doi: 10.1021/acs.jafc.1c05304
Gerin D, Dongiovanni C, De Miccolis Angelini RM, et al. (2018) First Report of Macrophomina phaseolina Causing Crown and Root Rot on Strawberry in Italy. Plant Disease 102(9): 1857. doi: 10.1094/PDIS-01-18-0191-PDN
Hajlaoui MR, Mnari-Hattab M, Sayeh M, et al. (2015) First report of Macrophomina phaseolina causing charcoal rot of strawberry in Tunisia. New Disease Reports 32(14). doi: 10.5197/j.2044-0588.2015.032.014
Hutton DG, Gomez AO, Mattner SW (2013) Macrophomina phaseolina and Its Association with Strawberry Crown Rot in Australia. International Journal of Fruit Science 13(1-2): Proceedings of the 2011 North American Strawberry Symposium, 149-155. doi: 10.1080/15538362.2012.698143
Islam MS, Haque MS, Islam MM, et al. (2012) Tools to kill: Genome of one of the most destructive plant pathogenic fungi Macrophomina phaseolina. BMC Genomics 13: 493. doi: 10.1186/1471-2164-13-493
Joshi K, Gothalwal R, Joshi N (2023) Biomanagement of Macrophomina phaseolina causing charcoal rot of plants. Macrophomina Phaseolina Ecobiology, Pathology and Management. Chapter 23, Pages 335-344. doi: 10.1016/B978-0-443-15443-0.00007-3
Kanaan H, Medina S, Minz D, et al. (2016) Soil suppressiveness against Macrophomina phaseolina s.l. as affected by cyclic temperature regimes. Phytoparasitica 44(3): 305-311. doi: 10.1007/s12600-016-0525-2
Kaur S, Dhillon GS, Brar SK, et al. (2012) Emerging phytopathogen Macrophomina phaseolina: biology, economic importance and current diagnostic trends. Critical Reviews in Microbiology 38(2): 136-151. doi: 10.3109/1040841X.2011.640977
Khambhati VH, Abbas HK, Sulyok M, et al. (2020) First Report of the Production of Mycotoxins and Other Secondary Metabolites by Macrophomina phaseolina (Tassi) Goid. Isolates from Soybeans (Glycine max L.) Symptomatic with Charcoal Rot Disease. Journal of Fungi 6(4): 332. doi: 10.3390/jof6040332
Kirschbaum DS, Vicente CE, Cano-Torres MA, et al. (2017) Strawberry in South America: from the Caribbean to Patagonia. ISHS Acta Horticulturae 1156: VIII International Strawberry Symposium. doi: 10.17660/ActaHortic.2017.1156.140
Kishore Babu B, Saxena AK, Srivastava AK, Arora DK (2007) Identification and detection of Macrophomina phaseolina by using species-specific oligonucleotide primers and probe. Mycologia 99(6): 797-803
Koike ST (2008) Crown Rot of Strawberry Caused by Macrophomina phaseolina in California. Plant Disease 92(8): 1253-1253. doi: 10.1094/PDIS-92-8-1253B
Koike ST, Arias RS, Hogan CS, et al. (2016) Status of Macrophomina phaseolina on Strawberry in California and Preliminary Characterization of the Pathogen. International Journal of Fruit Science 16 – Issue sup1: Proceedings of the 2015 North American Strawberry Symposium148-159 | Published online: 20 Jul 2016. doi: 10.1080/15538362.2016.1195313
Kouadri MEA, Zaim S, Bekkar AA (2021) First report of Macrophomina pseudophaseolina infecting Lens culinaris. Australasian Plant Dis. Notes 16: 26. doi: 10.1007/s13314-021-00440-0
Kumari PN, Sharma V (2013) Detached Leaf Assay for Resistance to Macrophomina phaseolina and Isolation of Toxin from Infected Leaves and its Analysis by TLC. J. Biol. Chem. Research. 30(1): 254-263. ISSN 2319-3077
Leyva-Mir SG, Velázquez-Martínez GC, Tlapal-Bolaños B, et al. (2015) Caracterización morfológica y molecular de aislados de Macrophomina phaseolina asociados a caña de azúcar en México. Revista Argentina de Microbiología 47(2): 143-147. doi: 10.1016/j.ram.2015.03.003
Lima WN, de Sousa Santos Alves CP, Negreiros AMP, et al. (2024) Macrophomina pseudophaseolina isolated from weeds is pathogenic against cowpea, mung bean, corn, and sorghum. Eur J Plant Pathol 168: 225–230. doi: 10.1007/s10658-023-02748-2
Lodha S, Sharma SK, Aggarwal RK (1997) Solarization and natural heating of irrigated soil amended with cruciferous residues for improved control of Macrophomina phaseolina. Plant Pathology 46: 186-190. doi: 10.1046/j.1365-3059.1997.d01-223.x
Maas JL (1998) Macrophomina leaf blight and dry crown rot and Macrophomina root rot and charcoal rot. Pages 26 and 59 in: Compendium of Strawberry Diseases, 2nd ed. J. L. Maas, ed. American Phytopathological Society, St. Paul, MN.
Madkour MA, Aly MH (1981) Cell wall degrading enzymes produced during pathogenesis of Macrophomina phaseolina on strawberry plants. Phytopathol. Z. 100: 36-43. doi: 10.1111/j.1439-0434.1981.tb03288.x
Mahato SB, Siddiqui KAI, Bhattacharya G, et al. (1987) Structure and stereochemistry of phaseolinic acid: A new acid from Macrophomina phaseolina. J. Nat. Prod. 50: 245–247. doi: 10.1021/np50050a024
McCain AH, Bega RV, Jenkinson JL (1982) Solar heating fails to control Macrophomina phaseolina. Phytopathology 72: 985.
Mendoza, JLH et al. (2015) Antibiosis of Trichoderma spp strains native to northeastern Mexico against the pathogenic fungus Macrophomina phaseolina. Brazilian Journal of Microbiology 46: 1093-1101. doi: 10.1590/S1517-838246420120177
Mertely JC, Seijo T, Peres NA (2005) First report of Macrophomina phaseolina causing a crown rot of strawberry in Florida. Plant Disease 84: 434. doi: 10.1094/PD-89-0434A
Ndiaye M, Termorshuizen AJ, van Bruggen AHC (2007) Combined effects of solarization and organic amendment on charcoal rot caused by Macrophomina phaseolina in the Sahel. Phytoparasitica 35: 392-400. doi: 10.1007/BF02980703
Ramezani M, Shier WT, Abbas HK, et al. (2007) Soybean Charcoal Rot Disease Fungus Macrophomina phaseolina in Mississippi Produces the Phytotoxin (−)-Botryodiplodin but No Detectable Phaseolinone. Journal of Natural Products 70(1): 128-129. doi: 10.1021/np060480t
Rogers LW, Koehler AM (2021) Nondestructive Sampling to Monitor Macrophomina phaseolina Root Colonization in Overwintering Stevia. Plant Health Progress 22: 151-153. doi: 10.1094/PHP-10-20-0092-BR
Salazar SM, Coll Y, Viejobueno J, Coll F (2016) Respuesta de plantas de frutilla a la aplicación de brasinoesteroides bajo condiciones de campo. Revista Agronómica del Noroeste Argentino 36(1): 37-41.
Sánchez S, Gambardella M, Henríquez JL, Díaz I (2013) First Report of Crown Rot of Strawberry Caused by Macrophomina phaseolina in Chile. Plant Disease 97(7): 996-996. doi: 10.1094/PDIS-12-12-1121-PDN
Sánchez S, Henríquez JL, Urcola LA, et al. (2016) Susceptibility of strawberry cultivars to root and crown rot caused by Macrophomina phaseolina. Journal of Berry Research 6(3): 345-354. doi: 10.3233/JBR-150114
Sánchez S, Chamorro M, Henríquez JL, et al. (2017) Genetic and biological characterization of Macrophomina phaseolina (Tassi) Goid. causing crown and root rot of strawberry. Chilean journal of agricultural research 77(4): 325-331. doi: 10.4067/S0718-58392017000400325
Santos AP, Muratore LN, Solé-Gil A, et al. (2021) Extremophilic bacteria restrict the growth of Macrophomina phaseolina by combined secretion of polyamines and lytic enzymes. Biotechnology Reports 32: e00674. doi: 10.1016/j.btre.2021.e00674
Shier TW, Nelson J, Abbas HK, Baird RE (2012) Root Toxicity of the Mycotoxin Botryodiplodin in Soybean Seedlings. Toxicon 60(2): 163. doi: 10.1016/j.toxicon.2012.04.134
Siddiqui KA, Gupta AK, Paul AK, Banerjee AK (1979) Purification and properties of heat-resistant exotoxin produced by Macrophomina phaseolina (Tassi) Goid in culture. Experientia 35(9):1222-3. doi: 10.1007/BF01963302
Smith RS, Krugman SL (1967) Control of the charcoal root disease of white fir by fall fumigation. Plant Disease Rep. 51: 671-674.
Su G, Suh S-O, Schneider RW, Russin JS (2001) Host Specialization in the Charcoal Rot Fungus, Macrophomina phaseolina. Phytopathology 91(2): 120-126. doi: 10.1094/PHYTO.2001.91.2.120
Sybuia PA, de Castro-Prado G, de Carvalho Nunes WM, et al. (2022) Parasexual recombination in Macrophomina pseudophaseolina and vegetative compatibility reactions in M. euphorbiicola. Eur J Plant Pathol 163: 937–950. doi: 10.1007/s10658-022-02530-w
Tjamos EC, Antoniou PP, Skourtaniotis A, et al. (2006) Impermeable plastics and methyl bromide alternatives incontrolling soilborne fungal pathogens of strawberries in Greece. Pages 255-257 in: Proc. 12th Congr. Mediterr. Phytopathol. Union, Rhodes,Greece.
Tonin RFB, Avozani A, Danelli ALD, et al. (2013) In vitro mycelial sensitivity of Macrophomina phaseolina to fungicides. Pesquisa Agropecuária Tropical 43(4): 460-466. doi: 10.1590/S1983-40632013000400014
Viejobueno J, Ramallo AC, Kirschbaum DS, et al. (2017) Severe outbreaks of strawberry crown and root charcoal rot caused by Macrophomina phaseolina in Tucumán, Argentina. Revista agronómica del noroeste argentino 37(2): 111-114. ISSN 0080-2069.
Viejobueno J, Aguirre CM, Baino OM, et al. (2017) Caracterización morfológica, cultural y molecular de aislamientos de Macrophomina phaseolina. Agrotecnia 25. REBIOS 2017. XI Reunión Nacional Científico-Técnica de Biología de Suelos, realizada en octubre de 2017 en la provincia de Corrientes, Argentina. Obtuvo una mención como mejor exposición póster. ISSN (Papel): 0328-4077 ISSN (on-line):2545-8906
Viejobueno J, Aguirre CM, Baino OM, et al. (2018) Caracterización patogénica de 21 aislamientos de Macrophomina phaseolina en plantas de frutillas cv. ‘Pájaro’. INTA E.E.A. Famaillá.
Viejobueno J, Albornoz PL, Martínez Zamora MG, et al. (2018) Respuesta histológica foliar en plantas de frutilla al tratamiento con Azospirillum brasilense y Macrophomina phaseolina. XXXIV Jornadas Científicas de la Asociación de Biología de Tucumán (ABT), realizadas en octubre de 2017 en Tafí del Valle, Tucumán, Argentina.
Viejobueno J, de los Santos B, Camacho-Sanchez M, et al. (2022) Phenotypic Variability and Genetic Diversity of the Pathogenic Fungus Macrophomina phaseolina from Several Hosts and Host Specialization in Strawberry. Current Microbiology 79, 189. doi: 10.1007/s00284-022-02883-9
Viejobueno J, Albornoz PL, Camacho M, et al. (2021) Protection of Strawberry Plants against Charcoal Rot Disease (Macrophomina phaseolina) Induced by Azospirillum brasilense. Agronomy 11(2): 195. doi: 10.3390/agronomy11020195
Wang YC, Mansouripour SM, Hewavitharana SS, Holmes GJ (2024) Effect of Cultivar and Temperature on Disease Development of Macrophomina Root Rot in Strawberry. Plant Health Progress 25: 255-261. doi: 10.1094/PHP-11-23-0100-RS
Yu C, Chen L, Gao YL, et al. (2022) Discovery and biosynthesis of macrophasetins from the plant pathogen fungus Macrophomina phaseolina. Front. Microbiol. 13: 1056392. doi: 10.3389/fmicb.2022.1056392
Zveibil A, Mor N, Gnayem N, Freeman S (2012) Survival, Host–Pathogen Interaction, and Management of Macrophomina phaseolina on Strawberry in Israel. Plant Disease 96(2): 265-272. doi: 10.1094/PDIS-04-11-0299