.
Condición fitosanitaria:
Candidatus Liberibacter asiaticus > Plaga Cuarentenaria Presente
Candidatus Liberibacter africanus > Plaga Cuarentenaria Ausente
Candidatus Liberibacter americanus > Plaga Cuarentenaria Ausente
.
Grupo de cultivos: Frutales (Cítricos)
Especie hospedante: Lima Tahiti (Citrus aurantifolia), limón (Citrus limonum), mandarina (Citrus nobilis), naranjo (Citrus sinensis), pomelo (Citrus paradisi), murraya (Murraya paniculata). Todas las variedades comerciales de cítricos son susceptibles al HLB.
Rango de hospedantes: específico, estrecho. El rango de hospedantes de Candidatus Liberibacter spp causantes de HLB se limita a los cítricos y sus parientes.
Epidemiología: es considerada una enfermedad poliética
Transmisión: Diaphorina citri («Psílido asiático de los cítricos»), de manera persistente (circulativa) y propagativa
Etiología: Bacteria Gram negativa. Considerada biotrófica. Limitada al floema. Fastidiosa (no cultivable).
Agente causal: Candidatus Liberibacter spp, candidatus name (nombre provisional para organismos bien caracterizados pero aún sin cultivar in vitro)
(Candidatus Liberibacter asiaticus, Candidatus Liberibacter africanus, Candidatus Liberibacter americanus)
Taxonomía: Bacteria > Proteobacteria > Alphaproteobacteria > Rhizobiales > Rhizobiaceae > Liberibacter
.
El patógeno causante del HLB es una bacteria de tipo Gram-negativa, exclusivamente localizada en los tubos del floema, no cultivable, denominada Candidatus Liberibacter ssp. El organismo procariota asociado a esta enfermedad recién fue descubierto en 1970.
.
Vector:
Diaphorina citri Kuwayama, 1907 («Psílido asiático de los cítricos»)
Taxonomía: Eukaryota > Opisthokonta > Metazoa > Eumetazoa > Bilateria > Protostomia > Ecdysozoa > Panarthropoda > Arthropoda > Mandibulata > Pancrustacea > Hexapoda > Insecta > Dicondylia > Pterygota > Neoptera > Paraneoptera > Hemiptera > Sternorrhyncha > Psylloidea > Liviidae > Diaphorina
.
.
f.
.
Antecedentes
El HLB es la enfermedad más destructiva de los cítricos en el mundo entero. Fue reportada por primera vez en el año 1919 en China, en donde se la denominó HuangLongBing (en chino, 黃龍病; pinyin, huánglóngbìng; literalmente, «enfermedad del Dragón amarillo» o «enfermedad del quemado del dragón»). De aquí proviene el acrónimo con el que se la conoce en la Argentina: el HLB. En inglés se la denominó «Greening» (Gottwald et al., 2007).
Actualmente, se encuentra presente en Asia, África, Oceanía, y en el Norte y Sur de países de América. En el continente americano, la primera detección y cita fue en el Estado de San Pablo, Brasil, en el año 2005. Al año siguiente fue reportada en Estados Unidos, y luego en Cuba, República Dominicana, Nicaragua, Honduras, Belize, México y Paraguay. El impacto devastador de la epidemia en México se relata en este video, y en Brasil se relata en este video.
En Florida, EE. UU. el 100% de las plantaciones de cítricos maduros son HLB positivos, lo que ha provocado una pérdida del 75% de la producción bruta de cítricos en comparación con la era previa al HLB (Milne et al., 2018). El impacto devastador de la epidemia en el estado de Florida se relata en este video.
Para la Argentina, el HLB es una amenaza cierta de consecuencias económicas potenciales muy importantes, debido a la cercanía de la frontera Argentina con la de Brasil (aprox. 200 Km. desde Puerto Iguazú). Por este motivo, el SENASA coordina el Programa Nacional de Prevención de Huanglongbing (PNPHLB), creado por resolución N° 517/09 de la Ex Secretaría de Agricultura, Ganadería, Pesca y Alimentación y luego ratificado por la Ley Nacional N° 26.888-2013.
.
- Distribución mundial del HLB. Fuente: SENASA
.
Síntomas
El HLB afecta principalmente a plantas jóvenes. Los árboles se vuelven improductivos y/o mueren. Todas las especies de cítricos, y sus variedades, son susceptibles a la enfermedad.
El síntoma inicial es el amarillamiento de una rama superior que contrasta con el verde normal. La enfermedad es sistémica, afecta a toda la planta. Sin embargo, su distribución es desigual: se observan algunas hojas con síntomas y otras, sin ellos. Los síntomas son más evidentes en otoño e invierno.
Hojas: moteado de bordes no definidos. Este consiste en una coloración amarillo pálido con áreas de color verde irregulares. Además, se produce defoliación, engrosamiento corchoso y aclaramiento de nervaduras. La asimetría de síntomas produce que de un lado de la nervadura central de la hoja se observen moteados, mientras que en el otro lado no se presenten.
Estos síntomas puede confundirse con deficiencias de nutrientes (nitrógeno, zinc, magnesio o manganeso) y también con enfermedades como gomosis (Phytophthora sp.) y clorosis variegada de los cítricos (Xylella fastidiosa).
Frutos: asimetría (corte transversal), aborto de semillas mientras que la maduración se produce a la inversa que lo normal.
.
El desarrollo de síntomas producto por la enfermedad es un proceso complejo y se basa en una red metabólica de múltiples capas que está regulada principalmente por fitohormonas. Los metabolitos de los cítricos desempeñan funciones vitales en el desarrollo de los síntomas del HLB a través de la modulación del metabolismo de los carbohidratos, la homeostasis de las fitohormonas, las vías antioxidantes o mediante la interacción con otras vías metabólicas, en particular que involucran aminoácidos, pigmentos foliares y poliaminas (Nehela y Killiny, 2020).
Los síntomas de las tres formas generales de HLB (la forma asiática, africana y americana) son similares. La forma asiática es más tolerante al calor y expresa síntomas tanto en condiciones frías como cálidas. La forma asiática es más severa en la mayoría, si no en todas, las especies de cítricos comerciales, causando muerte regresiva y eventualmente puede resultar en la muerte del árbol; mientras que la forma africana de HLB expresa síntomas solo en condiciones frías (20-25°C) y podría suprimirse. por exposición prolongada a temperaturas superiores a 30°C. La forma africana es más severa en mandarinas y naranjas dulces, mientras que los limones, limas y pomelos son más tolerantes (Gottwald et al., 2007; Nehela y Killiny, 2020).
.
VIDEO DESCRIPTIVO DE SÍNTOMAS: INTA
.
- Aspecto general de una planta afectada por HLB. Funte: FUNDECITRUS.
- Síntomas de moteado difuso. En plantas con síntomas de HLB, el cambio del color verde natural de la hoja al color amarillento no es abrupto ni sigue patrones definidos como corresponden a otras enfermedades o deficiencias de nutrientes. Fuente: SENASA
- Comparación entre síntomas de HLB y deficiencias nutricionales. Otros de los síntomas del HLB en hojas se observa como un amarillamiento de la nervadura central, y en algunos casos de las laterales. El engrosamiento de éstas, provoca una leve lesión sobre la superficie contigua de la hoja, que se cubre de un tejido de aspecto corchoso. Fuente: EEAOC
- Hojas con nervaduras amarillas, uno de los posibles síntomas observados en las hojas. Fuente: SENASA.
- Formación de corcho sobre las nervaduras engrosadas. Fuente: SENASA
- Múltiples síntomas de HLB: moteado difuso y nervadura central amarilla y algo engrosada. Fuente: SENASA
- Fruto con síntomas de HLB: maduración invertida, asimetría y coloración anaranjada de la zona placentaria. Fuente: SENASA
- Maduración invertida en frutos. Estos pierden todo atributo comercial, se vuelven más ácidos y tienden a tener una sensación de corcho cuando son consumidos. Fuente: SENASA
- Adultos y ninfas jóvenes del psílido Diaphorina citri, insecto vector del HLB, que se alimentan de hojas y tallos de cítricos.
- 01 Síntomas foliares del HLB en Citrus. Autor: Grafton-Cardwell B
- 02 Comparación de síntomas foliares de HLB con deficiencias nutricionales, y diferente crecimiento del fruto.
- Síntomas de HLB en hojas de pomelo
- Síntomas de HLB en hojas y frutos de cítricos. Angulo inferior derecho: Fruta ladeada con semillas abortadas y haces vasculares parduscos Autor: J. M. Bové, La Brède, France.
- 01 Hojas con síntomas de HLB: engrosamiento y cambio de coloración de nervaduras.
- 02 Hojas con síntomas de HLB
- 03 Hojas con síntomas de HLB
- 04 Hojas con síntomas de HLB
- 05 Hojas con síntomas de HLB
- 06 Hojas con síntomas de HLB
- 07 Hojas con síntomas de HLB
- 08 Hojas con síntomas de HLB
- 09 Hojas con síntomas de HLB
- 10 Hojas con síntomas de HLB
- 13 Frutos de plantas con HLB. Columnela de color naranja o amarillo fuerte.
- 12 Frutos de plantas con HLB. Sintoma tipico de maduración invertida.
- 14 Frutos de plantas con HLB. Columnela de color naranja o amarillo fuerte.
.
.
Diagnóstico y Detección
Los agentes causales del HLB, las especies de bacterias Candidatus Liberibacter spp. no se puede cultivar aún in vitro (Merfa et al., 2019).
El diagnóstico y detección se realiza mediante la técnica PCR Real Time (qPCR) (Li et al., 2006, 2007, 2009; Morgan et al., 2012; Park et al., 2018). Li et al. (2009) demostraron mediante cuantificaciones sistemáticas de la bacteria usando PCR real time tanto la presencia ubicua de Ca. L. asiaticus en árboles de cítricos sintomáticos (en láminas foliares, en las nervaduras centrales de las hojas, pecíolos foliares, corteza, en algunas pero no en todas las raíces), así como una gran variación entre árboles individuales y entre muestras de diferentes tejidos de los mismos árboles.
El período de incubación es variable y puede ser de 6 a 12 meses o más, lo cual dependerá de la edad de las plantas al momento de la infección y del triángulo de la enfermedad. De acuerdo con la sensibilidad de detección de los test de qPCR actualmente usados, la infección no se puede detectar inmediatamente después de la transmisión del vector y durante algún tiempo. En aquellos árboles que presentan muy pocos síntomas de HLB, la infección puede ser total o casi completamente sistémica; sin embargo, el título bacteriano es variable en porciones individuales del árbol y puede estar por debajo del umbral de detección de la qPCR (Gottwald et al., 2008; Tatineni et al., 2008; Teixeira et al., 2008). Por lo tanto, incluso si un árbol está infectado, las muestras recolectadas de una porción del árbol con un título bajo o nulo (generalmente asintomático) producirán una evaluación de falso negativo. Aunque la PCR permite detectar muchas infecciones asintomáticas, aún así se está detectando solo una parte de las infecciones asintomáticas más recientes en la plantación, y existe un número desconocido de infecciones con títulos por debajo de la capacidad de detección. La PCR es compleja y requiere mucho tiempo, y en este momento la capacidad de procesar miles de muestras necesarias para rastrear una epidemia sigue siendo de costo prohibitivo. De acuerdo con un estudio realizado por Irey et al. (2006), si una inspección visual revela un n% de árboles sintomáticos, se espera que haya aproximadamente un 2n% de árboles infectados presentes, más una población adicional de árboles infectados que siguen siendo subclínicos en relación con la detección por RT-PCR. Sin embargo, este experimento se llevó a cabo en invierno, un tiempo subóptimo para observar los síntomas visuales del HLB. La relación de árboles infectados / sintomáticos probablemente sería mucho mayor si las evaluaciones se hicieran durante la primavera o el verano. En otro estudio más reciente, se ha estimado experimentalmente que por cada planta infectada sintomática, confirmada por qPCR, habrá un promedio de 13 (entre 2 a 56) plantas infectadas (árboles HLB positivos) pero asintomáticos (T.R. Gottwald, datos no publicados). Por lo tanto, en las plantaciones infectadas con HLB, hay potencialmente muchos más árboles infectados que los detectables visualmente o mediante qPCR. Además, el seguimiento de la aparición de síntomas visuales (monitoreo) puede ser problemático debido a la variabilidad en el tiempo entre la transmisión del vector psílido y la aparición de síntomas visuales entre árboles de la misma edad.
.
Patología – interacción hospedante-patógeno
La bacteria experimenta un movimiento de célula a célula a través del flujo del floema y coloniza diferentes tejidos en los que puede tener diversas interacciones con el hospedante (Lovelace et al., 2024).
Candidatus Liberibacter asiaticus utiliza una salicilato hidroxilasa activa SahA para degradar el ácido salicílico (SA) y suprimir las defensas de las plantas (Li et al., 2017).
Citrus tristeza virus promueve la adquisición y transmisión de ‘Candidatus Liberibacter asiaticus’ por Diaphorina citri (Chen et al., 2023).
No se observó morfología flagelar en Candidatus Liberibacter asiaticus de muestras de cítricos, pero se observaron estructuras similares a flagelos en Candidatus Liberibacter asiaticus del intestino medio de D. citri infectado con CLas (Andrade et al., 2020). Como patógeno transfronterizo, CLas conserva una familia completa de 30 genes que codifican flagelos en su genoma significativamente reducido, entre los cuales el gen de la flagelina (flaA, CLIBASIA_02090) codifica monómeros de los filamentos (Duan et al., 2009). CLas flaA codifica 452 aminoácidos y contiene un dominio conservado de 22 aminoácidos (flg22) en las posiciones 29 a 50 del extremo N. Tiene actividad de patrón molecular asociado a patógenos (PAMP) e induce inmunidad innata en las plantas, incluida la muerte celular vegetal y la deposición de callosa (Zou et al., 2012). El patrón de expresión de los genes de la región flagelar de CLas varía en diferentes hospedantes, con una alta expresión en D. citri infectada con CLas y una expresión baja o nula en plantas de cítricos susceptibles (Yan et al., 2013; Andrade et al., 2020).
.
.
Forma de transmisión
Ca Liberibacter spp. se transmite a través de yemas y de insectos infectados, siendo la primera la más importante. El insecto vector es el psílido Diaphorina citri (Hemiptera: Liviidae), vulgarmente denominado «Psílido asiático de los cítricos» (Halbert et al., 2004). D. citri se adapta a temperaturas altas, se distribuye ampliamente en el sur de Asia y se extendió a otras regiones productoras de cítricos en el continente americano, y está presente en Argentina en las zonas citrícolas de Salta, Jujuy, Formosa, Misiones, Corrientes y Entre Ríos. Hasta el presente, D. citri aún no fue detectada en la provincia de Tucumán (principal provincia productora de limones), ni en San Pedro, provincia de Buenos Aires. Actualmente, en todas las zonas citrícolas, el SENASA monitorea la presencia o ausencia del vector. En los casos en donde se detecta, se realizan análisis del insecto mediante la técnica PCR Real Time (qPCR) para comprobar la presencia o ausencia de Ca Liberibacter spp (Morgan et al., 2012).
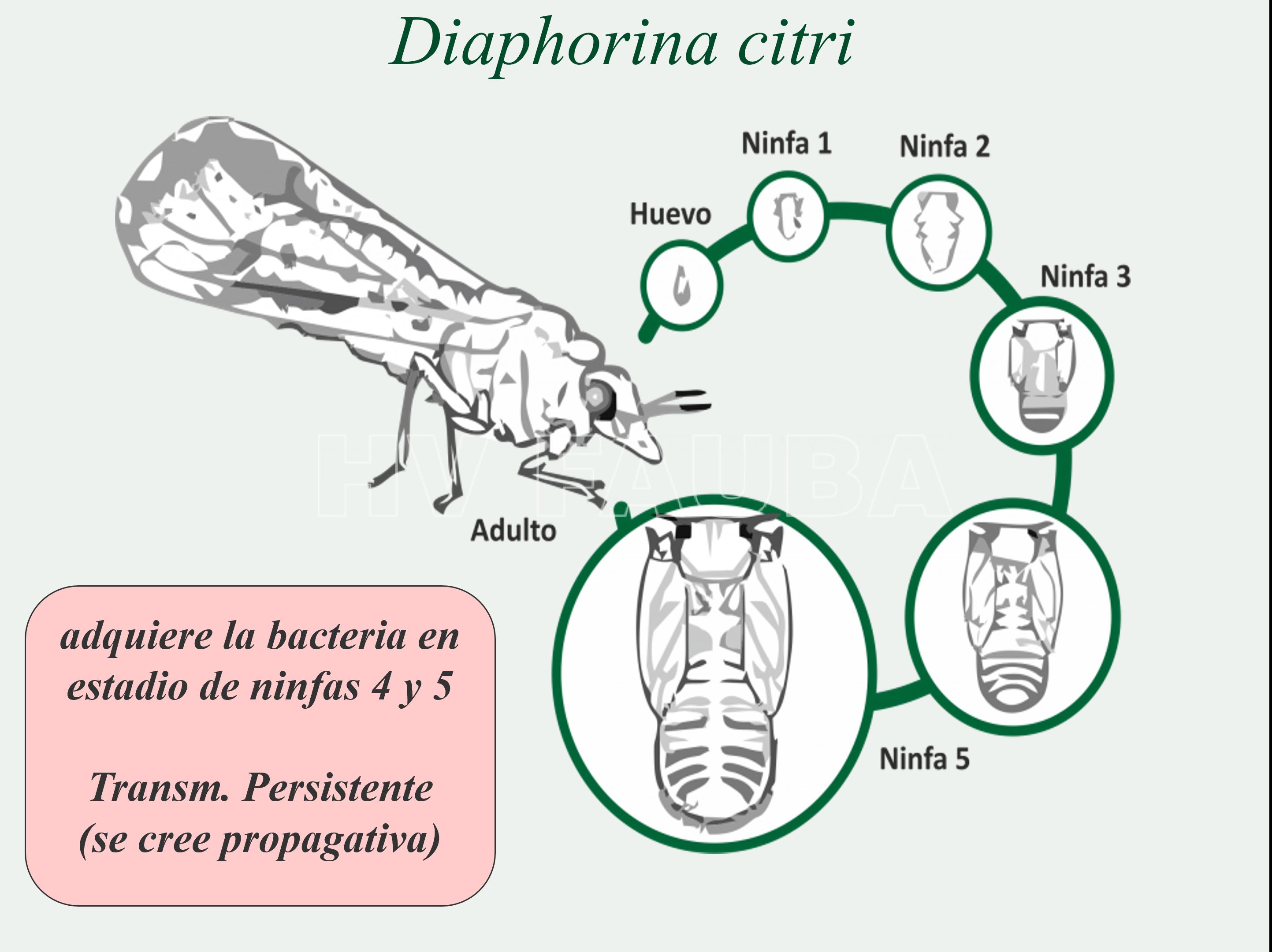
La transmisión por Diaphorina citri es de manera persistente, propagativa y circulativa (Ammar et al., 2019; Hosseinzadeh y Heck, 2023). Se cree que la bacteria se transmite de una manera persistente propagativa porque la bacteria se encuentra en varios órganos y tejidos de insectos, incluidos el intestino medio, el hemocele, el cuerpo graso, los ovarios y las glándulas salivales (Ammar et al., 2011; Brown et al., 2016; Canale et al., 2017; Ammar et al., 2019). Candidatus Liberibacter asiaticus se acumula dentro de las vacuolas asociadas al retículo endoplasmático en las células intestinales de Diaphorina citri (Ghanim et al., 2017). Luego de que las ninfas adquieren la bacteria, la titulación de esta se incrementa con el tiempo. Aunque los psílidos pueden adquirir Ca. Liberibacter en cualquier etapa de la vida, las etapas ninfales son más eficientes en la adquisición (Pelz-Stelinski et al., 2010, 2016). Está bien documentado que las ninfas de D. citri adquieren la bacteria de manera más eficiente que los adultos, y son capaces de transmitirla en estadios tardíos o después de su aparición como adultos. Sin embargo, los psìlidos adultos inoculan CLas de manera más eficiente que las ninfas cuando las CLas son adquiridas por ninfas en estadio temprano (Ammar et al., 2016; Ammar et al., 2020). Es decir, las ninfas de 4º y 5º estadío pueden adquirir la bacteria y transmitirla a los adultos. El patógeno puede ser adquirido por D. citri adulto después de 15 a 30 minutos de alimentarse de una planta infectada. La adquisición eficiente requiere períodos de alimentación más largos. Después de la adquisición, Ca. Liberibacter asiaticus puede ser detectada en los psílidos a lo largo de sus vidas. El insecto puede vivir hasta 3 meses, que es el tiempo de persistencia de la bacteria en el vector.
CLas coloniza la mayoría de los tejidos de D. citri (Hosseinzadeh et al., 2019). Se ha detectado la presencia de la bacteria CLas con una amplia distribución en el cerebro, las glándulas salivales, el sistema digestivo y el sistema reproductivo tanto de hembras como de machos, lo que indica una infección sistémica de CLas en D. citri (Nian et al., 2023). Por lo tanto, la infección de los órganos reproductivos sugiere la posibilidad de transmisibilidad materna y sexual. Ammar et al. (2011) detectaron CLas en ovarios de D. citri mediante microscopía de hibridación in situ con fluorescencia (FISH). Asimismo, Nian et al. (2023) observaron CLas en todos los huevos puestos y en las subsiguientes ninfas de primer y segundo estadio, lo que indica que un alto porcentaje de embriones y ninfas resultantes de madres infectadas con D. citri estaban infectadas con CLas. Las hembras CLas (+) pueden transmitir el patógeno a su descendencia de manera transovárica a una tasa del 18.9%, mientras que la adquisición de CLas por ninfas del sitio de oviposición donde se alimentan las hembras infectadas aumenta la transmisión a una tasa del 53.8 % (Pelz-Stelinski et al., 2010; Kelley y Pelz-Stelinski, 2019). Hosseinzadeh et al. (2019) encontraron que el análisis de título de CLas mostró títulos más altos en los órganos reproductores masculinos que en los femeninos. Los estudios demostraron que CLas puede transmitirse sexualmente de machos CLas (+) a hembras CLas (-) a una tasa de ~4% y, lo que es más interesante, estas hembras pueden transmitirlo a su descendencia a una tasa de ~0.8 % (Mann et al., 2011). CLas puede ser transportado por los espermatozoides y/u otros fluidos seminales durante el apareamiento, pero solo se puede detectar después de ~7 días de período de latencia, lo que respalda la idea de la propagación de CLas en los órganos reproductores femeninos. Si bien todavía existe un debate en la comunidad científica sobre si CLas se considera un patógeno o un simbionte de D. citri, la pregunta más interesante es si las cepas de CLas transmitidas sexualmente tienen la misma capacidad patogénica en D. citri o si la relación es más simbiótica que aquellas cepas de CLas adquiridas a través del aparato alimentador/intestino.
La infección con otros patógenos puede agravar la situación. Recientemente se ha determinado que infecciones de Citrus tristeza virus promueven la adquisición y transmisión de ‘Candidatus Liberibacter Asiaticus’ por Diaphorina citri (Chen et al., 2023).
Los vientos pueden dispersar los psílidos desde 1,5 hasta 4 km distancia.
Las fluctuaciones poblacionales del psílido están íntimamente relacionadas con el ritmo, cantidad y calidad nutricional de las brotaciones. El adulto coloca los huevos en los brotes tiernos (estadios B1 y B2) siendo estos el recurso alimenticio exclusivo de las ninfas pequeñas (estadios de desarrollo) (Hochmaier et al.).
Una descripción del insecto vector se observa en este video.
Monitoreo del vector del HLB “Diaphorina citri”. INTA
.
- Diaphorina citri adulto, notar el angulo sobre el cual se posa sobre la hoja de cítrico
- Diaphorina citri adulto, notar el angulo sobre el cual se posa sobre la hoja de cítrico
- Adulto de Diaphorina citri adulto. Autor: Salvador Vitanza
- Adulto de Diaphorina citri adulto. Autor: Salvador Vitanza
- 01 Psílido asiático de cítricos Autor: Mike Lewis/UCR
- 02 Diaphorina citri, el psílido asiático de los cítricos, es un hemíptero de la familia Psyllidae, transmisor de bacterias del género Candidatus Liberibacter spp., causantes del Huanglongbing de los cítricos. Es imprescindible el control del vector para evitar la enfermedad. Autor: Mike Lewis/UCR
- 03 Diaphorina citri. Fuente: USDA’s Lab at Ft. Detrick, Maryland. Autor: Mike Lewis/UCR
- 04 Ninfas de Diaphorina citri. Autor: Mike Lewis/UCR
.
.
En otras regiones citrícolas como África, se ha identificado al psílido Trioza erytreae Del Guercio (Hemiptera: Triozidae) como insecto vector de Ca. Liberibacter (Candidatus Liberibacter africanus) (Aubert, 1987; Aidoo, 2020). Recientemente, se ha reportado al psílido Diaphorina citri Kuwayama (Hemiptera: Liviidae) en la República de Benin, África occidental (Sétamou et al., 2023).
.
- Ciclo del psílido vector, Diaphorina citri, conocida como psílido asiático de los cítricos.
.
.
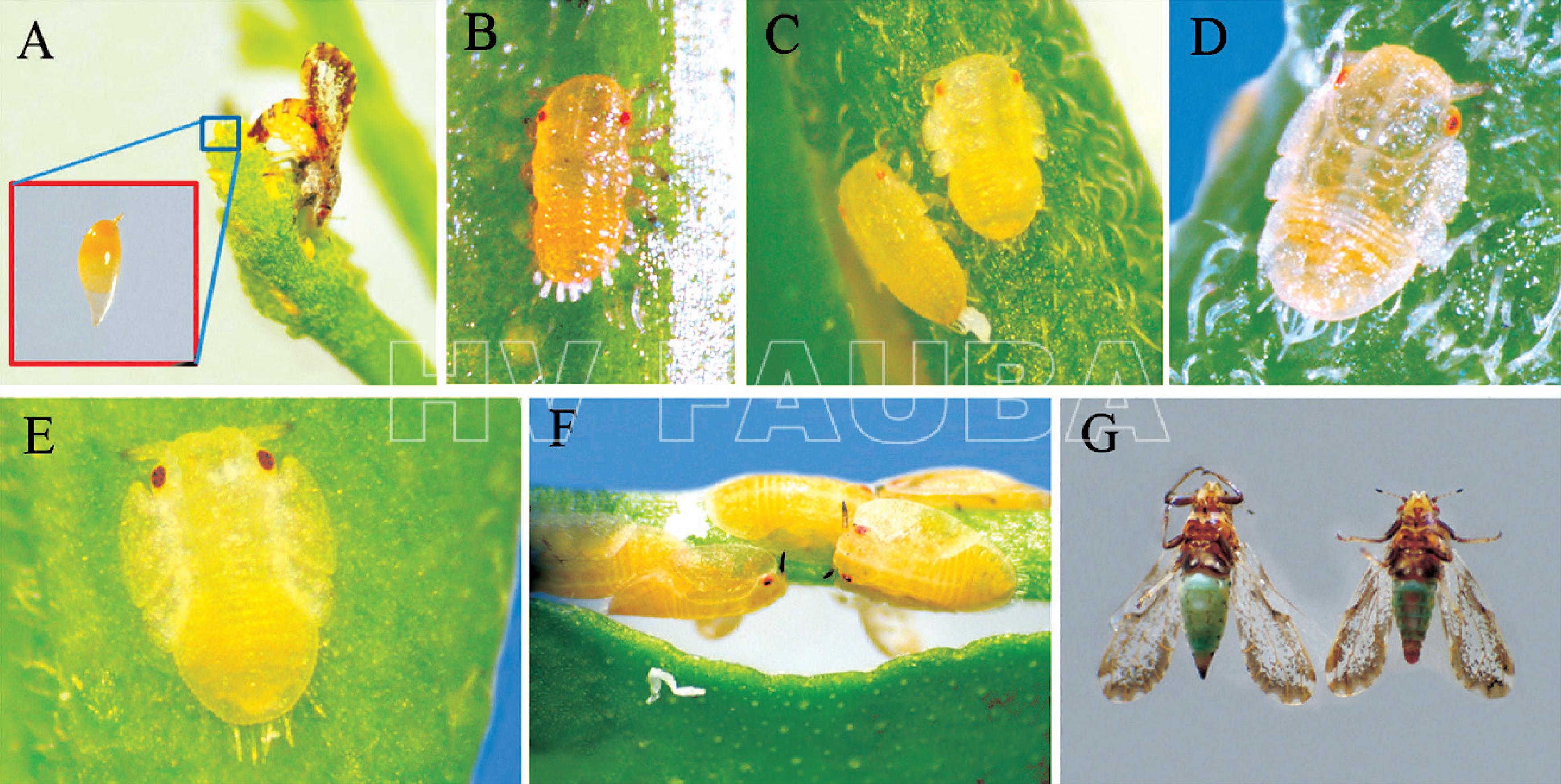
- Morfología de los estados de desarrollo de Diaphorina citri. (A) Hembra ovipositando sobre un brote de mirto. Huevo: primer plano. (B) Ninfa I. (C) Ninfa II. (D) Ninfa III. (E) Ninfa IV. Notar que los esbozos alares no sobrepasan los ojos. (F) Ninfa V. Notar que los esbozos alares sobrepasan los ojos. (G) Adultos de D. citri. Izquierda. Hembra. Derecha. Macho. Notar las diferencias en el ápice del abdomen. Autor: García et al., 2016
.
.
Hospedantes alternativos
Entre los hospedantes más importantes, la Murraya paniculata (mirto o jazmín árabe) tiene una gran difusión en Argentina. Esta planta es utilizada en las zonas citrícolas del norte de Argentina como planta ornamental. Diaphorina citri se ve atraído por la coloración amarilla de las hojas de Murraya paniculata, de las cuales se alimenta. Si esta planta se encuentra infectada con la bacteria, el insecto la adquiere y luego, al alimentarse de plantas cítricas sanas, transmite la enfermedad.
.
- En EE.UU., el USDA ha entrenado perros para detectar el HLB en Florida. Autor: USDA. Ver: Gottward et al., 2020 (https://www.pnas.org/content/117/7/3492)
.
.
Epidemiología
Desde el punto de vista epidemiológico, el HLB es considerada una enfermedad poliética.
El período de incubación del HLB puede ser bastante variable; de unos meses a uno o más años (Gottwald, 2010). Los árboles que expresan el inicio de la manifestación sintomática al mismo tiempo pueden haber sido infectados en diferentes momentos en el pasado. Datos de grandes extensiones citrícolas comerciales en Florida, EE. UU. en las que se ha llevado a cabo un manejo extensivo de psílidos y programas de remoción de árboles enfermos de HLB (erradicación) han indicado que se requieren de 2 a 2.5 años para reducir la acumulación de infecciones asintomáticas antes de que estas estrategias de manejo comiencen a mostrar algún efecto (M. Irey, datos no publicados ). Esta es una evidencia indirecta pero contundente de que la enfermedad posee un período de incubación de entre 1 a 2.5 años en montes frutales comerciales establecidos de 7 a 10 años de antigüedad. Los montes de cítricos más jóvenes manifestarán síntomas dentro de los 6 a 12 meses posteriores a la siembra, lo que indica que los árboles jóvenes de rápido crecimiento, mucho más pequeños en volumen de copa, tienen un período de incubación más corto (Gottwald, 2010). Observaciones en árboles de más de 10 años de edad indican un desarrollo de síntomas aún más lento. Estas observaciones, aunque no son cuantitativas, tomadas en conjunto permiten estimar una ventana de incubación temporal muy variable que puede variar desde unos pocos meses hasta varios años.
En las enfermedades virales o en aquellas causadas por bacterias fastidiosas, como el HLB, que no poseen signo y tienen características epidemiológicas similares, en las que interviene un insecto vector en la transmisión del agente causal, el concepto de latencia es diferente al de otros patosistemas en los que hay expresión de signos, como por ejemplo en aquellas enfermedades causadas por hongos, pseudohongos y bacterias. En el primer caso, el período de incubación y la latencia son dos procesos temporales concurrentes y relacionados: ambos comienzan en la infección. La latencia finaliza cuando comienza la infectividad y generalmente es seguida por el final del período de incubación, cuando la planta se vuelve sintomática. La latencia del HLB también es muy variable y aparentemente se ve muy afectada por la edad de los árboles y otros factores. Es probable que un árbol asintomático haya actuado como fuente de infección para muchos otros árboles, pero los síntomas de la enfermedad eran visualmente subclínicos en los árboles fuente (infectivos) en ese momento. De acuerdo con la sensibilidad de detección de los test de qPCR actualmente usados, la infección no se puede detectar inmediatamente después de la transmisión del vector y durante algún tiempo.
.
.
Manejo Integrado de la enfermedad
El HLB es una enfermedad sin cura en la actualidad.
Todos los cultivares y especies comerciales de cítricos son susceptibles al HLB. Las plantas, una vez infectadas, no se recuperan y se tornan comercialmente improductivas.
La base del programa de manejo debe ser la prevención (Pazolini et al., 2021).
La Base del Manejo del HLB en Argentina se centra en el Manejo Legal, lo que permite medidas de exclusión, erradicación, básicamente en conjunto con medidas de manejo cultural, control químico, biológico, etc. Para prevenir o evitar la diseminación de esta enfermedad, se deben implementar y gestionar en forma combinada las siguientes prácticas de manejo:
* MANEJO LEGAL: en Argentina se encuentra vigente el Programa Nacional de Prevención del Huanglongbing. Entre los diferentes objetivos y medidas implementadas por el PNPH se encuentran:
** No ingresar al país en forma ilegal material de propagación vegetativa de cítricos (yemas, injertos o plantines)
** Producción de plantas sanas en vivero (certificación de plantas cítricas, producidas solo bajo invernadero, no emplear plantas de origen desconocido)
** Monitorear plantas y poblaciones del vector, y eventual herradicación o control.
** Erradicación de hospedantes alternativos (ej. Murraya paniculata), el cual está prohibido por SENASA (Res. 447/2009).
** Control de traslado de fruta entre provincias (DTV-e)
* El artículo 19 de la Disposición DNPV N° 4/13 SENASA establece que todo productor de fruta tiene la obligatoriedad de demostrar con la Guía de Sanidad para el Tránsito de plantas y/o sus partes el origen del material de propagación plantado.
.
* Uso de plantas certificadas libre de enfermedad (producidas y certificadas en invernadero, con malla antiáfido y doble puerta de entrada, ambas con pediluvios para la desinfección del calzado de acuerdo con la legislación vigente, Res. SENASA 930/2009).
* Monitoreo del vector (por golpeteo en ramas, por trampas pegajosas, por inspección visual).
* Control del insecto vector (en vivero y monte frutal), tanto químico como biológico (ej. Tamarixia radiata). En el caso de control químico se debe prestar especial atenciaón a la tecnología de aplicación para lograr una correcta distribución del insecticida en el arbol (Menger et al., 2021; Rehberg et al., 2021).
* Detección temprana (PCR real time) y Erradicación de plantas enfermas. Actualmente se está desarrollando una técnica de detección molecular más sensible basada en la técnica Cas12a (Wheatley et al., 2021).
* Recientemente se han identificado especies de la subtribu Citrinae totalmente resistentes (Eremocitrus glauca y Papua / Nueva Guinea Microcitrus), así como sus híbridos y aquellas con Citrus, por lo que podrían ser una fuente de resistencia contra Las en programas de reproducción o intentar usarlos directamente como portainjertos cítricos resistentes a Las (Alves et al., 2021).
* La poda no elimina la bacteria.
.
.
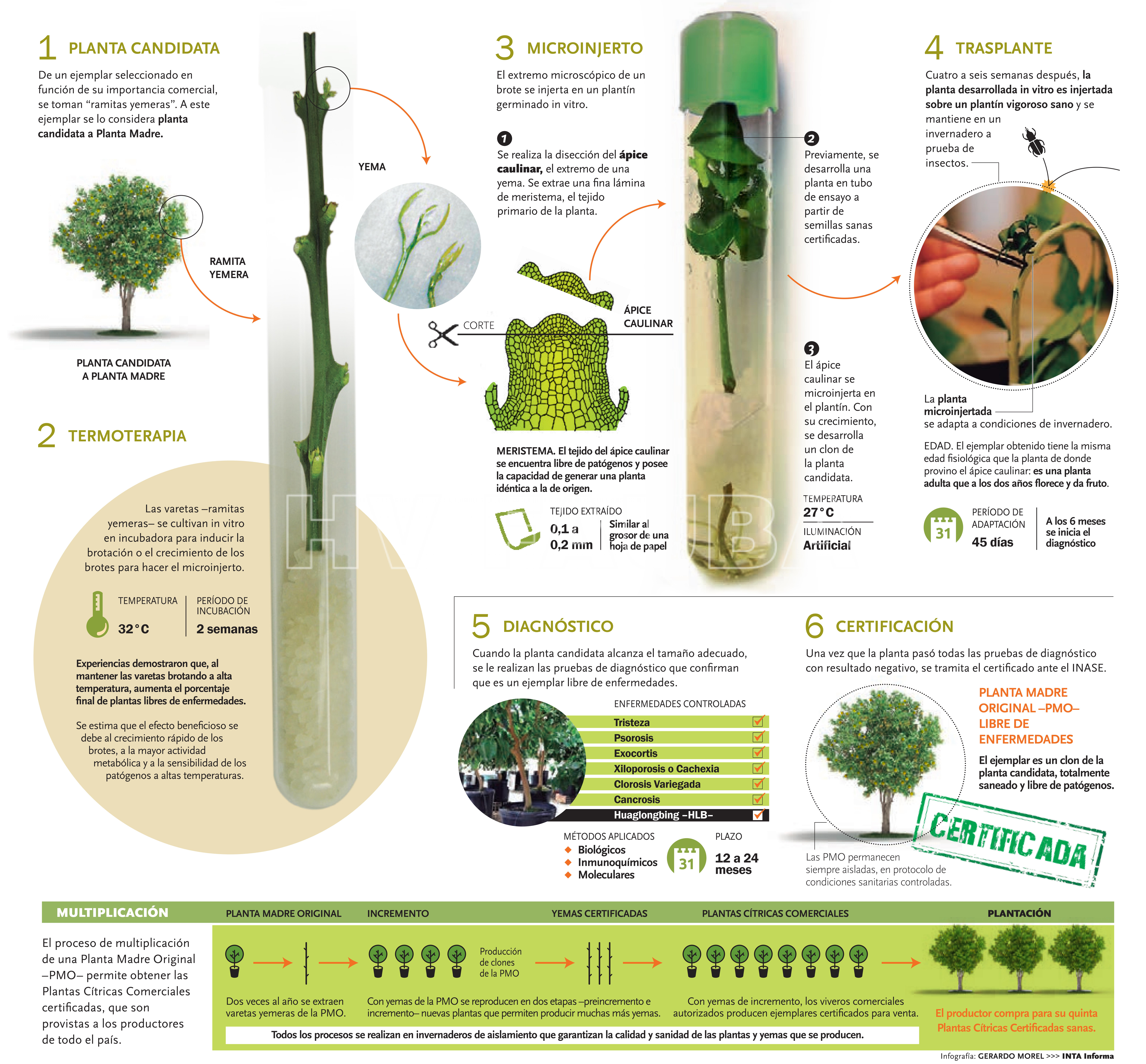
- Programa PROCITRUS INTA para para obtener variedades comerciales certificadas de cítricos que son libres de enfermedades y tienen excelente calidad genética. Esto permite que el productor puede contar con mayores rendimientos por hectárea y extender la vida útil de las plantas. FUENTE: INTA
.
.
- 15 Deficiencia de Magnesio
- 16 Deficiencia de Magnesio
- 17 Deficiencia de Magnesio
- 18 Deficiencia de Zinc
- 19 Deficiencia de Zinc
- 20 Deficiencia de Zinc
- 21 Comparación síntomas de HLB y Deficiencia de Zinc
- 22 Comparación síntomas de HLB y Deficiencia de Zinc
- 23 Comparación síntomas de HLB y Deficiencia de Zinc
- 24 Comparación síntomas de HLB y Deficiencia de Zinc
- 25 Comparación síntomas de HLB y Deficiencia de Zinc
.
.
SENASA
HLB – Programa Nacional de Prevención del Huanglongbing. SENASA
HLB – Programa Nacional de Prevención del Huanglongbing. Ministerio de Agroindustria
HLB – Programa Nacional de Prevención del Huanglongbing. Fiscalización y control sanitario
HLB – ¿Qué es el HLB? M. de Agroindustria > Sec. Agricultura, Ganadería y Pesca > Subse. Agricultura > Dir. Nac. de Fruticultura y Horticultura
Consultas y Denuncias: alertahlb@senasa.gov.ar / 0800-999-2386
.
Análisis epidemiológico a nivel nacional
Análisis epidemiológico por provincia
.
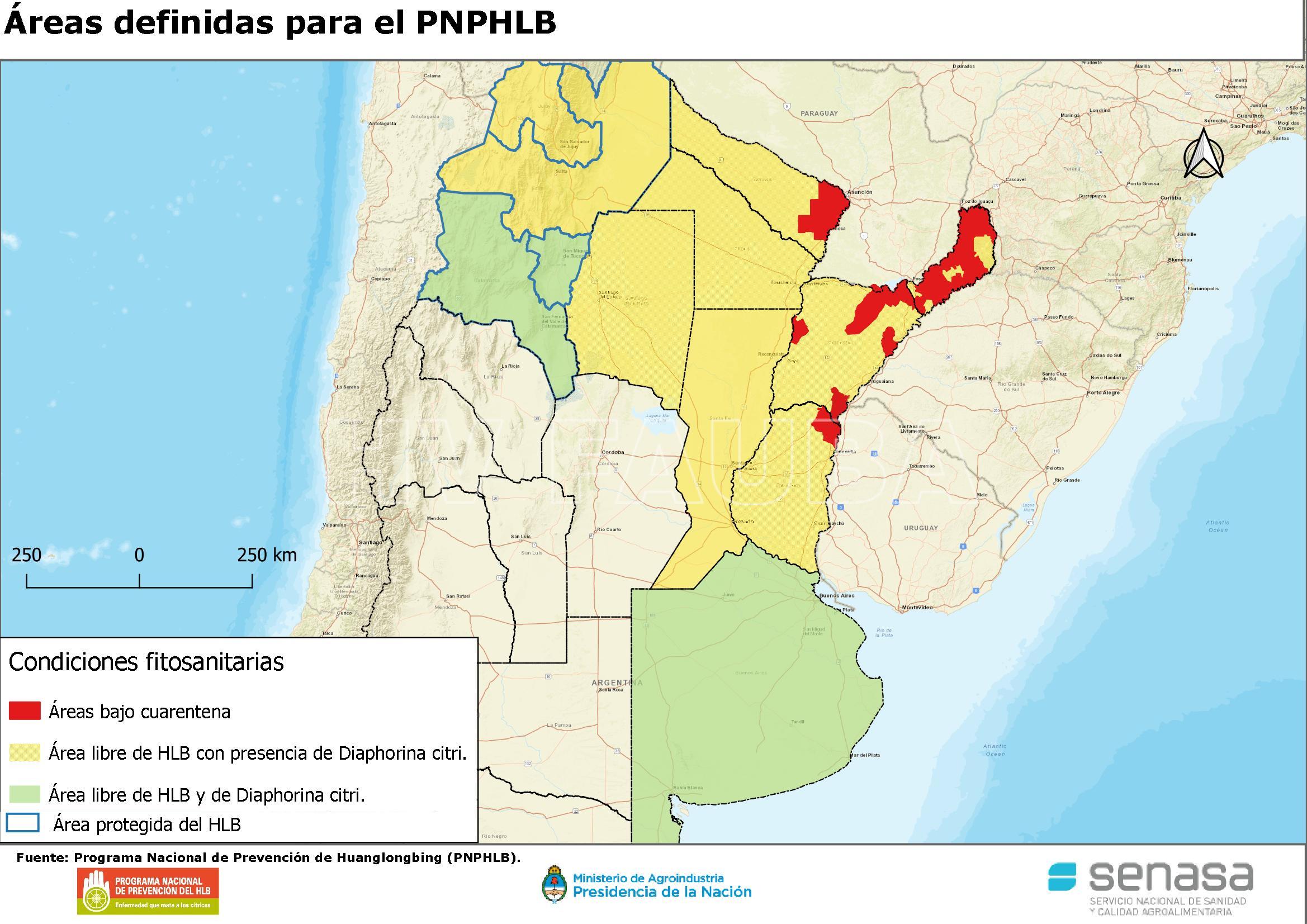
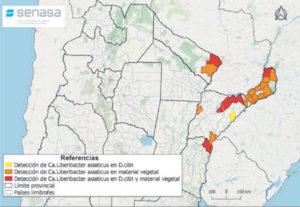
- Áreas de Argentina definidas con condición fitosanitaria para el PNPHLB. Fuente: www.argentina.gob.ar
.
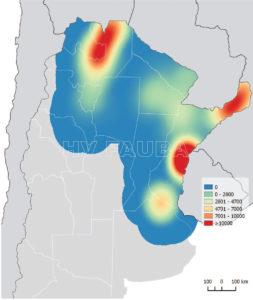
- Intensidad de monitoreo de HLB a Octubre 2019. Fuente: Datos Programa Nacional de Prevención del Huanglongbing (PNPHLB)
- Distribución de las detecciones de HLB a Octubre 2019. FUENTE: Datos Programa Nacional de Prevención del Huanglongbing (PNPHLB)
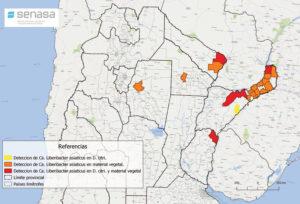
- Status de detección de HLB a nivel nacional en febrero de 2021. Fuente: PNPHLB
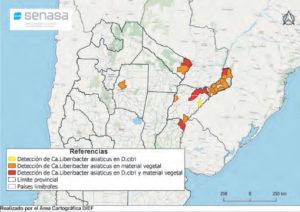
- Status de detección de HLB a nivel nacional en agosto de 2021. Fuente: PNPHLB
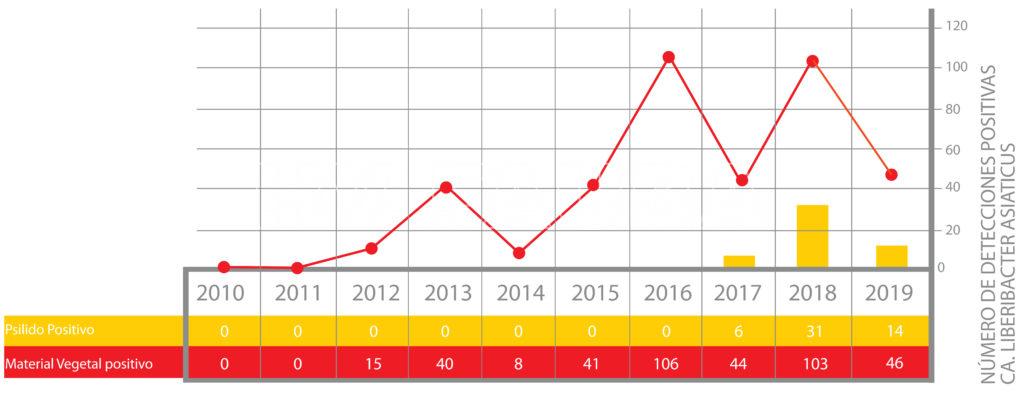
- Evolución del número de detecciones positivas de HLB en Argentina a Octubre 2019. FUENTE: Datos Programa Nacional de Prevención del Huanglongbing (PNPHLB)
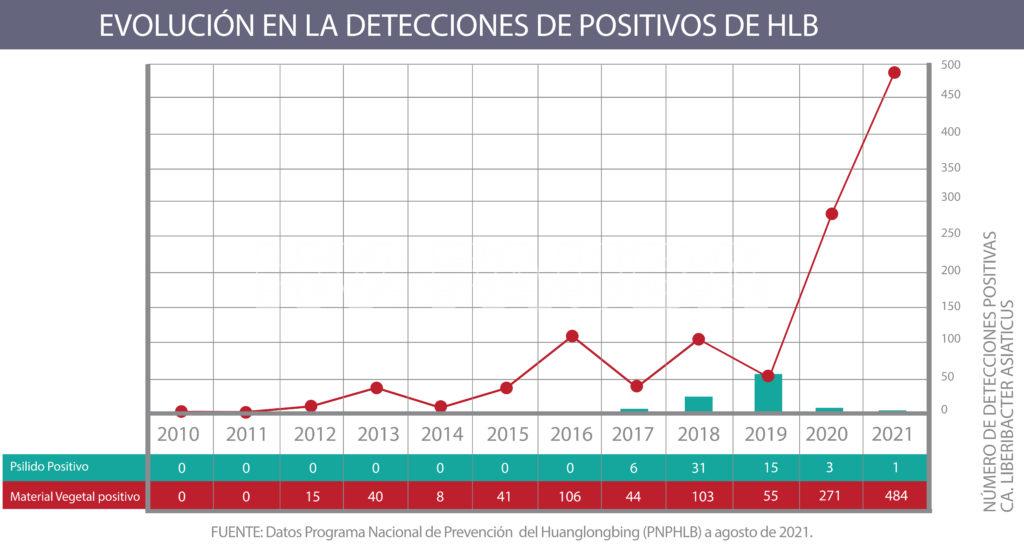
- Evolución del número de detecciones positivas de HLB en Argentina a Agosto 2021. FUENTE: Datos Programa Nacional de Prevención del Huanglongbing (PNPHLB)
.
.
Normativa Vigente
Ley Nacional N° 26.888 ratifica el Programa Nacional de Prevención de Huanglongbing (PNPHLB), creado por Resolución N° 517/09 de la Ex Secretaría de Agricultura, Ganadería, Pesca y Alimentación.
Resolución SENASA Nº 458/2005: Establece como de denuncia obligatoria la presencia en cítricos de sintomatología sospechosa de Huanglongbing (HLB).
Resolución Ex SAGPyA Nº 447/2009: Prohíbe la producción, plantación, comercialización y transporte de mirto o jazmín árabe (Murraya paniculata) en todo el territorio nacional.
Resolución SENASA Nº 517/2009. por la cual se crea el «Programa Nacional de Prevención del HLB».
Resolución SENASA Nº 930/2009: establece que todo material de propagación de cítricos, incluido la planta terminada, deberá producirse y mantenerse en vivero bajo cubierta en instalaciones que cuenten con cobertura impermeable al agua y todas las aberturas protegidas con tela de malla anti insectos; doble puerta de acceso con antecámara entre ellas; equipamiento de desinfección de vestimenta, manos y utencillos.
Resolución SENASA N° 959/2009, que prohíbe el movimiento de todo el material vegetal de propagación, las plantas y sus partes (excepto frutos), en todo el Territorio Nacional, sin previa autorización del SENASA.
Resolución SENASA N° 273/2010, que autoriza el uso, con carácter provisorio, de una lista de principios activos para el control del psílido denominado Diaphorina citri.
Disposición SENASA Nº 4/2013: Establece la creación del Registro Nacional Fitosanitario de Operadores de Materia de propagación, micropropagación y/o multiplicación vegetal, y los requisitos para su comercialización.
Resolución SENASA Nº 165/2013: Establece las diferentes áreas según su condición fitosanitaria respecto al HLB y la Diaphorina citri en la República Argentina, regulando el movimiento de fruta comercial y material de propagación vegetal entre áreas con distinta condición fitosanitaria.
Resolución SENASA N° 336/2014, que aprueba la reglamentación del Programa Nacional de Prevención de HLB creado por la Ley Nº 26.888.
Resolución SENASA N° 234/2016 aprueba el Sistema de Mitigación de Riesgo (SMR) transitorio para HLB y Diaphorina citri como alternativa al “Proceso con grado de selección asignado” para el traslado de fruta fresca cítrica desde las provincias de Corrientes y Entre Ríos hacia los partidos de San Pedro y Baradero, ambos en la Provincia de Buenos Aires.
Resolución SENASA N° 524/2018, plan de trabajo para el control y erradicación del HLB y su vector.
Resolución SENASA Nº 875/2020. Cambio Estatus Sanitario de la Enfermedad.Anula Resoluciones 165/2013 y 234/2016.
.
.
Artículos – Noticias
2022. Nov. 29. Se extiende el alerta fitosanitario en Tucumán para el control de Diaphorina citri. La medida del Senasa prorroga hasta el 31 de marzo de 2023 el alerta y establece la denuncia obligatoria ante la detección de la plaga.
2022. Nov. 2. Injectable Oxytetracycline Registered
2022. Jun. 21. Prevención del HLB: se erradicaron plantas de Murraya paniculata en Tucumán
2022. Abr. 06. Researcher: HLB Situation in Brazil Is ‘Alarming’
2022. Mar. 04. Presencia de Diaphorina citri en una planta de traspatio en la provincia de Tucumán
2021. Oct. 27. HLB tolerant rootstocks arrive in Australia
2020. Jul. 07. UC Riverside discovers first effective treatment for citrus-destroying disease
2019. USDA ARS. Barking Up the Right Tree: Canines Detect HLB
2018. Sep. 18. Dogs enlisted to sniff out disease in citrus trees
2018. Nov. 26. Detectaron un caso positivo de HLB en una planta de naranja en Entre Ríos
2018. Nov. 05. Aplican “deep learning” para detectar HLB en cítricos
2018. Oct. 05. Combate al HLB: la ciudad inició el reemplazo de mirtos por otras especies
2018. Jul. 12. Se destruyeron más de 4000 plantas cítricas por el HLB
2018. Jul. 11. Contra el HLB: Senasa destruyó más de 4 mil plantas cítricas
2018. Jun. 18. Crían una avispa para controlar el HLB
2018. Jun. 13. Villa del Rosario y Federación: Quemaron plantas cítricas que tenían HLB
2018. Abr. 17. Advierten sobre los riesgos del HLB para la producción de cítricos en la Argentina
2018. Feb. 15. Brasil: Identifican la feromona del insecto que transmite el HLB
2018. Ene. 08. Entre Ríos: detectan el vector de una enfermedad que amenaza a los cítricos
2017. Dic. 28. Se incrementa el área de expansión del HLB: piden reforzar el monitoreo y denunciar síntomas
2017. Dic. 20. Citricultura: se detectó la peligrosa enfermedad HLB en Entre Ríos
2017. Dic. 19. El Senasa detectó insectos portadores del HLB en el norte del Río Uruguay.
2017. Oct. 04. Detectaron plantas positivas al HLB en el norte de Corrientes
2017. Sep. 26. Preocupa la llegada del HLB al NOA tras el caso en Santiago del Estero
2017. Sep. 13. Se amplía el área afectada por la enfermedad más destructiva de los cítricos
2017. Jun. 22. El Senasa detectó tres casos positivos al HLB en Formosa y Chaco
.
Videos
Citrus Greening. USDAAPHIS
Detecting Asian citrus psyllid
Asian Citrus Psyllids and HLB – California Department of Food and Agriculture (CDFA)
Testing for HLB Using PCR Technology
.
Detección de HLB por perros entrenados:
Dogs can sniff out citrus greening disease
Early Detection of Citrus Greening using Dogs
Canines can detect trees infected with the bacterium that causes huanglongbing
Managing Asian Citrus Psyllid and Citrus Growth Using Particle Films
.
.
.
Bibliografía
CNAS. Information on Huanglongbing and Asian Citrus Psyllid
Achor D, Welker S, Ben-Mahmoud S, et al. (2020) Dynamics of Candidatus Liberibacter asiaticus Movement and Sieve-Pore Plugging in Citrus Sink Cells. Plant Physiology 182(2): 882‐891. doi: 10.1104/pp.19.01391
Agostini JP (2013) INTA Montecarlo. “Huanglongbing (ex Greening) y el trabajo conjunto de las Instituciones para frenar su ingreso en Argentina”
Ahmad K, Sijam K, Hashim H, et al. (2011) Field assessment of calcium, copper and zinc ions on plant recovery and disease severity following infection of Huanglongbing (HLB) disease. African Journal of Microbiology Research 5(28): 4967-4979. doi: 10.5897/AJMR11.236
Aidoo OF, Tanga CM, Mohamed SA, et al. (2020) Detection and monitoring of ‘Candidatus’ Liberibacter spp. vectors: African citrus triozid Trioza erytreae Del Guercio (Hemiptera: Triozidae) and Asian citrus psyllid Diaphorina citri Kuwayama (Hemiptera: Liviidae) in citrus groves in East Africa. Agr Forest Entomol, 22: 401-409. doi: 10.1111/afe.12395
Ajene IJ, Khamis FM, van Asch B, et al. (2020) Distribution of Candidatus Liberibacter species in Eastern Africa, and the First Report of Candidatus Liberibacter asiaticus in Kenya. Scientific Reports 10: 3919. doi: 10.1038/s41598-020-60712-0
Albrecht U, McCollum G, Bowman KD (2012) Influence of rootstock variety on Huanglongbing disease development in field-grown sweet orange (Citrus sinensis [L.] Osbeck) trees. Scientia Horticulturae 138: 210-220. doi: 10.1016/j.scienta.2012.02.027
Alquézar B, Carmona L, Bennici S, et al. (2022) Cultural Management of Huanglongbing: Current Status and Ongoing Research. Phytopathology 112(1): 11-25. doi: 10.1094/PHYTO-08-21-0358-IA
Alves KS, do Carmo LHM, Del Ponte EM (2020) Spatiotemporal spread of huanglongbing in commercial citrus orchards of Minas Gerais, Brazil. Trop. plant pathol. 45: 668–679 (2020). doi: 10.1007/s40858-020-00398-x
Alves MN, Lopes SA, Raiol-Junior LL, et al. (2021) Resistance to ‘Candidatus Liberibacter asiaticus,’ the Huanglongbing Associated Bacterium, in Sexually and/or Graft-Compatible Citrus Relatives. Front. Plant Sci. 11: 617664. doi: 10.3389/fpls.2020.617664
Alves KS, Rothmann LA, Del Ponte EM (2022) Linking Climate Variables to Large-Scale Spatial Pattern and Risk of Citrus Huanglongbing: A Hierarchical Bayesian Modeling Approach. Phytopathology 112(1): 189-196. doi: 10.1094/PHYTO-05-21-0219-FI
Albrecht U, Hall DG, Bowman KD (2014) Transmission Efficiency of Candidatus Liberibacter asiaticus and Progression of Huanglongbing Disease in Graftand Psyllid-inoculated Citrus. HORTSCIENCE 49(3):367–377.
Ammar ED, Shatters RG, Hall DG (2011) Localization of Candidatus Liberibacter asiaticus, Associated with Citrus Huanglongbing Disease, in its Psyllid Vector using Fluorescence in situ Hybridization. Journal of Phytopathology. 159: 726–734. doi: 10.1111/j.1439-0434.2011.01836.x
Ammar ED, Ramos JE, Hall DG, et al. (2016) Acquisition, replication and inoculation of Candidatus Liberibacter asiaticus following various acquisition periods on huanglongbing-infected citrus by nymphs and adults of the Asian citrus psyllid. PLoS ONE. 11: e0159594. doi: 10.1371/journal.pone.0159594
Ammar ED, Achor D, Levy A (2019) Immuno-ultrastructural localization and putative multiplication sites of huanglongbing bacterium in Asian citrus psyllid Diaphorina citri. Insects. 10: 422. doi: 10.3390/insects10120422
Ammar ED, George J, Sturgeon K, et al. (2020) Asian citrus psyllid adults inoculate huanglongbing bacterium more efficiently than nymphs when this bacterium is acquired by early instar nymphs. Scientific Reports. 10: 1–10. doi: 10.1038/s41598-020-75249-5
Andrade M, Li J, Wang N (2020) Candidatus Liberibacter asiaticus: virulence traits and control strategies. Tropical Plant Pathology. doi: 10.1007/s40858-020-00341-0
Andrade MO, Pang Z, Achor DS, et al. (2020) The flagella of ‘Candidatus Liberibacter asiaticus’ and its movement in planta. Mol. Plant Pathol. 21: 109–123. doi: 10.1111/mpp.12884
Armstrong CM, Zhou L, Luo W, et al. (2022) Identification of a Chromosomal Deletion Mutation and the Dynamics of Two Major Populations of ‘Candidatus Liberibacter asiaticus’ in Its Hosts. Phytopathology 112(1): 81-88. doi: 10.1094/PHYTO-08-21-0325-FI
Arratia-Castro AA, Santos-Cervantes ME, ArceLeal AP, et al. (2016) Detection and quantification of ‘Candidatus Phytoplasma asterisʼ and ‘Candidatus Liberibacter asiaticusʼ at early and late stages of Huanglongbing disease development. Canadian Journal of Plant Pathology 38()4: 411-421. doi: 10.1080/07060661.2016.1243586
Arredondo Valdés R, Delgado Ortiz JC, Beltrán Beache M, et al. (2016) A review of techniques for detecting Huanglongbing (greening) in citrus. Canadian Journal of Microbiology 62(10): 803-811. doi: 10.1139/cjm-2016-0022
Aubert B (1987) Trioza erytreae Del Guercio and Diaphorina citri Kuwayama (Homoptera: Psylloidae), the two vectors of citrus greening disease: biological aspects and possible control strategies. Fruits 42:149–62.
Avery PB, Duren EB, Qureshi JA, et al. (2021) Field Efficacy of Cordyceps javanica, White Oil and Spinetoram for the Management of the Asian Citrus Psyllid, Diaphorina citri. Insects. 12(9): 824. doi: 10.3390/insects12090824
Badaracco A, Redes FJ, Preussler CA, Agostini JP (2017) Citrus huanglongbing in Argentina: detection and phylogenetic studies of Candidatus Liberibacter asiaticus. Australasian Plant Pathology 46(2): 171–175. doi: 10.1007/s13313-017-0473-4
Bassanezi RB, Lopes SA, de Miranda MP, et al. (2020) Overview of citrus huanglongbing spread and management strategies in Brazil. Tropical plant pathology (accepted). doi: 10.1007/s40858-020-00343-y
Bassanezi RB, Primiano IV, Vescove HV (2021) Effect of enhanced nutritional programs and exogenous auxin spraying on huanglongbing severity, fruit drop, yield and economic profitability of orange orchards. Crop Protection 145: 105609. doi: 10.1016/j.cropro.2021.105609
Belasque JrJ, Bassanezi RB, Yamamoto PT, et al. (2010) Lessons from Huanglongbing management in São Paulo State, Brazil. Journal of Plant Pathology 92 (2): 285-302. doi: 10.4454/jpp.v92i2.171
Bendix C, Lewis JD (2018) The enemy within: phloem-limited pathogens. Molecular Plant Pathology 19: 238–254. doi: 10.1111/mpp.12526
Boava LP, Cristofani-Yaly M, Machado MA (2017) Physiologic, Anatomic, and Gene Expression Changes in Citrus sunki, Poncirus trifoliata, and Their Hybrids After ‘Candidatus Liberibacter asiaticus’ Infection. Phytopathology 107(5): 590-599. doi: 10.1094/PHYTO-02-16-0077-R
Bové (2006) Huanglongbing: a destructive, newly-emerging, century-old disease of citrus. Journal of Plant Pathology 88: 7-37. doi: 10.4454/jpp.v88i1.828
Bové JM (2014) Huanglongbing or yellow shoot, a disease of Gondwanan origin: Will it destroy citrus worldwide?. Phytoparasitica 42: 579–583. doi: 10.1007/s12600-014-0415-4
Britt K, Gebben S, Levy A, et al. (2020) The Detection and Surveillance of Asian Citrus Psyllid (Diaphorina citri)—Associated Viruses in Florida Citrus Groves. Front. Plant Sci. 10: 1687. doi: 10.3389/fpls.2019.01687
Brlansky RH, Rogers ME (2007) Citrus Huanglongbing: Understanding the Vector-Pathogen Interaction for Disease Management. Online. APSnet Features. doi: 10.1094/APSnetFeature-2007-1207
Brlansky RH, Dewdney MM, Rogers ME (2011) Florida Citrus Pest Management Guide: Huanglongbing (Citrus Greening). University of Florida, IFAS Extension.
Brown JK, Cicero JM, Fisher TW (2016) CHAPTER 28: Psyllid-Transmitted Candidatus Liberibacter Species Infecting Citrus and Solanaceous Hosts. Vector-Mediated Transmission of Plant Pathogens. pp 399-422. doi: 10.1094/9780890545355.028
Caceres S, Zarate A, Oviedo R (2008) Primera reunión de entomólogos dedicados al estudio del insecto vector de HLB.. – Publicación de la EEA Bella Vista Serie Técnica Nº 29. – Página/s: 48 pp. – ISBN/ISSN: ISSN 1515-9299.
Canale MC, Tomaseto AF, Haddad ML, et al. (2017) Latency and Persistence of ‘Candidatus Liberibacter asiaticus’ in Its Psyllid Vector, Diaphorina citri (Hemiptera: Liviidae). Phytopathology 107(3): 264-272. doi: 10.1094/PHYTO-02-16-0088-R
Canales E, Coll Y, Hernández I, et al. (2016) ‘Candidatus Liberibacter asiaticus’, Causal Agent of Citrus Huanglongbing, Is Reduced by Treatment with Brassinosteroids. PLoS ONE 11(1): e0146223. doi: 10.1371/journal.pone.0146223
Carmo-Sousa M, Cortés MTB, Lopes JRS (2020) Understanding psyllid transmission of Candidatus Liberibacter as a basis for managing huanglongbing. Trop. plant pathol. 45: 572–585. doi: 10.1007/s40858-020-00386-1
Cen H, Weng H, Yao J, et al. (2017) Chlorophyll Fluorescence Imaging Uncovers Photosynthetic Fingerprint of Citrus Huanglongbing. Frontiers in Plant Sciences 8: 1509. doi: 10.3389/fpls.2017.01509
Chen J, Pu X, Deng X, et al. (2009) A phytoplasma related to ‘Candidatus phytoplasma asteri’ detected in citrus showing Huanglongbing (yellow shoot disease) symptoms in Guangdong, P. R. China. Phytopathology 99(3): 236-42. doi: 10.1094/PHYTO-99-3-0236
Chen L, Liu Y, Wu F, et al. (2023) Citrus tristeza virus Promotes the Acquisition and Transmission of ‘Candidatus Liberibacter Asiaticus’ by Diaphorina citri. Viruses 15(4): 918. doi: 10.3390/v15040918
Chiyaka C, Singer BH, Halbert SE, et al. (2012) Modeling huanglongbing transmission within a citrus tree. Proc Natl Acad Sci USA 109(30): 12213-12218. doi: 10.1073/pnas.1208326109
Clark K, Franco JY, Schwizer S, et al. (2018) An effector from the Huanglongbing-associated pathogen targets citrus proteases. Nat Commun 9: 1718. doi: 10.1038/s41467-018-04140-9
Clark KJ, Pang Z, Trinh J, et al. (2020) Sec-Delivered Effector 1 (SDE1) of ‘Candidatus Liberibacter asiaticus’ Promotes Citrus Huanglongbing. Molecular Plant-Microbe Interactions 33(12): 1394-1404. doi: 10.1094/MPMI-05-20-0123-R
Cui X, Liu K, Huang J, et al. (2021) Population diversity of «Candidatus Liberibacter asiaticus» and Diaphorina citri in Sichuan: A case study for Huanglongbing monitoring and interception. Plant Dis. doi: 10.1094/PDIS-07-21-1539-RE
da Graça JV, Korsten L (2004) Citrus Huanglongbing: Review, Present status and Future Strategies. In: Naqvi S.A.M.H. (eds) Diseases of Fruits and Vegetables Volume I. pp 229-245. Springer, Dordrecht. doi: 10.1007/1-4020-2606-4_4
, , , ( 2015) Huanglongbing: An overview of a complex pathosystem ravaging the world’s citrus. J Integr Plant Biol 58: 373– 387. doi: 10.1111/jipb.12437
da Silva JR, de Alvarenga FV, Boaretto RM, et al. (2020) Following the effects of micronutrient supply in HLB-infected trees: plant responses and ‘Candidatus Liberibacter asiaticus’ acquisition by the Asian citrus psyllid. Trop. plant pathol. 45: 597–610. doi: 10.1007/s40858-020-00370-9
Dala-Paula BM, Plotto A, Bai J, et al. (2019) Effect of Huanglongbing or Greening Disease on Orange Juice Quality, a Review. Frontiers Plant Science 9: 1976. doi: 10.3389/fpls.2018.01976
Dan H, Ikeda N, Fujikami M, Nakabachi A (2017) Behavior of bacteriome symbionts during transovarial transmission and development of the Asian citrus psyllid. PLoS One. 12(12): e0189779. doi: 10.1371/journal.pone.0189779
De Francesco A, Lovelace AH, Shaw D, et al. (2021) Transcriptome profiling of Candidatus Liberibacter asiaticus in citrus and psyllids. bioRxiv 2021.08.09.455679; doi: 10.1101/2021.08.09.455679
De Francesco A, Lovelace AH, Shaw D, et al. (2022) Transcriptome Profiling of ‘Candidatus Liberibacter asiaticus’ in Citrus and Psyllids. Phytopathology 112(1): 116-130. doi: 10.1094/PHYTO-08-21-0327-FI
da Graça JV, Douhan GW, Halbert SE, et al. (2016) Huanglongbing: An overview of a complex pathosystem ravaging the world’s citrus. J Integr Plant Biol. 58(4): 373-87. doi: 10.1111/jipb.12437
Devi EJ, Labala RK, Modak R, et al. (2020) Molecular detection of “Candidatus Liberibacter asiaticus” causing HLB in Manipur and correlation of its incidence with elevation. Trop. plant pathol. 45, 658–667. doi: 10.1007/s40858-020-00392-3
, , , (2023) A prophage-encoded effector from “Candidatus Liberibacter asiaticus” targets ASCORBATE PEROXIDASE6 in citrus to facilitate bacterial infection. Molecular Plant Pathology 24: 302– 316. doi: 10.1111/mpp.13296
Duan Y, Zhou L, Hall DG, et al. (2009) Complete genome sequence of citrus Huanglongbing Bacterium, ‘Candidatus Liberibacter asiaticus’ obtained through metagenomics. Mol. Plant Microbe Interact. 22: 1011–1020. doi: 10.1094/MPMI-22-8-1011
Duan Q, Zhou M, Zhu L, Zhu G (2013) Flagella and bacterial pathogenicity. Basic Microbiol. 53: 1–8. doi: 10.1002/jobm.201100335
Dutt M, Barthe G, Irey M, Grosser J (2015) Transgenic Citrus Expressing an Arabidopsis NPR1 Gene Exhibit Enhanced Resistance against Huanglongbing (HLB; Citrus Greening). PLoS ONE 10(9): e0137134. doi: 10.1371/journal.pone.0137134
Dutt M, Mahmoud LM, Chamusco K, et al. (2021) Utilization of somatic fusion techniques for the development of HLB tolerant breeding resources employing the Australian finger lime (Citrus australasica). PLoS ONE 16(8): e0255842. doi: 10.1371/journal.pone.0255842
EFSA (European Food Safety Authority) et al. (2019) Pest survey card on Huanglongbing and its vectors. EFSA supporting publication 2019: 16( 4): EN-1574. 23 pp. doi: 10.2903/sp.efsa.2019.EN-1574
Espinosa-Zaragoza S, Pérez-De la O NB, Aguirre-Medina JF, López-Martínez V (2021) Does the African Citrus psyllid, Trioza erytreae (Del Guercio) (Hemiptera: Triozidae), Represent a Phytosanitary Threat to the Citrus Industry in Mexico? Insects 12(5): 450. doi: 10.3390/insects12050450
Ferrarezi RS, Qureshi JA, Wright AL, et al. (2019) Citrus Production Under Screen as a Strategy to Protect Grapefruit Trees From Huanglongbing Disease. Front. Plant Sci. 10:1598. doi: 10.3389/fpls.2019.01598
Fleites LA, Jain M, Zhang S, Gabriel DW (2014) «Candidatus Liberibacter asiaticus» prophage late genes may limit host range and culturability. Applied and environmental microbiology 80(19): 6023-30. doi: 10.1128/AEM.01958-14
Flores-Sánchez JL, Mora-Aguilera G, Loeza-Kuk E, et al. (2017) Diffusion Model for Describing the Regional Spread of Huanglongbing from First-Reported Outbreaks and Basing an Area Wide Disease Management Strategy. Plant Disease 101: 1119-1127. doi: 10.1094/PDIS-04-16-0418-RE
Folimonova SY, Achor DS (2010) Early events of citrus greening (Huanglongbing) disease development at the ultrastructural level. Phytopathology 100(9): 949-58. doi: 10.1094/PHYTO-100-9-0949
Fourie P, Kirkman W, Cook G, et al. (2020) First report of ‘Candidatus Liberibacter africanus’ associated with African Greening of Citrus in Angola. Plant Disease. doi: 10.1094/PDIS-06-20-1392-PDN
Fujiwara K, Iwanami T and Fujikawa T (2018) Alterations of Candidatus Liberibacter asiaticus-Associated Microbiota Decrease Survival of Ca. L. asiaticus in in vitro Assays Front. Microbiol. 9: 3089. doi: 10.3389/fmicb.2018.03089
Galdeano DM, de Souza Pacheco I, Alves GR, et al. (2020) Friend or foe? Relationship between ‘Candidatus Liberibacter asiaticus’ and Diaphorina citri. Tropical plant pathology 45: 559–571. doi: 10.1007/s40858-020-00375-4
García J, Ramos YP, Sotelo PA, Kondo T (2016) Biology of Diaphorina citri (Hemiptera: Liviidae) under glass house conditions in Palmira, Colombia. Revista Colombiana de Entomología 42. doi: 10.25100/socolen.v42i1.6667
Ghanim M, Achor D, Ghosh S, et al. (2017) ‘Candidatus Liberibacter asiaticus’ Accumulates inside Endoplasmic Reticulum Associated Vacuoles in the Gut Cells of Diaphorina citri . Sci Rep 7: 16945. doi: 10.1038/s41598-017-16095-w
Gottwald TR, Aubert B, Zhao X-Y (1989) Preliminary analysis of citrus greening (Huanglongbing) epidemics in the People’s Republic of China and French Reunion Island. Phytopathology 79: 687–93. doi: 10.1094/Phyto-79-687
Gottwald TR, da Graça JV, Bassanezi RB (2007) Citrus Huanglongbing: The pathogen and its impact. Online. Plant Health Progress. doi: 10.1094/PHP-2007-0906-01-RV
Gottwald T, Parnell S, Taylor E, et al. (2008) Within-tree spatial distribution of Candidatus Liberibacter asiaticus. Proc. Int. Res. Conf. Huanglongbing, pp. 270–73. LINK
Gottwald TR (2010) Current Epidemiological Understanding of Citrus Huanglongbing. Annual Review of Phytopathology 48: 119–39. doi: 10.1146/annurev-phyto-073009-114418
Gottwald TR, McCollum TG (2017) Huanglongbing solutions and the need for anti-conventional thought. Journal of Citrus Pathology 4(1): https://escholarship.org/uc/item/2fp8n0g1
Gottwald T, Poole G, McCollum T, et al. (2020) Canine olfactory detection of a vectored phytobacterial pathogen, Liberibacter asiaticus, and integration with disease control. Proc Natl Acad Sci U S A. 2020;117(7):3492‐3501. doi: 10.1073/pnas.1914296117
Grafton-Cardwell EE, Daugherty MP (2016) Asian Citrus Psyllid and Huanglongbing Disease. University of California Statewide IPM Program
Graham J, Gottwald T, Setamou M (2020) Status of Huanglongbing (HLB) outbreaks in Florida, California and Texas. Tropical Plant Pathology 45:265–278. doi: 10.1007/s40858-020-00335-y
Granato LM, Oliveira TS, Boscariol-Camargo RL, et al. (2020) ‘Candidatus Liberibacter asiaticus’ putative effectors: in silico analysis and gene expression in citrus leaves displaying distinct huanglongbing symptoms. Trop. plant pathol. 45,646–657. doi: 10.1007/s40858-020-00382-5
Haapalainen M (2014) Biology and epidemics of Candidatus Liberibacter species, psyllid-transmitted plant-pathogenic bacteria. Annals of Applied Biology 165(2): 172-198. doi: 10.1111/aab.12149
Halbert SE, Manjunath KL (2004) Asian citrus psyllids (sternorrhyncha: psyllidae) and greening disease of citrus: a literature review and assessment of risk in florida. Florida Entomologist 87(3): 330-353. doi: 10.1653/0015-4040(2004)087[0330:ACPSPA]2.0.CO;2
Hansen AK, Trumble JT, Stouthamer R, Paine TD (2008) A New Huanglongbing Species, “Candidatus Liberibacter psyllaurous,” Found To Infect Tomato and Potato, Is Vectored by the Psyllid Bactericera cockerelli (Sulc). Applied Environmental Microbiology 74(18): 5862. doi: 10.1128/AEM.01268-08
Hao G, Stover E and Gupta G (2016) Overexpression of a Modified Plant Thionin Enhances Disease Resistance to Citrus Canker and Huanglongbing (HLB). Front. Plant Sci. 7:1078. doi: 10.3389/fpls.2016.01078
Higgins SA, Mann M, Heck M (2022) Strain Tracking of ‘Candidatus Liberibacter asiaticus’, the Citrus Greening Pathogen, by High-Resolution Microbiome Analysis of Asian Citrus Psyllids. Phytopathology 112(11): 2273-2287. doi: 10.1094/PHYTO-02-22-0067-R
Hochmaier V, Mika R, Burdyn L. Monitoreo del vector del HLB “Diaphorina citri”. INTA EEA Conconrdia. Link
Hogenhout SA, Oshima K, Ammarel-D, et al. (2008) Phytoplasmas: bacteria that manipulate plants and insects. Molecular plant pathology 9(4):403-23. doi: 10.1111/j.1364-3703.2008.00472.x
Hosseinzadeh S, Shams-Bakhsh M, Mann M, et al. (2019) Distribution and Variation of Bacterial Endosymbiont and “Candidatus Liberibacter asiaticus” Titer in the Huanglongbing Insect Vector, Diaphorina citri Kuwayama. Microb Ecol 78: 206–222. doi: 10.1007/s00248-018-1290-1
Hosseinzadeh S, Ramsey J, Mann M, et al. (2019) Color morphology of Diaphorina citri influences interactions with its bacterial endosymbionts and ‘Candidatus Liberibacter asiaticus’. PLoS ONE 14(5): e0216599. doi: 10.1371/journal.pone.0216599
Hosseinzadeh S, Heck M (2023) Variations on a theme: factors regulating interaction between Diaphorina citri and “Candidatus Liberibacter asiaticus” vector and pathogen of citrus huanglongbing. Current Opinion in Insect Science 56: 101025. doi: 10.1016/j.cois.2023.101025
Hu J, Jiang J, Wang N (2017) Control of Citrus Huanglongbing (HLB) via Trunk Injection of Plant Activators and Antibiotics. Phytopathology (accepted). doi: 10.1094/PHYTO-05-17-0175-R
Hu B, Rao MJ, Deng X, et al. (2021) Molecular signatures between citrus and Candidatus Liberibacter asiaticus. PLoS Pathog 17(12): e1010071. doi: 10.1371/journal.ppat.1010071
Hunter WB, Cooper WR, Sandoval-Mojica AF, et al. (2021) Improving Suppression of Hemipteran Vectors and Bacterial Pathogens of Citrus and Solanaceous Plants: Advances in Antisense Oligonucleotides (FANA). Front. Agron. 3: 675247. doi: 10.3389/fagro.2021.675247
Inui Kishi RN, Stach-Machado D, Singulani JdL, et al. (2018) Evaluation of cytotoxicity features of antimicrobial peptides with potential to control bacterial diseases of citrus. PLoS ONE 13(9): e0203451. doi: 10.1371/journal.pone.0203451
Irey MS, Gast T, Gottwald TR (2006) Comparison of visual assessment and polymerase chain reaction assay testing to estimate the incidence of the Huanglongbing pathogen in commercial Florida citrus. Proc. Fla. State Hortic. Soc. 119:89–93. LINK
Jain M, Cai L, Fleites LA, et al. (2019) Liberibacter crescens Is a Cultured Surrogate for Functional Genomics of Uncultured Pathogenic ‘Candidatus Liberibacter’ spp. and Is Naturally Competent for Transformation. Phytopathology 109:1811-1819. https://doi.org/10.1094/PHYTO-04-19-0129-R
Kelley AJPelz-Stelinski KS (2019) Maternal Contribution of Candidatus Liberibacter asiaticus to Asian Citrus Psyllid (Hemiptera: Liviidae) Nymphs Through Oviposition Site Inoculation and Transovarial Transmission. Journal of Economic Entomology 112: 2565–2568. doi: 10.1093/jee/toz197
Keremane ML, Ramadugu C, Rodriguez E, et al. (2015) A rapid field detection system for citrus huanglongbing associated ‘Candidatus Liberibacter asiaticus’ from the psyllid vector, Diaphorina citri Kuwayama and its implications in disease management. Crop Protection 68: 41-48. doi: 10.1016/j.cropro.2014.10.026
Killiny N, Jones SE (2024) A Transmission Assay of ‘Candidatus Liberibacter asiaticus’ Using Citrus Phloem Sap and Topical Feeding to Its Insect Vector, Diaphorina citri. Phytopathology 114(9): 2176-2181. doi: 10.1094/PHYTO-05-24-0171-SC
Kwak Y, Sun P, Meduri VR, et al. (2021) Uncovering Symbionts Across the Psyllid Tree of Life and the Discovery of a New Liberibacter Species, “Candidatus” Liberibacter capsica. Front. Microbiol. 12: 739763. doi: 10.3389/fmicb.2021.739763
Ledford H (2017) Geneticists enlist engineered virus and CRISPR to battle citrus disease. Nature 545: 277–278. doi: 10.1038/545277a
Li W, Hartung JS, Levy L (2006) Quantitative real-time PCR for detection and identification of Candidatus Liberibacter species associated with citrus huanglongbing. Journal of Microbiological Methods 66(1): 104-115. doi: 10.1016/j.mimet.2005.10.018
Li W, Hartung JS, Levy L (2007) Evaluation of DNA amplification methods for improved detection of “Candidatus Liberibacter species” associated with citrus huanglongbing. Plant Disease 91: 51-58. doi: 10.1094/PD-91-0051
Li W, Levy L, Hartung JS (2009) Quantitative distribution of ‘Candidatus Liberibacter asiaticus’ in citrus plants with citrus huanglongbing. Phytopathology 99: 139-144. doi: 10.1094/PHYTO-99-2-0139
Li J, Pang Z, Trivedi P, et al. (2017 ) ‘Candidatus Liberibacter asiaticus’ Encodes a Functional Salicylic Acid (SA) Hydroxylase That Degrades SA to Suppress Plant Defenses. Mol Plant Microbe Interact. 30(8): 620-630. doi: 10.1094/MPMI-12-16-0257-R
Lopes SA, Bertolini E, Frare GF, et al. (2009) Graft transmission efficiencies and multiplication of ‘Candidatus Liberibacter americanus’ and ‘Ca. Liberibacter asiaticus’ in citrus plants. Phytopathology 99: 301-306. doi: 10.1094/PHYTO-99-3-0301
Lopes-da-Silva M, Martins OM, Wulff NA, et al. (2020) Survey of 16SrIX phytoplasmas associated with HLB-symptoms in weeds and leafhoppers at citrus orchards. Trop. plant pathol. 45, 680–683. doi: 10.1007/s40858-020-00345-w
Lopes SA, Cifuentes-Arenas JC (2021) Protocol for Successful Transmission of ‘Candidatus Liberibacter asiaticus’ from Citrus to Citrus Using Diaphorina citri. Phytopathology 111(12): 2367-2374. doi: 10.1094/PHYTO-02-21-0076-R
Lovelace AH, Wang C, Levy A, Ma W (2024) Transcriptomic profiling of ‘Candidatus Liberibacter asiaticus’ in different citrus tissues reveals novel insights into Huanglongbing pathogenesis. Mol Plant Microbe Interact. doi: 10.1094/MPMI-08-24-0102-R
Louzada ES, Vazquez OE, Evan Braswell W, et al. (2016) Distribution of ‘Candidatus Liberibacter asiaticus’ Above and Below Ground in Texas Citrus. Phytopathology 106(7): 702-709. doi: 10.1094/PHYTO-01-16-0004-R
Ma W, Pang Z, Huang X, et al. (2022) Citrus Huanglongbing is a pathogen-triggered immune disease that can be mitigated with antioxidants and gibberellin. Nat Commun 13: 529. doi: 10.1038/s41467-022-28189-9
Manjunath KL, Halbert SE, Ramadugu C, et al. (2008) Detection of ‘Candidatus Liberibacter asiaticus’ in Diaphorina citri and its importance in the management of citrus huanglongbing in Florida. Phytopathology 98: 387-396. doi: 10.1094/PHYTO-98-4-0387
Mann RS, Pelz-Stelinski K, Hermann SL, et al. (2011) Sexual Transmission of a Plant Pathogenic Bacterium, Candidatus Liberibacter asiaticus, between Conspecific Insect Vectors during Mating. PLoS ONE 6(12): e29197. doi: 10.1371/journal.pone.0029197
Mann M, Saha S, Cicero JM, et al. (2021) Quantification of new and archived Diaphorina citri transcriptome data using a chromosomal length D. citri genome assembly reveals the vector’s tissue-specific transcriptional response to citrus greening disease. bioRxiv 2021.09.19.460957; doi: 10.1101/2021.09.19.460957
Mann M, Saha S, Cicero JM, et al. (2022) Lessons learned about the biology and genomics of Diaphorina citri infection with «Candidatus Liberibacter asiaticus» by integrating new and archived organ-specific transcriptome data. Gigascience 11: giac035. doi: 10.1093/gigascience/giac035
Martini X, Malfa K, Stelinski LL, et al. (2020) Distribution, Phenology, and Overwintering Survival of Asian Citrus Psyllid (Hemiptera: Liviidae), in Urban and Grove Habitats in North Florida. Journal of Economic Entomology 113(3): 1080‐1087. doi: 10.1093/jee/toaa011
Mattos-Jr D, Kadyampakeni DM, da Silva JR, et al. (2020) Reciprocal effects of huanglongbing infection and nutritional status of citrus trees: a review. Trop. plant pathol. 45: 586–596. doi: 10.1007/s40858-020-00389-y
Menger R, Rehberg R, Trivedi P, et al. (2021) High spatial resolution fluorescence imagery for optimized pest management within a Huanglongbing-infected citrus grove. Phytopathology. doi: 10.1094/PHYTO-05-21-0211-FI
Merfa MV, Pérez-López E, Naranjo E, et al. (2019) Progress and Obstacles in Culturing ‘Candidatus Liberibacter asiaticus’, the Bacterium Associated with Huanglongbing. Phytopathology 109(7): 1092-1101. doi: 10.1094/PHYTO-02-19-0051-RVW
Merfa ESMV, Fischer ER, Silva MSE, et al. (2021) Probing the application of OmpA-derived peptides to disrupt the acquisition of ‘Candidatus Liberibacter asiaticus’ by Diaphorina citri. Phytopathology. doi: 10.1094/PHYTO-06-21-0252-FI
Milne AE, Teiken C, Deledalle F, et al. (2018) Growers’ risk perception and trust in control options for huanglongbing citrus-disease in Florida and California. Crop Protection 114: 177–186. doi: 10.1016/j.cropro.2018.08.028
Morelli M, Takayassu FH, de Andrade Pacheco C, et al. (2020) Impact of HLB on the physiological quality of citrus rootstock seeds and non-vertical ‘Candidatus Liberibacter asiaticus’ transmission. Trop. plant pathol. 45,620–625. doi: 10.1007/s40858-020-00371-8
Morgan JK, Zhou L, Li W, et al. (2012) Improved real-time PCR detection of ‘Candidatus Liberibacter asiaticus’ from citrus and psyllid hosts by targeting the intragenic tandem-repeats of its prophage genes. Mol Cell Probes 26: 90–98. doi: 10.1016/j.mcp.2011.12.001
Moschini RC, Heit GE, Conti HA, et al. (2010) Riesgo agroclimático de las áreas citrícolas de Argentina en relación a la abundancia de Diaphorina citri. Programa Nacional de prevención del Huanglongbing. SENASA. Informe enero de 2010. – Página/s: 14.
Munir S, Li Y, He P, et al. (2022) Defeating Huanglongbing Pathogen Candidatus Liberibacter asiaticus With Indigenous Citrus Endophyte Bacillus subtilis L1-21. Front. Plant Sci. 12: 789065. doi: 10.3389/fpls.2021.789065
Nehela Y, Killiny N (2020) Revisiting the Complex Pathosystem of Huanglongbing: Deciphering the Role of Citrus Metabolites in Symptom Development. Metabolites 10(10): 409. doi: 10.3390/metabo10100409
Nian X, Wu S, Li J, et al. (2023) Spatial Distribution and Temporal Dynamics of Candidatus Liberibacter Asiaticus in Different Stages of Embryos, Nymphs and Adults of Diaphorina citri. Int J Mol Sci. 24(10): 8997. doi: 10.3390/ijms24108997
Pacheco IdS, Galdeano DM, Maluta NKP, et al. (2020) Gene silencing of Diaphorina citri candidate effectors promotes changes in feeding behaviors. Sci Rep 10: 5992. doi: 10.1038/s41598-020-62856-5
Pagliaccia D, Shi J, Pang Z, et al. (2017) A Pathogen Secreted Protein as a Detection Marker for Citrus Huanglongbing. Frontiers in Microbiology 8: 2041. doi: 10.3389/fmicb.2017.02041
Pandey SS, N C Vasconcelos F, Wang N (2020) Spatiotemporal dynamics of Candidatus Liberibacter asiaticus colonization inside citrus plant and Huanglongbing disease development. Phytopathology. doi: 10.1094/PHYTO-09-20-0407-R
Pandey SS, Hendrich C, Andrade M, Wang N (2021) Candidatus Liberibacter: From Movement, Host Responses, to Symptom Development of Citrus HLB. Phytopathology. doi: 10.1094/PHYTO-08-21-0354-FI
Pandey SS, Xu J, Achor D, et al. (2022) Microscopic and transcriptomic analyses of early events triggered by Candidatus Liberibacter asiaticus in young flushes of HLB-positive citrus trees. Phytopathology. doi: 10.1094/PHYTO-10-22-0360-R
Pang Z, Zhang L, Coaker G, et al. (2020) Citrus CsACD2 Is a Target of Candidatus Liberibacter Asiaticus in Huanglongbing Disease. Plant Physiol. 184(2): 792-805. doi: 10.1104/pp.20.00348
Park JW, Louzada ES, Evan Braswell W, et al. (2018) A new diagnostic real-time PCR method for Huanglongbing detection in citrus root tissue. Journal of General Plant Pathology 84(5): 359-367. doi: 10.1007/s10327-018-0793-4
Pazolini K, Arruda JH, Chinelato GA, et al. (2021) Temporal Progress of Huanglongbing Epidemics and the Effect of Non-commercial Inoculum Sources on Citrus Orchards in São Paulo State, Brazil. Plant Disease. doi: 10.1094/PDIS-09-19-1945-RE
Pelz-Stelinski KS, Brlansky RH, Ebert TA, Rogers ME (2010) Transmission Parameters for Candidatus Liberibacter asiaticus by Asian Citrus Psyllid (Hemiptera: Psyllidae). Journal of Economic Entomology 103: 1531–1541. doi: 10.1603/EC10123
Pelz-Stelinski KS, Killiny N (2016) Better Together: Association with “Candidatus Liberibacter Asiaticus” Increases the Reproductive Fitness of Its Insect Vector, Diaphorina citri (Hemiptera: Liviidae). Annals of the Entomological Society of America. 109: 371–376. doi: 10.1093/aesa/saw007
Peng T, Yuan Y, Huang A, et al. (2023) Interaction between the flagellum of Candidatus Liberibacter asiaticus and the vitellogenin-like protein of Diaphorina citri significantly influences CLas titer. Front. Microbiol. 14: 1119619. doi: 10.3389/fmicb.2023.1119619
Pérez-González O, Gomez-Flores R, Montesinos-Matías R, et al. (2023) Improved Diaphorina citri (Hemiptera: Liviidae) Adults Biocontrol in Citrus by Hirsutella citriformis (Hypocreales: Ophiocordycipitaceae) Gum-Enhanced Conidia Formulation. Plants (Basel) 12(6): 1409. doi: 10.3390/plants12061409
Perilla-Henao LM, Casteel CL (2016) Vector-Borne Bacterial Plant Pathogens: Interactions with Hemipteran Insects and Plants. Frontiers in Plant Science 7: 1163. doi: 10.3389/fpls.2016.01163
Ramsey JS, Ammar ED, Mahoney JE, et al. (2022) Host Plant Adaptation Drives Changes in Diaphorina citri Proteome Regulation, Proteoform Expression, and Transmission of ‘Candidatus Liberibacter asiaticus’, the Citrus Greening Pathogen. Phytopathology 112(1): 101-115. doi: 10.1094/PHYTO-06-21-0275-R
Rashidi M, Lin CY, Britt K, et al. (2022) Diaphorina citri flavi-like virus localization, transmission, and association with Candidatus Liberibacter asiaticus in its psyllid host. Virology 567: 47-56. doi: 10.1016/j.virol.2021.12.009
Rehberg RA, Trivedi P, Bahureksa W, et al. (2021) Quantification of insecticide spatial distribution within individual citrus trees and efficacy through Asian citrus psyllid reductions under different application methods. Pest Manag Sci. 77(4): 1748-1756. doi: 10.1002/ps.6195
Reynaud B, Turpin P, Molinari FM, et al. (2022) The African citrus psyllid Trioza erytreae: An efficient vector of Candidatus Liberibacter asiaticus. Front. Plant Sci. 13: 1089762. doi: 10.3389/fpls.2022.1089762
Ribeiro C, Xu J, Hendrich C, et al. (2022) Seasonal transcriptome profiling of susceptible and tolerant citrus cultivars to citrus Huanglongbing. Phytopathology 113(2): 286-298. doi: 10.1094/PHYTO-05-22-0179-R
Riera N, Handique U, Zhang Y, et al. (2017) Characterization of Antimicrobial-Producing Beneficial Bacteria Isolated from Huanglongbing Escape Citrus Trees. Frontiers in Microbiology 8: 2415. doi: 10.3389/fmicb.2017.02415
Rios Glusberger P, Petrone JR, Muñoz-Beristain A, et al. (2023) Foliar Phosphate Applications Influence Organic Acid Composition in the Citrus Phloem and Could Reduce Huanglongbing Disease by Limiting CLas Titers. Plant Health Progress 24: 83-98. doi: 10.1094/PHP-05-22-0044-RS
Rodrigues JDB, Moreira AS, Stuchi ES, et al. (2020) Huanglongbing incidence, canopy volume, and sprouting dynamics of ‘Valencia’ sweet orange grafted onto 16 rootstocks. Trop. plant pathol. 45: 611–619. doi: 10.1007/s40858-020-00385-2
Roldán EL, Stelinski LL, Pelz-Stelinski KS (2023) Foliar Antibiotic Treatment Reduces Candidatus Liberibacter asiaticus Acquisition by the Asian Citrus Psyllid, Diaphorina citri (Hemiptera: Liviidae), but Does not Reduce Tree Infection Rate. J Econ Entomol. 116(1): 78-89. doi: 10.1093/jee/toac200
Rouse RE, Ozores-Hampton M, Roka FM, Roberts P (2017) Rehabilitation of Huanglongbing-affected citrus trees using severe pruning and enhanced Foliar nutritional treatments. HortScience 52 (7): 972-978. doi: 10.21273/HORTSCI11105-16
Salcedo-Baca D, Hinojosa R, Mora G, et al. (2010) Evaluación del impacto económico de la enfermedad de los cítricos Huanglongbing (HLB) en la cadena citrícola mexicana. Instituto Interamericano de Cooperación para la Agricultura (IICA), Mexico. 144 p.
Santos Silva M, Patt JM, de Jesus Barbosa C, et al. (2023) Asian citrus psyllid, Diaphorina citri (Hemiptera: Liviidae) responses to plant-associated volatile organic compounds: A mini-review. Crop Protection 169: 106242. doi: 10.1016/j.cropro.2023.106242
Sétamou M, Soto YL, Tachin M, et al. (2023) Report on the first detection of Asian citrus psyllid Diaphorina citri Kuwayama (Hemiptera: Liviidae) in the Republic of Benin, West Africa. Sci Rep 13: 801. doi: 10.1038/s41598-023-28030-3
Shi Q, Febres VJ, Zhang S, et al. (2018) Identification of Gene Candidates Associated with Huanglongbing Tolerance, Using ‘Candidatus Liberibacter asiaticus’ Flagellin 22 as a Proxy to Challenge Citrus. Molecular Plant-Microbe Interactions 31(2): 200-211. doi: 10.1094/MPMI-04-17-0084-R
Shokrollah H, Abdullah TL, Sijam K, Abdullah SNA (2011) Potential use of selected citrus rootstocks and interstocks against HLB disease in Malaysia. Crop Protection 30: 521-525. doi: 10.1016/j.cropro.2010.09.005
Soares JM, Tanwir SE, Grosser JW, et al. (2020) Development of genetically modified citrus plants for the control of citrus canker and huanglongbing. Tropical Plant Pathology 45: 237–250. doi: 10.1007/s40858-020-00362-9
Soratto TAT, Curtolo M, Marengo S, et al. (2020) QTL and eQTL mapping associated with host response to Candidatus Liberibacter asiaticus in citrandarins. Trop. plant pathol. 45: 626–645. doi: 10.1007/s40858-020-00372-7
Stover Ed, Stange Jr. RR, McCollum TG, et al. (2013) Screening antimicrobial peptides in vitro for use in developing transgenic citrus resistant to Huanglongbing and Citrus Canker. Journal of the American Society for Horticultural Science 138(2): 142–148.
Tatineni S, Sagaram US, Gowda S, et al. (2008) In planta distribution of ‘Candidatus Liberibacter asiaticus’ as revealed by polymerase chain reaction (PCR) and real-time PCR. Phytopathology 98: 592-599. doi: 10.1094/PHYTO-98-5-0592
Taylor EL, Gottwald TR, Adkins S (2023) Structural changes in Florida citrus production, 1980-2021 and associated consequences of weather events and disease. Journal of Citrus Pathology, 10. doi: 10.5070/
Texeira DC, Ayres J, Kitajima EW, et al. (2005) First Report of a Huanglongbing-Like Disease of Citrus in Sao Paulo State, Brazil and Association of a New Liberibacter Species, “Candidatus Liberibacter americanus”, with the Disease. Plant Disease 89(1): 107-107. doi: 10.1094/PD-89-0107A
Teixeira DC, Saillard C, Couture C, et al. (2008) Distribution and quantification of Candidatus Liberibacter americanus, agent of huanglongbing disease of citrus in Sao Paulo State, Brasil, in leaves of an affected sweet orange tree as determined by PCR. Mol. Cell. Probes 22: 139–50. doi: 10.1016/j.mcp.2007.12.006
Tipu MMH, Rahman MDM, Islam MdM, et al. (2020) Citrus greening disease (HLB) on Citrus reticulata (Mandarin) caused by Candidatus Liberibacter asiaticus in Bangladesh. Physiological and Molecular Plant Pathology 112: 101558. doi: 10.1016/j.pmpp.2020.101558
Trinh J, Li T, Franco JY, et al. (2022) Citrus relatives exhibit natural variation in perception and response magnitude to microbial features. bioRxiv 2022.07.15.500235; doi: 10.1101/2022.07.15.500235
Vasconcelos FNC, Li J, Pang Z, et al. (2020) Census of Candidatus Liberibacter asiaticus population inside the phloem of citrus trees. Phytopathology. doi: 10.1094/PHYTO-09-20-0388-R
Vosburg C, Sinn J, Orbovic V, et al. (2023) Assessment of grapefruit expressing anti-NodT antibody for huanglongbing resistance. PhytoFrontiers™ 0 0:ja. doi: 10.1094/PHYTOFR-06-23-0078-R
Wang N, Trivedi P (2013) Citrus Huanglongbing: A Newly Relevant Disease Presents Unprecedented Challenges. Phytopathology 103(7): 652-665. doi: 10.1094/PHYTO-12-12-0331-RVW
Wang N, Stelinski LL, Pelz-Stelinski KS, et al. (2017) Tale of the Huanglongbing Disease Pyramid in the Context of the Citrus Microbiome. Phytopathology 107: 4: 380-387. doi: 10.1094/PHYTO-12-16-0426-RVW
Wang N, Pierson EA, Setubal JC, et al. (2017) The Candidatus Liberibacter-Host Interface: Insights into Pathogenesis Mechanisms and Disease Control. Annual Review of Phytopathology 55: 451–482. doi: 10.1146/annurev-phyto-080516-035513
Wang Y, Halbert S, Mohamed S, et al. (2021) Mitochondrial genomes reveal diverse lineages of Diaphorina citri Kuwayama (Hemiptera: Sternorrhyncha: Psyllidae) in Kenya and La Réunion. Biol Invasions 23: 3109–3117. doi: 10.1007/s10530-021-02560-1
Wheatley M, Duan YP, Yang Y (2021) Highly sensitive and rapid detection of citrus Huanglongbing pathogen (Candidatus Liberibacter asiaticus) using Cas12a-based methods. Phytopathology. doi: 10.1094/PHYTO-09-20-0443-R
Willink E, Argañaraz M, Lizondo M, et al. (2006) Presencia de Diaphorina citri (Hemiptera: Psyllidae) en el Noroeste Argentino (NOA). – Página/s: 2. – ISBN/ISSN: ISSN 0373-5680.
Wu J, Alférez FM, Johnson EG, Graham JH (2018) Up-regulation of PR1 and less disruption of hormone and sucrose metabolism in roots is associated with lower susceptibility to ‘Candidatus Liberibacter asiaticus’. Plant Pathology (Online). doi: 10.1111/ppa.12838
Wu F, Huang M, Fox EGP, et al. (2021) Preliminary Report on the Acquisition, Persistence, and Potential Transmission of Citrus tristeza virus by Diaphorina citri. Insects 12(8): 735. doi: 10.3390/insects12080735
Wulff NA, Daniel B, Sassi RS, et al. (2020) Incidence of Diaphorina citri Carrying Candidatus Liberibacter asiaticus in Brazil’s Citrus Belt. Insects 11(10): 672. doi: 10.3390/insects11100672
Xi MY, Deyett E, Ginnan N, et al. (2022) Geographic Location, Management Strategy, and Huanglongbing Disease Affect Arbuscular Mycorrhizal Fungal Communities Across U.S. Citrus Orchards. Phytobiomes Journal 6: 342-353. doi: 10.1094/PBIOMES-03-22-0014-R
Xu Q, Cai JR, Zhang W, et al. (2022) Detection of citrus Huanglongbing (HLB) based on the HLB-induced leaf starch accumulation using a home-made computer vision system. Biosystems Engineering 218: 163-174. doi: 10.1016/j.biosystemseng.2022.04.018
Yamamoto PT, Felippe MR, Garbim LF, et al. (2006) Diaphorina citri (Hemiptera: Psyllidae): vector of the bacterium Candidatus Liberibacter americanus. Proc. Huanglongbing Green. Int. Workshop, p. 96. Ribeirao Preto, Braz. Araraquara, Braz: Fundecitrus
Yan Q, Sreedharan A, Wei S, et al. (2013) Global gene expression changes in Candidatus Liberibacter asiaticus during the transmission in distinct hosts between plant and insect. Mol. Plant Pathol. 14: 391–404. doi: 10.1111/mpp.12015
Yang C, Ancona V (2022) An Overview of the Mechanisms Against “Candidatus Liberibacter asiaticus”: Virulence Targets, Citrus Defenses, and Microbiome.Front. Microbiol. 13: 850588. doi: 10.3389/fmicb.2022.850588
Yuan X, Chen C, Bassanezi RB, et al. (2021) Region-Wide Comprehensive Implementation of Roguing Infected Trees, Tree Replacement, and Insecticide Applications Successfully Controls Citrus Huanglongbing. Phytopathology: PHYTO09200436R. doi: 10.1094/PHYTO-09-20-0436-R
Zhao H, Sun R, Albrecht U, et al. (2013) Small RNA profiling reveals phosphorus deficiency as a contributing factor in symptom expression for citrus huanglongbing disease. Mol Plant. 6(2):301-310. doi: 10.1093/mp/sst002
Zhou C (2020) The status of citrus Huanglongbing in China. Trop. plant pathol. 45: 279–284. doi: 10.1007/s40858-020-00363-8
Zhou Y, Tang Y, Hu C, et al. (2021) Soil applied Ca, Mg and B altered phyllosphere and rhizosphere bacterial microbiome and reduced huanglongbing incidence in gannan navel orange. Sci. Total Environ. 791: 148046. doi: 10.1016/j.scitotenv.2021.148046
, , , Prophage region and short tandem repeats of “Candidatus Liberibacter asiaticus” reveal significant population structure in China. Plant Pathology 00: 1– 11. doi: 10.1111/ppa.13332
Zheng L, Xu Q, Gong G, et al. (2023) Nicotiana tabacum as a dead-end trap for adult Diaphorina citri: A potential biological tactic for protecting citrus orchards. Front. Plant Sci. 13: 1081663. doi: 10.3389/fpls.2022.1081663
Zou H, Gowda S, Zhou L, et al. (2012) The destructive citrus pathogen, ‘Candidatus Liberibacter asiaticus’ encodes a functional Flagellin characteristic of a pathogen-associated molecular pattern. PLoS One 7: e46447. doi: 10.1371/journal.pone.0046447